הבדלים בין גרסאות בדף "בדיקת אפירמה לאבחון קשריות בלוטת התריס - Afirma genomic sequencing classifier for thyroid nodules diagnosis"
| (4 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 11: | שורה 11: | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | {{הרחבה|ערכים=[[בלוטת התריס]], [[בדיקת אפירמה]]}} | |
| − | {{הרחבה|בלוטת התריס}} | + | העדויות התומכות בשימוש בבדיקת [[Afirma]] באלגוריתם המעקב והטיפול אחר חולים עם קשריות בבלוטת התריס כוללות: מחקרי תיקוף פרוספקטיביים (Prospective) רב-מרכזיים כפולי-סמיות, סדרת מחקרים לתיקוף אנליטי של הבדיקה, ועשרות מחקרי עולם אמיתי שסיכמו את הניסיון עם הבדיקה במסגרת קלינית. הדור הראשון של הבדיקה Afirma GEC{{כ}} (Gene Expression Classifier) הפך זמין מסחרית בסוף 2010. נכון ל-2022, נעשה שימוש בדור השני של הבדיקה: Afirma GSC{{כ}} (Gene Sequencing Classifier). כ-66 אחוזים מהחולים עם אבחנה של ציטולוגיה (Cytology) לא חד-משמעית נמצאו עם תוצאה שפירה{{הערה|שם=הערה4|Syed Z Ali, et al. Extending Expressed RNA Genomics From Surgical Decision Making for Cytologically Indeterminate Thyroid Nodules to Targeting Therapies for Metastatic Thyroid Cancer. Cancer Cytopathol .2019 Jun;127(6):362-369. doi: 10.1002/cncy.22132. Epub 2019 Apr 24.}} ברמת ודאות גבוהה מ-96 אחוזים בבדיקת Afirma{{כ}}{{הערה|שם=הערה3|Kepal N. Patel, MD1; Trevor E. Angell, MD2; Joshua Babiarz, PhD3; et al Performance of a Genomic Sequencing Classifier for the Preoperative Diagnosis of Cytologically Indeterminate Thyroid Nodules JAMA Surg. 2018;153(9):817-824. doi:10.1001/jamasurg.2018.1153}}. יותר מ-94 אחוזים מהחולים שהנגע שלהם נמצא שפיר על ידי בדיקת Afirma GSC, לא הופנו לניתוח כריתת הבלוטה ולחלופין הופנו למעקב קליני והדמייתי בלבד{{הערה|שם=הערה4}}. |
| − | העדויות התומכות בשימוש בבדיקת [[Afirma]] באלגוריתם המעקב והטיפול אחר חולים עם קשריות בבלוטת התריס כוללות: מחקרי תיקוף פרוספקטיביים רב-מרכזיים כפולי-סמיות, סדרת מחקרים לתיקוף אנליטי של הבדיקה, ועשרות מחקרי עולם אמיתי שסיכמו את הניסיון עם הבדיקה במסגרת קלינית. הדור הראשון של הבדיקה | ||
== רקע == | == רקע == | ||
| − | קשרים בבלוטת התריס/מגן (Thyroid) הם שכיחים מאוד. הם מתגלים בכ-20–25 אחוזים בבדיקות על-קול (Ultrasound) ושכיחים יותר בנשים ועם העלייה בגיל. עם עליית היקפי השימוש בבדיקת על-קול של הצוואר, גובר בהתאמה הצורך בניהול מקרי חולים שלהם קשרים בבלוטת התריס. | + | קשרים בבלוטת התריס/מגן (Thyroid) הם שכיחים מאוד. הם מתגלים בכ-20–25 אחוזים בבדיקות על-קול ([[Ultrasound]]) ושכיחים יותר בנשים ועם העלייה בגיל. עם עליית היקפי השימוש בבדיקת על-קול של הצוואר, גובר בהתאמה הצורך בניהול מקרי חולים שלהם קשרים בבלוטת התריס. |
| − | החשיבות הקלינית של הערכת קשרים בבלוטת התריס היא לצורך שלילת [[ממאירות בבלוטה]], אשר שכיחה ב-4–6.5 אחוזים מהקשרים, וזו נעשית באמצעות FNA (Fine Needle Aspiration). | + | החשיבות הקלינית של הערכת קשרים בבלוטת התריס היא לצורך שלילת [[ממאירות בבלוטה]], אשר שכיחה ב-4–6.5 אחוזים מהקשרים, וזו נעשית באמצעות [[FNA בתריס|FNA]] {{כ}}(Fine Needle Aspiration). |
| − | ב-15–30 אחוזים מהדגימות שנשלחות לאבחנה ציטולוגית | + | ב-15–30 אחוזים מהדגימות שנשלחות לאבחנה ציטולוגית בעזרת FNA אי אפשר לקבוע כמקובל באמצעות בדיקה מיקרוסקופית את מידת הממאירות של הקשרית, והתוצאה הציטולוגית מוגדרת "חשודה" או "בעלת סיכון לא מוגדר" (Bethesda{{כ}} III/IV). |
תוצאה זו משמעותה שאי אפשר לקבוע את מידת הממאירות של הקשרית על סמך דגימת תאים (ציטולוגיה), אלא נחוצה הקשרית בשלמותה (פתולוגיה). | תוצאה זו משמעותה שאי אפשר לקבוע את מידת הממאירות של הקשרית על סמך דגימת תאים (ציטולוגיה), אלא נחוצה הקשרית בשלמותה (פתולוגיה). | ||
| − | החלטות קליניות לגבי מטופלים עם תוצאה ציטולוגית זו אינן קלות, ובמרבית המקרים הללו יופנה החולה לביצוע ניתוח אבחנתי הכולל כריתה חלקית של בלוטת התריס, וזאת למרות העובדה שב-70–80 אחוזים מהמקרים הקשרים נמצאים שפירים לאחר הניתוח{{הערה|שם=הערה1|Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19(11):1167-214.}}{{הערה|שם=הערה2|Wang C, Friedman L, Kennedy GC, et al. A Large Multicenter Correlation Study of Thyroid Nodule Cytopathology and Histopathology. Thyroid 2011;21(3):243-251.}} | + | החלטות קליניות לגבי מטופלים עם תוצאה ציטולוגית זו אינן קלות, ובמרבית המקרים הללו יופנה החולה לביצוע ניתוח אבחנתי הכולל כריתה חלקית של בלוטת התריס, וזאת למרות העובדה שב-70–80 אחוזים מהמקרים הקשרים נמצאים שפירים לאחר הניתוח{{הערה|שם=הערה1|Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19(11):1167-214.}}{{הערה|שם=הערה2|Wang C, Friedman L, Kennedy GC, et al. A Large Multicenter Correlation Study of Thyroid Nodule Cytopathology and Histopathology. Thyroid 2011;21(3):243-251.}}. |
== אפירמה - Afirma == | == אפירמה - Afirma == | ||
שיטות ציטוגנטיות (Cytogenetic) מורכבות הפכו לנגישות יותר, והן תופסות מקום מרכזי בניהול המטופל בכל תחומי הרפואה. בתחום בלוטת התריס בדיקות גנומיות, דוגמת בדיקת Afirma, נעשו מקובלות, והן נכללות בהנחיות הקליניות של האיגודים המקצועיים המובילים. מאמר זה יתאר את השיטה, יתרונותיה וחסרונותיה, ואת מיקומה בטיפול מיטבי במטופלים בעלי קשרים חשודים בבלוטת התריס. | שיטות ציטוגנטיות (Cytogenetic) מורכבות הפכו לנגישות יותר, והן תופסות מקום מרכזי בניהול המטופל בכל תחומי הרפואה. בתחום בלוטת התריס בדיקות גנומיות, דוגמת בדיקת Afirma, נעשו מקובלות, והן נכללות בהנחיות הקליניות של האיגודים המקצועיים המובילים. מאמר זה יתאר את השיטה, יתרונותיה וחסרונותיה, ואת מיקומה בטיפול מיטבי במטופלים בעלי קשרים חשודים בבלוטת התריס. | ||
| − | Afirma GSC{{כ}} | + | Afirma GSC{{כ}} היא בדיקה גנומית אבחנתית המיועדת לשלילת סיכון ל[[סרטן]] במטופלים עם קשריות בבלוטת התריס, שמידת ממאירותן אינה ניתנת לקביעה בציטולוגיה (Indeterminate cytology). מידע זה יכול לסייע לרופאים ולחולים במניעת ניתוח לכריתת בלוטת התריס שאינו מחויב המציאות. |
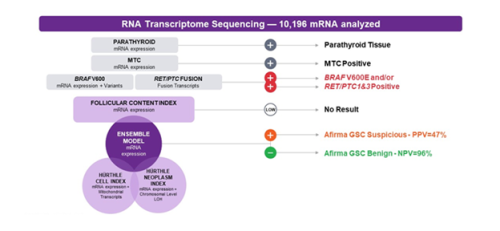
[[קובץ:Afirma1.png|ממוזער|מרכז|500 פיקסלים|תרשים 1: השלבים המתבצעים כחלק מתהליך האבחון בבדיקת Afirma GSC]] | [[קובץ:Afirma1.png|ממוזער|מרכז|500 פיקסלים|תרשים 1: השלבים המתבצעים כחלק מתהליך האבחון בבדיקת Afirma GSC]] | ||
| − | בדיקת Afirma פותחה ומבוצעת על ידי חברת Veracyte (San Francisco, California). הבדיקה עושה שימוש בטכנולוגיה לריצוף RNA של | + | בדיקת Afirma פותחה ומבוצעת על ידי חברת Veracyte {{כ}}(San Francisco, California). הבדיקה עושה שימוש בטכנולוגיה לריצוף RNA{{כ}} (Ribonucleic acid) של ה-Transcriptome התאי בקשרית החשודה לממאירות. הטכנולוגיה מאפשרת לבחון ביטוי של גנים (Genes), שינויים ברצף הגנומי, אובדן הטרוזיגוטיות (Heterozygosity) וגנום מיטוכונדריאלי (Mitochondrial genome). במבנה הבדיקה נבחן סט ראשוני של ממצאים הכולל רקמת Parathyroid וממצאים המעידים על סיכון מוגבר לממאירות, ביניהם: [[Medullary thyroid cancer]] ושונויות גנטיות בעלות קשר גבוה לסרטן תירואיד מסוג פפילרי [ביניהן וריאנט BRAF V600 ופיוז'נים (Fusion) מסוג,RET/PTC1 RET/PTC3]. בשלב הבא של הבדיקה נבחן ביטוי של למעלה מ-10 אלף גנים, המאפשר לסווג את הקשרית כשפירה ברמת ודאות גבוהה מ-96 אחוזים או חשודה לממאירות{{הערה|שם=הערה3}}. |
Afirma Xpression Atlas – פאנל הכלול בבדיקת אפירמה, בוחן שונויות גנומיות עם קשר לסרטן בלוטת התריס. הוא מיועד לקשריות שלאחר אבחנה שאינה חד-משמעית בבדיקה הציטולוגית סווגו כחשודות לממאירות בבדיקת Afirma GSC, וכן לקשריות שאובחנו בסיווג Bethesda V/VI (חשודות לממאירות או ממאירות). פאנל XA מספק מידע לגבי הימצאות וריאנטים ופיוז'נים גנומיים הקשורים בסרטן בלוטת התריס בתאי דגימת הקשרית. ממצאים אלו תורמים מידע בעל משמעות קלינית ומאפשרים התאמת טיפול אישי. באמצעותם ניתן לדייק את רמת הסיכון לממאירות בקשריות לאחר אבחנה ציטולוגית שאינה חד-משמעית, לאפיין את סוג הגידול, ולהתאים טיפולים תרופתיים מכוונים בגידולים מפושטים. | Afirma Xpression Atlas – פאנל הכלול בבדיקת אפירמה, בוחן שונויות גנומיות עם קשר לסרטן בלוטת התריס. הוא מיועד לקשריות שלאחר אבחנה שאינה חד-משמעית בבדיקה הציטולוגית סווגו כחשודות לממאירות בבדיקת Afirma GSC, וכן לקשריות שאובחנו בסיווג Bethesda V/VI (חשודות לממאירות או ממאירות). פאנל XA מספק מידע לגבי הימצאות וריאנטים ופיוז'נים גנומיים הקשורים בסרטן בלוטת התריס בתאי דגימת הקשרית. ממצאים אלו תורמים מידע בעל משמעות קלינית ומאפשרים התאמת טיפול אישי. באמצעותם ניתן לדייק את רמת הסיכון לממאירות בקשריות לאחר אבחנה ציטולוגית שאינה חד-משמעית, לאפיין את סוג הגידול, ולהתאים טיפולים תרופתיים מכוונים בגידולים מפושטים. | ||
| שורה 38: | שורה 37: | ||
[[קובץ:Afirma2.png|ממוזער|מרכז|600 פיקסלים|תרשים 2: היישום הקליני של בדיקת Afirma GSC ופאנל Xpression Atlas{{כ}}{{הערה|שם=הערה4}}]] | [[קובץ:Afirma2.png|ממוזער|מרכז|600 פיקסלים|תרשים 2: היישום הקליני של בדיקת Afirma GSC ופאנל Xpression Atlas{{כ}}{{הערה|שם=הערה4}}]] | ||
| − | כפי שניתן לראות בתרשים, ניתן לשקול את ביצוע הבדיקה כאשר תוצאת בדיקת ה-FNA בקשרית מצביעה על כך שאין דרך לקבוע בוודאות את דרגת ממאירותה. בחולים עם דגימות FNA שנקבעו שפירות (בתסדה 2) או ממאירות בציטולוגיה ( | + | כפי שניתן לראות בתרשים, ניתן לשקול את ביצוע הבדיקה כאשר תוצאת בדיקת ה-FNA בקשרית מצביעה על כך שאין דרך לקבוע בוודאות את דרגת ממאירותה. בחולים עם דגימות FNA שנקבעו שפירות (בתסדה 2) או ממאירות בציטולוגיה (Bethesda V/VI), או במקרים שאין די תאים לקביעת האבחנה (Bethesda I), לא נוכל להסתייע בשיטה הציטוגנטית. |
| − | חולים שקיבלו תשובה של Indeterminate ( | + | חולים שקיבלו תשובה של Indeterminate {{כ}}(Bethesda III/IV) על פי הציטולוגיה, נשלחים לרוב לניתוח להסרת הבלוטה ונאלצים להתמודד, לשארית חייהם, עם מצב כרוני הדורש טיפול. לפי הספרות והניסיון המצטבר, רוב החולים שמקבלים תשובה המעידה על סיכון נמוך לממאירות לפי בדיקת Afirma, נמנעים מביצוע ניתוח ובכך נמנעים סבל מיותר, סיבוכים פוטנציאליים מהניתוח ועלויות למערכת. |
==מחקרים שביססו את תקפות הבדיקה ויעילותה== | ==מחקרים שביססו את תקפות הבדיקה ויעילותה== | ||
| − | במחקר פרוספקטיבי | + | במחקר פרוספקטיבי ורב-מרכזי{{הערה|שם=הערה3}} שפורסם ב-JAMA Surgery נבחנו 191 קשריות של 183 מטופלים שסווגו כבעלות דרגת ממאירות בלתי ניתנת לקביעה (Bethesda III/IV). תוצאות בדיקת Afirma GSC הושוו לאבחנה ההיסטופתולוגית (Histopathologic) באופן כפול-סמיות. שכיחות הממאירות בקבוצה זו על פי הבדיקה ההיסטופתולוגית הייתה 24 אחוזים. במחקר דווח ערך ניבוי שלילי של 96 אחוזים לבדיקת ה-Afirma GSC. כלומר, הסיכון שדגימה שנקבעה כשפירה בבדיקת Afirma תהיה בעצם ממאירה הוא פחות מ-4 אחוזים. סיכון זה דומה לסיכון לטעות בתשובה ציטולוגית (כשדגימה שנקבעה בציטולוגיה כשפירה תהיה בעצם ממאירה) שעומד על 6–7 אחוזים{{הערה|שם=הערה3}}. הנחיות עדכניות ממליצות תמיד להמשיך במעקב קליני והדמייתי גם בקשרים בעלי סיכון נמוך לממאירות{{הערה|שם=הערה1}}{{הערה|שם=הערה2}}. |
| − | 13 מחקרי מעקב קליני עצמאיים דיווחו על הניסיון עם בדיקת Afirma במסגרת עולם אמיתי. מחקרי העולם האמיתי אימתו את אמינות הבדיקה. תוצאות המחקרים הציגו ערך ניבוי שלילי (NPV) גבוה של של 96–100 אחוזים. המחקרים הדגימו גם כי כשני שלישים (67 | + | 13 מחקרי מעקב קליני עצמאיים דיווחו על הניסיון עם בדיקת Afirma במסגרת עולם אמיתי. מחקרי העולם האמיתי אימתו את אמינות הבדיקה. תוצאות המחקרים הציגו ערך ניבוי שלילי (Negative Predective Value ,NPV) גבוה של של 96–100 אחוזים. המחקרים הדגימו גם כי כשני שלישים (67 אחוזים) בממוצע מהדגימות מסווגות באמצעות בדיקת Afirma GSC כשפירות, וכשני שלישים (65 אחוזים) מהקשריות שסווגו כחשודות לממאירות בבדיקת Afirma נמצאו חיוביות לממאירות או NIFTP{{כ}} (Non-Invasive Follicular Thyroid neoplasm with Papillarylike nuclear features) בבדיקה פתולוגית לאחר הניתוח{{הערה|שם=הערה5|Harrell, R.M., et al., Statistical Comparison of Afirma GSC and Afirma GEC Outcomes in a Community Endocrine Surgical Practice: Early Findings. Endocr Pract, 2019. 25(2): p. 161-164.2. }}{{הערה|שם=הערה6|Endo, M., et al., Afirma Gene Sequencing Classifier Compared with Gene Expression Classifier in Indeterminate Thyroid Nodules. Thyroid, 2019. 29(8): p. 1115-1124.3. }}{{הערה|שם=הערה7|Angell, T.E., et al., Independent Comparison of the Afirma Genomic Sequencing Classifier and Gene Expression Classifier for Cytologically Indeterminate Thyroid Nodules. Thyroid, 2019. 29(5): p. 650-656.4. }}{{הערה|שם=הערה8|San Martin, V.T., et al., Real-world Comparison of Afirma GEC and GSC for the Assessment of Cytologically Indeterminate Thyroid Nodules. J Clin Endocrinol Metab, 2020. 105(3).5. }}{{הערה|שם=הערה9|Wei, S., et al., Performance of the Afirma genomic sequencing classifier versus gene expression classifier: An institutional experience. Cancer Cytopathol, 2019. 127(11): p. 720-724.6. }}{{הערה|שם=הערה10|Andrioli, M., et al., Testing for Afirma in Thyroid Nodules with High-Risk Indeterminate Cytology (TIR3B): First Italian Experience. Endocr Pathol, 2020. 31(1): p. 46-51.7. }}{{הערה|שם=הערה11|Geng, Y., J.S. Aguilar-Jakthong, and N.A. Moatamed, Comparison of Afirma Gene Expression Classifier with Gene Sequencing Classifier in indeterminate thyroid nodules: A single-institutional experience. Cytopathology, 2021. 32(2): p. 187-191.8. }}{{הערה|שם=הערה12|Livhits, M.J., et al., Effectiveness of Molecular Testing Techniques for Diagnosis of Indeterminate Thyroid Nodules: A Randomized Clinical Trial. JAMA Oncol, 2021. 7(1): p. 70-77.9. }}{{הערה|שם=הערה13|Gortakowski, M., K. Feghali, and I. Osakwe, Single Institution Experience with Afirma and Thyroseq Testing in Indeterminate Thyroid Nodules. Thyroid, 2021. 31(9): p. 1376-1382.10. }}{{הערה|שם=הערה14|Zhang, L., et al., Performance of Afirma genomic sequencing classifier vs gene expression classifier in Bethesda category III thyroid nodules: An institutional experience. Diagn Cytopathol, 2021. 49(8): p. 921-927.11. }}{{הערה|שם=הערה15|Polavarapu, P., et al., Comparison of Afirma GEC and GSC to Nodules Without Molecular Testing in Cytologically Indeterminate Thyroid Nodules. J Endocr Soc, 2021. 5(11): p. bvab148.12. }}{{הערה|שם=הערה16|Babazadeh, N.T., et al., Thyroid nodule molecular profiling: The clinical utility of Afirma Xpression Atlas for nodules with Afirma Genomic Sequencing Classifier-suspicious results. Surgery, 2022. 171(1): p. 155-159.13. }}{{הערה|שם=הערה17|Yang, Z., et al., Performance of Afirma Gene Sequencing Classifier versus Gene Expression Classifier in thyroid nodules with indeterminate cytology. J Am Soc Cytopathol, 2022. 11(2): p. 74-78.14. Goffredo et al., Hürthle cell carcinoma: a population-level analysis of 3311 patients. Cancer, 2013. 119(3): p. 504-511.100% }}. |
הבדיקה נמצאת בשימוש רחב בארצות הברית. בישראל היא מוצעת לרכישה באופן פרטי בעלות של 3,200 דולר. קיימים כיסויים דרך ביטוחים משלימים של קופות החולים וחברות ביטוח פרטי. חברת כצט משווקת את הבדיקה בישראל. | הבדיקה נמצאת בשימוש רחב בארצות הברית. בישראל היא מוצעת לרכישה באופן פרטי בעלות של 3,200 דולר. קיימים כיסויים דרך ביטוחים משלימים של קופות החולים וחברות ביטוח פרטי. חברת כצט משווקת את הבדיקה בישראל. | ||
| − | מרבית בתי החולים בישראל מציעים את השירות. הבדיקה מבוצעת | + | מרבית בתי החולים בישראל מציעים את השירות. אחד המרכזים בהם הבדיקה מבוצעת בארץ היא המכון האנדוקריני באיכילוב במסגרת מרפאת על-קול וניקורים של קשרים בבלוטת התריס. |
==פרוגנוזה== | ==פרוגנוזה== | ||
בעזרת השימוש בבדיקת Afirma נמנעים ניתוחים מיותרים של כריתת בלוטת התריס בחולים עם קשרים שפירים שבבדיקה ציטולוגית לא ניתן היה לקבוע את מידת הממאירות שלהם, ובכך נמנע הסבל הכרוך בהחלמה מניתוח וסיבוכיו. | בעזרת השימוש בבדיקת Afirma נמנעים ניתוחים מיותרים של כריתת בלוטת התריס בחולים עם קשרים שפירים שבבדיקה ציטולוגית לא ניתן היה לקבוע את מידת הממאירות שלהם, ובכך נמנע הסבל הכרוך בהחלמה מניתוח וסיבוכיו. | ||
| − | נסייג כי עד | + | נסייג כי עד ספטמבר 2022, עלותה הגבוהה של הבדיקה הופכת אותה לפחות זמינה לציבור הרחב של המטופלים. התקווה היא שעם התקדמות הטכנולוגיה והעלייה בהיקפי השימוש, עשוי המחיר לרדת. |
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| שורה 68: | שורה 67: | ||
* [http://www.irisyaish.co.il/endocrinology/בדיקת-אפירמה-לצורך-הערכה-של-קשרים-בבלו/ לאתר של ד"ר יעיש] | * [http://www.irisyaish.co.il/endocrinology/בדיקת-אפירמה-לצורך-הערכה-של-קשרים-בבלו/ לאתר של ד"ר יעיש] | ||
| − | {{ייחוס|ד"ר איריס יעיש - מומחית | + | {{ייחוס|ד"ר איריס יעיש - מומחית ברפואה פנימית ואנדוקרינולוגיה, מנהלת מערך בריאות טרנסג'נדרים באיכילוב}} |
<center>'''גרסה ראשונה של מאמר זה פורסמה בכתב העת לרפואת המשפחה, דצמבר 2015, גיליון מס' 184, מדיקל מדיה'''</center> | <center>'''גרסה ראשונה של מאמר זה פורסמה בכתב העת לרפואת המשפחה, דצמבר 2015, גיליון מס' 184, מדיקל מדיה'''</center> | ||
גרסה אחרונה מ־19:42, 27 בספטמבר 2022
| בדיקת אפירמה של בלוטת התריס | ||
|---|---|---|
| Afirma test for the evaluation of the thyroid gland | ||

| ||
| שמות נוספים | בדיקת אפירמה לצורך הערכה של קשריות בבלוטת התריס עם ציטולוגיה לא חד משמעית Afirma test for evaluation of thyroid nodules with ambiguous cytology |
|
| ICD-10 | Chapter C 73.{{{3}}}, Chapter D 34.{{{3}}}, Chapter E 04.1, Chapter E 04.2 | |
| ICD-9 | 226
, 241.0 |
|
| MeSH | D016606 | |
| יוצר הערך | ד"ר איריס יעיש | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – בלוטת התריס, בדיקת אפירמה
העדויות התומכות בשימוש בבדיקת Afirma באלגוריתם המעקב והטיפול אחר חולים עם קשריות בבלוטת התריס כוללות: מחקרי תיקוף פרוספקטיביים (Prospective) רב-מרכזיים כפולי-סמיות, סדרת מחקרים לתיקוף אנליטי של הבדיקה, ועשרות מחקרי עולם אמיתי שסיכמו את הניסיון עם הבדיקה במסגרת קלינית. הדור הראשון של הבדיקה Afirma GEC (Gene Expression Classifier) הפך זמין מסחרית בסוף 2010. נכון ל-2022, נעשה שימוש בדור השני של הבדיקה: Afirma GSC (Gene Sequencing Classifier). כ-66 אחוזים מהחולים עם אבחנה של ציטולוגיה (Cytology) לא חד-משמעית נמצאו עם תוצאה שפירה[1] ברמת ודאות גבוהה מ-96 אחוזים בבדיקת Afirma[2]. יותר מ-94 אחוזים מהחולים שהנגע שלהם נמצא שפיר על ידי בדיקת Afirma GSC, לא הופנו לניתוח כריתת הבלוטה ולחלופין הופנו למעקב קליני והדמייתי בלבד[1].
רקע
קשרים בבלוטת התריס/מגן (Thyroid) הם שכיחים מאוד. הם מתגלים בכ-20–25 אחוזים בבדיקות על-קול (Ultrasound) ושכיחים יותר בנשים ועם העלייה בגיל. עם עליית היקפי השימוש בבדיקת על-קול של הצוואר, גובר בהתאמה הצורך בניהול מקרי חולים שלהם קשרים בבלוטת התריס.
החשיבות הקלינית של הערכת קשרים בבלוטת התריס היא לצורך שלילת ממאירות בבלוטה, אשר שכיחה ב-4–6.5 אחוזים מהקשרים, וזו נעשית באמצעות FNA (Fine Needle Aspiration).
ב-15–30 אחוזים מהדגימות שנשלחות לאבחנה ציטולוגית בעזרת FNA אי אפשר לקבוע כמקובל באמצעות בדיקה מיקרוסקופית את מידת הממאירות של הקשרית, והתוצאה הציטולוגית מוגדרת "חשודה" או "בעלת סיכון לא מוגדר" (Bethesda III/IV).
תוצאה זו משמעותה שאי אפשר לקבוע את מידת הממאירות של הקשרית על סמך דגימת תאים (ציטולוגיה), אלא נחוצה הקשרית בשלמותה (פתולוגיה). החלטות קליניות לגבי מטופלים עם תוצאה ציטולוגית זו אינן קלות, ובמרבית המקרים הללו יופנה החולה לביצוע ניתוח אבחנתי הכולל כריתה חלקית של בלוטת התריס, וזאת למרות העובדה שב-70–80 אחוזים מהמקרים הקשרים נמצאים שפירים לאחר הניתוח[3][4].
אפירמה - Afirma
שיטות ציטוגנטיות (Cytogenetic) מורכבות הפכו לנגישות יותר, והן תופסות מקום מרכזי בניהול המטופל בכל תחומי הרפואה. בתחום בלוטת התריס בדיקות גנומיות, דוגמת בדיקת Afirma, נעשו מקובלות, והן נכללות בהנחיות הקליניות של האיגודים המקצועיים המובילים. מאמר זה יתאר את השיטה, יתרונותיה וחסרונותיה, ואת מיקומה בטיפול מיטבי במטופלים בעלי קשרים חשודים בבלוטת התריס.
Afirma GSC היא בדיקה גנומית אבחנתית המיועדת לשלילת סיכון לסרטן במטופלים עם קשריות בבלוטת התריס, שמידת ממאירותן אינה ניתנת לקביעה בציטולוגיה (Indeterminate cytology). מידע זה יכול לסייע לרופאים ולחולים במניעת ניתוח לכריתת בלוטת התריס שאינו מחויב המציאות.
בדיקת Afirma פותחה ומבוצעת על ידי חברת Veracyte (San Francisco, California). הבדיקה עושה שימוש בטכנולוגיה לריצוף RNA (Ribonucleic acid) של ה-Transcriptome התאי בקשרית החשודה לממאירות. הטכנולוגיה מאפשרת לבחון ביטוי של גנים (Genes), שינויים ברצף הגנומי, אובדן הטרוזיגוטיות (Heterozygosity) וגנום מיטוכונדריאלי (Mitochondrial genome). במבנה הבדיקה נבחן סט ראשוני של ממצאים הכולל רקמת Parathyroid וממצאים המעידים על סיכון מוגבר לממאירות, ביניהם: Medullary thyroid cancer ושונויות גנטיות בעלות קשר גבוה לסרטן תירואיד מסוג פפילרי [ביניהן וריאנט BRAF V600 ופיוז'נים (Fusion) מסוג,RET/PTC1 RET/PTC3]. בשלב הבא של הבדיקה נבחן ביטוי של למעלה מ-10 אלף גנים, המאפשר לסווג את הקשרית כשפירה ברמת ודאות גבוהה מ-96 אחוזים או חשודה לממאירות[2].
Afirma Xpression Atlas – פאנל הכלול בבדיקת אפירמה, בוחן שונויות גנומיות עם קשר לסרטן בלוטת התריס. הוא מיועד לקשריות שלאחר אבחנה שאינה חד-משמעית בבדיקה הציטולוגית סווגו כחשודות לממאירות בבדיקת Afirma GSC, וכן לקשריות שאובחנו בסיווג Bethesda V/VI (חשודות לממאירות או ממאירות). פאנל XA מספק מידע לגבי הימצאות וריאנטים ופיוז'נים גנומיים הקשורים בסרטן בלוטת התריס בתאי דגימת הקשרית. ממצאים אלו תורמים מידע בעל משמעות קלינית ומאפשרים התאמת טיפול אישי. באמצעותם ניתן לדייק את רמת הסיכון לממאירות בקשריות לאחר אבחנה ציטולוגית שאינה חד-משמעית, לאפיין את סוג הגידול, ולהתאים טיפולים תרופתיים מכוונים בגידולים מפושטים.
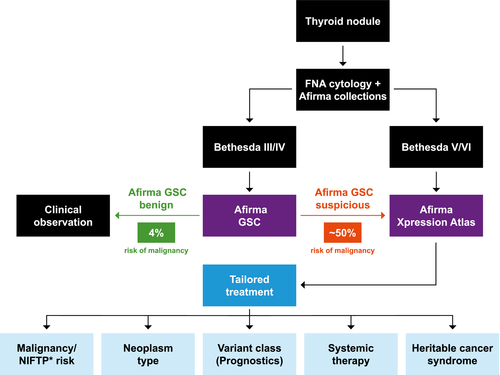
כפי שניתן לראות בתרשים, ניתן לשקול את ביצוע הבדיקה כאשר תוצאת בדיקת ה-FNA בקשרית מצביעה על כך שאין דרך לקבוע בוודאות את דרגת ממאירותה. בחולים עם דגימות FNA שנקבעו שפירות (בתסדה 2) או ממאירות בציטולוגיה (Bethesda V/VI), או במקרים שאין די תאים לקביעת האבחנה (Bethesda I), לא נוכל להסתייע בשיטה הציטוגנטית.
חולים שקיבלו תשובה של Indeterminate (Bethesda III/IV) על פי הציטולוגיה, נשלחים לרוב לניתוח להסרת הבלוטה ונאלצים להתמודד, לשארית חייהם, עם מצב כרוני הדורש טיפול. לפי הספרות והניסיון המצטבר, רוב החולים שמקבלים תשובה המעידה על סיכון נמוך לממאירות לפי בדיקת Afirma, נמנעים מביצוע ניתוח ובכך נמנעים סבל מיותר, סיבוכים פוטנציאליים מהניתוח ועלויות למערכת.
מחקרים שביססו את תקפות הבדיקה ויעילותה
במחקר פרוספקטיבי ורב-מרכזי[2] שפורסם ב-JAMA Surgery נבחנו 191 קשריות של 183 מטופלים שסווגו כבעלות דרגת ממאירות בלתי ניתנת לקביעה (Bethesda III/IV). תוצאות בדיקת Afirma GSC הושוו לאבחנה ההיסטופתולוגית (Histopathologic) באופן כפול-סמיות. שכיחות הממאירות בקבוצה זו על פי הבדיקה ההיסטופתולוגית הייתה 24 אחוזים. במחקר דווח ערך ניבוי שלילי של 96 אחוזים לבדיקת ה-Afirma GSC. כלומר, הסיכון שדגימה שנקבעה כשפירה בבדיקת Afirma תהיה בעצם ממאירה הוא פחות מ-4 אחוזים. סיכון זה דומה לסיכון לטעות בתשובה ציטולוגית (כשדגימה שנקבעה בציטולוגיה כשפירה תהיה בעצם ממאירה) שעומד על 6–7 אחוזים[2]. הנחיות עדכניות ממליצות תמיד להמשיך במעקב קליני והדמייתי גם בקשרים בעלי סיכון נמוך לממאירות[3][4].
13 מחקרי מעקב קליני עצמאיים דיווחו על הניסיון עם בדיקת Afirma במסגרת עולם אמיתי. מחקרי העולם האמיתי אימתו את אמינות הבדיקה. תוצאות המחקרים הציגו ערך ניבוי שלילי (Negative Predective Value ,NPV) גבוה של של 96–100 אחוזים. המחקרים הדגימו גם כי כשני שלישים (67 אחוזים) בממוצע מהדגימות מסווגות באמצעות בדיקת Afirma GSC כשפירות, וכשני שלישים (65 אחוזים) מהקשריות שסווגו כחשודות לממאירות בבדיקת Afirma נמצאו חיוביות לממאירות או NIFTP (Non-Invasive Follicular Thyroid neoplasm with Papillarylike nuclear features) בבדיקה פתולוגית לאחר הניתוח[5][6][7][8][9][10][11][12][13][14][15][16][17].
הבדיקה נמצאת בשימוש רחב בארצות הברית. בישראל היא מוצעת לרכישה באופן פרטי בעלות של 3,200 דולר. קיימים כיסויים דרך ביטוחים משלימים של קופות החולים וחברות ביטוח פרטי. חברת כצט משווקת את הבדיקה בישראל.
מרבית בתי החולים בישראל מציעים את השירות. אחד המרכזים בהם הבדיקה מבוצעת בארץ היא המכון האנדוקריני באיכילוב במסגרת מרפאת על-קול וניקורים של קשרים בבלוטת התריס.
פרוגנוזה
בעזרת השימוש בבדיקת Afirma נמנעים ניתוחים מיותרים של כריתת בלוטת התריס בחולים עם קשרים שפירים שבבדיקה ציטולוגית לא ניתן היה לקבוע את מידת הממאירות שלהם, ובכך נמנע הסבל הכרוך בהחלמה מניתוח וסיבוכיו.
נסייג כי עד ספטמבר 2022, עלותה הגבוהה של הבדיקה הופכת אותה לפחות זמינה לציבור הרחב של המטופלים. התקווה היא שעם התקדמות הטכנולוגיה והעלייה בהיקפי השימוש, עשוי המחיר לרדת.
ביבליוגרפיה
- Afirma coverage CMS database 2012
- ↑ 1.0 1.1 1.2 Syed Z Ali, et al. Extending Expressed RNA Genomics From Surgical Decision Making for Cytologically Indeterminate Thyroid Nodules to Targeting Therapies for Metastatic Thyroid Cancer. Cancer Cytopathol .2019 Jun;127(6):362-369. doi: 10.1002/cncy.22132. Epub 2019 Apr 24.
- ↑ 2.0 2.1 2.2 2.3 Kepal N. Patel, MD1; Trevor E. Angell, MD2; Joshua Babiarz, PhD3; et al Performance of a Genomic Sequencing Classifier for the Preoperative Diagnosis of Cytologically Indeterminate Thyroid Nodules JAMA Surg. 2018;153(9):817-824. doi:10.1001/jamasurg.2018.1153
- ↑ 3.0 3.1 Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19(11):1167-214.
- ↑ 4.0 4.1 Wang C, Friedman L, Kennedy GC, et al. A Large Multicenter Correlation Study of Thyroid Nodule Cytopathology and Histopathology. Thyroid 2011;21(3):243-251.
- ↑ Harrell, R.M., et al., Statistical Comparison of Afirma GSC and Afirma GEC Outcomes in a Community Endocrine Surgical Practice: Early Findings. Endocr Pract, 2019. 25(2): p. 161-164.2.
- ↑ Endo, M., et al., Afirma Gene Sequencing Classifier Compared with Gene Expression Classifier in Indeterminate Thyroid Nodules. Thyroid, 2019. 29(8): p. 1115-1124.3.
- ↑ Angell, T.E., et al., Independent Comparison of the Afirma Genomic Sequencing Classifier and Gene Expression Classifier for Cytologically Indeterminate Thyroid Nodules. Thyroid, 2019. 29(5): p. 650-656.4.
- ↑ San Martin, V.T., et al., Real-world Comparison of Afirma GEC and GSC for the Assessment of Cytologically Indeterminate Thyroid Nodules. J Clin Endocrinol Metab, 2020. 105(3).5.
- ↑ Wei, S., et al., Performance of the Afirma genomic sequencing classifier versus gene expression classifier: An institutional experience. Cancer Cytopathol, 2019. 127(11): p. 720-724.6.
- ↑ Andrioli, M., et al., Testing for Afirma in Thyroid Nodules with High-Risk Indeterminate Cytology (TIR3B): First Italian Experience. Endocr Pathol, 2020. 31(1): p. 46-51.7.
- ↑ Geng, Y., J.S. Aguilar-Jakthong, and N.A. Moatamed, Comparison of Afirma Gene Expression Classifier with Gene Sequencing Classifier in indeterminate thyroid nodules: A single-institutional experience. Cytopathology, 2021. 32(2): p. 187-191.8.
- ↑ Livhits, M.J., et al., Effectiveness of Molecular Testing Techniques for Diagnosis of Indeterminate Thyroid Nodules: A Randomized Clinical Trial. JAMA Oncol, 2021. 7(1): p. 70-77.9.
- ↑ Gortakowski, M., K. Feghali, and I. Osakwe, Single Institution Experience with Afirma and Thyroseq Testing in Indeterminate Thyroid Nodules. Thyroid, 2021. 31(9): p. 1376-1382.10.
- ↑ Zhang, L., et al., Performance of Afirma genomic sequencing classifier vs gene expression classifier in Bethesda category III thyroid nodules: An institutional experience. Diagn Cytopathol, 2021. 49(8): p. 921-927.11.
- ↑ Polavarapu, P., et al., Comparison of Afirma GEC and GSC to Nodules Without Molecular Testing in Cytologically Indeterminate Thyroid Nodules. J Endocr Soc, 2021. 5(11): p. bvab148.12.
- ↑ Babazadeh, N.T., et al., Thyroid nodule molecular profiling: The clinical utility of Afirma Xpression Atlas for nodules with Afirma Genomic Sequencing Classifier-suspicious results. Surgery, 2022. 171(1): p. 155-159.13.
- ↑ Yang, Z., et al., Performance of Afirma Gene Sequencing Classifier versus Gene Expression Classifier in thyroid nodules with indeterminate cytology. J Am Soc Cytopathol, 2022. 11(2): p. 74-78.14. Goffredo et al., Hürthle cell carcinoma: a population-level analysis of 3311 patients. Cancer, 2013. 119(3): p. 504-511.100%
קישורים חיצוניים
- בדיקת אפירמה לצורך הערכה של קשרים בבלוטת התריס עם ציטולוגיה לא חד-משמעית, מדיקל מדיה
- לאתר של ד"ר יעיש
המידע שבדף זה נכתב על ידי ד"ר איריס יעיש - מומחית ברפואה פנימית ואנדוקרינולוגיה, מנהלת מערך בריאות טרנסג'נדרים באיכילוב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק