בדיקת Gamma hydroxybutyric acid
| מדריך בדיקות מעבדה | |
| בדיקת gamma-Hydroxybutyric acid | |
|---|---|
| שמות אחרים | .GHB, sodium oxybate, 4-hydroxybutanoic acid, γ-Hydroxybutyric acid |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | מדידת תכשירים העלולים לגרום נזק חמור עד כדי תמותה |
| טווח ערכים תקין | בדם: 0.17-1.51 מיליגרם/ליטר; בשתן: 0.34-5.7 מיליגרם/ליטר |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
זיהוי וכימות של GHB בנוזלי הגוף בחקירה מדיקו-לגלית של מקרי אונס, ותרחישים פליליים אחרים, כמו גם כחומר פסיכו-אקטיבי.
תכונות פיזיולוגיות של GHB
מבחינת המבנה שלו, GHB היא חומצת שומן קצרת-שרשרת (Zvosec וחב' ב-Sleep Med משנת 2009). GHB הוא נוירוטרנסמיטור וחומר פסיכו-אקטיבי טבעי של הגוף, המשמש כקודמן (precursor) של GABA, של גלוטמאט, ושל גליצין באזורי מוח מסוימים. הוא פועל על קולטן ייחודי, והוא אגוניסט חלש של הקולטן GABAB. GHB שימש ברפואה כחומר מרדים, וכטיפול בתופעות כגון cataplexy שהיא הופעה פתאומית וחולפת של חולשת שרירים המלווה בהכרה מלאה, אשר בדרך כלל נגרמת מרגשות כמו צחוק, בכי, או פחד, כטיפול ב-narcolepsy (ישנוניות-יתר בשעות היום) (Mayer ב-Exp Rev Neurotherap משנת 2012), או באופן נדיר יותר לטיפול באלכוהוליזם (Benzer ב-eMedicine משנת 2007, Keating ב-Clin Drug Invest משנת 2014, ו-Caputo וחב' ב-Eur Rev Med Pharmacol Sci משנת 2015). עם זאת, אין ודאות ביתרון של GHB על פרמקותרפיות אחרות לטיפול בתלות באלכוהול (Leone וחב' ב-Cochrane Database Systemic Rev משנת 2010). GHB משמש בעיקר באופן בלתי חוקי כמשפר ביצועי אתלטים, כסם אונס, או חומר בשעות בילוי ושעשוע. GHB משמש בצורת המלח שלו, כמו sodium-GHB הידוע כ-Xyrem, או בצורת מלח האשלגן שלו GHB .(KGHB) נוצר גם על ידי תסיסה ומופיע במשקאות כבירה ומספר יינות, בבשר בקר ובפירות הדר קטנים (Weil ו-Winifred ב-Depressants משנת 1993).
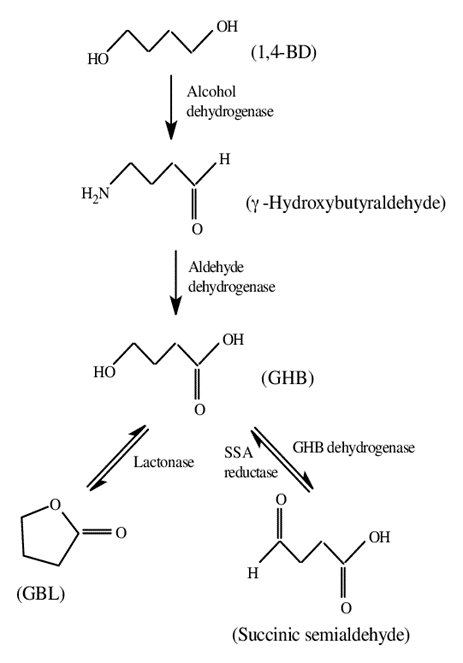
במפגע של חסר האנזים succinic semialdehyde dehydrogenase מוצאים הצטברות של GBH בדם. לעיתים משמש GHB לטיפול off-label בפיברומיאלגיה (Calandre וחב' ב-Expert Opin Pharmacother משנת 2015, ו-Staud באותו כתב עת משנת 2011). בארצות הברית יש אישור לשימוש ב-sodium oxybate ) xyrem) במצב משולב של קטפלקסיה ונרקולפסיה (Scrima וחב' ב-Sleep משנת 1990), GHB נמצא מגביר באופן אמין את שינת slow-wave (Scrima וחב' ב-Sleep Res משנת 1991, Van Cauter וחב' ב-J Clin Invest משנת 1997, ו-Scrima ו-Shander ב-N Eng J Med משנת 1991). כן נמצא ש-GHB מקטין את הנטייה לשינת REM. ה-FDA נתן אישור לשימוש ב-Xyrem לאחר שהוכח שתכשיר זה אינו טרטוגני, קרצינוגני או הפאטוקסי (Guiraud וחב' ב-Eur Neuropsychopharmacol משנת 2021), היתרונות הבטיחותיים שלו על אתנול, מסבירים מדוע GHB ממשיך להיחקר כמועמד להחליף אלכוהול (Nutt וחב' ב-Lancet משנת 2007). אנליזה של GHB כתכשיר של פנאי ובילוי (recreational) מבחינת הנזק הכרוך בו בהשוואה לעוד 19 תכשירים המשמשים למטרה דומה, מציבה את GHB במקום ה-15 מבחינת התלות שהוא מפתח, במקום ה-19 מבחינת הנזק הפיזי, ובמקום ה-14 מבחינת הנזק החברתי (Schep וחב' ב-Clin Toxicol משנת 2012). למטה תרשים של המטבוליזם של GHB:
GHB מהווה סַם הַרְגָּעָה ב-CNS ומשמש כחומר מְשַׁכֵּר (Galloway וחב' ב-Alcohol משנת 2000). השפעותיו מושוות לאלו של אלכוהול ושל methylenedioxymethamphetamine (להלן MDMA) או של ecstasy ליצירת אאופוריה, חוסר עכבות, ליבידו מוגבר, ועידוד אמפתיה בין-אישית. במינונים גבוהים GHB עשוי לגרום לבחילות, טשטוש, הִתְרַגְּשׁוּת, הִתְנַמְנְמוּת, הפרעות ראייה, נשימה מדוכאת, אמנזיה, איבוד הכרה ומוות. צריכה במקביל של GHB עם תכשירי הרגעה אחרים כאלכוהול או בנזודיאזפינים, עלולה לגרום להשפעה סינרגיסטית שכן כולם נקשרים לקולטן GABA. השפעת GHB יכולה להימשך בין 1.5 ל-4 שעות, או אף יותר מכך אם המינון שלו גבוה (Thai וחב' ב-J Clin Psychopharmacol משנת 2006). צריכה משולבת של GHB ואלכוהול עלולה לגרום לעצירת נשימה והקאות ביחד עם שינה עמוקה, מה שעלול להסתיים במוות (Busardo ו-Jones ב-Curr Neuropharmacol משנת 2006). מינון מקובל לשעת הפנאי והחברותא הוא של 1–2 גרם שמקנה תחושת אאופוריה, אך מינונים גבוהים יותר יוצרים השפעות של תפקוד מוטורי פגוע והתנמנמות. שני מלחים נוספים של GHB, נגזרות סידן ומגנזיום, זמינים אף הם אך הם מקובלים פחות ממלח הנתרן.
מספר קדם-תכשירים, כגון gamma-butyrolactone להלן GBL ו-butanediol-1,4 עוברים הסבה ל-GHB בקיבה ובצירקולציה, ואף הם בעלי תכונות טוקסיות (Jones ב-J Clin Forensic Med משנת 2001). שני החומרים הללו עלולים להיות מעורבבים עם ממסים מזיקים המיועדים לשימוש תעשייתי כגון מסירי צבע או מדללי לכה. GHB כשלעצמו חסר צבע או ריח. ועדה פרלמנטרית בריטית בדו"ח משנת 2006, קבעה שהשימוש ב-GHB מסוכן פחות מעישון טבק, או צריכת אלכוהול, מבחינת פיתוח תלות בחומר זה או מבחינת נזק חברתי (Kam ו-Yoong ב-Anaesthesia משנת 1998). החל משנות ה-90 הפך GHB לתכשיר "מועדונים חברתיים" כיוון שמינון קטן שלו נחשב אאופורייאנטי ואַפְרוֹדִיזְיָאק, המעורר תשוקה מינית (Carter ב-Drugs Alcohol dependence משנת 2009, ו-Klein ו-Kramer ב-AANA J משנת 2004, מספר אתלטים נתפסו כשהם משתמשים ב-GHB, בהיותו משווק כתכשיר אנלוגי, אם כי אין ראיות לכך שהוא בונה שרירים או משפר ביצועים.
תופעות לוואי של GHB
שילוב עם אלכוהול: באדם נמצא ש-GHB מפחית את קצב הפינוי של אלכוהול, מה שיכול להסביר את עצירת הנשימה שדווחה בשימוש משולב של השניים (Zvosec וחב' ב-Proc Am Acad Forensic Sci משנת 2006). סקירת הפרטים של 194 מקרי מוות המיוחסים ל-GHB, מצאה שהרוב הגדול של פטירות אלו נגרמו מדיכוי נשימה שנגרם על ידי האינטראקציה של GHB עם אלכוהול או עם תכשירים אחרים (Zvosec וחב' ב-Am J Emerg Med משנת 2011). מדידת רמת GHB בדמם של נפטרים מצריכת התכשיר העלתה תחום מאוד רחב של 18-4,400 מיליגרם לליטר. GHB אנדוגני מיוצר בגוף בריכוזים מאוד קטנים, ורמתו בדם במדידות שלאחר המוות הן בתחום בין 30–50 מיליגרם/ליטר (Sircar ו-Basak ב-Pharmacol Biochem Behaviour משנת 2004).
נוירוטוקסיות: במחקרים אחדים נמצא ש-GHB פוגע בזיכרון מרחבי, בזיכרון בעבודה, בלמידה ובזיכרון כללי בחולדות המוזרקות כרונית עם GHB (Garcia וחב' ב-Psicothema משנת 2006, Sircar וחב' ב-Ann NY Acad Sci משנת 2008, ו-Sgaravatti וחב' ב-Neurochem Int משנת 2007). השפעות אלו כנראה כרוכות עם הירידה בביטוי של הקולטן ל-NMDA בקליפת המוח וכנראה גם באזורי מוח אחרים. בנוסף, הנזק נגרם על ידי עקה חמצונית (Sgaravatti וחב' ב-Metabolic Brain Dis משנת 2007, ו-Galloway וחב' ב-Addiction משנת 1997). כמות ה-GHB שנמצאת ביין אינה משמעותית מבחינה פרמקולוגית לגרום להשפעה פסיכו-אקטיבית (Elliott ו-Burgess ב-Forensic Sci Int משנת 2005).
למטה מופיעה האזהרה של ה-FDA לגבי הטוקסיות של GHB:
התמכרות: היו מספר דיווחים של מקרי מוות כתוצאה מגמילה מ-GHB. התמכרות מתפתחת כאשר שימוש מתמיד בתכשיר פוגע בשווי המשקל הנורמלי של תהליכים מוחיים המבקרים בתגמול, בזיכרון ובקוגניציה, מה שמאלץ את המשתמש לחזור ולצרוך את התכשיר באופן כפייתי (Colombo וחב' ב-Eur J Pharmacol משנת 1995).
גמילה מ-GHB: חומר זה כרוך בתסמונת גמילה המתבטא בנדודי שינה, דאגנות, ורעד, המתפוגגים בדרך כלל תוך 3–21 יום (Santos ו-Olmedo ב-Emerg MedPract משנת 2017). לעיתים תסמונת הגמילה עלולה להיות חמורה עד כדי אשפוז ביחידת טיפול נמרץ. במקרים האחרונים הטיפול הוא במתן benzodiazepines לשליטה על הזיות חריפות, לעיתים עד כדי מתן למעלה מ-100 מיליגרם ביום של diazepam. גם טיפול עם baclofen הוצע כטיפול חלופי לבנזודיאזפינים על בסיס נתוני ניסויים בחיות (LeTourneau וחב' ב-Neurocritical Care משנת 2008). baclofen הוצע לראשונה לטיפול בגמילה מ-GHB כיוון שבנזודיאזפינים אינם משפיעים על קולטני GABAB בניגוד ל-baclofen (van Noorden וחב' ב-Gen Hosp Psychiat משנת 2009).
מנת-יתר של GHB: הטיפול בצריכת מנת יתר של GHB עלול להיות קשה בגלל ההשפעות המרובות של GHB בגוף (Michael ו-Harrison ב-Emerg Med J משנת 2005). GHB נוטה לגרום לאיבוד הכרה מהיר במינון שמעל 3,500 מיליגרם, כאשר מינון בודד של מעל 7,000 מיליגרם יכול לגרום להפסקת נשימה מסכנת חיים, ומנות גבוהות עוד יותר עלולות להאט קצב לב עד כדי הפסקת פעולת הלב. תופעות לוואי נוספות כוללות פרכוסים, ובחילות והקאות. הסיכון הגדול במינון יתר של GHB הוא הפסקת הנשימה (Carai וחב' ב-Ann Emerg Med משנת 2005). גורמים שכיחים יחסית למוות מתאונות GHB כולל בליעת קיא, השתנקות תנוחתית, ותאונות דרכים בנהיגה תחת השפעת התכשיר.
סינתזה אנדוגנית של GHB
תאים מייצרים GHB על ידי חיזור של succinic semialdehyde על ידי האנזים reductase. אנזים זה מושרה על ידי רמות cAMP מוגברות (Kemmel וחב' ב-Neurosci משנת 1998), דהיינו חומרים המגבירים רמת cAMP כגון forskolin ו-vincopetin יכולים להגביר את הסינתזה של GHB ואת הפרשתו לדם. והיפוכו של דבר, יצירה אנדוגנית של GHB באלה הנוטלים חומצה ולפרואית תעוכב על ידי העיכוב של מעבר מחומצה סוקצינית ו-semialdehyde ל-GHB (Loscher ב-Antiepileptic Drugs משנת 2002). אלה עם מפגע הידוע כחסר של-succinic semialdehyde dehydrogenase הם בעלי רמות מוגברות של GHB בשתן, בפלזמת הדם ובנוזל השדרה. התפקוד המדויק של GHB בגוף אינו ברור, אך ידוע לדוגמה שהמוח מבטא מספר גדול של קולטנים המשופעלים על ידי GHB (Andriamampandry וחב' ב-FASEB J משנת 2003). קולטנים אלה הם מעוּררים מטבעם ולכן אינם אחראיים להשפעות המרגיעות של GHB, אך הם נמצאו מגבירים את פעילות הנוירוטרנסמיטור המעורר העיקרי glutamate (Castelli וחב' ב-J Neurochem משנת 2003). תכשירים אנטי-פסיכוטיים אחרים ממשפחת הבנזאמידים, כגון amisulpride ו-nemonapride נמצאו נקשרים in vivo לקולטנים המשופעלים על ידי GHB (Maitre וחב' ב-Eur J Pharmacology משנת 1994). כאמור, GHB הוא הקודמן של GABA של גלוטמאט ושל גליצין באזורי מוח שונים (Gobaille וחב' ב-J Pharmacol Exp Ther משנת 1999), ולמרות הנוירו-טוקסיות המודגמת של GHB, יש לו גם תכונות המגינות על תאים בכך שהוא מונע היפוקסיה (Ottani וחב' ב-Brain Res משנת 2003).
פרמקולוגיה: ל-GHB יש שני אתרי קישור נפרדים ב-CNS (Wu וחב' ב-Neuropharmacology משנת 2004). GHB פועל כאגוניסט בקולטן המעכב שלו (Cash וחב' ב-Biochem Pharmacol משנת 1999) ופועל כאגוניסט חלש בקולטן המעכב של GABA (Maitre וחב' ב-Medecine/Sciences משנת 2005). GHB פועל במוח יונקים בדומה לנוירוטרנסמיטורים אחדים (Waszkielewicz ו-Bojarski ב-Polish J Pharmacol משנת 2004). GHB מסונתז כנראה מ-GABA בנוירונים GABAnergic והוא נמצא משפעל נוירונים אוקסיטוסינרגיים ב-supraoptic nucleus (McGregor וחב' ב-Br J Pharmacol משנת 2008). GHB משרה את ההצטברות של נגזר של טריפטופן או של טריפטופן עצמו במרחב החוץ-תאי, כנראה על ידי הגברת הטרנספורט של טריפטופן דרך מחסום דם-מוח (BBB). תכולת מספר חומצות אמינו בדם, כולל זו של טריפטופן, מוגברת על ידי החדרה היקפית של GHB. התַּחְלוּפָה (turnover) של סרוטונין ברקמות המושרית על ידית GHB, נגרמת כנראה על ידי ההגברה בטרנספורט של טריפטופן למוח, וקליטתו על ידי תאים סרוטונרגיים. כיוון שהמערכת הסרוטונגית כרוכה בשינה, במצבי רוח ובדאגנות, גירוי מערכת זו על ידי מינון גבוה של GHB עשוי להיות כרוך במספר אירועים נוירו-פרמקולוגיים המושרים על ידי צריכת GHB. עם זאת, GHB מגיע לריכוזים מוחיים גבוהים גם כשהוא ניתן במינונים תרפויטיים, וכך הוא משפעל קולטני GABAB, האחראיים להשפעותיו המרגיעות (Dimitrijevic וחב' ב-Eur J Pharmacol משנת 2005). ההשפעות המרגיעות של GHB נחסמות על ידי אנטגוניסטים של GABAB.
התפקיד של הקולטן של GHB בהשפעות ההתנהגותיות של GHB מסובך יותר. הקולטנים של GHB מרוכזים בצפיפות באזורי מוח שונים, כולל הקורטקס וההיפוקמפוס, ואלה הקולטנים אליהם נקשר GHB בזיקה גבוהה יותר. יש ראיות לכך ששפעול הקולטנים של GHB באזורי מוח מסוימים, גורם להפרשה של ,glutamate הנוירוטרנסמיטור המעורר ביותר. השפעול של הקולטן של GHB וכן שלGABAB, אחראי לפרופיל ההתמכרות ל-.GHB השפעה של GHB על שחרור דופאמין היא דו-פאזית (Hechler וחב' ב-J Neurochem משנת 1991). ריכוזי GHB נמוכים מעודדים שחרור דופאמין דרך הקולטן שלGHB (Maitre וחב' ב-J Pharmacol Exp Ther משנת 1990), ואילו ריכוזי GHB גבוהים מונעים שחרור דופאמין דרך הקולטנים של GABAB בדומה לאגוניסטים נוספים של GABAB כ-baclofen ו-phenibut (Smolders וחב' ב-Eur J Pharmacol משנת 1995). לאחר פאזה ראשונה של עיכוב, שחרור דופאמין מוגבר דרך הקולטן ל-GHB. העיכוב וההגברה של שחרור דופאמין על ידי GHB, מעוכבים על ידי אנטגוניסטים של אופיואידים כגון naloxone ו-naltrexone. התכשיר dynorphin יכול לשחק תפקיד בעיכוב של שחרור דופאמין על ידי κ opioid receptors (Mamelak וחב' ב-Neurosci Biobehav Rev משנת 1989).
נתונים אלה מסבירים את ההשפעה הפרדוקסלית של GHB שיכולה להיות מרגיעה אך גם מעוררת, כמו גם השפעת ה-rebound שלו שחווים אלה הנוטלים GHB כמסייע לשינה, כאשר הם מתעוררים פתאומית לאחר מספר שעות של שינה עמוקה. נראה שכעבור זמן מה, יורדים ריכוזי GHB מתחת לסף הנדרש לשפעול משמעותי של הקולטן ל-GABA, ואז משופעל הקולטן ל-GHB הגורם להתעוררות מהשינה.
סונתזו אנלוגים של GHB דוגמת -hydroxy-4-methylpentanoic acid4 ונוסו בבעלי חיים להבנת צורת הפעולה של GHB (Wu וחב' ב-J Pharmacol Exp Ther משנת 2003). אנלוגים של GHB דוגמת methyl-'GHB-3 כמו גם methyl-GHB4-3 וכן phenyl-GHB-1 נמצאו מייצרים השפעות דומות של GHB במספר ניסויים בחיות, מבין אנלוגים אלה, רק methyl-GHB-4 דווח כתכשיר של abuse בקרב משתמשים אחדים, אך הוא יותר טוקסי מאשר GHB ובעל נטייה לגרום לבחילה והקאות. התכשיר γ-hydroxybutyraldehyde אף הוא קודמן של GHB, אך עם זאת, כמקובל עם כל האלדהידים האליפטיים, תכשיר זה צורב ובעל ריח דוחה וטעם תפל, וגורם לבחילה והקאות.
היסטוריה
הכימאי הרוסי Alexander Zaytsev חקר את החיזור של סוקציניל כלוריד ופרסם ראשון על התוצר GHB בשנת 1874. אך רק בראשית שנות ה-60 של המאה ה-20 ביצע Henri Laborit מחקר על GHB באדם במהלך מחקריו על הנוירוטרנסמיטור GABA (על פי Laborit וחב' ב-Agressologie משנת 1960). GHN נחקר במגוון של שימושים כמו במהלך צירי לידה, או כסם מפחית חרדה. GHB נחקר לאחר עירוי ורידי לצורך הרדמה בטיפולים כירורגיים, והחל להיות משווק באירופה בשנת 1964 למטרה זו, אך לא זכה להצלחה בשל תופעות לוואי כפרכוסים, אם כי עד שנת 2006 המשיך לשמש למטרה זו באיטליה ובצרפת אם כי לא בהיקף גדול. GHB שימש לטיפול בהתמכרות לאלכוהול אף על פי שהראיות ליעילות טיפול זה חלשות. באיטליה ממשיך התכשיר sodium oxybate לשמש למניעת התמכרות האמורה (Haller וחב' ב-J Anal Toxicol משנת 2006). במאי 1990 הוצג GHB כתוסף מזון ושווק ל"בוני גוף" כתחליף לטריפטופן שהוסר בשנת 1989 מהמדפים כאשר אצוות שלו התגלו כמזוהמות (Ito וחב' ב-Food Chem Toxicol משנת 1992), ועלולות לגרום לתסמונת eosinophilic-myalgia (על פי Smith ו-Garrett ב-Inflamm Res משנת 2005). בשנת 2005 הסיר ה-FDA את האיסור על צריכת טריפטופן (Kapalka ב-Elsevier/AP). עד נובמבר 1989 נרשמו 57 מקרי תחלואה שנרשמו כתוצאה מצריכת תוספי GHB שדווחו ל-CDC על ידי נוטלי 3 כפיות GHB, שאמנם לא גרמו למוות אך תשעה מהמדגם האמור אושפזו בטיפול נמרץ (Dyer ב-Am J Emerg Med משנת 1991). בנובמבר 1990 הוכרז השימוש ב-GHB כבלתי חוקי, כשהתברר השימוש בו כסם אונס (Mason ו-Kerns ב-Acad Emerg Med משנת 2002).
תוצאות השימוש ב-GHB
GHB נצרך באופן אופייני כנוזל (Van Amsterdam וחב' ב-Neurosci Biobehav Rev משנת 2012). לאחר נטילתו באופן פומי הוא משפיע בחולדות כבר לאחר 15–30 דקות (Lettieri ו-Fung ב-J Pharmacol Exp Ther משנת 1979). ריכוזי השיא של GHB בדם מושגים תוך 25–60 שניות לאחר הנטילה (Andersen וחב' ב-Deutsch Arzteblatt Int משנת 2008 ו-Tarabar ו-Nelson ב-Toxicol Rev משנת 2004). צריכת GHB מקובלת במינון של עד 10 גרם בחלוקה למספר מנות (Ting Wong וחב' ב-Trends Pharmacol Sci משנת 2004), כאשר מנה של 2–3 גרם משרה הירדמות. צורכי GHB מדווחים על הרגשה טובה, אאופוריה, חוסר-עכבות, והגברה של קשר חברתי וליבידו (Abanades וחב' ב-J Clin Psycopharmacol משנת 2007). שלא בדומה ל-MDMA ותכשירי "מסיבות" אחרים, צריכה נשנית של GHB תוך פרקי זמן קצרים אינה נסבלת בקרב שוחרי ריקוד ומוזיקה רעשנית (Winstock וחב' ב-Drug Alcohol Dependence משנת 2001). תקופת מחצית החיים הקצרה של GHB תואמת את נטייתם של צורכי סמי מסיבות המדווחים על כך שאינם סובלים מתופעות של hungover ביום שלאחר צריכת החומר, בהשוואה לסמים אחרים בעלי אופי דומה (Brenneisen וחב' ב-J Anal Toxicol משנת 2004, ו-Palamar ו-Halkitis ב-Int J Drug Policy משנת 2006). קיים קו עדין בין השפעה טוקסית לבין נטילת מנת-יתר שאינה גורמת נזק (Aromatario וחב' ב-Forensic Sci Int משנת 2012).
בגלל הספיגה המהירה יותר של GBL ביחס ל-GHB, מנת יתר של GBL היא מסוכנת ובעייתית יותר מאשר מנת יתר של GHB או של B-1,4. תכשיר סינתטי חדש יותר, SCH-50911 הפועל כאנטגוניסט בררני של GABAB, ופועל במהירות להסב לאחור מנת יתר של GHB בעכברים, אך לא נוסה עדיין באדם.
זיהוי השימוש ב-GHB: במשתמשים ב-GHB שהגיעו לאשפוז, ניתן לכמת את ריכוז GHB בפלזמת הדם למטרה פורנזית לאחר נהיגה שהסתיימה בתאונה או מסיבות מדיקו-לגליות במקרי מוות מצריכת יתר של תכשיר זה. במטופלים שטופלו ב-GHB למטרות תרפויטיות ריכוז GHB בפלזמה 50–250 מיליגרם/ליטר, ובאלה שנעצרו בגין נהיגה פרועה ריכוז GB בפלזמה 50–500 מיליגרם/ליטר. באלה שנפטרו מצריכת יתר של GHB ריכוזו עלול להגיע ל-100-1,000 מיליגרם/ליטר. שתן בדרך כלל מועדף כדגימה למטרות שגרתיות של ניטור התכשיר. butyrolactone-γ (GBL), ו-1,4-butanediol מוסבים ל-GHB בגוף. בינואר 2016 דווח שפותחה שיטה לזיהוי GHB ברוק כנטילת דגימת גוף מהירה באתר התרחיש הנחקר.
הוראות לביצוע הבדיקה
לבדיקת GHB בשתן יש צורך ליטול דגימת שתן אקראית, בנפח של 5 מ"ל (נפח מינימלי של 2.8 מ"ל). שתן שנשמר בטמפרטורת החדר יציב למשך 48 שעות לצורך הבדיקה, או למשך 7 ימים כשהוא נשמר בקירור, או למשך 3 שבועות בהקפאה.
לבדיקת GHB בדם, יש ליטול 5 מ"ל דם (או נפח מינימלי של 1.2 מ"ל) למבחנת NaF/oxalate (פקק בצבע אפור), או למבחנת סודיום הפארין (פקק בצבע ירוק), או למבחנת ספירת-דם (EDTA פקק בצבע סגלגל). הדם מועבר למעבדה תוך 3 ימים מנטילתו כאשר נשמר בטמפרטורת החדר, או אם הבדיקה נשלחת למעבדה לאחר 3 ימים מנטילת הדם, יש לשמור או בקירור או בהקפאה. הבדיקה מתבצעת באופן איכותי על ידי GC-MS, או באופן כמותי על ידי LC-MS/MS. ניתן כמו כן לזהות שימוש ב-GHB על ידי אנליזה של חומר זה בשיער.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק