הבדלים בין גרסאות בדף "גורם קרישה 10 - Factor X"
(←ראו גם) |
|||
| שורה 85: | שורה 85: | ||
* [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
* [[בדיקות תפקודי קרישה|בדיקות מעבדה - תפקודי קרישה]] | * [[בדיקות תפקודי קרישה|בדיקות מעבדה - תפקודי קרישה]] | ||
| + | |||
{{ייחוס בן עמי}} | {{ייחוס בן עמי}} | ||
גרסה מ־14:07, 22 במרץ 2020
| מדריך בדיקות מעבדה | |
| גורם קרישה 10 | |
|---|---|
| Factor X | |
| שמות אחרים | פקטור X, גורם קרישה X, F10, פקטור סטיוארט-פראוור, Stuart-Prower factor |

| |
| מעבדה | המטולוגיה בדם |
| תחום | קרישת דם |
| טווח ערכים תקין | 45-155% מרמת הנורמה (Girolami et al Eur J Haematology משנת 2016). |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – תפקודי קרישה
מטרת בדיקת פקטור X
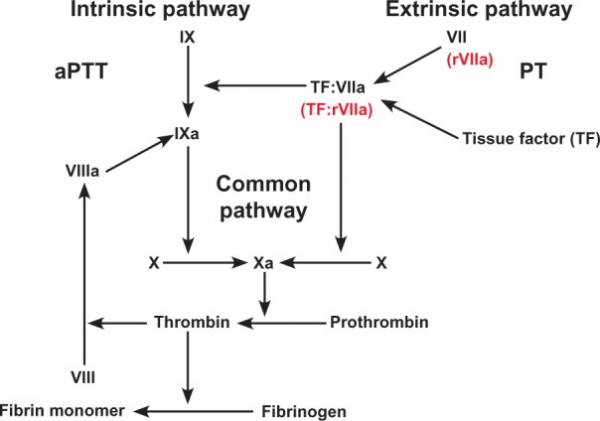
כאשר קיים חשד לחסר פקטור X; לצורך מדידת רמת הפארין בדם (ובעיקר הפארין קטן-מולקולרי) לצורך העיכוב של Xa; הצורך להעריך את הפעילות נוגדת הקרישה בדם; הערכת תפקוד המוסטאטי במחלת כבד; בירור של תוצאות PT (זמן פרותרומבין) או activated partial thromboplastin time (או APTT) ממושכים.
הפיזיולוגיה של פקטור X
פקטור X, הידוע גם כ- Stuart–Prower factor, הוא אנזים מסוג serine endopeptidase ברצף שלבי הקרישה, ובעל משקל מולקולרי של 59,000 דלטון. פקטור X מסונטז בכבד בתלות בוויטמין K, כאשר הגן המקודד לו באדם ממוקם בכרומוזום 13, באתר q3413, בקרבה גדולה לגן המקודד לפקטור VII (על פי Scambler ו-Williamson ב- Cytogenet Cell Genet משנת 1985, ו-Ott ו-Pfeiffer ב-Hum Hered משנת 1984). פקטור X משופעל על ידי הידרוליזה, לקבלת פקטור Xa על ידי פקטור IX (בסיוע הקו-פקטור שלו-פקטור VIII), וכן על ידי פקטור VII (בסיוע הקו-פקטור שלו הידוע כ-tissue factor). פקטור Xa חיוני להפיכת פרותרומבין לתרומבין, על ידי ביקוע פרותרומבין בשני אתרים: קשר Arg-Thr וקשר Arg-Ile. תהליך זה מסתייע על ידי יצירת קומפלקס בין Xa לבין קו-פקטור V המשופעל, בקומפלקס ה-prothrombinase. פקטור Xa עובר אינאקטיבציה על ידי ZPI המעכב של protein Z-dependent protease, שהוא serpin המעכב serine protease. הזיקה של קו-פקטור V המשופעל לפקטור Xa גדלה פי-1,000 בנוכחות protein Z, אך קו-פקטור זה אינו נזקק ל-protein Z לצורך האינאקטיבציה של של פקטור XI. פגמים ב-protein Z מגבירים את פעילות פקטור Xa ואת הנטייה ליצירת פקקת. תקופת מחצית החיים של פקטור X היא 40-45 שעות.
המבנה של Factor Xa
בחודש מאי 1993 פוענח לראשונה המבנה הגבישי של פקטור Xa אנושי, 191 מבנים גבישיים של פקטור Xa צמוד למעכבים שונים נמצאים בבנק הנתונים. האזור הפעיל של Xa מחולק ל-4 "תת-כיסים" המסומנים כ-S1 עד S4. תת הכיס S1 קובע את הבררנות ויכולת הקישור של Xa, ואילו תת הכיס S2 הוא קטן ושטוח ופעילותו אינה מוגדרת, אם כי הוא מתלכד עם תת הכיס S4. תת הכיס S3 ממוקם על המסגרת של S1 והוא נחשף לממס. לתת הכיס S4 יש שלושת מקטעי קישור לליגנד: "הקופסא ההידרופובית", "החור הקטיוני" ואתר המים. מעכבי Xa בדרך כלל נקשרים בקונפורמציית L, כאשר חלק אחד של הליגנד נקשר לכיס האניוני S1, בשיתוף Asp189, Ser195 ו-Tyr228, ואילו חלק אחר של הליגנד תופס את הכיס הראומטי S4 בשיתוף Tyr99, Phe174 ו-Trp215.
תפקיד פקטור X בתחלואה
חסר מולד של פקטור X נדיר ביותר (1 ל-500,000 עד מיליון לידות-חי), והוא בא לביטוי בדימום מהאף (אפיסטקסיס), בהצטברות דם במפרקים (המרטרוזיס) ובאיבוד דם ממערכת העיכול. מעבר לחסר מולד של פקטור X, חסר זה עלול להופיע במספר מצבי מחלה כמו בעמילואידוזיס בגין ספיחה של פקטור X לפיברילות של עמילואיד במערכת הווסקולרית (Dejhansathit ו-Suvannasankha ב-Investig Med High Impact Case Rep משנת 2019, Furie וחב' ב-N Eng J Med משנת 1981, Patel וחב' ב-Hematol Oncol Stem Cell משנת 2019 ו-Choufani וחב' ב-Blood משנת 2001). טיפול בוויטמין K עשוי לסייע למטופלים עם חסר נרכש של פקטור X, אך אינו משפיע על אלה עם חסר מולד של פקטור X. חסר בוויטמין K או טיפול בקומאדין מביא ליצירת פקטור Xa בלתי פעיל. חסר נרכש של פקטור X יכול להופיע גם במחלת כבד חמורה, וב-disseminated intravascular coagulation. רמות מופחתות של פקטור X ניתן למצוא גם במיאלומה, בילדים עם כוויות חמורות, בהדבקות עם Mycoplasma pneumonia, במטופלים עם אנטי-קואגולנטים כתוצאה מלופוס, בלויקמיה ובמחלות נאופלסטיות אחרות (Bouchard וחב' ב-J Biol Chem משנת 1997). נכון לשנת 2007 רוב התכשירים נוגדי הקרישה מכוונים לאינאקטיבציה של פקטור Xa (Winslow ו-Johnson ב-Wall Street Journal משנת 2007). פולימורפיזמים בפקטור X נכרכו בשכיחות מוגברת של זיהומים בקטריאליים, מה שמצביע על תפקיד אפשרי בוויסות התגובה החיסונית לחיידקים פתוגניים (Skaar וחב' ב-Infection Immunity משנת 2019).
רמות פקטור X מוגברות בהיריון או בנשים הצורכות גלולות למניעת היריון
חסר מוחלט של פקטור X עלול לגרום למות העובר בעודו ברחם, או לדימומים קטלניים תוך 5 ימים לאחר הלידה במודל של עכברים טרנסגניים נטולי פקטור X (Dewerchin וחב' ב-Thromb Haemost משנת 2000). פקטור Xa יכול לשחק תפקיד פיזיולוגי בשפעול של פקטור VII (Rao ו-Rapaport ב- Proc Natl Acad Sci U S A משנת 1988, של פקטור VIII (Neuenschwander ו-Jesty ב-Arch Biochem Biophys משנת 1992) ושל פקטור V (Moncovik ו-Tracy ב-Biochemistry משנת 1990). למרות שכל פני שטח ממברנות המבטאים פוספוליפידים אניוניים עשויים לסייע ליצירת קומפלקס prothrombinase, פני הטסיות המשופעלות מתאימים במיוחד למטרה זו. יצירת קומפלקס prothrombinase על פני טסיות אינה תוצאה ישירה של הרכב הפוספוליפידים, אלא מסתייעת על ידי אחד או יותר חלבונים הנקשרים לתאים אלה.
פעילות של פקטור X
בשלב א', פקטור VII נקשר לחלבון הטרנס-ממברנלי tissue factor על פני התאים, ומומר לפקטור VIIa, כאשר התוצאה היא יצירת הקומפלקס factor VIIa/TF, המקטלז את השפעול של פקטור X ושל פקטור IX. פקטור Xa הנוצר על שטח הפנים של תאים נושאי tissue factor, מגיב עם פקטור Va ליצירת הקומפלקס prothrombinase המייצר כמויות קטנות של תרומבין על פני התאים הנושאים tissue factor. בשלב ב', אם נוצר די תרומבין, מתרחש שפעול טסיות-דם ושפעולם של פקטורים הקשורים לטסיות-דם. בשלב ג', שלב יצירת התרומבין, פקטור XIa משפעל את פקטור IX החופשי על פני טסיות הדם המשופעלות. פקטור IXa המשופעל ביחד עם פקטור VIIIa יוצרים את קומפלקס ה-"tenase" המשפעל יותר פקטור X, וכתוצאה מכך נוצרים יותר קומפלקסים חדשים של prothrombinase עם פקטור Va. פקטור Xa הוא המרכיב העיקרי של קומפלקס ה-prothrombinase, וכך נוצרות כמויות גדולות של תרומבין. כל מולקולה של פקטור Xa יכולה לייצר 1,000 מולקולות של תרומבין. היצירה המוגברת של תרומבין אחראית לפולימריזציה של פיברין ליצירת הקריש.
פקטור Xa משחק תפקיד גם בתהליכים ביולוגיים אחרים שאינם קשורים ישירות לקרישת דם, כגון ריפוי פצעים, תהליכי דלקת, אנגיוגניות וטרשת עורקים. קומאדין, שהוא נגזר סינתטי של coumarin, הוא נוגד הקרישה הנפוץ ביותר בארה"ב. במספר מדינות אירופיות, נגזרים אחרים של coumarin נמצאים בשימוש כגון phenprocoumon ו-acenocoumarol. כל התכשירים הללו הם אנטגוניסטים של ויטמין K, ומעכבים בהפטוציטים את הקרבוקסילציה התלויה בוויטמין K של פקטורי הקרישה II (פרותרומבין), IX ,VII ו-X (Turpie ב-Arterioscl Thromb Vasc Bio משנת 2007).
מחקר של Li וחב' ב- Thromb Haemost משנת 2019, מציע שהקשר הדי-סולפידי Cys22-Cys27 במקטע הפרוטאזי של פקטור X קובע במידה רבה את הפעילות הקרישתית של פקטור זה. פגם בקשר דיסולפידי זה, מונע את כושר הפעילות של ה-N טרמינל של המקטע הקטליטי של פקטור X, ומונע את השינוי המבני המתרחש בהפיכת הזימוגן לאנזים פעיל. בנוסף לפעילות הקדם-קרישתית, יש לפקטור X פעילויות מיטוגניות וקדם-דלקתיות. פעילותו המיטוגנית של פקטור X הודגמה בתאי שריר חלקים, ואילו הפעילות הקדם-דלקתית שלו מתווכת לאחר קישורו לקולטנו (Altieri ו-Edgington ב-J Immunol משנת 1990).
מחקרים מראים שפקטור X יכול להיווצר בתאי סרטן, ולדוגמה הם מיוצרים על ידי תאי סרטן רירית הרחם, אל לא על ידי תאי אנדומטריום בריאים (Sierko וחב' ב-In vivo מנת 2019). יתרה מכך, protein z ומעכב פרוטאזות התלוי ב-protein Z, הפועלים יחדיו לעכב את פקטור X, מבוטאים באופן חזק בתאי סרטן האנדומטריום, מה שמצביע על המעורבות של חלבונים אלה בתהליך הסרטני באנדומטריום. יש ראיות לכך שגם סרטני הקיבה והמעי הגס יכולים לבטא את פקטור X.
שימוש תרפויטי בפקטור X
ישנם 2 תרכיזים של פקטור X הזמינים מסחרית למטרה טיפולית: "Factor X P Behring" המיוצר על ידי CSL Behring (על פי Brooker ב-World Federation of Hemophilia משנת 2008), והתכשיר "Coagadex" המיוצר על ידי Bio Products Laboratory שקיבל את אישור ה-FDA באוקטובר 2015 ואת אישור ה-EU במרס 2016.
התכשירים נוגדי הקרישה המקובלים ביותר בשגרה הקלינית, קומאדין, סדרות הפארין השונות ו-fondaparinux, פועלים לנטרל את פעילות פקטור Xa בדרגות שונות. מודלים מסורתיים של קרישת דם שפותחו בשנות ה-60, חזו 2 מפלי קרישה (cascades) נפרדים, המפל האקסטרינזי בו שיחק תפקיד tissue factor, והמפל האינטרינזי העיקרי. שני מסלולים אלה מתלכדים לצומת משותפת, או יצירת הקומפלקס של פקטורי Xa/Va אשר ביחד עם יוני סידן תוך היצמדות לפוספוליפידים, מייצרים את פקטור IIa (תרומבין) מפקטור II (פרותרומבין). מודל תאי חדש של קרישה, מצטייר כמִתאר שלם יותר של שלבי הקרישה. במודל מעודכן זה ישנם 3 שלבים:
- אתחול הקרישה על תאים נושאי tissue factor
- העצמת הסיגנל על ידי תרומבין המיוצר בתאים נושאי tissue factor
- הגברת יצירת תרומבין על פני טסיות-דם
פקטור Xa הוא בעל תפקיד מפתח בכל שלושת השלבים הללו (Hoffman ו-Monroe ב-Hematol/Oncol Clin North America משנת 2007).
הפארין (בלתי מקוטע) ונגזריו הקטן-מולקולריים (LMWH), נקשרים לקו-פקטור (antithrombin (AT, כדי לגרום לאינאקטיבציה של מספר פקטורי קרישה כגון IIa ,Xa ,XIa ו-XIIa. הזיקה של הפארין בלתי-מקוטע ושל אחדים מה-LMWHs לפקטור Xa מגוונת ביותר, והיעילות של נוגדי-קרישה המבוססים על הפארין גדלה ככל שהבררנות שלהם לפקטור Xa גדלה.
LMWH מראה יכולת אינאקטיבציה מוגברת של פקטור Xa, בהשוואה להפארין הבלתי מקוטע. Fondaparinux, תכשיר המבוסס על הרצף החמש-סכרידי של הפארין, הוא בעל בררנות אף גדולה מזו של LMWH לגבי פקטור Xa. אינאקטיבציה זו של פקטור Xa על ידי הפארינים מוגדרת כ"בלתי ישירה" כיוון שהיא נסמכת על הנוכחות של (antithrombin (AT, ולא על אינטראקציה ישירה עם פקטור Xa. תכשירים חדשים המעכבים באופן ספציפי את פקטור Xa פותחו, והם כוללים את (rivaroxaban ,apixaban , betrixaban, 517717, edoxabandarexaban (YM150, ו-813893. לתכשירים עדכניים אלה יתרון בכך שהם ניטלים באופן פומי, ושהם מתחילים להשפיע מהר יותר. הם גם יותר יעילים כנגד פקטור Xa בכך שהם מעכבים גם את פקטור Xa החופשי, וגם את הפקטור הזה בקומפלקס ה-prothrombinase שלו. חוקרים אמריקאים בשנת 1953 ובריטיים בשנת 1956 (Telfer וחב' ב-Br J Haematol משנת 1956) תיארו באופן בלתי תלוי חסר של פקטור X. הפקטור קרוי על שם מטופל אמריקאי (Rufus Stuart) ומטופלת בריטית (Audrey Prower) שאובחנו עם חסר זה.
היבטים מעבדתיים של קביעת פקטור X
מגבלות בקביעת רמת פקטור X יכולות להיגרם על ידי:
- דגימות דם שנקרשו באופן חלקי כתוצאה מאי-ערבוב נאות עם תמיסת סודיום ציטראט במבחנת האיסוף
- הוספה מוגזמת של דם למבחנת האיסוף באופן המשנה את היחס הרצוי של 1:9 של דם/ציטראט
- פלזמה שלא אוחסנה כנדרש בהקפאה עמוקה
- זיהום עם הפארין או מיהול יתר של הדגימה כשיש שימוש בצנתר הקבוע בווריד (indwelling catheter)
שגיאות אנליטיות העלולות להתרחש כאשר הפלזמה המוליטית, ליפמית או איקטרית מה שעלול לפגוע במדידה הפוטו-אלקטרית במכשור המקובל.
- ממצאים במחקרים על קרישת דם בחסר של פקטור X כוללים את הממצאים הבאים
- זמן פרותרומבין (PT) מאורך
- זמן של activated partial thromboplastin time (או aPTT) מאורך
- זמן דימום בתחום הנורמה;
- זמן Russell viper venom מאורך. ארס נחש זה מבקע את פקטור X ליצירה של פקטור Xa משופעל.
התוצאות של בדיקות למדידת פקטור X יכולות להשתנות, בתלות אם חסר פקטור זה הוא type 1 (סינתזה מופחתת של פקטור X), או type 2 (יצירה של פקטור X לא תפקודי). במטופלים עם חסר type 1 יש הפחתה הן של פקטור X אנטיגני וכן של של פקטור X תפקודי. במטופלים עם חסר פקטור X מסוג type 2, הרמה התפקודית של פקטור זה פוחתת, ואילו הרמה האנטיגנית שלו יכולה להיות נורמלית או מופחתת.
מוטציות שונות הפוגעות בפקטור X
מוטציית Gly366Ser גרמה לביטול הפעילות של פקטור X בגבר צרפתי (Isshiki וחב' ב-Blood Coagul Fibrinolysis משנת 2005). ואילו המוטציות Phe31Ser, וכן 514delT ו-T516G גרמו לחסר מולד של פקטור X במטופלים ממוצא הודי (Jayandharan וחב' ב-J Thromb Haemost משנת 2005). אחת המוטציות, Cys364Arg, הורסת את הקשר הדי-סולפידי במקטע הקטליטי של פקטור X, וגורמת לחסר חמור של פקטור זה (Todd וחב' ב-Haemophilia משנת 2006). בסעודיה נמצאו 2 משפחות עם אנומליה המכונה factor X-Riyadh כתוצאה ממוטציה Glu51Lys (Al-Hilali וחב' ב-Thromb Haemost משנת 2007). בהונגריה אותר factor X Debrecen, בו מוטציה Gly204Arg גורמת לסינתזה של חלבון שאינו מופרש ולחסר חמור של פקטור X (Bereczky וחב' ב-Haematologica משנת 2008). בצרפת זוהה factor X Marseille עם תפקוד לקוי כתוצאה ממוטציה Ser334Pro (Bezeaud וחב' ב-Eur J Biochem משנת 1995). ביפן בודד factor X Tokyo עם חסר בפטור זה כתוצאה ממוטציה Gla32Gln (Zama וחב' ב-Br J Haematol משנת 1999).
הגישה הקלינית
הטיפול בחסר פקטור X היא פרטני לכל מטופל, כאשר המטרה היא לשחזר את רמותיו ל-10-40% מהרמה הנורמלית. התכשיר Coagadex ניתן לאחר אפיזודת דימום במינון של IU/kg25 בעירוי לווריד. טיפול זה אמור להינתן למטופלים עם חסר מולד מתון של פקטור X על מנת להפחית את הסיכון של דימומים לאחר פרוצדורות כירורגיות. יש המלצה לטפל במטופלים עם חסר מולד של פקטור X על ידי תרכיז של פקטור X ממקור פלזמה בדרגת טוהר גבוהה (Escobar וחב' ב-Hemophilia משנת 2016). מתן תרכיז זה של פקטור X נמצא יעיל בקבוצות הגיל השונות (Kulkarni וחב' ב-J Thromb Haemost משנת 2018).
עירוי של פלזמה קפואה טרייה (Octaplas) מספיקה בדרך כלל לכל האפיזודות של דימומים. המינון המומלץ לטיפול האחרון הוא בעירוי תוך ורידי של 15-20 מ"ל לק"ג משקל גוף. בגלל תקופת מחצית החיים הארוכה יחסית של פקטור X, המינון בתחילת הטיפול יכול להיות מלווה על ידי מנות תחזוק (maintenance) של 3-6 מ"ל לק"ג משקל גוף, אחת ל-12 עד 24 שעות. תרכיזים של קומפלקס פרותרומבין (PCCs) שימשו גם כן להגדלת הרמות של פקטור X. תרכיזים אלה מכילים את פקטורי הקרישה IX, VII, II, X ו-protein C. יש לנקוט זהירות בטיפול בתרכיזים אלה כדי למנוע רמות פקטור X מעל 50% מהרמות הנורמליות, מה שעלול לגרום לאפיזודות פקקתיות-תסחיפיות. נעשה שימוש בטיפול בתרכיזים אלה בתרחישים סב-ניתוחיים כדי לטפל בחסר נרכש של פקטור X, הכרוך ב-light-chain amyloidosis סיסטמית (Litvak וחב' ב-Am J Haematology משנת 2014). טיפול בוויטמין K עשוי לסייע למטופלים עם חסר נרכש של פקטור X, אך אינו משפיע על אלה עם חסר מולד של פקטור X. במטופלים עם חסר נרכש של פקטור X בגלל עמילואידוזיס, הסרת הטחול נמצאה תועלתית בשיקום של רמות פקטור X בצירקולציה (Greipp וחב' ב-N Eng J Med משנת 1979, ו- Rosensteinוחב' ב- Arch Intern Med משנת 1983).
הוראות לביצוע הבדיקה
הנבדק אמור להפסיק ליטול מספר מדללי דם על פי הנחיות הרופא. הבדיקה מתבצעת בפלזמה דלה בטסיות-דם. את הדם נוטלים במבחנת ציטראט (פקק תכלת), ויש לסרכז את הדם תוך 4 שעות מנטילתו, ולהעביר את הפלזמה המתקבלת למבחנת פלסטיק. לאחר סירכוז נוסף, על מנת להשקיע את טסיות הדם, יש לאסוף את הפלזמה תוך הימנעות מאיסוף 0.25 מ"ל שבתחתית המבחנה. יש להקפיא מיד את הפלזמה בטמפרטורה של 20- מעלות, או אף עדיף בטמפרטורה של 40- מעלות. הדגימה בתמיסת סודיום ציטראט יציבה בהקפאה למשך 14 יום. שיטת הבדיקה: Optical Clot-Based.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק