גלוטתיון - Glutathione
| מדריך בדיקות מעבדה | |
| גלוטתיון | |
|---|---|
| Glutathione | |
| שמות אחרים | GSH ,Gamma-Glutamyl-Cysteinyl-Glycine ,L-Glutathione |
| מעבדה | כימיה בדם או המטולוגיה בדם |
| תחום | מאזני חמצון-חזור של מסלולים מטבוליים בגוף |
| טווח ערכים תקין | סך-גלוטתיון בפלזמה (מחוזר+מחומצן) 544-1,228 מיקרומול/ליטר רמת גלוטתיון מחוזר (GSH) באריתרוציטים: 6.57±1.04 מיקרומול/גרם המוגלובין; 190±30.2 מיקרומול/1012 אריתרוציטים; 2.23±0.35 מיקרומול/מ"ל של אריתרוציטים דחוסים. |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
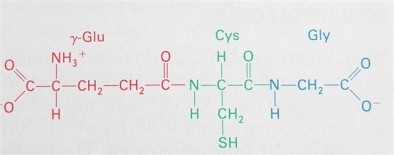
גלוטתיון (להלן GSH) הוא נוגד-חמצון חשוב בצמחים, שמרים, בעלי חיים ובחיידקים אחדים, ומסוגל למנוע נזק למרכיבי תא חיוניים, נזק שעלול להיגרם על ידי מטבוליטים הידועים כ-ROS או reactive oxygen species כגון רדיקאלים חופשיים, פראוקסידים ומתכות כבדות (Pompella וחב' ב Biochem Pharmacol משנת 2003) .מדובר בתלת-פפטיד עם קשר γ -פפטידי שונה מהמקובל בין קבוצת ה-carboxyl בשרשרת הצדדית של חומצה גלוטמית וקבוצת האמינו של ציסטאין, כאשר קבוצת הקרבוקסיל של ציסטאין קשורה בקשר פפטידי רגיל לגליצין.
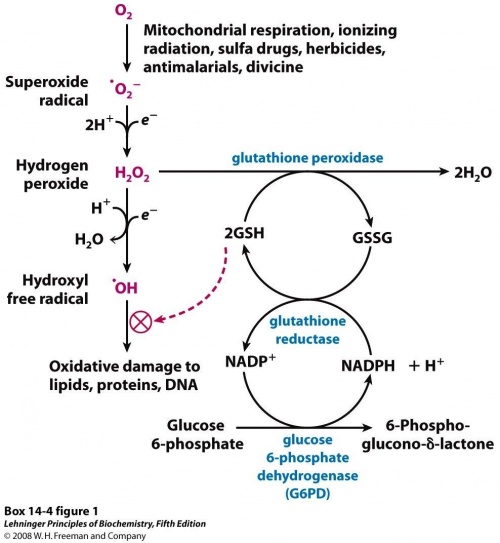
שיירי ה-thiol בציסטאין המשמשים כגורם מחזר, נשמרים במצב מחוזר אף בריכוזים גבוהים יחסית של 5 מילימולר בתאים של בעלי חיים. GSH מחזר קשרים די-סולפידים (GSSG) הנוצרים בחלבונים ציטופלזמטיים לציסטאינים, בהיותם תורמי אלקטרונים. בתהליך זה מותמר גלוטתיון לצורתו המחומצנת GSSG או גלוטתיון דיסולפיד. ברגע שגלוטתיון מתחמצן, הוא מחוזר בחזרה על ידי האנזים הקונסטיטוטיבי glutathione reductase שפעילותו תמידית, תוך שימוש ב-NADPH כתורם אלקטרונים (Couto וחב' ב-J Proteom Res משנת 2013) היחס בין GSH ל-GSSG בתוך תאים משמש לעתים תכופות כמדד לעקה החמצונית של התא Locatelli) וחב' ב-Clin Chem משנת 2001, ו- Lu ו-Shelly - ב- Biochim Biophys Acta משנת 2013). אכן בשל יעילות האנזים המחזר, למעלה מ-90% מהגלוטתיון בתאים נורמאלים נמצא בצורה מחוזרת Halprin) ב- J Invest Dermathol משנת 1967). רדיקלים חופשיים נוצרים ללא הרף בתאים, כאשר בפעילות גופנית מוגברת נוצרים יותר רדיקלים אלה. נמצא שגלוטתיון עשוי לשפר ביצועים של ספורטאים, ומקנה להם סיבולת גופנית רבה יותר. גם חשיפה למזהמים כימיים וקרינה מעלה את ריכוז הרדיקלים החופשיים.
הביוסינתזה של גלוטתיון
רוב היצורים האאוקריוטים כאדם, מסנתזים גלוטתיון בעצמם, אם כי אחדים מתוכם כגון entamoeba או גם giardia לא מסוגלים לכך. מבין הפרוקריוטים שהם המיקרואורגניזמים החד-תאיים כגון חיידקים, רק חברי משפחת ה-halobacteria יודעים לייצר גלוטתיון בעצמם (Copley וחב' ב Genome Biol משנת 2002). באדם, גלוטתיון אינו פריט תזונתי חיוני, שכן שכן הוא מיוצר בגוף מחומצות האמינו ציסטאין, גליצין וחומצה גלוטמית. ציסטאין הוא הגורם מגביל הקצב (rate- limiting factor) בביוסינתזה של גלוטתיון, שכן חומצת אמינו זו יחסית מעטה בפריטי מזון. בתאים, הסינתזה של גלוטתיון מתבצעת ב-2 שלבים התלויים ב-ATP: בשלב הראשון חיבור בין L-glutamate וציסטאין ליצירת γ-glutamylcysteine בעזרת האנזים γ-glutamylcysteine synthetase הידוע גם כ--glutamate cysteine ligase (להלן GCL), שהוא ה-rate-limiting factor בסינתזה של גלוטתיון (White וחב' ב-Anal Biochem משנת 2003). בשלב השני, מתחבר גליצין לקצה ה-C טרמינאלי של γ-glutamylcysteine על ידי האנזים glutathione synthetase . האנזים GCL הוא הטרודימרי במבנהו, ומורכב מתת יחידות קטליטית ומודולטורית. תת היחידה הקטליטית נחוצה ומספיקה לכל הפעילות האנזימטית, בה בשעה שתת היחידה המודולטורית מגבירה את היעילות הקטליטית של האנזים.
עכברים טרנסגניים החסרים את היחידה הקטליטית מתים עוד לפני לידתם (Dalton וחב' ב Biochim Biophys Res Commun משנת 2000), ואילו עכברים החסרים את תת היחידה המודולטורית, רק סובלים מפעילות מופחתת של GSH ומרְגישוּת מוגברת לחומרים טוקסיים (Young וחב' ב-J Biol Chem משנת 2002, ו McConnachie -וחב' ב-Toxicol Sci משנת 2007). בה בשעה שכל התאים בבעלי חיים מסוגלים לייצר GSH, יצירת טריפפטיד זה בכבד הכרחית. עכברים בהם מושרית באופן גנטי אי-היכולת לסנתז גלוטתיון רק בכבד מתים בחודש הראשון (Chen וחב' ב Hepatology משנת 2007, ו-Sies וחב' ב Radical Biol Med משנת 1999). הטרנספורט העיקרי של גלוטתיון מהכבד לדם מונע על ידי גרדיאנט אלקטרוכימי באופן ספציפי על ידי חלבוני טרנספורט RcGshT ו-RsGshT (על פי Li וחב' ב- The Yale J Biol Med משנת 1997). גם מיץ מרה הוא מדיום בו מועבר גלוטתיון מהכבד לדם.
החשיבות של γ-glutamylcysteine כקודמן (precursor) של סינתזת גלוטתיון
γ-glutamylcysteine (להלן GGC) הוא קודמן מידי של GSH, ולכן אספקה של GGC עמדה במוקד של מאמצים תרפויטיים החל ממחקריהם של Puri ו-Meister משנת 1983. השימוש המתועד הראשון של GGC במוח פורסם על ידי Pileblad ו-Magnusson ב-Biochem Pharmacol משנת 1992 על ידי הזרקה ישירה של GGC לתוך המוח. בשנת 1997 דיווח Dringen ב-J neurochem, שתאי אסטרוגליה מסוגלים לנצל GGC. רוב המחקרים על GGC היו קדם-קליניים המבוססים על נסיונות in vivo במודלים בחיות, או בניסויים in vitro על תאי מוח בתרבית תאים. טרם הודגם שהגברת רמת GGC עשויה אמנם להפחית עקה חמצונית במוח, מה שמזוהה עם דעיכה קוגניטיבית ( Le ב-Neurotoxicity משנת 2011).
המעבר מגלוטתיון מחוזר למחומצן
גלוטתיון נמצא בתא בצורותיו המחוזרת (GSH) והמחומצנת (GSSG). ב-GSH קבוצת ה-thiol של ציסטאין מסוגלת לתרום (-H++ e) למולקולות אחרות כמו reactive oxygen species ולנטרל אותם, או לציסטאינים של חלבונים על מנת לשמר את מצבם המחוזר. על ידי תרומת האלקטרון, גלוטתיון עצמו הופך לפעיל, ומגיב מיד עם מולקולת גלוטתיון ריאקטיבית אחרת ליצירת גלוטתיון דיסולפידי (GSSG). פעילות זו נתמכת על ידי הריכוז הגבוה יחסית של גלוטתיון בתאי הכבד (עד 7 מילימולר) על פי Kaplowitz ב The Yale J Biol Med משנת 1986. כללית, אינטראקציות בין GSH ומולקולות אחרות בעלות אלקטרופיליות יחסית גבוהה יותר, מביאות להתדלדלות של רמות GSH בתאים. GSH יכול לעבור רגנרציה מ- GSSG על ידי האנזים glutathione reductase (להלן GSR) בעזרת NADPH המחזר FAD הנמצא ב GSR לייצר FADH-anion באופן זמני. אניון זה מבקע במהירות את הקשר הדיסולפידי בין שני הציסטאינים Cys58-ו- Cys63, מה שגורם ל- Cys63 לתקוף באופן נוקלאופילי את הסולפיד הקרוב במולקולת GSSG בתמיכת שייר His467 ליצירה של קשר דיסולפידי מעורב (GS-Cys58) וכן ליצירה של GS-anion. שייר His467 של GSR בשלב זה גורם לפרוטונציה של GS-anion ליצירת ה-GSH הראשון, לאחר מכן, שייר Cys63 תוקף נוקלאופילית את הסולפיד של Cys58, וכך משתחרר GS-anion הקולט פרוטון ומשתחרר מהאנזים וכך נוצר ה-GSH השני. כך, מכל יחידה של GSSG ו-NADPH, נוצרות 2 מולקולות של GSH, שיכולות לפעול כנוגדי-חמצון המנטרלים reactive oxygen species בתא.
מגוון התפקודים של גלוטתיון
- שומר על הסטטוס המחוזר של glutaredoxin ושל glutathione peroxidase (על פי Grant ו-Chris ב-mol Microbiol משנת 2001).
- הוא אחד מנוגדי החמצון האנדוגניים העיקריים המיוצרים בתא, המנטרל רדיקאלים חופשיים ותרכובות עתירות חמצן, וכן מגן על נוגדי חמצון כמו ויטמין E בצורתם המחוזרת הפעילה (Dringen ב-Prog Neurobiol משנת 2000, ו-Scholz וחב' –Ann NY Acad Sci משנת 1989, ו-Hughes ב-Nature משנת 1964).
- גלוטתיון משמש בריאקציות מטבוליות כגון סינתזה ותיקון של DNA, בסינתזה של חלבונים ושל פרוסטגלנדינים, בטרנספורט של חומצות אמינו ובשפעול אנזימים. לכן כל מערכת בגוף יכולה להיות מושפעת מהסטאטוס של מערכת גלוטתיון, בעיקר מערכות החיסון, העצבים, העיכול והריאות.
- לגלוטתיון תפקיד חיוני במטבוליזם של ברזל.
- לגלוטתיון תפקיד בהתקדמות מחזור חיי התא, וכן במות התא. הוא מווסת שינויים ב-redox בחלבוני הגרעין החיוניים לאתחל את התמיינות תאים (differentiation). הבדלים ברמות GSH קובעים גם כן את מנגנון תמותת תאים שיכול להיות אפופטוטי או נקרוטי (Hall ב-Eur J Clin Invest משנת 1999).
תפקוד גלוטתיון בבעלי חיים
GSH משמש כמצע בריאקציות קוניוגציה המקוטלזות על ידי אנזימי glutathione S-transferase בציטוזול, במיקרוזומים, ובמיטוכונדריה. עם זאת, GSH מסוגל להשתתף בקוניוגציות לא-אנזימטיות עם כימיקאלים אחדים.
במקרה של N-acetyl-p-benzoquinone imine או NAPQI, המטבוליט הפעיל של cytochrome P450 הנוצר על ידי acetaminophen, ההופך לטוקסי כאשר מתדלדלת רמת GSH על ידי רמת-יתר של התרופה, גלוטתיון הוא antidote הכרחי להתמודד עם מנת-יתר זו.
גלוטתיון נקשר ל-NAPQI ומסייע לדה-טוקסיפיקציה שלו. יכולת זו מאפשרת ל-GSH להגן על קבוצות ה-thiol של חלבוני התא, שאם לא כן, אלה היו עוברים מודיפיקציות קו-ולנטיות, ו-NAPQI היה מתחיל להגיב עם חלבוני התא ולהמית את התאים. הטיפול המומלץ במקרים של מנת-יתר של משכך כאבים זה, הוא במתן N-acetyl-L-cysteine, אותו הופכים התאים ל-L-cysteine, היכול לשמש לסינתזה de novo של GSH. גלוטתיון מחוזר משתתף בסינתזה של leukotriene, והוא משמש קו-פקטור של האנזים glutathione peroxidase.
GSH היא גם מולקולה הידרופילית המתווספת לטוקסינים ליפופילים ולפסולת בכבד בעת תהליך של ביו-טרנספורמציה והפיכתם לחלק מנוזל המרה. גלוטתיון נחוץ גם לדה-טוקסיפיקציה של methylglyoxal שהוא טוקסין הנוצר בשעת מטבוליזם בתא. ריאקציית דה-טוקסיפיקציה האחרונה מתבצעת על ידי מערכת ה-glyoxalase, כאשר glyoxalase I מקטלז את הפיכת methylglyxal ו-GSH ל-S-D-lactoyl-glutathione. לעומת זאת, glyoxalase II מקטלז את ההידרוליזה של S-D-lactoyl-glutathione לגלוטתיון ול-D-lactic acid.
גלוטתיון, ביחד עם גלוטתיון מחומצן (GSSG) ועם S-nitrosoglutathione או GSNO, נמצאו נקשרים לאזור המזהה glutamate של הקולטנים המוחיים NMDA ו-AMPA (דרך שיירי ה- γ-glutamyl שלהם, ולכן GSH, GSSG ו-GSNO עשויים לשמש נוירו-מודולטורים אנדוגניים (Steullet וחב' ב-Neuroscience משנת 2006, וכן Varga וחב' ב-Neurochem Res משנת 1997, ו- Janáky וחב' ב-J Neurochem משנת 1999). בריכוזי מילימולר, שלושת החומרים האמורים יכולים גם להשתתף במודולציה של סטטוס ה-redox של הקולטן NMDA. בנוסף, נמצא שגלוטתיון נקשר ומשפעל קולטנים יונוטרופים מה שיכול לכונן קולטני גלוטתיון, וכך באופן פוטנציאלי יכול גלוטתיון להיחשב לנוירוטרנסמיטור (Oja וחב' ב-Neurochem Int משנת 2000).
שימושי גלוטתיון
הגלוטתיון מחזק את פעילות התאים במערכת החיסון, שתפקודיה נחלשים עם הגיל, מפחית נזקים הכרוכים בצריכת סוכר על ידי חולי סוכרת, ובנחשפים למזהמים כימיים ולקרינה. גלוטתיון משתתף בריאקציות הכוללות התחברות לשומנים ואחרים, ובתגובות חיזור, בתוך אברונים תאיים כגון, מיטוכונדריות ומיקרוזומים. גלוטתיון מנטרל את תוצרי הפירוק של polyunsaturated fatty acids הנמצאים בממברנות תאים כתוצאה מפעילות של פראוקסידים של שומנים. גלוטתיון מחזר ויטמינים כגון C, A, ו- E לאחר שקלטו רדיקלים חופשיים וחומצנו על ידם, ופועל למחזר ויטמינים אלה לפעולה נוספת. גלוטתיון מגן על רכיבי תאים, בפרט על חלבונים כקולאגן, וחלבונים אחרים ברקמות החיבור, מפני חמצון, ובכך פועל כמונע הזדקנות. גלוטתיון מגן על תאי המוח, בפרט לאחר פגיעה טראומטית בו, הגורמת ליצירת עודף חומצה גלוטאמית בסינאפסות של העצבים. זה עלול למנוע קליטת ציסטאין, ההכרחי ליצירת הגלוטתיון. ללא הגנת גלוטתיון של התאים מפגיעה חימצונית, תאים במוח עלולים להינזק ולמות. אי לכך נטילת גלוטתיון מקטינה גם נזק מוחי. מוח האדם המהווה רק 2% ממשקל הגוף, צורך בערך 20% מהחמצן הנצרך על ידי הגוף. לכן המוח רגיש במיוחד לנזקי רדיקאלים חופשיים, ומכאן חשיבות גלוטתיון בהגנה על המוח.
גלוטתיון מונע נזק חמצוני לעור (Jansen וחב' ב- Canadian Journal of Physiology and Pharmacology משנת 1975, והוא מסוגל לגרום להבהרת העור. ההשפעה האחרונה של גלוטתיון כמבהיר עור התגלתה כהשפעה נלווית במתן כמויות גדולות של גלוטתיון (Prasad וחב' ב-J Toxicol משנת 2009). השפעה זו של גלוטתיון מתרחשת בשלבים שונים של מלנוגנזה, על ידי עיכוב של סינתזת מלנין על ידי חסימת היכולת של הקודמן L-Dopa להגיב עם האנזים tyrosinase בתהליך יצירת מלנין (Matsuki וחב' ב- Yakugaku Zasshi משנת 2008). מחקר של Scott וחב' משנת 1976 ב-Comparative Biochemistry and Physiology, מצא שגלוטתיון מעכב יצירת מלנין על ידי אינאקטיבציה ישירה של האנזים tyrosinase, על ידי קישור וכלציה (chelation) של נחושת עם האתר הפעיל של האנזים. ההשפעה נוגדת החמצון של גלוטתיון מאפשרת לו לעכב את סינתזת מלנין על ידי דיכוי של רדיקאלים חופשיים ושל פראוקסידים התורמים לשפעול של tyrosinase (על פי Karg וחב' ב-J Invest Dermatol משנת 1993). התכונות נוגדות החמצון של גלוטתיון מספקות לעור הגנה מפני קרינת UV ותהליכים אחרים המייצרים רדדיקאלים חופשיים המזיקים לעור וגורמים להיפר-פיגמנטציה (Shindo ו-Hashimoto ב-Arch Dermatol Res משנת 1995). ברוב היונקים יצירת מלנין מכילה את הפיגמנט החום-שחור eumelanin והפיגמנט הצהוב-אדום pheomelanin כתערובת או כקו-פולימרים (Ito ב-J Invest Dermatol משנת 1993).
עלייה ברמת גלוטתיון עשויה להשרות בתאי הפיגמנט ייצור של pheomelanin במקום eumelanin (Jara וחב' ב-Biochim Biophys Acta משנת 1988). מחקר של Chang מצא שרמות נמוכות ביותר של GSH, כרוכות בפיגמנטציה של eumelanin, ואילו הרמות הגבוהות ביותר של GSH כרוכות בפיגמנטציה של pheomelanin ולעור כהה יותר.
גורמים המסייעים להגברת רמת GSH בתאים
מגנזיום ואשלגן נדרשים עבור השלבים האנזימטיים התלויים באנרגיה לצורך סינתזה של GSH, בנוסף לציסטאין שהוא חומצת האמינו הקובעת את קצב הסינתזה הזו. תוצרים תזונתיים שתועדו כמגבירים את ביוסינתזה של GSH באריתרוציטים הם חלבון מי-גבינה (Whey), חומצה α-lipoic, curcumin, סלניום, Silymarin, ויטמינים C ו-E, ובמידה קטנה יותר N-acetyl-L-cysteine. סוגי מזון עתירי-גלוטתיון הם אלה העשירים בחומצות אמינו עתירות גופרית כגון בשר לא מעובד, ביצים חיות, שום, ברוקולי, אספרגוס, אבוקדו, פטרוזיליה ותרד. חלבון מי-גבינה מכיל כמויות גדולות ביותר של קודמנים טבעיים של גלוטתיון: ציסטאין קשור קו-ולנטית, lactoferrin, אימונוגלובולינים, ופפטידים פעילים.
הזמינות של גלוטתיון ממזון הנלקח פומית, אינה גבוהה ואין בה כדי להגביר באופן ניכר את רמת הגלוטתיון בפלזמה או בתוך התאים, זאת משתי סיבות:
- נטילה פומית של התלת-פפטיד האמור חושפת אותו לפעילות נמרצת של פפטידאזות בקיבה ולפירוקו
- היעדר של נשא ספציפי או טרנספורטר ברמת הממברנה של התא שיחדירו לתאים (Allen ו-Bradley ב-J Altern Complement Med משנת 2011, ו-Witschi וחב' ב-Eur J Clin Pharmacol משנת 1992).
30-60% של גלוטתיון אובדים בבישול, ועד 100% ממנו אובדים באריזתו כמזון משומר (canning).
ויטמין D הפעיל (1,25 dihydroxy) מגביר את רמות גלוטתיון במוח ונראה שהוא משמש קטליסט ליצירת גלוטתיון (Garcion וחב' ב-Trends Endocrinol Metabol משנת 2002). המטבוליט S-adenosylmethionine המהווה תווך בטרנספר של קבוצות מתיל, מגביר את ריכוזי גלוטתיון בתאים בעיקר באלה הסובלים ממחלות כבד (Lieber ו-Charles ב-Am J Clin Nutr משנת 2002, ו-Vendemilae וחב' ב-Scand J Gastroenterol משנת 1989 ו-Loguercioet וחב' ב-Alcohol Alcoholism משנת 1994). גם במצבים כמו myelofibrosis או בחסר של האנזים pyrimidine-5'-nucleotidase מוגברת רמת גלוטתיון.
מצבים בהם רמת גלוטתיון נמוכה
תרחישים גופניים בהם קיים מאזן שלילי של חנקן כמו שמוצאים במחלה קרדיו-וסקולארית, בסרטן, AIDS, הפאטיטיס, סוכרת type 2, ספסיס, מצבי טראומה, כוויות, פעילות אתלטית בעצימות גבוהה, במצבי צום ורעב מתמשך. רמות נמוכות של גלוטתיון מוצאים גם באלכוהוליזם ומחלות נוירו-ניווניות כגון אלצהיימר ופרקינסון, בחשיפה לאלמנטים טוקסיים, כמו כספית, ארסן, קדמיום, מנגן וברזל, וכן לתרופות שונות.
במצבים אלה מתקיימת פעילות גליקוליטית מוגברת, הכרוכה בכיחשון (cahexia) הנובעת מרמות מופחתות של oxidative phosphorylation (על פי Droge ו-Holm ב-FASEB J משנת 1997, ו-Tateishi וחב' ב-J Biochem משנת 1974). כמו כן רמת גלוטתיון נמוכה באלה עם חסר האנזים G6PD, GSH-synthetase, חסר ב-γ-glutamyl synthetase, חשיפה לעןפרת, או באלה עם המוגלובין C.
שיטות לקביעת גלוטתיון
רמות GSH בתאים גבוהות בסדרי גודל מאשר רמתו בפלזמה, המייצגת בעיקר את גלוטתיון המיוצר ומיוצא מהכבד. גלוטתיון מחוזר היא הצורה הפעילה של התלת-פפטיד, והיחס בין הצורה המחוזרת והפעילה של גלוטתיון היא באופן נורמאלי 9:1. כאשר נוטלים דגימת דם, הגלוטתיון המחוזר באריתרוציטים רגיש מאוד לחמצון והיחס גלוטציון מחוזר למחומצן פוחת באופן מהיר. שיטות שונות למנוע את החמצוןex vivo של הגלוטתיון המחוזר אינן מעשיות, ומדידה ישירה של גלוטתיון מחוזר in vivo אינה מתאפשרת בשגרת המעבדה הקלינית. לכן מבחינה קלינית רצוי למדוד את סך רמת הגלוטתיון (מחוזר + מחומצן) כמדד של סטאטוס גלוטתיון והמטבוליזם שלו.
- ריאגנט Ellman ו-monobromobimane: ניתן לגלות גלוטתיון מחוזר על ידי ריאגנט Ellman או נגזרות של bimane כגון monobromobimane, שהיא שיטה רגישה. בפרוצדורה זו גורמים לליזיס של תאים, ותרכבות ה-thiol בהם עוברות מיצוי על ידי בופר HCl. בשלב זה מחזרים את ה-thiols עם DTT או dithiothreitol ומסמנים אותם עם monobromobimane, והם הופכים להיות פלואורסצנטיים לאחר קישורם ל-GSH. מפרידים אז את ה-thiols הללו על ידי HPLC, ואת עוצמת הפלואורסצנציה מכמתים עם גלאי פלואורסצנטי.
- שיטת ThiolQuant Green: Jiang וחב' פרסמו ב-ACS Chem Biol משנת 2015 שיטה כמותית של הדגמה (imaging) של גלוטתיון בתאים חיים תוך שימוש בגשוש (probe) הפלואורסצנטי ThiolQuant Green הנקשר באופן הפיך לגלוטתיון. גשוש זה יכול לא רק לבצע מדידות ברזולוציה גבוהה של רמות גלוטתיון בתאים בודדים שניתן לזהות במיקרוסקופ, אלא גם ניתן להשתמש בשיטת סימון זו ב-flow cytometry.
- גָשוֹשים (probes) של גלוטתיון על בסיס חלבון: גישה נוספת המאפשרת מדידה של פוטנציאל redox של גלוטתיון ברזולוציה גבוהה בתאים חיים, מבוססת על redox imaging תוך שימוש ב-roGFP או redox-sensitive green fluorescent protein או ב-rxYFP או redox sensitive yellow fluorescent protein (על פי Maulucci וחב' ב-Sci Signaling משנת 2008). את רמות GSSG קשה למדוד במדויק בשיטות אלו, בגלל ריכוזיו הפיזיולוגיים המאוד נמוכים: ריכוז GSSG ברקמות סולידיות נע בין 10-50 מיקרומולר, ובין 2-5 מיקרומולר בדם (13-33 ננומול/גרם המוגלובין). היחס בין GSH ל-GSSG נע בין 100 ל-700.
הוראות לביצוע הבדיקה
לצורך קביעת סל רמת גלוטתיון בפלזמה, יש לדגום דם במבחנת ספירת דם (פקק סגלגל, EDTA). אין לסרכז את הדם, ויש להעבירו כדם מלא בקירור למעבדה במהירות האפשרית. יש לפסול דגימה שהגיעה למעבדה בטמפרטורת החדר או בהקפאה. דם המוליטי גם כן בלתי קביל. הדם המגיע מקורר יציב בקירור למשך 3 שבועות. מחקר שהתבצע באוניברסיטת Emory באטלנטה, מצא שינויים מחזוריים ברמת גלוטתיון בדגימות הדם לאורך היממה. רמת גלוטתיון מגיעה לשיאים 6 שעות לאחר ארוחות, והיא נמוכה ביותר בשעות הבוקר המוקדמות. לכן יש להקפיד בכל מעבדה על נקודת זמן קבועה בשעות הבוקר לנטילת דם לצורך בדיקה זו.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק