גנים מאוחים של משפחת NTRK וחלבוני TRK במחלת הסרטן - יעדים לטיפול מכוון מטרה - NTRK gene fusions and TRK proteins in cancer - targets for cancer therapy
| גנים מאוחים של משפחת NTRK וחלבוני TRK במחלת הסרטן - יעדים לטיפול מכוון מטרה | ||
|---|---|---|
| NTRK gene fusions and TRK proteins in Cancer - Targets for cancer therapy | ||
| ||
| יוצר הערך | ד"ר צחי הרץ ופרופ ניר פלד | |
הקדמה
התהוותם של תאי סרטן היא תהליך רב גורמי ורב שלבי אשר תחילתו בתא בריא אשר עובר רצף שינויים גנטיים לאורך חודשים ושנים. שינויים מסוג זה מתרחשים בגופנו אלפי פעמים ביום, אך מאותרים באופן שוטף ומתוקנים בצורה יעילה. בנוכחות יכולת בקרה תקינה, מסולק התא הפגום באמצעות הטייתו למנגנוני הרג עצמי או אף לפיצוץ ישיר של תאים פגומים על ידי מנגנוני בקרה התערבותיים.
השינויים הגנטיים מתרחשים בגן אחד, בשניים או אף בגנים מרובים. לעיתים, שינוי גנטי אחד מוביל לשני שמוביל לשלישי וכך הלאה, בעוד זה האחרון הוא זה אשר אחראי להעדר יכולת בקרה תאית (תא סרטני) בעוד השינוי הראשוני כבר אינו רלוונטי לתוצר הגידולי הקונקרטי הסופי ולכן אינו יעד לטיפול אנטי-סרטני התערבותי.
שינויים גנומיים אלו יכולים להתרחש ברמת המטען הגנטי הבסיסי (DNA) או ברמת הוויסות הגנומי (DNA METHYLATION) או ברמת המטען הגנומי המוביל לייצור חלבוני (RNA). אנו למדים כי שינויים נוספים יתכנו באופן עיבוד ה RNA אך על כך ראוי להרחיב בפרק אחר. פרק זה, יתמקד בשינויים המאותרים במטען הגנומי הבסיסי, קרי ה- DNA ומתוכם בשינויי איחוי (FUSION ) מסוג NTRK.
תקלות גנומיות מתחלקות למספר קבוצות:
- שינויים נקודתיים (מוטציות נקודתיות) - החלפת אבן יסוד אחת בשנייה (החלפת נוקלאוטידים) המובילה לשינוי תיפקודי
- שינויי חסר – חסר של נוקלאוטיד אחד או רצף נוקלאוטידים מתוך המטען הגנומי. חסר זה גורם להפרעה תפקודית
- תוספות של נוקלאוטידים לרצף גנומי (INSERTION)
- איחויים בהם מוחלף מקטע גנומי אחד במקטע כלשהו מגן אחר. כלומר היווצרות רצף גנומי חדש שהינו איחוי של של שני מקטעי גנים נפרדים. במקרים אלו, מופעל הגן המאוחה בצורה שאינה תקינה אשר גורמת להתהוות סרטנית.
איתורם של הגנים מאוחים, FUSION , המכונים גם טרנסלוקציות, הפך להיות אחראיים לחלק משמעותי בהיווצרות הגידולית ובפרק זה נעסוק בסוג מסויים של איחוי של גן NTRK.
גנים מאוחים - Fusion Genes
גנים מאוחים הם שני מקטעים של גנים שונים המתחברים ביחד והופכים להיות רצף גנומי אחד. שני המקטעים מתחברים זה לזה בצורות שונות, הכוללות בעיקר חיבור באותו הכיוון או חיבור הפוך (כיוונים שונים). לעיתים מתקיימת תקלה נוספת בחלק המאוחה כדוגמת שינוי חסר או תוספת (INSERTION) של נוקלאוטידים הגורמת גם כן לפגיעה תפקודית של החלבון הסופי.
האיחוי הגנומי מוביל ליצירת חלבון שלא לצורך או ליצירת חלבון פגום או אף להשתקה של חלבון. בהתאם לכך, מאובחן האיחוי באמצעות צביעה של החלבון הספציפי או איתור החלבון הפגום או איתור של מקטעי הגנום המתחברים זה לזה. התקדמות הטכנולוגיה לריצוף גנומי מאפשר איתורם של איחויים אלו ברמת רגישות גבוהה במיוחד ופותחת אפשרויות טיפול נקודתיות.
ההימצאות של גנים מאוחים משתנה באופן נרחב, על פני סוגי סרטן שונים. גנים מאוחים רבים ספציפיים לתתי-סוגים של סרטן. בהתאם לכך, זיהוי מהיר ומדויק של גנים מאוחים יכול להוביל התערבות טיפולית המתמקדת בעצירת התפקוד של החלבון אשר מבוטא שלא לצורך או מבוטא בצורתו הפגומה.
משפחת הגנים של NTRK (Neurotrophic Tropomyosin Receptor Kinase)
משפחת הגנים NTRK מורכבת מ-3 גנים (NTRK2, NTRK1 ו-NTRK3) המתבטאים בעיקר במערכת העצבים המרכזית והפריפרית אך יכולים להופיע גם במערכות אחרות בגוף. איחויים של הגן NTRK מופיעים בטווח רחב של מחלות סרטן וחסימתו הובילה למספר טיפולים פורצי דרך אשר אושרו על ידי ה FDA כדוגמת LAROTRECTINIB, ENTRECTINIB ותרופות נוספות המצויות בפיתוח כדוגמת Altiratinib ו- sitravatinib [1].
חלבוני ה-TRK מעניינים במיוחד בשל היכולת להתערבות טיפולית מאוד סלקטיבית וטווח מאוד רחב של מחלות סרטן, כגון סרטן המעי הגס, ממאירות פפילרית של בלוטות התריס, סרטן הריאה, סרטן שד מפריש, סרקומות, סרטן מוח (גליובלסטומה)[2].
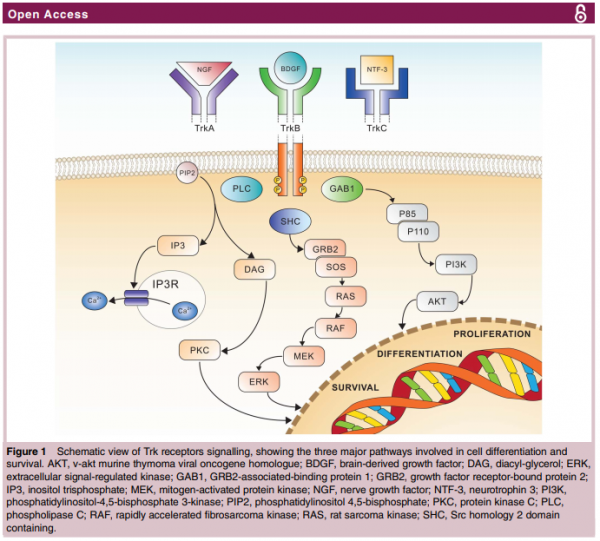
מנגנון הפעולה של משפחת ה-TRK מסוכם בתרשים הבא[3]:
מערכת הטרופומיוזין רצפטור קינאז (TRK)
מבנה חלבוני ה-TRK
חלבוני TRK הם ממשפחת קולטנים ממרבנליים (קרום התא) הבנויים מאתר תוך-תאי עם פעילות קינאז תלוית-טירוזין, הקשורה דרך מבנה חוצה קרום לאתר חוץ תאי, המורכב משני קולטנים שונים.
נוירוטרופינים - החלבונים הנקשרים לקולטני TRK
קולטני TRK מופעלים על ידי משפחה של 4 חלבונים הנקראים נוירוטרופינים. הנויטרופינים ממלאים תפקידים רבים בהתפתחות ובתפקוד של מערכת העצבים. לכל אחד מהנוירוטרופינים יש ספציפיות ל-TRK מסוים והוא נקשר אליו באפיניות גבוהה.
מסלול העברת הסיגנל של TRKs
המסלול הנורמלי של העברת הסיגנל של TRK מתחיל כאשר קשירה של נוירוטרופין לקולטני TRK על פני התא, גורמת להיצמדות של שני קולטנים. צימוד זה מוביל להפעלה עצמית של הרצפטור כלפי מטה והזנת מסלול תאי פנימי.
מיקום ופיזיולוגיה של קולטני TRK
קולטני TRK מתבטאים בעיקר ברקמה העיצבית וממלאים תפקיד חיוני במהלך התפתחות עוברית, כמו גם בתפקוד הנורמלי של מערכת העצבים. האקטיבציה של קולטני TRK על ידי נוירוטרופינים היא בעלת השפעה על מגוון של אירועים עיצביים, כמו התמיינות ושרידות של תאי עצב, שגשוג תאי, וחיזוק הרשת הנוירוגנית.
מערכת זו קשורה לתהליך הזיכרון, כאב והתמצאות. פגיעה במערכת זו מובילה להפרעות בתחושת כאב, זכרון, שינוי בהרגלי אכילה, הפרעות למידה ולעיתים מובילה להתמייינות סרטנית.
קולטני TRK, מפעיליהם - הנוירוטרופינים והמסלול הנורמלי של העברת האותות (Signal transduction) של TRK
קולטני TRK מייצגים, באופן כללי, את המבנה המוכר של קולטני טירוזין קינאז (Tyrosine kinase). קולטנים אלה מורכבים מאתר חוץ-תאי אליו נקשר הליגנד, ממבנה החוצה את ממברנת התא ומאזור תוך תאי, בעל פעילות אנזימטית של טירוזין קינאז.
קולטני TRK הם בעלי זיקה גבוהה לארבעה ליגנדים חלבוניים מקבוצת הנוירוטרופינים (Neurotrophins) הנקשרים אליהם ומפעילים אותם. הנויטרופינים ממלאים תפקידים רבים בהתפתחות ובתפקוד של מערכת העצבים. לכל אחד מהנוירוטרופינים יש ספציפיות ל-TRK מסוים והוא נקשר אליו בזיקה גבוהה.
המסלול הנורמלי של העברת האותות של TRK מתחיל כאשר קשירה של נוירוטרופין לקולטני TRK, באתר החוץ תאי גורמת להיצמדות של שני קולטנים (דימריזציה). לאחר הדימריזציה מתבצעים זירחונים של שיירי טירוזין מסוימים, הנדרשים לצורך ההפעלה של קולטן TRK ולהנעה של מסלולי העברת אותות המשכיים, היכולים להביא, בין היתר, לעליה בשגשוג תאי ולגדילה, למניעת אפופטוזיס (מוות תאי מתוכנן) ולהגדלה בשרידות תאית.
גנים מאוחים הקשורים למשפחת NTRK ומנגנונים כמניעי סרטן (Oncogenic drivers)
איחוי הגן TPM3-NTRK1, אותר בחולה עם סרטן של המעי הגס והחלחולת (CRC), בשנת 1986, ומאז זוהו, יותר מ-80 גנים מאוחים ממשפחת ה-NTRK, על פני מגוון רחב של גידולים.
מרבית האיחויים המאפיינים את ה- NTRKs מכילים אזור של הגן השותף, המקודד לאחד או יותר אתרי דימריזציה.
אתרי דימריזציה אלה מתווכים פעילות טירוזין קינאז הקורית ללא תלות בקישור של ליגנד לצורך הפעלה (זאת אומרת, פעילות קונסטיטוטיבית - Constitutive), ובכך מקנים פוטנציאל אונקוגני, באמצעות אותות, המועברים ללא-הפרעה, בהמשך המסלול, ומקדמים שגשוג תאים ושרידות. הפעלה בלתי מבוקרת זו של מסלול העברת האותות, עלולה לגרום לסרטן או לסייע בהתפתחותו.
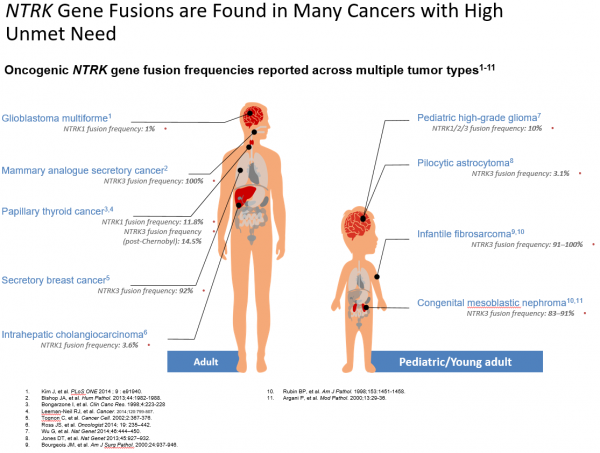
מחלות סרטן עם איחויי NTRKs
מספר מחלות סרטן נדירות מציגות שכיחות גבוהה (מעל 80 אחווזים) של איחויי NTRKs, בעוד שמחלות סרטן נפוצות יותר, מראות שכיחות נמוכה יותר (פחות מ-25 אחוזים) של איחויי NTRKs. ההערכה הכללית היא כי איחויי NTRKs קורים בעד 1 אחוז מכלל הגידולים המוצקים. מסתמן, כי אירועי איחוי גנים קורים בצורה נפוצה יותר עם NTRK1 ו-NTRK3, למעט כנראה, בגידולים במוח.
מחלות סרטן נדירות
נמצא כי האיחוי ETV6-NTRK3 מופיע בכ-70% מהמקרים של פיברוסרקומה של תינוקות (Infantile fibrosarcoma – IFS) . המחלה מייצגת פחות מ-1 אחוז מכלל מחלות הסרטן בילדים, אך היא הסרקומה של רקמות רכות (שאינה רבדומיוסרקומה), הנפוצה ביותר בילדים מתחת לגיל שנה. כמו כן נמצא האיחוי במחלה זהה היסטולוגית ל-IFS, נפרומה מזובלסטית מולדת (Congenital mesoblastic nephroma – CMN), גידול מסוג תאי ציר (Spindle) של הכליה, אשר קורה באותה קבוצת גיל ומייצג כ-5 אחוזים מכלל מחלות הסרטן של הכליה בילדות.
האיחוי ETV6-NTRK3 נתגלה מאוחר יותר אף בשתי מחלות נדירות נוספות, בקרצינומה מפרישה של השד (Secretory breast carcinoma – SBC) המהווה כ-0.15 אחוז מכלל סרטני השד ובקרצינומה מפרישה של בלוטות הרוק (Mammary analogue secretory carcinoma - MASC).
סוגים נפוצים של סרטן
איחויי NTRKs בסוגי סרטן נפוצים, מופיעים בשכיחות נמוכה יחסית, ואותרו בסרטן פפילרי של בלוטת התריס (Papillary thyroid cancer - PTC), סרטן המעי הגס והחלחולת (CRC), סרטן התוספתן ((Appendix cancer, סרטן ריאות של תאים לא-קטנים (Non-small cell lung cancer - NSCLC), סרקומה (Sarcoma), מלנומה (Melanoma) ובמחלות סרטן של מערכת העצבים המרכזית - כולל גליובלסטומה רב-צורנית (Glioblastoma multiforme – GBM) וגליומות ואסטרוציטומות פדיאטריות.
בנוסף לכך, נמצא כי מחלות סרטן נפוצות המעגנות איחויים של NTRKs, כמו סרטני ריאות ומלנומות נמצאו כבעלי נטייה לגרורות במערכת העצבים המרכזית.
מחלות סרטן אחרות
איחויים של NTRKs דווחו בסרטן תוך-כבדי של דרכי המרה (Intrahepatic cholangiocarcinoma), בסרטני כיס המרה (Gallbladder adenocarcinomas), בסרטן שד (Breast cancer), בגידולים סטרומליים גסטרואינטסטינליים (Gastrointestinal stromal tumours - GIST), בסרטני לבלב (Pancreatic carcinomas), בגידולים נוירואנדוקריניים של המעי הדק, ועוד. בנוסף לנוכחות בגידולים מוצקים, איחויים של NTRKs אותרו בלוקמיה לימפובלסטית חריפה (Acute lymphoblastic leukaemia - ALL) ולוקמיה מיאלואידית חריפה (Acute myeloid leukaemia - AML) בשכיחות של פחות מ-5 אחוזים.
טיפול מכוון מטרה עם מעכבי TRKs במחלות סרטן עם איחויי NTRKs
מעכבי Tyrosine kinase (TKIs) כמעכבי קולטני TRKs
ניסויים פרה-קליניים עם מעכבים של קולטני TRK וניסויים קליניים נוספים, עם מעכבים של טירוזין קינאז (TKIs), אישרו את התפקיד שממלאים איחויים של NTRKs כמניעים אונקוגניים (Oncogenic drivers) .
מספר TKIs עם דרגות שונות של פעילות כנגד TrkB ,TrkA ו\או TrkC, ניתנים לסיווג כמעכבי קינאזות מרובות (מולטי-קינאזות) עם פעילות כנגד טווח רחב של יעדים, בכללם TRKs. קבוצת מעכבי המולטי-קינאזות כוללת את קריזוטיניב (crizotinib), קבוזנטיניב (cabozantinib), אנטרקטיניב (entrectinib) ועוד.
המעכב הסלקטיבי היחיד של TRKs, הנמצא בשימוש הוא Larotrectinib.
מעכבי TRKs מהדור הראשון, שאושרו לשיווק בארצות הברית ובישראל, עבור טיפול בגידולים מוצקים, המעגנים איחויים של NTRKs, ללא מוטציות עמידות, הם לרוטרקטיניב (ויטראקבי, באייר ישראל) אשר אושר לשיווק עבור טיפול בכל הגילאים ואנטרקטיניב (רוזליטרק, רוש ישראל) אשר אושר לשיווק עבור טיפול בילדים מגיל 12 שנים ובמבוגרים.
ניסויים פרה-קליניים של לרוטרקטיניב (larotrectinib) ואנטרקטיניב (entrectinib)
על בסיס ניסויים במבחנה (In vitro) לרוטרקטיניב ואנטרקטיניב עיכבו קולטני TRK בריכוזים ננומולריים נמוכים ונמצאו יעילים ביותר, בעיכוב גדילה של תאים שעברו התמרה (טרנסדוקציה) עם איחויי NTRKs שונים ושל קווי תאים של סרטן ראשוני שעיגנו סידור-מחדש של NTRKs, במבחנה ובעכברים.
טיפול במודלים של סרטן שהכילו גנים מאוחים של NTRKs, הביאו לעיכוב של מסלולי העברת אותות, המובילים להתפתחות סרטן.
ניסויים קליניים של לרוטרקטיניב (larotrectinib) ואנטרקטיניב (entrectinib)
לרוטרקטיניב הוא מעכב פומי פוטנטי וסלקטיבי של שלושת קולטני ה-TRK.
הפעילות של לרוטרקטיניב בחולים עם גידולים בעלי איחויים של NTRKs נחקרה ב-3 ניסויים קליניים שכללו חולים פדיאטריים, מתבגרים ומבוגרים.
55 חולים עם גידולים מוצקים נכללו באנליזה הראשונית ו-159 חולים נחקרו במסגרת אנליזה מרוכזת. גידולים של בלוטות הרוק (22 אחוזים), סרקומה של רקמות רכות (20 אחוזים), פיברוסרקומה של תינוקות (IFS) (13 אחוזים) וסרטן של בלוטת התריס (9 אחוזים), היו הגידולים הנפוצים ביותר.
שיעור התגובה האובייקטיבית (Objective Response Rate - ORR) היה כ-80 אחוזים, ושיעור התגובה המלאה (Complete Response - CR) היה 16 אחוזים. תופעות הלוואי הרציניות הנפוצות ביותר, שהיו קשורות לטיפול, היו עליות ברמות אנזימי כבד ובחילה.
אף על פי שרוב החולים בניסויים קיבלו לרוטרקטיניב עבור מחלה גרורתית, במספר חולים הייתה מחלה מקומית מתקדמת, למשל 2 ילדים עם IFS של הברך, שחוו הצטמקות משמעותית של הגידולים עם הטיפול, מה שמנע כריתה של הגפיים. מקרים אלה מבליטים את השימוש הפוטנציאלי של עיכוב TRK, כטיפול נאו-אדג'ובנטי עבור חולים עם איחויים של NTRKs ועם מחלה שאינה גרורתית.
אנטרקטיניב, שייך לקבוצת מעכבי המולטי קינאזות ואף הוא מעכב פומי של כלל ה-TRKs, עם פעילות נוספת כנגד ROS1 ו-ALK. תוצאות אנליזה מרוכזת של ניסויים קליניים עם אנטרקטיניב, בחולים מבוגרים עם גידולים מוצקים מתקדמים או גרורתיים, ועם איחויי NTRKs, הראו שיעור תגובה אובייקטיבית (ORR) של 57 אחוזים ושיעור תגובה מליאה (CR) של 7 אחוזים. תופעות הלוואי הרציניות הנפוצות ביותר, הקשורות לטיפול, היו הפרעות במערכת העצבים.
עמידות לטיפול
עמידות ללרוטרקטיניב ולאנטרקטיניב עלולה להתרחש על ידי התפתחות של מוטציות ב-NTRKs. מעכבי TRKs מדור-שני, למשל סליטרקטיניב (selitrectinib, Bayer/Loxo) נמצאים תחת פיתוח קליני, תוך התבססות על יכולתם להתגבר על עמידות נרכשת, המתווכת על ידי מוטציות נרכשות ב-NTRKs.
הבהרה:
- אין באמור לעיל, משום ייעוץ או המלצה רפואית או תרופתית כלשהם, והמידע אינו בא להחליף בדיקה וייעוץ על ידי רופא מומחה או טיפול תרופתי
- בכל עניין רפואי או תרופתי, יש לפנות לרופא המטפל
ביבליוגרפיה
- ↑ https://esmoopen.bmj.com/content/esmoopen/1/2/e000023.full.pdf
- ↑ Amatu A, SartoreBianchi A, Siena S. NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open 2016;1:e000023. doi:10.1136/esmoopen-2015- 000023
- ↑ Amatu A, et al. ESMO Open 2016;1:e000023. doi:10.1136/esmoopen-2015-000023
- The impact of translocations and gene fusions on cancer causation: Mitelman F et al., Nat Rev Cancer. 2007 Apr; 7(4):233-45.
- Detecting and targeting oncogenic fusion proteins in the genomic era: Davare MA & Tognon CE., Biol Cell. 2015 May; 107(5):111-29.
- NTRK fusion-positive cancers and TRK inhibitor therapy: Cocco E et al., Nat Rev Clin Oncol. 2018 Dec; 15(12):731-747.
- Gene fusions and chimeric RNAs, and their implications in cancer: Wu H et al., Genes Dis. 2019 Aug 30; 6(4):385-390.
- Tropomyosin receptor kinase (TRK) biology and the role of NTRK gene fusions in cancer:Amatu A et al., Ann Oncol. 2019 Nov; 30 Suppl 8:viii5-viii15.
- NTRK Fusions in Central Nervous System Tumors: A Rare, but Worthy Target: Gambella A et al., Int J Mol Sci. 2020 Jan 23; 21(3). pii: E753.
- Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials: Hong DS et al., Lancet Oncol. 2020 Apr; 21(4):531-540.
- Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials: Doebele RC et al., Lancet Oncol. 2020 Feb; 21(2):271-282.
המידע שבדף זה נכתב על ידי ד"ר צחי הרץ B.Pharm. Ph.D., יועץ בנושאי תרופות ותוספי תזונה, פרופ ניר פלד, מנהל המחלקה לאונקולוגיה , סורוקה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק