דימות שד צפוף - Dense breast tissue imaging
הופניתם מהדף דימות שד צפוף לדף הנוכחי.
| דימות שד צפוף | ||
|---|---|---|
| Dense breast tissue imaging | ||

| ||
| יוצר הערך | ד"ר זהבה גלימידי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
רקמת השד מורכבת מרקמה בלוטית, רקמת חיבור ושומן. בגיל צעיר יש כמות רבה יותר של רקמה בלוטית בשד, ואילו בגיל מבוגר יותר (לאחר גיל המעבר), יש כמות רבה יותר של רקמה שומנית. לעיתים, גם אצל נשים מבוגרות (באחוז מסוים) כמות רקמת השד הפיברוטית-חיבורית רבה יותר מכמות רקמת השומן[1]. ריבוי רקמה פיברוטית ובלוטית יוצר מראה של שד צפוף (ולבן) בממוגרפיה (Mammography), ואילו רקמה שומנית נראית "שקופה" בצילום רנטגן, ושחורה יותר בממוגרפיה. על רקע זה קל יותר לראות הסתיידויות וגידולים, שמתאפיינים במרבית המקרים בצפיפות גבוהה.
שד צפוף מהווה אתגר רדיולוגי לא פשוט. רקמת שד צפופה מפחיתה במידה ניכרת את רגישות בדיקת הממוגרפיה ועדיין אין לוותר על בדיקה זו, מכיוון שהיא הבדיקה הטובה ביותר לזיהוי הסתיידויות בשד. גם אצל נשים עם שד צפוף, ניתן לגלות הסתיידויות זעירות - מיקרוקלציפיקציות, היכולות להוות את הסימן הראשון לסרטן מסוג DCIS (Ductal Carcinoma In Situ). עם זאת, במקרים של שד צפוף, כאשר יכולת בדיקת הממוגרפיה לגלות גושים נמוכה, יש צורך בבדיקות דימות נוספות לצורכי אבחון. במרבית המקרים הבדיקה הראשונה שתבוצע היא בדיקת אולטרסאונד (US, Ultrasound), ולנשים הנמצאות בסיכון גבוה, תתבצע גם בדיקת תהודה מגנטית (MRI, Magnetic Resonance Imaging). טכנולוגיות חדשות שפותחו לאחרונה, פותחות אפשרויות רבות, ביניהן ביצוע בדיקות המותאמות אישית לנבדקת, בהתאם לגורמי הסיכון ולמצבה הקליני.
שד צפוף ומשמעותו
שד צפוף מכיל יותר רקמה בלוטית/פיברוטית ופחות רקמת שומן. קשה מאוד להעריך את צפיפות רקמת השד על ידי מישוש. ההערכה מתבצעת בעיקר באמצעות בדיקת ממוגרפיה. הרדיולוג מעריך את צפיפות רקמת השד בהתאם ללקסיקון של הקולג׳ האמריקאי לרדיולוגיה (ACR, American College of Radiology), בו נקבע סולם בן ארבע דרגות הקרוי BI-RAD (Breast Imaging and Reporting System)[2]:
- BI-RAD דרגה 1:
- פחות מ-25% רקמת שד צפופה
- BI-RAD דרגה 2:
- בין 26% ל-50% רקמת שד צפופה
- BI-RAD דרגה 3:
- בין 51% ל-75% רקמת שד צפופה
- BI-RAD דרגה 4:
- יותר מ-75% רקמת שד צפופה
כאשר צפיפות רקמת השד היא בדרגה של 1-2, השד אינו נחשב צפוף. לעומת זאת כאשר צפיפות רקמת השד מוערכת בממוגרפיה בדרגה 3-4, השד נחשב צפוף, גורם המעלה את הסיכון לפתח סרטן שד, ומוריד את רגישות בדיקת הממוגרפיה.
- ירידה ברגישות בדיקת הממוגרפיה
צפיפות רקמת שד גבוהה מורידה את רגישות בדיקת הממוגרפיה, שכן רקמת שד צפופה וגושים בשד, נראים בממוגרפיה לבנים. מסיבה זו, כאשר ישנו גוש ברקמת שד צפופה (לבנה), הוא "נבלע" ברקע הלבן ולא ניתן להבדיל ביניהם. במחקר שנערך על ידי מנדלסון ושותפיה[3] הראו החוקרים שכאשר רקמת השד היא בעיקר שומנית, רגישות בדיקת הממוגרפיה עומדת על כ-80%. רגישות זאת צונחת ב-30%, כאשר השד צפוף מאוד.
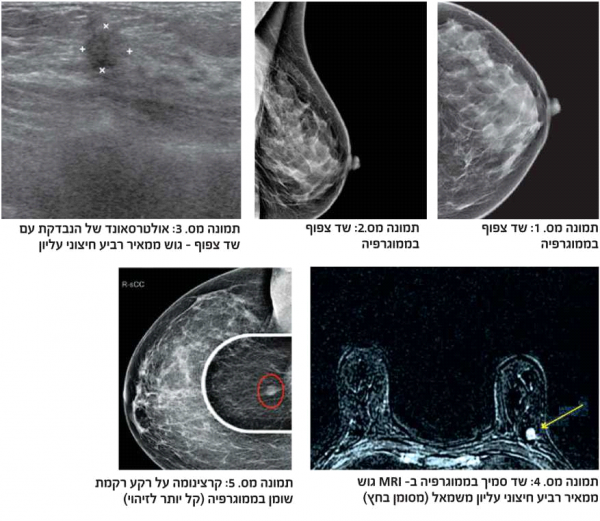
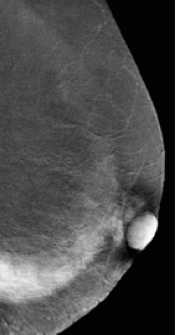
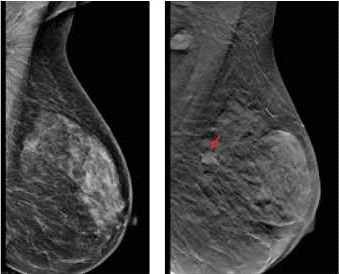
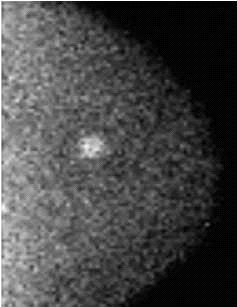
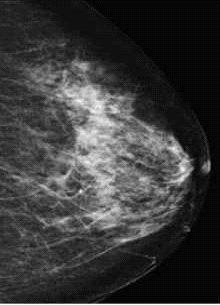
דוגמה לכך ניתן לראות בתמונות 1-4 בהן נראית רקמת שד צפופה (ללא גורמי סיכון נוספים), כפי שהיא משתקפת בממוגרפיה. בבדיקה זו לא נראה ממצא חשוד, אך בבדיקת האולטרסאונד נמצאה קרצינומה בגודל של 0.7 ס"מ (סנטימטר) בשד שמאל, ברביע החיצוני העליון. אותו ממצא נראה גם ב-MRI. לעומת זאת, תמונה מספר 5 היא דוגמה של בדיקת ממוגרפיה בה נראית קרצינומה על רקע של רקמת שד שומנית, עובדה המקלה על גילוי גידול מסוג זה.
- צפיפות שד גבוהה כגורם המעלה את הסיכון לחלות בסרטן השד
הקשר בין צפיפות גבוהה של השד בממוגרפיה וסיכון מוגבר לפתח סרטן שד תואר על ידי חוקרים שונים[4],[5],[6],[7],[8], כאשר הראשון שתיאר זאת היה וולף[9] בשנת 1976.
מהנתונים שהתקבלו מ-CBDIG (California Breast Density Information Group)[10] עולה, כי ישנם חוקרים הטוענים שצפיפות גבוהה של השד מעלה את הסיכון לסרטן השד פי 4-6, ואילו אחרים סבורים שרמת הסיכון לפתח סרטן שד בשל שד צפוף, פחותה יותר.
נתונים נוספים שהתקבלו מה-CBDIG מצביעים על כך של-10% מהנשים יש שד צפוף מאוד (דרגה 4), והן נמצאות בדרגת סיכון כפולה לחלות בסרטן שד, מאשר נשים שאצלן רקמת השד צפופה פחות. כמו כן, נתון נוסף מצביע על כך שלנשים רבות (כ-40% מאוכלוסיית הנשים) יש שד צפוף הטרוגני (דרגה 3) ולהן יש סיכוי של פי 1.2 לחלות בסרטן השד.
רקמת שד צפופה נחשבת לגורם סיכון בינוני המעלה את הסיכון לחלות בסרטן השד (גורם סיכון גבוה, כגון נשאות גנטית, מעלה את הסיכון לחלות בסרטן השד בשיעור של 20% ואף למעלה מזה). בשל מורכבות הנושא, הועבר במספר מדינות בארצות הברית חוק המחייב את הרדיולוגים לדווח לנשים שנבדקו בבדיקה זו, מהי דרגת צפיפות רקמת השד, על מנת שיופנו להתייעצות ובדיקות סריקה נוספות, כמו אולטרסאונד ו-MRI (כמפורט באתר D.E.N.S.E Are You Dense Advocacy)[11]. בישראל, לעומת ארצות הברית, לא קיים חוק כזה אולם נהוג לדווח לאישה לאחר הבדיקה, מהי דרגת צפיפות השדיים שלה. לפרמטר של צפיפות השד אין השפעה על היכולת לזהות גידולים ברקמת השד באמצעי דימות אחרים לרבות אולטרסאונד, MRI או מיפוי איזוטופי של השד.
חשיבות הממוגרפיה הדיגיטלית בשד צפוף
הממוגרפיה היא שיטת הסריקה היחידה שהוכיחה את תרומתה בהפחתת התמותה מסרטן השד, באוכלוסייה רחבת היקף. אולם כאמור, רגישות הבדיקה יורדת מאוד כאשר מדובר בשד צפוף. עם זאת, אחת המסקנות שעולה ממחקר DMIST (Digital Mammographic Imaging Screening)[12], בו בוצעה השוואה בין ממוגרפיה דיגיטלית ואנאלוגית באוכלוסייה של 49,528 נשים, שביצעו את שני סוגי הממוגרפיה, היא, שלממוגרפיה דיגיטלית יש יתרון בגילוי סרטן השד כאשר השד צפוף. בניגוד לממוגרפיה אנאלוגית, הדטקטור הדיגיטלי קולט את קרני הרנטגן כאותות חשמליים ולכן התמונה מתקבלת ישירות בצורה דיגיטלית, וניתן לפענחה על גבי תחנת עבודה ייעודית ולא על גבי סרטי צילום. הפענוח על תחנת העבודה מאפשר להגדיל ממצאים חשודים, לשנות את בהירות התמונה מבלי לחשוף את הנבדקת לקרינה נוספת, וכן לשמר את התמונה בארכיון דיגיטלי. כמו כן כשהתמונות דיגיטליות, ניתן להתקין תוכנות היכולות לשמש כלי עזר לאיתור ממצאים חשודים בשד.
בדיקות סריקה נוספות לשד צפוף
- אולטרסאונד ידני (Hand held US)
זוהי בדיקה נפוצה וזמינה שאינה דורשת הזרקת חומר ניגוד ואינה כרוכה בקרינה מייננת. בדיקת האולטרסאונד מבוססת על שליחת גלי קול על ידי מתמר לאיברים בגוף וקליטתם בחזרה. כמות האנרגיה החוזרת תלויה במאפיינים הספציפיים של כל רקמה וכך נוצרת תמונת האולטרסאונד. התהליך דומה לפעולת הרדאר. כדי לבצע אולטרסאונד של השד יש צורך במתמר היכול לשלוח גלי קול בתדר גבוה (לפחות) 7 MHz (מגה־הרץ) המתאים להדמיית איברים שטחיים יותר כדוגמת השד.
חסרונות הבדיקה: הבדיקה ארוכה יחסית ותלויה במידה רבה במיומנות המבצע. במחקר של Kolb[13] משנת 1998, נמצא שבבדיקת אולטרסאונד לנשים עם שד צפוף, שתוצאות בדיקת הממוגרפיה שלהן הייתה תקינה ניתן לאבחן עוד שלושה מקרי סרטן שד לכל 1,000 נשים. הגידולים שהתגלו באולטרסאונד לא היו שונים מבחינת גודלם והפיזור שלהם, לעומת הגידולים הלא-נמושים (שלא ניתן למשש אותם) שנמצאו בממוגרפיה.
במחקרים נוספים שבוצעו למשל על ידי קריסטל[14] או לקונט[15], נמצא שהאולטרסאונד הוא כלי יעיל בגילוי סרטן השד בנשים עם שד צפוף, במיוחד כאשר מדובר בנשים הנמצאות בסיכון גבוה לפתח מחלה זו. במחקר אחר שנערך על ידי החוקר Blume, 6666 Imaging Network ACRIN[16], נבדקו 2,809 נשים עם שד צפוף וסיכון מוגבר לפתח סרטן שד. נמצא, שהוספה של בדיקת אולטרסאונד מעבר לבדיקת הממוגרפיה, הביאה לגילוי מוגבר של סרטן השד, בשיעור של 1.1-7.2 מקרים, ל-1,000 נשים המצויות בסיכון. מאידך, שימוש בבדיקה זו עלול להגביר את שיעור התוצאות החיוביות השגויות (False positive result), דבר העלול לגרום לבדיקות מעקב רבות, ובדיקות ביופסיה מיותרות.
- אולטרסאונד אוטומטי (AWBUS, Automated Whole Breast Ultrasound System)
זוהי בדיקת אולטרסאונד המתבצעת באמצעות מתמר הנע בצורה אוטומטית-רובוטית על גבי משטח המונח על השד. לאחר מכן ניתן לבצע שחזור תלת מימדי של בדיקה זו (תמונות 6-7). בדיקה זו מהווה בדיקה משלימה לממוגרפיה, והיא אינה באה במקומה. לפי מחקרים שונים[17], שיעור גילוי סרטן השד בבדיקת אולטרסאונד אוטומטי לנשים עם שד צפוף, דומה לשיעור הגילוי בבדיקת אולטרסאונד ידנית, ועומד על 3.6 מקרים של סרטן שד שמתגלים לכל 1,000 נבדקות, עם ערך חיזוי חיובי גבוה יותר, בשיעור של 38%.
חשוב לציין שמכשיר האולטרסאונד האוטומטי הוא אותו מכשיר באמצעותו מתבצעת סריקה ידנית. השוני היחיד בין שתי השיטות מתבטא בטכניקת איסוף התמונות, שמתבצעת על ידי המכשיר בצורה אוטומטית. בשיטה זו הרדיולוג אינו מבצע את הבדיקה בעצמו, אלא מפענח את הצילומים על גבי מסך אחרי הבדיקה. אם מתגלה ממצא חשוד בבדיקת האולטרסאונד האוטומטי, יש צורך לבצע בדיקה ידנית ממוקדת לממצא, על מנת להגדיר אותו ואת מאפייניו, ולבצע ביופסיה במידת הצורך.
- בדיקה באמצעות MRI
לפי מחקרים שונים[18],[19],[20] ביניהם עבודותיה של Khul, נמצא כי בדיקת MRI יעילה יותר מממוגרפיה ואולטרסאונד בגילוי מוקדם של סרטן השד, בקרב נשים הנמצאות בסיכון גבוה (בשל נשאות גנטית או סיפור משפחתי). עם זאת, MRI שדיים היא בדיקה בעלת שיעור גבוה מאוד של ממצאים חיוביים שגויים (False positive result), המגיעים עד ל-30%, ויש לקחת נתון זה בחשבון כאשר דנים ביתרונות ובחסרונות של הבדיקה.
במחקר שנערך על ידי Berg ושותפיה[21] נמצא שבדיקת MRI שדיים, בנוסף לבדיקות הסקר האחרות ממוגרפיה ואולטרסאונד, יעילה למדי לנשים בסיכון גבוה עם שד צפוף: היא יכולה לגלות עוד 14.7 מקרים של סרטן השד לכל 1,000 נשים. חשוב להדגיש שהנתונים בספרות המקצועית לגבי חשיבות בדיקת ה-MRI כבדיקת סריקה בנשים עם שד צפוף, מתייחסים בעיקר לנשים בסיכון גבוה (המודלים לחישוב הסיכון לחלות בסרטן השד מפורטים במקורות[22],[23],[24],[25]). בנוסף, לפי המלצות הקולג׳ האמריקאי לרדיולוגיה, לנשים בסיכון גבוה מומלץ לבצע בדיקת MRI כבדיקת סריקה[26]. יודגש שמרקם צפוף של השד בלבד (ללא גורמי סיכון נוספים), אינו נחשב כשלעצמו גורם סיכון גבוה המחייב הוספת בדיקת MRI כבדיקת סריקה באופן שגרתי.
הקריטריונים לפיהם נקבע מי הן הנשים הנמצאות בסיכון גבוה ללקות בסרטן השד הם:
- נשים שהן נשאיות של מוטציות בגנים BRCA1/2
- קרובת משפחה מדרגה ראשונה (שטרם נבדקה) של נשאית BRCA
- נשים שקיבלו טיפול באמצעות קרינה לאזור בית החזה, בין הגילאים 10-30
- נשים שלהן סיכון של למעלה מ-20% לפתח סרטן השד במהלך חייהן
נשים בסיכון בינוני וסיכון רגיל
נשים שחלו בעבר בסרטן שד מסוג לובולר (Lobular), ניאופלזיה (Neoplasia) ואטיפיה (Atypia) נמצאות ברמת סיכון בינוני. לפי האגודה האמריקאית לסרטן[27], שד צפוף מהווה גורם סיכון בינוני לפתח סרטן שד במשך החיים, בשיעור שנע בין 15% ל-20%. למרות זאת, לפי הנחיותיה של אגודה זו אין מספיק נתונים בקבוצת סיכון זאת על מנת לתמוך או לשלול ביצוע של בדיקת MRI. נכון לעכשיו, אין הנחיה של משרד הבריאות בישראל לבצע בדיקת MRI לנשים עם שד צפוף, ללא גורמי סיכון אחרים. על פי ארגוני בריאות אחרים בעולם אין צורך לבצע בדיקת MRI לנשים שלהן סיכון הנמוך מ-15% לחלות בסרטן השד ורקמת השד שלהן אינה צפופה.
שיטות הדמיה נוספות
קיימות היום שיטות הדמיה אחרות באמצעותן ניתן להתגבר על הבעיה של שד צפוף וגורמי סיכון נוספים:
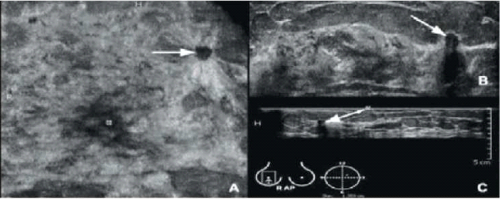
- ממוגרפיה עם חומר ניגוד (Contrast enhanced mammography)
בשיטה זו מזריקים חומר ניגוד (על בסיס יוד) ומצלמים את השד בשתי רמות אנרגיה (Dual energy). בדומה ל-MRI, ניתן לגלות בבדיקה זו גושים או ממצאים שזרימת הדם אליהם מוגברת (תמונות 8-8א).
לפי מחקר שבוצע[28] בשנת 2012 על ידי החוקר Dromain, נמצא כי בדיקת ממוגרפיה עם חומר ניגוד המתווספת לבדיקת ממוגרפיה רגילה ולבדיקה באמצעות אולטרסאונד, יכולה לשפר את רגישות הבדיקה באופן משמעותי: מ-71% בלבד, ל-78%.
- טומוסינתזיס (Digital breast tomosynthesis)
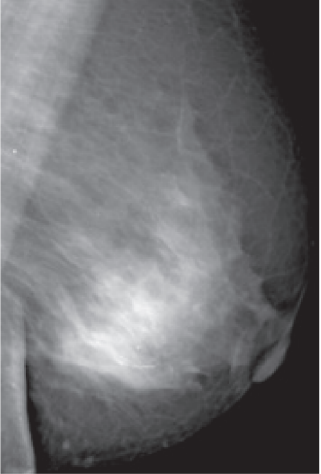
טומוסינתזיס היא שיטה של ממוגרפיה דיגיטלית בה מצלמים את השד במספר זוויות במטרה למנוע חפיפה של רקמות השד אחת על גבי השנייה, כמו בממוגרפיה הרגילה. בשיטה זאת נוצרים חתכים טומוגרפים בדומה לבדיקת טומוגרפיה ממוחשבת (CT, Computed Tomography).
שיטה זאת הוכחה כמפחיתה הן את אחוז הקריאה החוזרת והן את אחוז התוצאה השלילית השגויה (FN, False Negative result) בשד הצפוף (תמונה 9). חסרון השיטה מתבטא בכמות הקרינה; בבדיקה זו כמות הקרינה גבוהה יותר לעומת כמות הקרינה בבדיקת ממוגרפיה דיגיטלית רגילה.
- מיפוי איזוטופי של השד
במיפוי איזוטופי של השד נעשה שימוש בשתי שיטות:
- Positron Emission Mammography - PEM
- Breast Specific Gamma Imaging - BSGI
שתי השיטות מבוססות על פעילות מטבולית בשד, ולשתיהן ערך ניבוי חיובי (PPV, Positive Predictive Value) גבוה וערך ניבוי שלילי (NPV, Negative Predictive Value) נמוך. השיטות הללו אינן תלויות בצפיפות השד, כמות הקרינה בהן גבוהה יחסית, והן אינן נחשבות כבדיקות סריקה סטנדרטיות (תמונות 10-11).
ביבליוגרפיה
- Drukteinis JS, Mooney BP, Flowers CI, Gatenby RA. Beyond mammography: new frontiers in breast cancer screening. Am J Med. 2013 Jun;126(6):472-9. Epub 2013 Apr 3.
- ↑ Kopans DB. Breast Imaging. Third edition. Philadelphia: Lippincott Williams; 2007.
- ↑ D'Orsi CJ, Sickles EA, Mendelson EB, et al. ACR BI-RADS® Atlas, Breast Imaging Reporting and Data System. Reston: American College of Radiology; 2013.
- ↑ Mandelson MT, Oestreicher N, Porter PL, et al. Breast density as a predictor of mammographic detection: comparison of interval- and screen-detected cancers. J Natl Cancer Inst. 2000 Jul 5;92(13):1081-7.
- ↑ Byng JW, Yaffe MJ, Jong RA, et al. Analysis of mammographic density and breast cancer risk from digitized mammograms. Radiographics. 1998 Nov-Dec; 18(6): 1587-98.
- ↑ Vachon CM, van Gils CH, Sellers TA, et al. Mammographic density, breast cancer risk and risk prediction. Breast Cancer Res. 2007;9(6):217.
- ↑ Schreer I. Dense breast tissue as an important risk factor for breast cancer and implications for early detection. Breast Care (Basel). 2009;4(2):89-92. Epub 2009 Apr 24.
- ↑ Pinsky RW, Helvie MA. Mammographic breast density: effect on imaging and breast cancer risk. J Natl Compr Cane Netw. 2010 Oct;8(10):1157-64.
- ↑ Boyd NF, Guo H, Martin LJ, et al. Mammographic density and the risk and detection of breast cancer. N Engl J Med. 2007 Jan 18;356(3):227-36.
- ↑ Wolfe JN. Breast patterns as an index for developing breast cancer. AJR Am J Roentgenol. 1976 Jun;126(6):1130-7.
- ↑ Lipson JA, Hargreaves J, Price ER, et al. The California breast density information group: a collaborative response to the issues of breast density, breast cancer risk, and breast density notification legislation. Radiology. 2013 Dec;269(3):887-92. Epub 2013 Oct 28. Available from: http://breastdensity.info
- ↑ Are You Dense Advocacy. Are You DENSE? D.N.E.S.E® State Efforts [Internet]. Connecticut: Are you Dense Inc.; 2011 [Last updated 2014]. Available from: http://www.areyoudenseadvocacy.org/
- ↑ Pisano ED, Hendrick RE, Yaffe MJ, etal. Diagnostic accuracy of digital versus film mammography: exploratory analysis of selected population subgroups in DMIST. Radiology. 2008 Feb;246(2):376-83.
- ↑ Kolb TM, Lichy J, Newhouse JH. Occult cancer in women with dense breasts: detection with screening US-diagnostic yield and tumor characteristics. Radiology. 1998 Apr;207(1): 191-9.
- ↑ Crystal P, Strano SD, Shcharynski S, Koretz MJ. Using sonography to screen women with mammographically dense breasts. AJR Am J Roentgenol. 2003 Jul; 181 (1): 177-82.
- ↑ Leconte I, Feger C, Galant C, et al. Mammography and subsequent whole-breast sonography of nonpalpable breast cancers: the importance of radiologic breast density. AJR Am J Roentgenol. 2003 Jun;180(6):1675-9.
- ↑ Berg WA, Blume JD, Cormack JB, et al. Combined screening with ultrasound and mammography vs mammography alone in women at elevated risk of breast cancer. JAMA. 2008 May 14;299(18):2151-63.
- ↑ Kelly KM, Dean J, Comulada WS, Lee SJ. Breast cancer detection using automated whole breast ultrasound and mammography in radiographically dense breasts. Eur Radiol. 2010 Mar;20(3):734-42. Epub 2009 Sep 2.
- ↑ Plevritis SK, Kurian AW, Sigal BM, et al. Cost-effectiveness of screening BRCA1/2 mutation carriers with breast magnetic resonance imaging. JAMA. 2006 May 24;295(20):2374-84.
- ↑ שםהערה19
- ↑ Kuhl CK, Schrading S, Leutner CC, et al. Mammography, breast ultrasound, and magnetic resonance imaging for surveillance of women at high familial risk for breast cancer. J Clin Oncol. 2005 Nov 20;23(33):8469-76.
- ↑ Berg WA, Zhang Z, Lehrer D, et al. Detection of breast cancer with addition of annual screening ultrasound or a single screening MRI to mammography in women with elevated breast cancer risk. JAMA. 2012 Apr 4;307(13): 1394-404.
- ↑ Gail MH, Brinton LA, Byar DP, et al. Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst. 1989 Dec 20;81 (24): 1879-86.
- ↑ Claus EB, Risch N, Thompson WD. Autosomal dominant inheritance of early-onset breast cancer. Implications for risk prediction. Cancer. 1994 Feb 1;73(3):643-51.
- ↑ Berry DA, Inversen ES Jr, Gudbjartsson DF, et al. BRCAPRO validation, sensitivity of genetic testing of BRCA1/BRCA2, and prevalence, of other breast cancer susceptibility genes. J Clin Oncol. 2002 Jun 1 ;20(11):2701-12.
- ↑ Tyrer J, Duffy SW, Cuzick J. A breast cancer prediction model incorporating familial and personal risk factors. Stat Med. 2004 Apr 15;23(7): 1 111 -30.
- ↑ Mainiero MB, Lourenco A, Mahoney MC, et al ACR Appropriateness Criteria® breast cancer screening [Internet]. Reston: American College of Radiology (ACR); 2012. Available from: http://www.acr.0rg/~/ media/ACR/Documents/AppCriteria/Diagnostic/ BreastCancerScreening.pdf
- ↑ American Cancer Society. Breast cancer: early detection [Internet]. Atlanta: American Cancer Society; 2014. Available from: http://www. cancer.org/cancer/breastcancer/moreinformation/ breastcancerearlydetection/
- ↑ Dromain C, Thibault F, Diekmann F, et al. Dual-energy contrast-enhanced digital mammography: initial clinical results of a multireader, multicase study. Breast Cancer Res. 2012 Jun 14;14(3):R94.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר זהבה גלימידי - מנהלת היחידה לדימות השד, הקריה הרפואית לבריאות האדם רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק