הבדלים בין גרסאות בדף "דלקת מפרקים שגרונתית - טיפולים חדשים - New therapies for rheumatoid arthritis"
(←אבחון) |
|||
| שורה 15: | שורה 15: | ||
{{הרחבה|דלקת מפרקים}} | {{הרחבה|דלקת מפרקים}} | ||
| − | [[דלקת מפרקים שגרונתית]] (Rheumatoid arthritis) היא מחלת חיסון עצמי (Autoimmune disease) דלקתית, כרונית ורב מערכתית, אשר הגורם לה אינו ידוע. המחלה מתאפיינת בדלקת ממושכת ושגשוגית של הרקמה הסינוביאלית (Synovial tissue) ומעורבות דלקתית של איברים שונים. היא נחשבת למחלת המפרקים הדלקתית השכיחה ביותר, כאשר 1%{{כ}}-0.5 מהאוכלוסייה הבוגרת לוקים בה. המחלה מאובחנת בדרך כלל בטווח גילאי 60-{{כ}}40 שנים, ושכיחותה בקרב נשים גבוהה פי שניים-שלושה בהשוואה לגברים. | + | '''[[דלקת מפרקים שגרונתית]]''' (Rheumatoid arthritis) היא מחלת חיסון עצמי (Autoimmune disease) דלקתית, כרונית ורב מערכתית, אשר הגורם לה אינו ידוע. המחלה מתאפיינת בדלקת ממושכת ושגשוגית של הרקמה הסינוביאלית (Synovial tissue) ומעורבות דלקתית של איברים שונים. היא נחשבת למחלת המפרקים הדלקתית השכיחה ביותר, כאשר 1%{{כ}}-0.5 מהאוכלוסייה הבוגרת לוקים בה. המחלה מאובחנת בדרך כלל בטווח גילאי 60-{{כ}}40 שנים, ושכיחותה בקרב נשים גבוהה פי שניים-שלושה בהשוואה לגברים. |
בדומה למחלות חיסון עצמי אחרות, למרות שהגורם המשרה את המחלה אינו ידוע, קיימת חשיבות לגורמים סביבתיים, חיסוניים, הורמונאליים ותורשתיים להתפתחות המחלה ולקביעת חומרתה. | בדומה למחלות חיסון עצמי אחרות, למרות שהגורם המשרה את המחלה אינו ידוע, קיימת חשיבות לגורמים סביבתיים, חיסוניים, הורמונאליים ותורשתיים להתפתחות המחלה ולקביעת חומרתה. | ||
גרסה מ־14:07, 18 בדצמבר 2014
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| דלקת מפרקים שגרונתית - טיפולים חדשים | ||
|---|---|---|
| New therapies for rheumatoid arthritis | ||
| שמות נוספים | חידושים בטיפול בדלקת מפרקים שיגרונית | |
| יוצר הערך | פרופ׳ מחמוד אבו-שקרה |
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – דלקת מפרקים
דלקת מפרקים שגרונתית (Rheumatoid arthritis) היא מחלת חיסון עצמי (Autoimmune disease) דלקתית, כרונית ורב מערכתית, אשר הגורם לה אינו ידוע. המחלה מתאפיינת בדלקת ממושכת ושגשוגית של הרקמה הסינוביאלית (Synovial tissue) ומעורבות דלקתית של איברים שונים. היא נחשבת למחלת המפרקים הדלקתית השכיחה ביותר, כאשר 1%-0.5 מהאוכלוסייה הבוגרת לוקים בה. המחלה מאובחנת בדרך כלל בטווח גילאי 60-40 שנים, ושכיחותה בקרב נשים גבוהה פי שניים-שלושה בהשוואה לגברים.
בדומה למחלות חיסון עצמי אחרות, למרות שהגורם המשרה את המחלה אינו ידוע, קיימת חשיבות לגורמים סביבתיים, חיסוניים, הורמונאליים ותורשתיים להתפתחות המחלה ולקביעת חומרתה.
למחלה יש השפעה על אורך החיים ואיכותם, כמו גם על תפקוד החולים. עבודות מתחילת שנות ה־ 90 דווחו שהמחלה מקצרת את משך החיים ב- 18-3 שנים. בנוסף, לאחר 10 ו- 20 שנות מחלה, 50 ו- 90% מהחולים, בהתאמה, מאבדים לחלוטין את כושר העבודה ומפתחים מוגבלות ונכות משמעותיות.
ביטויים קליניים עיקריים
דלקת מפרקים שגרונתית היא מחלה רב מערכתית עם מעורבות הקשורה במפרקים. בחלק מהחולים מופיעים ביטויים דלקתיים חוץ מפרקיים. בנוסף, המחלה קשורה עם תחלואה נלווית, הכוללת שכיחות גבוהה של זיהומים, ממאירות לימפופרוליפרטיבית (Lymphoproliferative malignancy) וטרשת עורקים מואצת.
המחלה מערבת את מפרקי כפות הידיים והרגליים, ובהעדר מעורבות מפרקים אלו יש לשקול אבחנה אחרת. המעורבות המפרקית מתאפיינת על יד דלקת סימטרית (Symmetric inflammation) של מפרקי האינטרפלאנגיאלים הקריבנים (Proximal interphalangeal joints), מפרקי מטהקארפו-פלאנגיאלים (Metacarpophalangeal joints), שורשי כפות ידיים, מרפקים, ירכיים, כתפיים, קרסוליים וכפות רגליים. אופי כאב המפרקים הוא דלקתי ומתאפיין בנפיחות, כאב ונוקשות במנוחה והקלה לאחר הפעלת המפרק. בהעדר אבחון וטיפול מוקדם, חלק משמעותי מהחולים מפתח עיוותים אופייניים הגורמים למגבלות ונכות. עיוותים אלו גורמים לאבוד המבנה והתפקוד התקין של המפרק כתוצאה מהרס רקמת הסחוס, שחיקה (Erosion) של עצמות, פגיעה במיתרים וגידים ודלדול רקמת השרירים.
התופעות חוץ מפרקיות מתחלקות לשתי קבוצות עיקריות:
- תופעות משניות לשקיעת מכלולים חיסוניים (Immune complexes) ברקמות וכלי דם: כגון דלקת של קרום הריאה (Pleuritis) והלב (Pericarditis), כיבים עוריים, קשריות שגרונתיות (Rheumatoid nodule) ודלקת של כלי דם (Vasculitis).
- תופעות משניות להסננה ניכרת של הרקמות על ידי תאי דלקת: כגון תסמונת פלטי (Felty's syndrome), תסמונת סיוגרן (Sjögren's syndrome), הגדלת קשריות לימפה (Lymphadenopathy) והגדלת טחול (Splenomegaly).
גורמי סיכון להתפתחות המחלה
גורמים סביבתיים ותורשתיים קשורים בהתפתחות המחלה. בתחילת שנות ה- 70 תואר הקשר התורשתי בין דלקת מפרקים שגרונתית ו- 4DR-HLA. תפקיד מערכה ה- HLA הוא זיהוי אנגדים (Antigens) שונים והצגתם לתאים לימפוציטים (Lymphocytes) מסוג T. מערכת HLA מקודדת על ידי הגן 1DRB-HLA. לגן זה יש יותר מ- 20 אללים (Alleles) שונים. אצל מרבית האוכלוסייה הלבנה קיימים שני האללים הקשורים בהתפתחות המחלה, והם 0401*1DRB ו- 404*1DRB. האלל 404/0401*1DRB מתאפיין במחלה בעלת מהלך קשה המלווה בעיוותי מפרקים ושחיקת המפרקים.
מאז שנת 2007 פורסמו מספר עבודות המצביעות על רב-צורתיות (Polymorphism) של גנים שונים הקשור בהתפתחות המחלה.
עישון הוא גורם הסיכון הסביבתי המובהק ביותר הקשור בהתפתחות המחלה.
אבחון
האבחנה של דלקת מפרקים שגרונתית היא בעיקר קלינית ומבוססת על נוכחות דלקת מפרקים בעלת מאפיינים דלקתיים ובהעדר הסבר אחר לדלקת המפרק. בשנת 2010 פורסמו מדדים חדשים לאבחון המחלה. מדדים אלה התבססו על עבודה משותפת של האיגוד האמריקאי למחלות פרקים (American college of rheumatology) והאיגוד האירופאי נגד מחלות פרקים (European league against rheumatism). על פי מדיים אלו, האבחנה נקבעת על פי צבירת שש מתוך עשר נקודות אפשריות בארבעה מדורים שונים.
| ניקוד !!מספר מפרקים מעורב (ניקוד: 5-0)!! I | ||
| מפרק בינוני עד גדול | ||
| 0 | מפרק אחד בלבד | |
| 1 | 10-2 מפרקים | |
| מפרקים קטנים בלבד | ||
| 2 | 3-1 מפרקים | |
| 3 | 10-4 מפרקים | |
| 5 | מעל 10 מפרקים כאשר אחד לפחות מפרק קטן | |
בדיקות סרולוגיות- גורם שגרוני (RF ,Rheumatoid Factor) ונוגדנים נגד פפטידים ציקליים שעברו ציטרולינציה
(ACPA ,Anti Cyclic Citrullinated Peptide Antibodies) (ניקוד: 3-0) || II | ||
| 0 | RF ו-ACPA שליליים | |
| 2 | RF או ACPA חיוביים בכייל נמוך | |
| 3 | RF או ACPA חיוביים בכייל נמוך | |
| שקיעת דם ו- c-reactive protein (ניקוד 0-1) | ווו | |
| 0 | שקיעת דם ו-CRP תקינים | |
| 1 | שקיעת דם או CRP מוגברים | |
| משך התסמינים (ניקוד: 1-0) | IV | |
| 0 | פחות מ- 6 שבועות | |
| 1 | מעל 6 שבועות | |
פאתוגנזה של דמ"ש
דלקת מפרקים שיגרונית היא מחלה דלקתית המתאפיינת בשפעול מספר רב של תאים דלקתיים.
שפעול של תאי T ומאקרופאגים על ידי אנטיגן לא ידוע מלווה ביצור ציטוקינים שונים כולל אינטרלוקין 1 ו-6, TNF (Tumor necrosis factor- alpha) וציטוקינים רבים אחרים. לחלק מציטוקינים אלו קיימת פעילות המגבירה אה הפעילות הדלקתית וחלקם מדכאים פעילות דלקתית. בסופו של תהליך קיימת פעילות יתר של ציטוקינים המגבירים פעילות דלקתית. ציטוקינים אלו גורמים לגיוס תאים דלקתיים שונים, שגשוג של תאי הרקמה הסינוביאלית, יצירת נוגדנים, יצירת רקמת הפאנוס האופיינית לדמ"ש ושחרור אנזימים שונים הגורמים להרס ואיבוד רקמת הסחוס.
בנוסף, לתאי B יש חשיבות פאתוגנית עיקריה, בהיותם מתפקדים בתאים המציגים אנטיגנים ומשפעלים תאי T וכן, ברקמה הסינוביאלית מחולי דמ"ש ישנה הסננה של תאי פלסמה המפרישים גורם ראומטי. רמה גבוהה של גורם ראומטי קשורה עם מחלה קשה ופעילה, מעורבות חוץ מפרקית ותמותה גבוהה.
גורם ראומטי אינו רגיש לאבחנה של דמ"ש הוא מופיע בקרב 70%-50% מהחולים בלבד וגם איננו ייחודי לדמ"ש. ניתן למצוא אותו במחלות רקמת חיבור שונות, זיהומים כרוניים כמו זיהום עם נגיף הפטיטים c, גיל מבוגר וממאירות [1].
ACPA Anti-Citrulllnated Peptide Antibody)) הוא נוגדן עצמי נוסף שהתגלה בנסיוב של חולי דמ"ש. הנוגדן מכוון נגד מקטע אנטיגני המכיל את החומצה האמינית ציטרולין. חומצה זו היא נגזרת של החומצה ארגינין לאחר שפעול של האנזים peptidyle arginine deaminase.
נוגדני ACPA הם ייחודים ביותר לאבחון דמ"ש עם סגוליות של 100%-98% ורגישות של 68% -80%.הנוגדן נמצא אצל 35% מחולי דמ"ש ללא גורם ראומטי.
בחולים עם דלקת מפרקים בשלב מוקדם ( 3 חודשים מהופעת תסמינים) וללא אבחנה ברורה, לנוכחות ACPA קיימת סגוליות של 96% לאבחון דמ"ש לעומת 91% לגורם ראומטי מסוג IgM. הערך המנבא חיובי היה 91%. מוסף, לנוגדנים אלו יש ערך מנבא של 91% לפתח ארוזיות בעצם שנתיים לאחר האבחנה[2].
טיפול תרופתי בדמ"ש
מטרת הטיפול התרופתי בדמי׳ש היא הפחתת כאב ונפיחות, שיפור התפקוד, מניעת הופעת עיוותים והרס מפרקים ושיפור איכות החיים של החולים. בחולים עם דמ"ש יש שכיחות גבוהה של תחלואה קרדיו-ואסקולארית, זיהומים חיידקיים ונגיפיים וסיכון מוגבר לפתח מחלות לימפופרוליפרטיביות. טיפול בגורמי סיכון לטרשת, מתן חיסונים מקיפים וסקירה לממאירות מהווים חלק מהטיפול והמעקב השוטפים בחולים.
הקו הראשון של טיפול בדמ"ש במטרה לשנות את מהלך המחלה מבוסס על קבוצת התכשירים הנקראת DMARDs (Disease Modifying Anti-Rheumatic Drugs). תכשירים אלו מהווים היום את הקו הטיפולי העיקרי. לאחר קביעת האבחנה. כל חולה עם דמ"ש חייב לקבל לפחות תכשיר אחד מקבוצה זו. ברוב המרכזים בעולם מקובל לשלב 3-2 DMARDS בזמן קביעת האבחנה ואילו חלק מהמרכזים מעדיפים להתחיל בתרופה אחת ולהוסיף תכשיר נוסף רק במידה ויש העדר תגובה נאותה. שילוב של מטוטרקסט אה סולפאהסאלזין ותכשירי אנטי-מלריה הוא שילוב מקובל מאוד, המשתווה ביעילותו לטיפול ביולוגי [3].
ב-70%-60% מהחולים מלווה טיפול ב-DMARDS בהפוגה או פעילות נמוכה של המחלה.
בעשור האחרון יצאו חלק מהתכשירים השייכים לקבוצת ה- DMARDs משימוש ובמקביל התווספו תכשירים אחרים. מטוטרקסט נחשב עדיין לתרופת הבחירה. התכשיר יעיל ולאחר שבועיים של טיפול מתקבלת תגובה המתבטאת בירידה במספר המפרקים המודלקים, בעוצמת הכאב ובשיפור ברמה התפקודית. מטוטרקסט ניתן במנה שבועית המחולקת לאורך 24 שעות או בהזרקה תת עורית פעם בשבוע, במינון של 15 מ"ג-25 מ"ג לשבוע.
ליפלונומאיד (LEFLUNOMIDE) הוא תכשיר נוסף מקבוצת DMARDS עם מנגנון פעולה דומה למטוטרקסט. הוא מעכב יצור פירמידין על ידי עיכוב פעילות האנזים dihydroorotate dehydrogenase. כ-50% מהחולים המטופלים בתרופה הגיבו לטיפול בהתאם למדד המקובל. תופעת הלוואי העיקרית, בדומה למטוטרקסט, היא פגיעה בתפקודי כבד ובנוסף התרופה טרטוגניה במידה ניכרת[4].
טיפולים ביולוגיים
בהעדר תגובה נאותה לטיפול בתכשירי DMARDS, טיפול הבחירה הבא הוא טיפול ביולוגי.
הטיפולים הביולוגיים הוכנסו לשימוש רחב באמצע שנות ה-90 והם מבוססים על איתור תא, קולטן או ציטוקין בעלי חשיבות עליונה בפתוגנזה של המחלה ופיתוח נוגדן או קולטן שמטרתו לנטרל את פעילותם.
הטיפול הביולוגי הוא ייחודי ומכוון כנגד מתווך יחיד. טבלה 2 מסכמת את התכשירים הביולוגיים הזמינים לטיפול בדמ"ש. הטיפולים הביולוגיים הזמינים בארץ ובעולם מתחלקים ל-3 קבוצות עיקריות:
| מינון | צורת מתן | אתר פעילות | מבנה עיקרי | שם התכשיר |
|---|---|---|---|---|
| 3 מ"נ/ק"ג | דרך הוריד בשבוע 0, 2, 6 וכל 8 שבועות אתרי זה | TNF | נונדן אנושי-כימירי igGl | Infliximab |
| 25 מ"ג פעמיים בשבוע | הורקה תת עורית | TNF | חלבון שנוצר מחיבור של lg אינושי לבין שרשרת P75 של הקולטן ל TNF (P75-Fc IgG) | Etanercept |
| 40 מ"ג כל שבועיים | הזרקה תת עורית | TNF | נוגדן חד שבטי lgG1 | Adalimumab |
| 50 מ"ג כל חודש | הזרקה תת עורית | TNF | נוגדן חד שבטי אנושי lgG1k | Golimumab |
| 400 מ"ג בשבוע 0, 2, 4 ואתרי זה 200 מ"ג כל שבוע | הזרקה | TNF | Fab' fragment אנושי קשור ל- polyethylene glycol | Certolizumab pegol |
| 8-4 מ"ג/ק"ג 162 מ"ג כל שבועיים | הזרקה פעם בחודש הזרקת תת-עורית | קולטן של IL-6 | נוגדן חד שבטי אנושי lgG1 | Tocilizumab |
| 500-1000 מ"ג כל עירוי
|
עירוי לתוך הוריד, ימים 29,15,1 וכל 28 יום לאחר מכן מתן תת עורי | מניעת קשירת CD80 (מקרופאנים) ו-CD28 (תאי T) | Fusion protein הכולל CTLA4 ו-FcIgG | Abatacept |
| שני טיפולים במיגון של 1000 מ"ג ביום 11-15 | דרך הוריד | CD20 (B תאי) | נוגדן כימירי | Mabthera |
טיפול נגד ציטוקינים
הקבוצה הראשונה של טיפולים ביולוגיים כוונה נגד הציטוקין Tumor necrosis factor אלפא (TNF).
בנסיוב ובנוזל הסינוביאלי ישנם רמה גבוהה של TNF אלפא המיוצר על ידי תאי T המסננים את הממברנה הסינוביאלית ופעילות זו נחשבת כהתרחשות מרכזית הגורמת לדלקת כרונית בדמ"ש.
טיפול ביולוגי נגד הציטוקין 6-IL מהווה אבן דרך עיקרית בטיפול בדמ"ש. הטיפול שווק בתחילה כתכשיר הניתן דרך הווריד בתדירות של פעם בחודש, אך לאחרונה גם בצורת מתן תת-עורי. יתרונו העיקרי של תכשיר זה הוא בכך שהוא ניתן כטיפול יחיד ללא צורך בטיפול מקבוצת DMARDs [5]
טיפול נגד Co-stimulation
תהליך ההצגה של אנטיגן פתוגני על ידי התאים המאקרופאגים (antigen presenting cell) לתאי T קשור באינטראקציה בין שני סוגי התאים בתהליך אשר נקרא co-5timuiation.
Abatacept ומעכב קשירת CD80 הנמצא על פני מאקרופאגים למולקולת CD28 על פני תאי T, התכשיר נמצא כטיפול יעיל בדמ"ש. הוא ניתן במתן תוך ורידי וגם תת עורי. יעילותו נבדקה מול אדאלימומאב ונמצאה דומה[6].
טיפול נגד תאי B
קבוצה נוספת של טיפולים היא כנגד CD20 הנמצא על פני תאי B. טיפול זה נחשב לקו אחרון של טיפול כיוון שהוא מכוון נגד תאים ומלווה בדיכוי של תאי B.
דור חדש של טיפולים לדמ"ש
דור חדש של טיפולים בדמ"ש מכוון לעכב פעילות תוך תאית המתרחשת בעקבות קשירתם של ציטוקינים לקולטנים על פני ממברנת התאים.
כאשר ציטוקין נקשר לקולטן שלו על פני ממברנת התא הוא גורם לשרשרת של פעילות אנזימטית תוך תאית הגורמת להעברת סיגנלים לתוך גרעין התא. סיגנל זה גורם לשפעול DNA בתוך הגרעין והתוצאה של פעילות זו תהיה ייצור ציטוקינים או מתווכי דלקת אחרים המגבירים את שרשרת הפעילות הדלקתית.
אחד המנגנונים התוך תאיים אשר נבדק בהרחבה וכנגדו פותחו טיפולים הוא מנגנון הקשור באנזים TYROSINE KINASE. אנזים זה פועל על ידי פוספרליזציה של אנזימים וחלבונים אחרים.
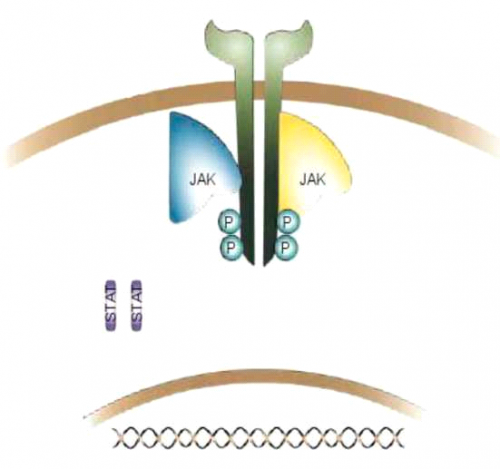
מערכת האנזימים JANUS KINASE) JAK) נחקרה בצורה רחבה. מערכת זו כוללת 4 אנזימים JAKI TYK2 JAK3 JAK2. בדרך כלל קשורים 2 זוגות של האנזימים JAK לקולטן של הציטוקין ומהווים חלק ממנו (ראה תרשים 1א').
מספר רב של ציטוקנים פועלים דרך מערכת JAK ומביניהם IL-2, IL-4, IL-6, IL-7, IL-9, IL-12, IL-15, IL-21, IL-23, IFNα, IFNβ, ו-IFNγ
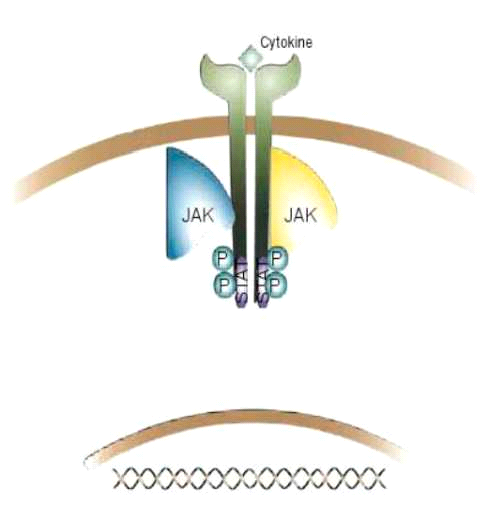
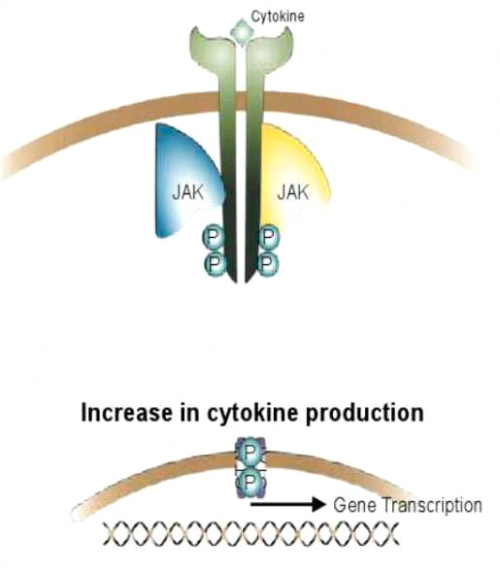
בעקבות קשירה של ציטוקין לקולטן מתרחשת שרשרת של תגובות תוך תאיות המופיעות לפי הסדר הבא (תרשים 1ב׳, ג׳) [7] , [8]:
- שינוי במבנה התוך תאי של הקולטן (Receptor polymerization).
- שינוי במבנה ושפעול JAK (פוספורליזציה עצמית של האנזים),
- פוספורליזציה של הקולטן בחלקו התוך תאי, ויצירת אתר קשירה למולקולת STAT Signal)
Transducer and Activator of Transcription) .
- קשירת של חלבון STAT לקולטן. (תרשים 1בי).
- פוספורליזציה של STAT.
- שחרור STAT מהקשר שלו לקולטן ונדידתו לתוך הגרעין (תרשים 1ג׳).
- הפעלת DNA וייצור ציטוקינים אחרים (gene transcription).
מעכבי האנזים JAK הם הדור החדיש ביותר של טיפול בדמ"ש. הם אינם נחשבים בטיפולים ביולוגיים כיוון שאינם מנטרלים תא או ציטוקין ייחודי. מחקרים הראו שיש להם פעילות DMARDS כיוון והם משנים אה מהלך המחלה. לכן הם מהווים קבוצה חדשה של תכשירים לטיפול בדמ"ש.
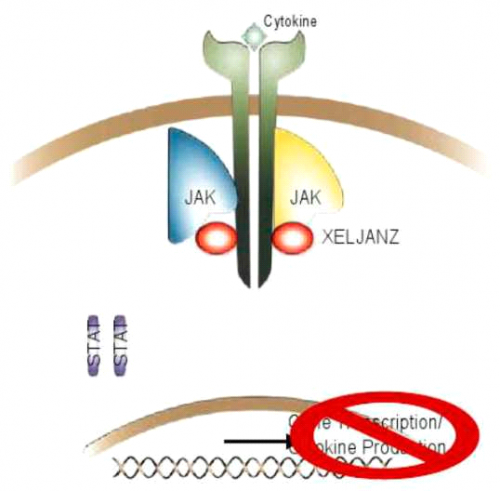
TOFACITINIB CITRATE הוא מעכב ייחודי, סלקטיבי ותחרותי הפיך של JAK אשר נחקר בצורה רחבה ואף נרשם לטפול בעולם ובארץ. התכשיר פותח נגד JAK3 אבל נמצא שנקשר גם JAKI וגם נגד JAK2. עיכוב פעילות 3/JAKI היא הרבה יותר גבוהה מזו של JAK2 התכשיר נקשר לאתר קושר ATP על פני JAK ועל ידי כך מונע פוספורליזציה עצמית של JAK לאחר קשירת ציטוקינים שונים לקולטן שלהם על פני ממברנת התא (תרשים 2).
כתוצאה מעיכוב זה, JAK לא הופך להיות פעיל ובעקבות כך לא מתרחש שפעול STAT ולא מתרחשת העברת סיגנלים לתוך הגרעין והתהליך הדלקתי לא מתקדם. מנגנון זה גורם לעיכוב פעילות ציטוקינים שונים ובעיקר 7-IL-15 , IL, 21-IL-6 , IL אינטרפרון אלפא וביתא.
TOFACITINIB ניתן בצורה פומית. הוא נספג מהר תוך חצי שעה עם bioavailability של 74%. הוא מופרש תוך 3.2 שעות דרך הכבד(70%) ודרך הכליה(30%).
TOFACITINIB נמצא יעיל בטיפול בדמ"ש עם טווח בטיחות מקובל. בנוסף להיותו תכשיר פומי, הוא פועל בצורה מהירה. במרבית החולים פעילות קלינית ניצפת תוך שמעיים מתחילת הטיפול. התכשיר נבדק בשני מינונים שונים, 5 ו־10 מ"ג, וניתן פעמיים ביום. שני המינונים מקובלים לשימוש קליני.
יעילות TOFACITINIB נבדקה בקבוצות שונות של חולים עם דמ"ש פעילה בחומרה בינונית עד קשה. המחקרים כללו חולים שלא הגיבו לטיפול במטוטרקסט, אצל חולים לאחר כישלון טיפול בבולמי TNF, בשילוב עם מטוטרקסט בהשוואה לחולים אשר טופלו במטוטרקסט בלבד או DMARDS אחרים, במקביל לטיפול בהומירה בהשוואה לאינבו וגם נבדקה יעילותו כטיפול יחיד.
טבלה מס׳ 3 מסכמת את המחקרים הראשיים שבדקו יעילות התרופה בדמ"ש. היעילות נבדקה בעזרת מדדים מקובלים להערכת הגובה קלינית שכללו אחוז החולים שהשיגו 20% שיפור במספר מפרקים נפוחים ביחד עם מספר מפרקים רגישים ו-3 מתוך 5 משתנים נוספים הכוללים שקיעת דם או c-reactive protein, הערכה כללית של פעילות המחלה על ידי הראומטולוג והחולה, הערכה כללית של חומרת כאב המפרקים על ידי המטופל והערכה כללי של מוגבלות על ידי החולה (ACR 20 response) .
מדד נוסף שנבדק הוא אחוז החולים שמחלתם נכנסה להפוגה מלאה או הפכה למחלה עם פעילות נמוכה. תוצא זה נבדק בעזרת המדד 28-DAS המבוסס על הערכת 28 מפרקים, שקיעת דם או CRP והערכה כללית של פעילות המחלה על ידי החולה. ערך מתחת ל-2.6 נחשב להפוגה ואילו ערך הנמוך מ-3.2 מעיד על פעילות נמוכה.
| ref | acr20 קבוצת השוואה | acr20 קבוצת טיפול | קבוצת השוואה | מספר החולים שנכללו | מאפייני חולי המחקר |
|---|---|---|---|---|---|
| 10 | 25% | 51.5%
|
MTX | 800 | חולים שלא הניבו לטיפול ב-MTX |
| MTX | חולים שלא קבלו MTX | ||||
| 13 | 28.3% | 51.5%
|
DMARDs | 717 | Tofacitinib או Adalimumab |
| 11 | 31.2% | 52.7%
|
DMARDs | 792 | בשילוב עם DMARD |
| 12 | 24% | 42%
|
טיפול ב-MTX | 389 | בשילוב עם MTX אצל תולים שלא הגיבו ל- TNFi |
| 13 | 26.7% | 59.8% 5mg
|
ללא DMARDs (למעט נוגדי מלריה או פרדנזון 10mg | 611 | טיפול יחיד ללא DMARDs (monotherapy) |
בטיחות
תופעות הלוואי השכיחות אשר דווחו בחולים אשר טופלו ב- TOFACITINIB כוללות: כאב בטן, שלשול, כאב ראש וזיהומים של דרכי הנשימה העליונות. ב-4% מהחולים שהשתתפו במחקרים הופסק הטיפול עקב תופעות לוואי. זיהומים קשים המצריכים אשפוז וטיפול אנטיביוטי פרנטראלי נצפו בכ-1% מהחולים. המונה לזיהומי דרכי נשימה, זיהומי רקמות רכות וזיהומים אחרים. מספר מדד של חולים אובחנו עם שחפת.
עלייה של 14%-12% ברמת LDL-cholesterol תוארה ובנוסף נצפתה עלייה דומה ברמת –HDL cholesterol.
ההשפעה על ספירת הדם התבטאה בירידה בספירת נויטרופילים ולימפוציטים. ממוצע הירידה בספירה נויטרופילים היה כ-800 נויטרופלים בקרב החולים שטופלו ב-5 מ"ג ו-1,300 בקרב חולים שטופלו ב-10 מ"ג פעמיים ביום. לא נצפתה נויטרופניה קשה.
סיכום
TOFACITINIB שייכת לדור חדש של תכשירים לטיפול בדמ"ש. תכשירים אלו ממנים מולקולות קטנות (Smallmolecules). התכשיר נבדק בחולים עם דמ"ש בשלבים שונים של המחלה ובכל המחקרים נמצא יותר יעיל בהשוואה לקבוצה ההשוואה.
לא בוצעו מחקרים שהשוו יעילות תכשירים אלו בהשוואה לכל הטיפולים הביולוגיים הנמצאים בשימוש רחב.
פרופיל הבטיחות של התרופה דומה למדווח בשאר הטיפולים הביולוגיים.
ביבליוגרפיה
- ↑ MCLNNES IB, SCHETT G. THE PATHOGENESIS OF RHEUMATOID ARTHRITIS. NEJM. 2011:365:2205-19.
- ↑ WHITING PF, SMIDT N, STERNE JA, ET I. SYSTEMATIC REVIEW: ACCURACY OF ANTL-CITRUL-LINATED PEPTIDE ANTIBODIES FOR DIAGNOSING RHEUMATOID ARTHRITIS. ANN INTERN MED. 2010;152:456-64.
- ↑ O'Dell JR, MikulsTR, Taylor TH, eta i. Therapies for active rheumatoid arthritis after methotrexate failure. N Engl J Med. 2013;369:307-18
- ↑ SMOLEN JS, KALDEN JR, SCOTT DL, ET AL. EFFICACY AND SAFETY OF LEFLUNOMIDE COMPARED WITH PLACEBO AND SULPHASALAZINE IN ACTIVE RHEUMATOID ARTHRITIS: A DOUBLE-BLIND, RANDOMISED, MULTICENTRE TRIAL. EUROPEAN LEFLUNOMIDE STUDY GROUP. LANCET. 1999;353:259-66
- ↑ Burmester GR, Rubbert-Roth A, Cantagrel A, et al. A randomised, double-blind, parallel-group study of the safety and efficacy of subcutaneous Tocilizumab versus intravenous Tocilizumab in combination with traditional disease-modifying antirheumatic drjgs in patients with moderate to severe rheumatoid arthritis. Ann Rheum Dis2013 Sep 12. [Epub ahead of print]
- ↑ SCHIFF M, WEINBLATT ME, VALENTE R, ET AL. HEAD-TO-HEAD COMPARISON OF SUBCUTANEOUS Abatacept VERSUS Adalimumab FOR RHEUMATOID ARTHRITIS: TWO-YEAR EFFICACY AND SAFETY FINDINGS FROM AMPLE TRIAL. ANN RHEUM DIS. 2013 AUG 20.
- ↑ O'SHEAJJ, PLENGER. JAK AND STAT SIGNALING MOLECULES IN IMMUNOREGULATION AND IMMUNE-MEDIATED DISEASE. IMMUNITY. 2012:36:542-550.
- ↑ JIANG J, GHORESCHI K, DEFLORIAN F, ETAL. EXAMINING THE CHIRALITY, CONFORMATION AND SELECTIVE KINASE INHIBITION OF 3-((3R4׳R)-4-METHYL3־-(METHYL(7H-PYRROLO[2,3-D] PYRIMIDIN-4-YL)AMINO)PIPERIDIN-1־YL)3־-OXOPROPANENITRILE(CP690,550־
- Ghoreschi K, Laurence A, O'SheaJJ. Janus kinases in immune cell signaling. Im¬munol Rev. 2009:228:273-287.
- van der Heijde D, Tanaka y, Fleischmann R, et al. Tofacitinib (CP-690,550) in pa-tientswith rheumatoid arthritis receiving methotrexate: twelve-month data from a twenty-four-month phase III randomized radiographic study. Arthritis Rheum. 2013 65:559-70.
- KremerJ, Li ZG, Hall S, Fleischmann R, etal. Tofacitinib in combination with non-biologic disease-modifying antirheumatic drugs in patients with active rheumatoid arthritis: a randomized trial. Ann Intern Med. 2013 Aug 20:159:253-61
- Burmester GR, Blanco R, Charles-Schoeman C, et al Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet. 2013;381:451-60
- Fleischmann R, Kremer J, Cush J, etal. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med. 2012 ;367:495-507
קישורים חיצוניים
- חידושים בטיפול בדלקת מפרקים שיגרונית, TheMEDICAL
המידע שבדף זה נכתב על ידי פרופ׳ מחמוד אבו-שקרה, מנהל היחידה לראומטולוניה ומחלקה לרפואה פנימית ד, המרכז הרפואי אוניברסיטאי םורוקה, באר שבע


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק