האטה בגדילה תוך רחמית - Intrauterine growth restriction
| האטה בגדילה תוך רחמית | ||
|---|---|---|
| IntraUterine Growth Restriction | ||
| ICD-10 | Chapter P 05.9 | |
| ICD-9 | 764.9 | |
| MeSH | D005317 | |
| יוצר הערך | פרופ' קובי בר, פרופ' אברהם גולן |
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – האטה בגדילה תוך רחמית, היריון מרובה עוברים
זיהוי האטה בגדילה תוך רחמית (IUGR, Intrauterine Growth Restriction) מהווה אתגר חשוב במיילדות מודרנית כיוון שהיא תופעה שכיחה (חמישה עד עשרה אחוזים מכלל ההריונות) וכרוכה בסיכון מוגבר לתמותה ותחלואה בטווח הקצר והארוך, ואף לסיבוכים במערכת הלב וכלי הדם בגיל המבוגר (תיאוריית Barker). ההאטה בגדילה מהווה תת קבוצה לקבוצה הטרוגנית של עוברים הקטנים לגיל ההיריון (SGA, Small for Gestational Age), הקשורה לאטיולוגיות שונות, שיטות ניהול היריון שונות ופרוגנוזה שונה ממקרה למקרה.
באבחון האטה בגדילה תוך רחמית יש לוודא את גיל ההיריון המתבסס בעיקר על מדידות באולטראסאונד בשליש הראשון או השני להיריון. יש לזהות עובר קטן לגיל היריון לפי הערכת משקל סונוגרפית מתחת לאחוזון 10 לעקומת גדילה נורמלית של אוכלוסיה ישראלית.
את הגורמים להאטה בגדילה תוך רחמית ניתן לחלק לאימהיים, עובריים ושלייתיים. בהאטה בגדילה חמורה ומוקדמת, יש להעמיק את בירור האטיולוגיה.
בפגיעה מוקדמת נצפה להתפתחות של האטה בגדילה סימטרית וכאשר יש הפרעה וסקולרית שביטויה הוא אי ספיקה שלייתית, תתפתח האטה בגדילה מאוחרת מסוג אסימטרי. מודל היפוקסמיה-אסידמיה (Hypoxemia-acidemia) או קומפנסציה-דה-קומפנסציה (Compensation-decompensation) מתאים להאטה בגדילה תוך רחמית עם מרכיב וסקולרי דומיננטי ומתבסס על עקרונות הדופלר.
בהאטה בגדילה תוך רחמית יש לתזמן את מועד הילוד לנקודת הזמן האופטימלית מבחינת שבוע היריון, המהווה את המשתנה החשוב ביותר לתוצאות ההיריון, ולפני הופעת סימנים של אסידמיה כדי להפחית מחד את שיעור התמותה התוך רחמית ומאידך את שיעור התמותה והתחלואה המשניים לפגות.
קביעת גיל היריון
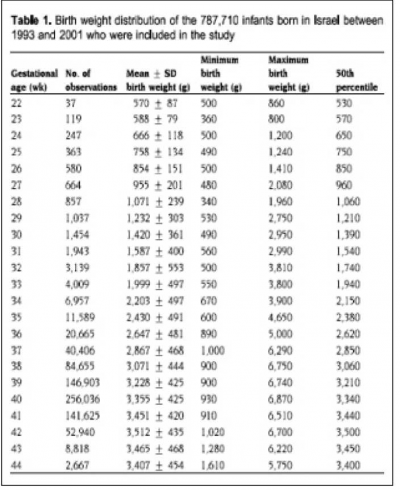
כדי לאבחן האטה בגדילה תוך רחמית, בראש ובראשונה יש לוודא את גיל ההיריון. בקביעת גיל היריון ידוע שהסתמכות על מועד הווסת האחרון אינה מדויקת מעבודות שהשוו את גיל ההיריון להריונות הפריה חוץ גופית. בעוד שאחוז השגיאה היה גבוה (שלושה שבועות) כשגיל ההיריון הסתמך על וסת אחרון, ההערכה הסונוגרפית הצביעה על אחוזי שגיאה נמוכים (ארבעה ימים). לכן יש להסתמך בקביעת גיל היריון על מדידת גודל העובר באולטראסאונד במידה שהפער בין גיל היריון לפי אולטראסאונד ולפי הווסת האחרון הוא שבוע או יותר, CRL (Crown Rumph Length) בשליש הראשון של ההיריון, ובסוף שליש ראשון ותחילת שני על פי מדידות של איברי העובר כ-HC (Head Circumference) ושילוב של מספר פרמטרים [FL (Femur Length), AC (Abdominal circumference), HC][1]. ככל שגיל ההיריון מאוחר יותר, אחוז השגיאה גדל ומדידות באולטראסאונד משקפות את גודל העובר ולא את גיל ההיריון.
אבחנה
ההגדרה הקלאסית של האטה בגדילה תוך רחמית היא כשל של העובר להשיג את פוטנציאל הגדילה שנקבע לו מלכתחילה. כיוון שקשה לאבחן כשל זה של העובר, כאשר דנים בהאטה בגדילה תוך רחמית נעזרים בהגדרת העובר הקטן לגיל היריון. לצורך זה יש להסתמך על עקומות גדילה של אוכלוסיה נורמלית. קיימות מספר עקומות גדילה: כאלו המבוססות על משקלי לידה וכאלו המבוססות על הערכה אולטראסונוגרפית, עקומות גדילה בינלאומיות ועקומות גדילה ארציות. עקומות הגדילה המבוססות על הערכה אולטראסונוגרפית נעזרות בהערכת משקל סונוגרפית (EFW, Estimated Fetal weight) מחושב על פי נוסחאות מקובלות (כגון Shepard + Hadlock). הנכון ביותר יהיה להיעזר בעקומות גדילה מתוקנות (Customized) המתקנות את אחוזוני הגדילה של העובר בהתאם לנתוני רקע של האישה כגובה ומשקל, מוצא אתני ומשקלי לידה בעבר[2]. עקומות אלו, שחושבו בארצות כגון שבדיה, אנגליה ואוסטרליה, התבררו כמהימנות ביותר לחיזוי אבחנה אמיתית של האטה בגדילה תוך רחמית כיוון שבאבחון על סמך עקומות אלו יש חשיבות קלינית רבה בזיהוי המקרים הבעייתיים וניתן לדייק בחיזוי שיעורי התמותה והתחלואה של ילודים אלה[3].
כיוון שאין עקומות גדילה מתוקנות המתייחסות לאוכלוסיה ישראלית, ברירת המחדל תהיה שימוש בעקומות גדילה של אוכלוסיה ישראלית. יש בנמצא שלוש עקומות גדילה ישראליות, אך המגמה המסתמנת היא שימוש בעקומות של שאול דולברג וחבריו, שחושבו על סמך נתונים של 780 אלף ילודים[4]. אין מן הנמנע שבאבחון נכון של האטה בגדילה תוך רחמית יש להתחשב בנתוני הרקע האימהיים.
ברוב המאמרים בספרות מגדירים עובר קטן לגיל ההיריון לצורך אבחון האטה בגדילה תוך רחמית על פי הערכת משקל אולטרסונוגרפית או משקל הלידה מתחת לאחוזון 10 לעקומת גדילה. ניתן גם להחמיר בהגדרה לעוברים מתחת לאחוזון 5 או 2.5, אך אז יש הפחתה ברגישות הבדיקה על חשבון עלייה בסגוליות. ניתן אף להיעזר באבחון במדידת היקף הבטן (הגדרת סף של AC מתחת לאחוזון 2.5 עד אחוזון 5). האטה בגדילה תוך רחמית ניתן לאבחון על פי שבירת אחוזוני גדילה. זיהוי שבירת אחוזוני גדילה מתאפשר על ידי לפחות שתי מדידות בהפרש מינימלי של עשרה ימים ביניהן. אבחון שבירת אחוזוני גדילה מחייב מעקב גדילה צמוד, הערכות חוזרות של מצב העובר תוך רחמית לצורך תזמון אופטימלי של הילוד. על כך יש פחות נתונים בספרות ולכן הגישה המעשית מתבססת על אבחון עובר קטן לגיל ההיריון[5].
אטיולוגיה
בירור האטיולוגיה - הגישה הנכונה בהאטה בגדילה תוך רחמית היא לרכז את מירב המאמצים בתת הקבוצה הבעייתית שלה צפויה פרוגנוזה של יותר תמותה ותחלואה, ובקבוצה זאת להקדיש את מירב המאמצים באבחון נכון, בחיפוש אטיולוגיה וניהול זהיר של ההיריון כדי להגיע לאופטימום לגבי תזמון ואופן הלידה.
מנגנוני גדילה נורמליים ואבנורמליים - את גדילת העובר ניתן לחלק לשלושה שלבים: עד שבוע 20 להיריון מתבצע תהליך מיטוזה מהירה, עלייה במספר התאים וקצב הגדילה עומד על כחמישה גרם ליום. בין שבוע 20 ל-28 להיריון מתבצע תהליך היפרפלזיה והיפרטרופיה וקצב הגדילה עומד על כ-20-15 גרם ליום. משבוע 28 להיריון מתבצע תהליך גדילה מהיר בגודל התא עם הצטברות רקמת שומן ורקמת חיבור וקצב הגדילה עומד על כ-35-30 גרם ליום, שלב שבו העובר צובר את מירב משקלו. המנגנון השולט בווסת קצב הגדילה הוא הגנום העוברי בשלבים המוקדמים של ההיריון אך בשלבים המאוחרים נוספים גורמים כתזונה, גורמים סביבתיים והשפעות הורמונליות. לכן התזמון שבו נוצרת ההפרעה בגדילת העובר מהווה מדד חשוב בחומרת ההאטה בגדילה, בסיבה להאטה בגדילה (שלא ניתן לגלות תמיד), בסוג ההאטה ובפרוגנוזה שניתן להעריך לבני הזוג. כאשר הפגיעה תהיה מוקדמת, נצפה להתפתחות של האטה בגדילה סימטרית בשלב של חלוקת התא, העובר יראה גדילה לאורך זמן באחוזון קטן מ-10, ללא שינוי ביחס היקף ראש לבטן.
יש להתייחס ביתר חומרה לעוברים עם האטה מואצת בגדילת הראש, אז יש צורך בבירור מיוחד הכולל אנטומיה מפורטת של המוח [באמצעות אולטראסאונד ו/או MRI (Magnetic Resonance Imaging)], במיוחד כאשר היקף הראש קטן ביותר משתי סטיות תקן לגיל ההיריון, ואז יש לשלול מיקרוצפליה ו/או תסמונת. הפגיעה המוקדמת תתבטא בפגיעה בגנום והיא עלולה להיות משנית למום מבני, כרומוזומלי או גנטי, או לחשיפה מוקדמת לנזק ויראלי [CMV (Cytomegalovirus) לדוגמה], טוקסי (אלכוהול לדוגמה) וכדומה.
כאשר הפגיעה תהיה מאוחרת, תתפתח האטה בגדילה מסוג אסימטרי בשלב גדילת התאים ואז נצפה לגדילה תקינה של העובר עד לשלב ההפרעה שמעבר לו תוצר שבירת אחוזוני הגדילה לכיוון אחוזון מתחת ל-10, יחד עם עלייה ביחס בין היקף הראש להיקף הבטן, תופעה הנקראת Head Sparing Effect. ההפרעה המאוחרת עלולה להיות משנית להפרעה וסקולרית הן על רקע מחלת כלי דם אימהית והן על רקע אידיופתי, והתוצאה תתבטא באי ספיקה שלייתית.
בחלק ניכר מהמקרים לא תיווצר תמונה קלאסית של האטה בגדילה סימטרית או אסימטרית אלא תמונה מעורבת (Mixed Type). לדוגמה, עובר עם הפרעה כרומוזומלית ידגים תבנית האטה בגדילה סימטרית, אך ברגע מסוים תיווצר אי ספיקה שלייתית על רקע אברציות כרומוזומליות של השליה המלוות באופן טיפוסי הפרעה כרומוזומלית של העובר, ואז תתווסף האטה בגדילה אסימטרית.
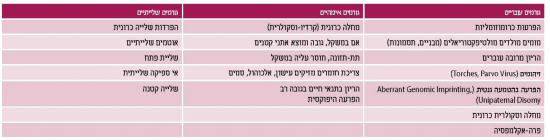
בחלוקה של תת הקבוצה הבעייתית של האטה בגדילה, מקובל להתייחס ל-25 אחוז מהמקרים כאל הפרעה שמקורה בעובר (מום כרומוזומלי או מבני או חשיפה למזהם) וב-75 אחוז מהמקרים הפרעה שמקורה סביבתי הקשורה למחלה אימהית, שיבוש ממקור שלייתי או הפרעה סביבתית (חשיפה לטוקסינים וכדומה). גם בחלוקה של הפרעה שמקורה בעובר (אינטרינסית) או מקורה בסביבת העובר (אקסטרינסית), יש להבדיל בין מצב פתולוגי למצב תקין, כיוון שלעתים יש חפיפה קלינית המקשה על ההבדל. לדוגמה, עובר קטן לגיל ההיריון מסיבה אינטרינסית יכול להיות משני למוצא אתני (אם ילידת הודו, שם המשקל הממוצע הוא 2,600 גרם), שהוא מצב נורמלי, לעומת הפרעה כרומוזומלית שהיא מצב פתולוגי. חפיפה קלינית קיימת גם בגורמים האקסטרינסים לעובר קטן לגילו: מחלה וסקולרית אימהית הגורמת אי ספיקה שלייתית, מצב פתולוגי לעומת אם החיה בתנאי גובה, מצב פיזיולוגי. טבלה מספר 1 מסכמת את הסיבות להאטה בגדילה תוך רחמית כאשר חלוקה נוספת היא לגורמים אימהיים, עובריים ושלייתיים. ככל שתמונת ההאטה בגדילה חמורה יותר ומוקדמת, יש מקום להעמיק את בירור האטיולוגיה.
המרכיב הגנטי
רוב הגנים האוטוזומלים מקורם מהתבטאות אללים של שני ההורים. מכלל הגנים של תהליך ההטמעה (Imprinting) בעובר, עלול להתבטא רק אלל של אחד ההורים בחלק קטן של המקרים, וקיימות לכך מספר דוגמאות קליניות (טרטומה מבטאת גנום אימהי והיריון מולרי גנום אבהי). תופעה זאת, הנקראת UPD (Uni-Paternal Disomy), תוארה לראשונה בעכברים, מהווה תופעה שכיחה לחשיפת הטמעה בבני אדם ותורמת בכ-50 אחוז לאנאפלואידיה בתאי מין. למעשה, תופעת UPD מהווה מנגנון פיזיולוגי לתיקון היריון עם טריזומיה ומטרתה להיפטר מעודף כרומוזומלי, כאשר התוצאה עלולה להיות ביטוי הומולוגי מאותה גמטה. הביטוי השכיח לכך יהיה בשליה שבחלקה שונה כרומוזומלית מן העובר, תופעה המכונה CPM (Cofined Placental Mosaicism). למשל, נוכחות טריזומיה 16 בשליה קשורה להאטה בגדילה ובמקרים אלה יש לברר גם קריוטיפ עוברי.
ככלל, UPD ממקור אבהי קשור לעודף גדילה ו-UPD ממקור אימהי קשור להאטה בגדילה. תיאוריה זאת של Haig[6] נתמכת בתסמונות קליניות שבהן הוכח ביטוי יתר גנטי ממקור אימהי והאטה בגדילה כמו בתסמונת Silver-Russel, בניגוד לתסמונת הכרוכה בגדילת יתר (תסמונת Beckwith-wiedemann) שבה נמצא ביטוי יתר גנטי אבהי[7]. לכן, הערכה כרומוזומלית במקרי האטה בגדילה תוך רחמית מהווה חלק חשוב בבירור.
בסדרה גדולה של האטה בגדילה של עוברים מתחת לאחוזון 10 לעקומת גדילה נמצאה אברציה כרומוזומלית ב-19 אחוז מהמקרים[8]. בנוסף לטריזומיות השכיחות, נמצאו הפרעות כרומוזומליות נוספות כ-Deletions, Duplications ו-Ring chromosomes, שאותן לא תמיד ניתן לגלות באנליזה רגילה של מי שפיר ולא בבדיקת FISH ממי שפיר, המוגבלת לטריזומיות שכיחות ולכרומוזומי המין.
במידה שהוחלט על בירור כרומוזומלי של האטה בגדילה תוך רחמית, יש עדיפות לדיקור חבל השורר לדם עוברי על פני דיקור מי שפיר, כי אז התשובה היא מלאה יותר ומהירה יותר. לתשובה מהירה יש חשיבות במקרים אלה שבחלקם מאובחנים מאוחר ובחלקם דורשים ילוד בתוך זמן קצר עקב הידרדרות במצב העובר. ניתן אף לשלוח דגימת מי שפיר למרכז המבצע סדרת בדיקות גנטיות לאיתור האטיולוגיה של האטה בגדילה תוך רחמית (Signature Genomic chip).
המרכיב הווסקולרי
כאשר יש הפרעה וסקולרית שביטויה הוא אי ספיקה שלייתית, תתפתח האטה בגדילה מסוג אסימטרי בשלב מאוחר יחסית, יחד עם Head sparing effect. אולם, גם בעובר עם הפרעה כרומוזומלית, שיתאפיין בהאטה בגדילה מוקדמת ובתבנית סימטרית, עלולה להיווצר אי ספיקה שלייתית על רקע אברציות כרומוזומליות של השליה, המלוות באופן טיפוסי הפרעה כרומוזומלית של העובר (תופעת ה-CPM), כדי ליצור תמונה קלינית מעורבת. גם עוצמת ותזמון ההפרעה הווסקולרית השלייתית יכולים להשתנות מבחינת דרגת החומרה. למשל, הפרעה וסקולרית מוקדמת תוביל לכשל בהשרשה ולהפלה נדחית. הפרעה בסוף השליש הראשון להיריון (שבוע 16-14) תמנע התפתחות תקינה של השליה שתוביל לאיסכמיה שלייתית המהווה את הבסיס הפתופיזיולוגי להתפתחות האטה בגדילה תוך רחמית אידיופתית על רקע וסקולרי ובמנגנון דומה להתפתחות פרהאקלמפסיה (Preeclampsia). בחלק מהמקרים תתפתח בנוסף לתסמונת האימהית האטה בגדילה. הפרעה מאוחרת בתפקוד השלייתי לאורך זמן תיצור האטה מאוחרת בגדילה, לעתים אף בסמוך למועד הלידה.
היריון מרובה עוברים
האטה בגדילה עלולה להתרחש גם בהיריון מרובה עוברים. כאשר נוצר פער בגדילה בין עוברים בהיריון תאומים (Discordant twins) יש לוודא אם אחד מהעוברים מפתח האטה בגדילה תוך רחמית, מתחת לאחוזון 10 לעקומת גדילה נורמלית מותאמת להיריון תאומים[4]. יש הבדל גדול בהיריון תאומים עם שק כוריון משותף ושקי מי שפיר נפרדים (Monochorionic biamniotic twins) או תאומים עם שק כוריון ושק מי שפיר נפרדים (Bichorionic biamniotic twins). בתאומים עם שק כוריון משותף, האטה בגדילה יכולה להופיע בצורת תסמונת TTTS (Twin To Twin Transfusion) ולכך יש ניהול נפרד. לעיתים יכולה להתפתח האטה בגדילה תוך רחמית באחד מהעוברים בתאומים מונוכוריונים על רקע הפרעה וסקולרית דיסטלית ואז לא יהיו הסימנים האופייניים ל-TTTS אך יכולה להיווצר תלות בין העוברים עקב כוריון משותף.
שונה התמונה בתאומים עם שק כוריון נפרד שבהם עלולה להתפתח האטה בגדילה של אחד העוברים ללא תלות בעובר השני. תוצאות היריון יהיו בדומה להיריון של עובר אחד. האטה בגדילה של אחד העוברים מתבטאית בעלייה בתמותה תוך רחמית ולאחר הלידה בעלייה בתחלואה לטווח הקצר ולטווח הארוך ובשכיחות יתר של מחלות קרדיווסקולריות בגיל המבוגר ביחס לעובר התקין.
בכל מקרה, ניהול האטה בגדילה תוך רחמית בעובר אחד מתוך תאומים מונוכוריונים או ביכוריונים הוא מורכב יותר כי יש להתחשב במצבו של העובר התקין, בעיקר בהחלטה לגבי תזמון הלידה בגיל היריון צעיר.
פרוגנוזה
האטה בגדילה מתבטאת בעלייה בתמותה תוך רחמית ולאחר הלידה בעלייה בתחלואה לטווח הקצר ולטווח הארוך ובשכיחות יתר של מחלות קרדיוסקולריות בגיל המבוגר. שיעור תמותת ילודים מגיע ל-79 אחוז בעובר קטן לגילו ביחס ל-61 אחוז בעובר מתאים לגילו בשבוע 25-24 ולשבעה אחוזים ביחס ל-4.2 אחוזים בשבוע 31-30 בהתאמה, לפי נתוני פגייה ארציים מישראל[9]. כלומר, סיכון יחסי לתמותה בילוד קטן לגילו עומד על 1.9 היחס לעובר מתאים לגילו בכל שבוע היריון.
שיעורי התחלואה המיידית גם הם גבוהים יותר בילודים קטנים לגילם ביחס למתאימים לגילם; סיכון יחסי ל-RDS (Respiratory Distress Syndrome) - 1.09, סיכון יחסי ל-BPD (Bronchopulmonar Dysplasia) - 1.66 ול-ROP (Retinopathy Of Prematurity)- 1.86[9]. נתונים אלה שוללים את הגישה בעבר, לפיה ילודים קטנים לגיל היריון עמידים יותר בפני סיבוכים. נהפוך הוא, ילודים אלה יקבלו יותר טיפול בסטרואידים לבשלות ריאתית במהלך ההיריון, ובקבוצה זאת יש להקפיד הקפדה יתרה על טיפול זה.
חשיבות גדולה יותר מיוחסת לתחלואה לטווח הארוך בילודים קטנים לגיל היריון; תוצאות עבודות ארוכות טווח עד גיל עשר, הכוללות תוצאות מבחנים קוגניטיביים, מראות כי בילודים אלה שכיחות יתר של הפרעות בגדילה והיקפי ראש קטנים יותר, הפרעות קוגניטיביות ותבחיני IQ ירודים יותר, הפרעות מוטוריות והפרעות למידה בסדר גודל כללי של כעשרה אחוזים מוגבלות פיזית, חמישה אחוזים עיכוב התפתחותי וכ-30 אחוז הפרעות קלות ובהתאם לגיל ההיריון בלידה[10],[11]. גם שכיחות שיתוק מוחין גבוהה יותר במשקלי לידה נמוכים ומגיעה לסיכון יחסי פי ארבעה עד שישה בילודים בשבועות 32 עד 42 ביחס לילודים במשקל תקין[12] ולסיכון יחסי נמוך יותר בשבועות היריון מוקדמים יותר.
התיאוריה ע"ש Barker[13], המבוססת על נתונים אפידמיולוגים ועל מודל חיות מעבדה, מצביעה על קשר ברור בין תחלואה קרדיוסקולרית בגיל המבוגר כיתר לחץ דם וסוכרת, פגיעה באיברי מטרה כמחלת לב איסכמית ושבץ, לבין משקלי לידה נמוכים. ההנחה מתבססת על מודל Thrifty phenotype שבו סביבה תוך רחמית עוינת יוצרת תת תזונה המאלצת את העובר לעבור שינויי התאמה לסביבה שבה שיוכל לשרוד. שינויים אלה כוללים התאמה קרדיוסקולרית המשנה את תכונות כלי הדם (ראו מודל קומפנסציה/ דה-קומפנסציה בהמשך) , מפחיתה את מספר הנפרונים הכלייתיים ומובילה ליתר לחץ דם בגיל מבוגר, לשינוי במטבוליזם כבדי שיוביל לדיסליפידמיה ולשינוי בציר היפותלמוס-היפופיזה-אדרנל שיוביל לאי סבילות לסוכרים (Glucose intolerance) שיתבטא בסוכרת מסוג 2.
פתופיזיולוגיה
ההאטה בגדילה מהווה קבוצה הטרוגנית הקשורה לאטיולוגיות שונות, שיטות ניהול היריון שונות ופרוגנוזה שונה ממקרה למקרה, ולכן לא ניתן להתוות פתופיזיולוגיה משותפת לכל המקרים. גם כאשר המרכיב הוסקולרי דומיננטי הוא יכול להוות חלק מתמונה מעורבת כמו במום כרומוזומלי. ניתן לגבש תבנית פתופיזיולוגית המתבססת על הפרעה וסקולרית שלייתית, אך גם בזאת הביטוי הקליני יהיה תולדה של עוצמת ותזמון ההפרעה. הפרעה בסוף השליש הראשון להיריון (שבוע 16-14) תמנע התפתחות תקינה של השליה שתוביל לאיסכמיה שלייתית המהווה את הבסיס הפתופיזיולוגי להתפתחות האטה בגדילה התוך הרחמית אידיופתית על רקע וסקולרי ובמנגנון דומה להתפתחות פרהאקלמפסיה. גם כאן נוכל למצא את המאפיינים של פגיעה מסיבה לא ידועה (גנטית? דלקתית? אימונולוגית?) היוצרת הפרעה בשגשוג וחדירה של תאי טרופובלסט לעומק המיומטריום לעורקי הרחם הספירלים והחלפת תאי האנדותל הוסקולרי האימהיים. כתוצאה מכך, אותם כלי הדם לא יעברו שינוי תכונות המאפשרות התאמה לדרישה הוסקולרית המתגברת של יחידת רחם-שליה-עובר. בשלב מאוחר יותר בהיריון ייווצרו שינויים איסכמיים שיובילו לשפעול ולנזק לתאי האנדותל ולשפעול ביתר של המערכת הדלקתית, מערכת טסיות הדם והקרישה. בהתבסס על הפרעה וסקולרית ובשימוש במשתנים קליניים, עקרונות שיטת הדופלר והבנת הפתולוגיה השלייתית, ניתן לגבש את מודל ההפרעה הוסקולרית, שניתן להיעזר בו בניהול מקרים:
מודל ההיפוקסיה-היפוקסמיה-אסידמיה או מודל הקומפנסציה-דה-קומפנסציה עוברית[5] - מודל זה מתאים לתת קבוצת האטה בגדילה תוך רחמית עם מרכיב וסקולרי דומיננטי, כזה שיתבטא בהפרעה בתבניות זרימה בדופלר מערכת עורקית ו/או ורידית של העובר. הפרעה בדופלר נמצאת במתאם להפרעה משמעותית שלייתית, וכפי שנמצא במחקרים, במצבים אלה ניתן לזהות חסימת כלי דם שלייתיים ביותר מ-70 אחוז משטח השליה. זאת תת קבוצה בדרגת חומרה גבוהה שהעוברים בה עלולים להידרדר במהרה ולכן יש צורך בהשגחה צמודה.
חסימת כלי דם בשליה יוצרת תנגודת גבוהה לזרימה בחבל הטבור, המתבטאת בירידה במרכיב הדיאסטולי עד כדי העדר זרימה דיאסטולית (AEDV, Absent End Diastolic Velocity) בעורק הטבורי (Umbilical artery). זהו שלב ההיפוקסמיה המהווה שלב מוקדם שבו יכול העובר לעמוד תוך כדי תהליכי פיצוי הכוללים בעיקר שינויים במערכת העורקית שלו (Arterial redistribution). העובר משפר את זרימת הדם המוחית ויוצר את תופעת Head sparing. תבנית זרימת הדם ב-MCA (Middle Cerebral Artery) המתאפיינת בדרך כלל בתנגודת גבוהה לזרימה משתנה, לתנגודת נמוכה עם ירידה ב-PI (Pulsatility Index). במקביל וכחלק מתהליך הפיצוי, ניתן לזהות עלייה יחסית בתנגודת בכלי דם עורקיים כלייתיים ובטניים ללא שינוי במערכת הוורידית.
כאשר התנגודת השלייתית מוסיפה להיות גבוהה, בשלב מאוחר "מתעייף" העובר ומתקשה במנגנוני הפיצוי. זהו שלב הדה-קומפנסציה או האסידמיה שיכול להיווצר בין שבעה ימים ל-14 יום מהשלב המוקדם. העובר מאבד את יכולת הוויסות העורקית ואז תופיע עלייה בתנגודת ב-MCA (עלייה ב-PI) עם עלייה בתנגודת הוורידית, בעיקר ב-Ductus venosus. בשלב סופי תופיע פולסציה בוריד הטבורי (Umbilical vein). העלייה בתנגודת הוורידית משקפת מצב שבו העובר מתקשה לעמוד בתנגודת השלייתית המוגברת ומפתח כשל לבבי, ומכאן הדרך להידרדרות נוספת שתתבטא ב-NST (Non Stress Test) וב-BPP (Biophysical Profile) קצרה. בשלב מאוחר זה, בדרך כלל עלולה להופיע החמרה בתנגודת השלייתית שתתבטא בזרימה דיאסטולית הפוכה בעורק הטבורי (היפוך זרימה דיאסטולית - REDV, Reverse End Diastolic Velocity). בעבודה השוואתית אכן נמצא שתוצאות ההיריון מבחינת תמותת ותחלואת ילודים היו טובות פחות בקבוצה עם עלייה בתנגודת ורידית ביחס לקבוצה עם תנגודת ורידית תקינה[14].
ניהול מקרה
כדי לאמת את האבחנה ולחקור את המרכיב האטיולוגי, יש באנמנזה מכוונת לוודא את גיל ההיריון, סוג ההיריון (ספונטני, הפרייה חוץ גופית), גיל אימהי, מוצא, משקל לפני הלידה, עלייה במשקל במהלך ההיריון, משקל וגובה של האב, מחלות אימהיות כמחלות רקע כרוניות וסקולריות, מומים (כגון מומי לב) ומחלות במהלך ההיריון כיתר לחץ דם הריוני/ סוכרת היריון. יש לוודא משקלי לידה בהריונות קודמים, עישון, שימוש בתרופות/ אלכוהול/ סמים, מצב סוציואקונומי, הפרעות במבנה הרחם כגון: מומים, שרירנים, הידבקויות תוך רחמיות. יש לתשאל לגבי בדיקות שנעשו עד כה במהלך ההיריון כגון ברור סרולוגיה אימהית מתחילת ההיריון (TORCH, VDRL), שקיפות עורפית, חלבון עוברי, סקירות מערכות, דיקור מי שפיר, בדיקות לאבחון סוכרת בהיריון, מועד אבחון האטה בגדילה תוך רחמית/עובר קטן לגיל ההיריון, ניסיון לבנות עקומת גדילה ומיקום ותקינות השליה.
השלמת הבירור על פי אטיולוגיה משוערת תיעשה בדיון על כל מקרה לגופו כתכנית לזיהוי בעיה מבנית בעובר (מום לבבי/ מערכת העיכול/ מערכת שתן וגניטליה) על ידי ביצוע שקיפות עורפית, סקירות מערכות ואקו-לב עובר במידת הצורך, זיהוי בעיה כרומוזומלית על פי שקיפות עורפית + סמנים ביוכימיים וסקירת מערכות וייעוץ גנטי בשאלה של בירור קריוטיפ מלא והצורך בדיקור מי שפיר או חבל השורר.
בחשד למקור זיהומי יש לבצע סרולוגיה ל-Parvovirus, TORCH, VRDL, ולעתים אף לברר עדות לזיהום בדיקור מי שפיר. בחשד למקור אימהי, יש לאבחן ולטפל במחלת רקע אימהית כגון: איזון לחץ דם, איזון סוכרת, איזון תרופתי של מחלות כרוניות/ התלקחויות, בירור תסמונת APLA (Anti Phospholipid Antibodies), השלמת דופלר עורקי הרחם - Uterine artery כמקור אטיולוגי למחלה וסקולרית אימהית [הופעה של Early diastolic notch או תנגודת לזרימה מוגברת (עלייה ב-PI)].
המטרות בניהול האטה בגדילה תוך רחמית הן: אבחון מצב היפוקסמיה, החלטה לגבי ילוד במצב אסידמיה והימנעות מתוצאות היריון פחות טובות כתוצאה מהידרדרות תוך רחמית במצב העובר. לשם כך עלינו להשתמש בכלים העומדים לרשותנו לצורך הערכת מצב העובר תוך-רחמית (Fetal well being): NST ,BPP הכולל הערכת כמות מי שפיר - AFI (Amniotic Fluid index) ו-EFW (Estimated Fetal Weight) לצורך הערכת גדילה.
הערכת דופלר של עורק טבורי למדידת יחס סיסטולה לדיאסטולה, המבטא תנגודת שלייתית, מהווה חלק חשוב בהערכת מצב העובר. במידה שערך זה תקין, ניתן להסתפק בבדיקה זו. במידה שהערך פתולוגי (AEDV, או קרוב לכך), יש לבצע הערכה וסקולרית מלאה של העובר בדופלר הכוללת: Middle cerebral artery, Ductus venosus ,Umbilical vein. האטה בגדילה תוך רחמית עם זרימה פתולוגית בעורק טבורי (קרוב להעדר ועד העדר זרימה דיאסטולית) ו/או שינוי ב-NST ו/או BPP פתולוגי מחייב אשפוז, מתן Celestone והערכות לילוד. בשאר המקרים, יש צורך במעקב במרפאת רפואת האם והעובר עם שימוש באולטראסאונד, NST, דופלר בתדירות התלויה בחומרת ההאטה בגדילה התוך הרחמית, בין פעמיים לשבוע עד אחת לשבועיים.
תזמון הלידה
יש לנסות לתזמן את מועד הילוד (Timing of delivery) לנקודת הזמן האופטימלית מבחינת שבוע היריון המהווה את המשתנה החשוב ביותר לתוצאות ההיריון ולפני הופעת סימנים של אסידמיה, על מנת להפחית מחד את שיעור התמותה התוך רחמית ומאידך את שיעור התמותה והתחלואה הפרינטלית משניים לפגות. עדיין קיימת מחלוקת בספרות לגבי תזמון לידה אופטימלי בהאטה בגדילה תוך רחמית לגבי עוברים עם עלייה בתנגודת ורידית בגיל היריון צעיר. יש כאלה שגורסים ילוד, לעומת המצדדים בניהול שמרני לשיפור בבשלות. לעומת זאת קיימת הסכמה שכאשר יש הידרדרות במצב העובר המתבטאית ב-NST או ב-BPP פתולוגיים, יש ליילד את העובר. עיקר הבעייתיות נוצרת בגילאי היריון צעירים כאשר העובר הוא על גבול החיות (שבוע 26-23), שבהם בכל החלטה הפרוגנוזה של העובר חמורה ויש לידע את בני הזוג על כך.
מחלוקת לגבי תזמון הלידה קיימת בשבועות מתקדמים יותר (שבוע 34 עד המועד) בקבוצת האטה בגדילה קלה יותר ללא הפרעה בזרימת הדם בחבל השורר, והצורך בהשראת לידה נדון בכל מקרה לגופו. העבודה היחידה בספרות הדנה בתזמון הלידה בהאטה בגדילה תוך רחמית היא מחקר ה-GRIT (Growth Restriction Intervention Trial)[15]. במחקר זה 588 עוברים עם האטה בגדילה התוו בצורה אקראית לילוד מיידי או לניהול שמרני. בניתוח תוצאות הילודים בגיל שנתיים, אמנם לא נמצא הבדל בשיעור תמותה ונכות בין הקבוצות, אך בקבוצת העוברים מתחת לשבוע 31 להיריון, נמצאו תוצאות היריון טובות יותר בקבוצת הניהול השמרני (חמישה אחוזי נכות) לעומת קבוצת הילוד המיידי (13 אחוזי נכות). עבודה זאת מחזקת את הגישה השמרנית בהאטה בגדילה תוך רחמית, בעיקר סביב שבוע 31 להיריון.
לגבי אופן הלידה, אין מדובר בניתוח קיסרי בכל המקרים. יש לדון בכל מקרה לגופו ולאפשר לידה נרתיקית ו/או השראת לידה במקרים הקלים והמאוחרים יותר. מצד שני, במקרים הקשים יותר, עם מרכיב וסקולרי דומיננטי והפרעה בתבניות זרימה בדופלר, במיוחד שיש צורך בתזמון לידה, יתקשה העובר הספציפי לעמוד בתהליך לידה עקב רזרבה שלייתית מופחתת, ולכן שיעור הניתוחים הקיסריים יגבר.
מניעה
סטטיסטית, רוב מקרי האטה בגדילה בעולם, ובעיקר בעולם השלישי, הם תוצאה של תת תזונה. במקרים אלה שיפור בתזונה, בתנאי החיים ובאיכות הטיפול הרפואי עשוי למנוע חלק גדול מהמקרים. לעומת זאת, קבוצת ההאטה בגדילה התוך הרחמית על רקע אידיופתי היא קשה למניעה כי ברוב המקרים התפתחות אי ספיקה שלייתית היא במנגנון לא ברור. ניסיונות לטיפול מונע באספירין במינון נמוך בקבוצה זאת די נכשלו. לעומת זאת, ניתן למנוע חלק מהמקרים בנוכחות מחלת רקע אימהית על ידי איזון מצב האם. לדוגמה, איזון יתר לחץ דם כרוני, שימוש בטיפול מונע משולב (אספירין במינון נמוך ו-LMWH - Heparin Low Molecular weight) בתסמונת APLA.
הקשר בין האטה בגדילה התוך רחמי וטרומבופיליה מולדת אינו חד דיו מכדי להמליץ על בירור וטיפול מונע בכל מקרה, אך יש מקום לשקול בירור ואף טיפול מונע (LMWH + אספירין במינון נמוך) במקרים קשים, חוזרים ומוקדמים של האטה בגדילה התוך רחמית, ובנוכחות טרומבופיליה משמעותית מעבדתית.
מחקר עתידי
להבנת ההפרעה השלייתית ניתן לגשת מכיוונים שונים:
- הבנת המנגנון המולקולרי/ גנטי של האטה בגדילה תוך רחמית והקשר להתפתחות השליה[7]
- מחקרי דופלר-זרימה על תת קבוצות של האטה בגדילה להבנת המרכיב הווסקולרי[5]
- הבנת הפתולוגיה השלייתית על ידי הערכה היסטולוגית של הממצאים השלייתיים עם חלוקה לממצאים ממקור וסקולרי/ דלקתי אימהי או לממצאים וסקולרים/ דלקתיים עובריים[16]
- הבנת התפתחות האטה בגדילה בעזרת מודל מתמטי/ הנדסי של מערכת אם/שליה/ עובר[17]
ביבליוגרפיה
- ↑ Manning FA. General principales and applications of ultrasonography. In: Creasy RK, Resnik R, editors. Maternal-fetal medicine: principles and practice. Philadelphia: Saunders, 2004
- ↑ McCowan LME, Harding JE, Stewart AW. Customised birthweight centiles predict SGA pregnancies with perinatal morbidity. BJOG. 2005; 112, 1026-1033
- ↑ Gardosi J, Chang A, Kalyan B, Sahota D, Symonds EM. Customised antenatal growth charts. Lancet 1992; 1;339(8788): 283-287
- ↑ 4.0 4.1 4.2 Dollberg S, Haklai Z, Mimouni FB, Gorfein I, Gordon ES. Birth weight standards in the live-born population in Israel. Isr Med Assoc J 2005 ;7(5): 311-314
- ↑ 5.0 5.1 5.2 Baschat AA, Hecher K. Fetal growth restriction due to placental disease. Semin Perinat 2004; 28: 67-80
- ↑ Moore T, Haig D. Genomic imprinting in mammalian development; a parent tag of war. Trends Genetics 1991; 7: 45-49
- ↑ 7.0 7.1 Monk D, Moore GE. Intrauterine growth restriction-genetic causes and consequences. Semin Fetal Neonat Med 2004; 9: 371-378
- ↑ Snijders RJ, Sherrod C, Gosden CM, Nicolaides KH. Fetal growth retardation: associated malformations and chromosomal abnormalities. Am J Ob Gyn 1993; 168: 547-555
- ↑ 9.0 9.1 Regev R, Lusky A, Dolfin T, Litmanovitz I, Arnon S, Reichman B; Israel Neonatal Network. Excess mortality and morbidity among small-for-gestational-age premature infants: a population-based study. J Pediat 2003; 143: 186-191
- ↑ Kok JH, den Ouden AL, Verloove-Vanhorick SP, Brand R. Outcome of very pre- mature small for gestational age infants: the first nine years of life. BJOG 1998; 105: 162-168
- ↑ Eichenwald EC, Stark AR. Management and outcome of very low birth weight. New Eng J Med 2008; 358: 1700-1711.
- ↑ Jarvis S, Glinianaia SV, Torrioli MG et al. Cerebral palsy and intrauterine growth in single birth: European collaborate study. Lancet 2003; 362: 1106-1111
- ↑ Barker DJ. The fetal and infant origins of disease. Eur J Epidemiol 1995; 25; 457-463
- ↑ Ferrazzi E, Bozzo M, Rigano S et al. Temporal sequence of abnormal Doppler changes in the peripheral and central circulatory systems of the severely growth-restricted fetus. US Obstet Gyn 2002; 19: 140-146
- ↑ The GRIT study group. Infant well being at 2 years of age in the growth restriction intervention trial (GRIT): multicentred randomized controlled trial. Lancet 2004; 364: 513-520
- ↑ Kovo M, Schreiber L, Ben-Haroush A, Wand S, Golan A, Bar J. Placental Vascular Lesion Differences in Pregnancy Induced Hypertension and Normotensive Fetal Growth Restriction. 29th Annual Scientific Meeting of the Society for Maternal-Fetal Medicine, San Diego, CA, USA, 2009.
- ↑ Luria O, Bar J, Kovo M, Golan A, Barnea O. Estimation of the hemodynamic status of the growth-restricted fetus by mathematical modeling of Doppler ultrasound signals. Medical Physics and Biomedical Engineering World Congress, 2009.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' קובי בר, מנהל יחידת אם-עובר, פרופ' אברהם גולן, מנהל אגף נשים ויולדות, המרכז הרפואי וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק