המדריך לטיפול בסוכרת - גנטיקה של סוכרת וסיבוכיה - Genetics of diabetes and its complications
הופניתם מהדף הגנטיקה של סוכרת וסיבוכיה לדף הנוכחי.
המדריך לטיפול בסוכרת
מאת המועצה הלאומית לסוכרת, משרד הבריאות. עורכים מדעיים: ד"ר עופרי מוסנזון, פרופ׳ איתמר רז
| המדריך לטיפול בסוכרת | ||
|---|---|---|

| ||
| שם המחבר | פרופסור בנימין גלזר, ד"ר שרה צנגן | |
| שם הפרק | הגנטיקה של סוכרת וסיבוכיה | |
| מאת | המועצה הלאומית לסוכרת, משרד הבריאות |
|
| מועד הוצאה | 2022 | |
| מספר עמודים | 619 | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סוכרת
סוכרת היא הפרעת חילוף חומרים חמורה המאופיינת בפגמים הן בהפרשת והן בפעילות האינסולין. שכיחות המחלה גוברת במהירות והיא הופכת לבעיה בריאותית עולמית משמעותית[1][2]. ניתן לחלק את הסוכרת למספר סיווגי משנה שונים, כל אחד עם מאפיינים קליניים ייחודיים. לגנטיקה תפקיד חשוב בקביעת הסיכון של כל אחד מסוגי הסוכרת, אולם סיכון זה שונה במידה ניכרת בין הסוגים השונים של המחלה. הבנת הסיכון הגנטי הכולל מאפשרת לאמוד את הסבירות של בני משפחותיהם של המטופלים לפתח סוכרת. לדוגמה, במקרים מסוימים, בחולים עם סוכרת monogenic (ראו להלן) קביעה האטיולוגיה הגנטית של הסוכרת של הפרט, מעבר לכך שהיא יכולה להיות קריטית למתן הטיפול המתאים, היא גם מאפשרת להעריך את הסיכון והטיפול המתאים לקרובי המשפחה של המטופל. אף על פי שלאבחנה הגנטית יש תפקיד מרכזי בקביעת טיפול רק במיעוט קטן של החולים, סביר להניח שבעתיד הידע הגנטי יאפשר טיפול מותאם יותר במסגרת הרפואה המותאמת אישית.
העקרונות לקביעה של סיכון גנטי
וריאציה גנטית (מוטציה) יכולה להיות הגורם הישיר של המחלה כמו במקרה של מחלות גנטיות קלאסיות המכונות מחלות מונוגמיות. מחלות אלו נגרמות כתוצאה מפגם בגן בודד. במצבים אחרים השונות הגנטית יכולה להשפיע על רמת הסיכון, להוריד או להעלות, מבלי לגרום למחלה באופן ישיר. במקרה האחרון, שילוב של מספר גורמים המשנים את רמת הסיכון הגנטי מצטברים וקובעים יחדיו אה הסיכון הגנטי הכולל של הפרט לחלות במחלה. מחלות בעלות דפוסי הורשה מורכבים המשלבות סיכונים רבים מכונות מחלות פוליגנטיות.
מחלות מונונוגמית
מחלות גנטיות קלאסיות נגרמות על ידי מוטציות בגנים ספציפיים הגורמות ישירות לפנוטיפ המחלה. לדוגמה, בסיסטיק פיברוזיס, מוטציה בגן CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) גורמת לשינויים בהפרשה של תאים בסמפונות (ובאיברים אחרים), דבר הגורם להופעת המחלה. באופן כללי, ניתן לומר שיש יחסי גומלין ישירים בין נוכחותה של מוטציה בגן לבין הופעתה של המחלה, אך המופעים יכולים להיות מגוונים ובעלי דרגות חומרה משתנות. המופעים השונים יכולים לנבוע ממוטציות שונות באותו הגן או ממוטציות בגנים אחרים ואף יכולים להיות תוצאה של השפעות מהסביבה.
זיהוי המוטציה הגורמת למחלה מאפיינים קליניים ברורים של מחלה מונוגמית הוא קריטי לטיפול נכון. בעבר, זיהוי הגנים הגורמים למחלה או מוטציה במשפחה עם חשד קליני של מחלת מונוגמית שעדיין לא הוגדרה מבחינה גנטית, היה קשה והצריך שנים רבות של עבודה והשקעה כספית גדולה. לאחר השלמתו של ריצוף הגנום האנושי והשיטות החדישות לריצוף מהיר וזול יחסית של גנים, בהינתן גישה ל-DNA, ברוב המקרים, ניתן לרצף את הגנום השלם של משפחה בגודל מתאים עם פנוטיפ ברור בצורה יעילה ובכך לזהות את הגן הפגוע.
מחלות פוליגנטיות
במחלות ותכונות עם מאפיינים תורשתיים רבים, כאשר נבחנים הפנוטיפים בשושלת משפחתית, קשה למצוא מודל ברור המסביר את אופי ההורשה, כפי שנעשה עבור מחלות מונוגמיות. באופן כללי, השונות הגנטית בין שני אנשים מוערכת בכ-0.6 אחוזים מהגנום (20 מיליון בסיסים של DNA) אך רק חלק קטן מהשונות הגנטית הזו גורם לליקויים חמורים בתפקוד הגן. כאשר הליקויים הגנטיים מופיעים בצורה הומוזיגוטית (שני אללים זהים של הגן המוטנטי) שינויים אלו יכולים לגרום למחלות מונוגמיות. רוב 20 מיליון הווריאציות הגנטיות נמצאות מחוץ לאזורים שמקודדים לגנים, אבל חלק מהם נמצאים באזורים רגולטוריות (אזורים שחשובים לוויסות שעתוק ה-DNA בתהליך יצירת החלבון) ובכך יכולים להשפיע על רמות ביטוי גנים מבלי להשפיע ישירות על פעילות החלבון. לרוב המכריע של הווריאציות הגנטיות אין השפעה בכלל על תפקוד הגן או על ביטויו, או שתיתכן השפעה קטנה ועדינה שלא תהווה למעשה גורם סיכון משמעותי בהתפתחות המחלה. אולם, למרות ההשפעה הקטנה שיש לכל וריאנט בנפרד, חלקם עשויים לשנות (להגדיל או להקטין) את הסיכון של הפרט לחלות במחלה. השינוי ברמת הסיכון עשוי להיות מספיק גדול ולהוות גורם מכריע בהעלאת הסיכון לחלות במחלה בצורה משמעותית בהתייחס לאחוז הסיכוי באוכלוסייה הכללית אך לעיתים קרובות הוא קטן מאוד ולכן משנה בצורה מאוד זעירה את הסיכון לפתח את המחלה. וריאנטים גנטיים הקשורים לרמות סיכון משתנות יכולים להימצא באופן נדיר או שכיח מאוד באוכלוסייה. במקרים מסוימים וריאנט שמגביר את הסיכון למחלה מסוימת עשוי בפועל להיות נוכח למעלה מ-50 אחוזים של האוכלוסייה.
זיהוי וריאנטים גנטיים המשנים את הסיכון של המחלה יכול להיות קשה מאוד, במיוחד אם האפקט הוא קטן ושכיחות הווריאנט נמוכה. מחקרים כאלה יכולים להתבסס על מחקרי תאחיזה או מחקרי אסוציאציה.
מחקרי תאחיזה מתבססים על מציאת הורשה של אלל מסוים שמופיע באופן משמעותי יותר בצאצאים חולים במחלה מאשר בצאצאים בריאים שאין להם את המחלה, אך מחקרים אלו מצריכים קבלה של DNA ונתונים ופנוטיפ ממספר גדול של פרטים במשפחות מורחבות, דבר המהווה אתגר גדול במחלה כמו סוכרת מסוג 2 שפורצת בדרך כלל בגיל מתקדם. במבחני האסוציאציה מחפשים הבדלים גנטיים בין שתי אוכלוסיות שונות, אחת עם המחלה והשנייה ללא מחלה. בשנים הראשונות של המחקר הגנטי של מחלות פוליגנטיות, חוקרים בחרו גנים ספציפיים בעלי סבירות גדולה להיות קשורים למחלה וחיפשו בהם או בקרבתם שינויים גנטיים ואז ערכו לגנים אלו מבחני תאחיזה או אסוציאציה גנטית באוכלוסיות מחקר קטנות יחסית. גישה זו נחלה הצלחה לעיתים נדירות. במאז סוף המאה ה-20, רוב מבחני האסוציאציה עושים שימוש בכלים המאפשרים גישה כוללת שחוקרת את כלל הגנום ללא הטיה לכיוון גנים או אזורים ספציפיים בגנום. במחקרי הקשר כלל גנומי GWAS) Genome-Wide Association Studies) הקושי הוא בצורך לסרוק עשרות אלפים ואפילו מאות אלפים של דגימות DNA של משתתפים, המחולקים לקבוצת חולים ולקבוצת ביקורת. קושי נוסף נובע מכך שבקבוצות אתניות נפרדות יכולים להימצא וריאנטים שונים באסוציאציה עם סיכון גבוה יותר לפתח את המחלה. הווריאנטים האלה יכולים להיות שונים בין הקבוצות האתניות השונות, דבר המצריך ביצוע GWAS נפרד לכל קבוצה אתנית. כמו כן, זיהוי הוואריאציות הגנטיות הקשורות למחלה הוא הצעד הראשון בלבד ועדיין ייתכנו קשיים רבים בדרך למציאת השונות הגנטית המהווה את גורם הסיכון למחלה. זהו נושא מורכב ומעניין אשר דורש דיון ארוך ומעמיק יותר, החורג מתחום הנושא העיקרי של פרק זה.
הבסיס הגנטי של הסוגים השונים של סוכרת
סוכרת מסוג 1 (Type 1 Diabetes (T1D
סוג זה מאופיין בתהליך אימוני ובהרס של תאי הבטא בלבלב האחראיים לייצור אינסולין. תהליך זה מוביל, בסופו של דבר, לחוסר מוחלט באינסולין ולתלות מלאה במתן אינסולין חיצוני באמצעות זריקות תת-עוריות או משאבת אינסולין. שכיחות סוכרת מסוג 1 באוכלוסייה הכללית היא כ-0.5 בטווח של 3 אחוזים עד 3.5 אחוזים בפינלנד וסרדיניה ו-0.2 אחוז ביפן[3].
בישראל, שכיחות סוכרת מסוג 1 היא כ-0.4 אחוז ועולה בצורה ניכרת בקרובי משפחה מדרגה ראשונה (טבלה מספר 1). ממצא זה מעיד על הרקע הגנטי החזק של סוכרת מסוג 1. באופן מפתיע השכיחות הגנטית בקרב זוגות תאומים זהים היא רק 30 אחוזים עד 50 אחוזים, דבר המעיד על כך שגם לגורמים הסביבתיים יש חשיבות בהתפרצות המחלה. הזהות המדויקת של הגורמים הסביבתיים האלה עדיין אינה ידועה, אך נראה שנגיפים וחשיפה למזונות, לאלרגנים ולגורמים שעדיין אינם מזוהים, משפיעה על התפרצות המחלה.
הגנים החשובים ביותר המעורבים בנטייה לפתח את המחלה הם הגנים לסיווג רקמות בכרומוזום 6 בקומפלקס HLA) Human Leukocyte Antigen) אולם, זוהו יותר מ-40 גנים נוספים שנמצאו כמגבירים את הסיכון לפתח סוכרת מסוג 1[4].
בשנת 2016 פיתחו Patel ושותפיו כלי גנטי חדשני בשם GRS) Type 1 Diabetes Genetic Risk Score). כלי זה, המבוסס על גנוטיפ של 30 וריאנטים הקשורים לסוכרת מסוג 1, הצליח להבדיל בין חולים הסובלים מ-T1D לבין סוגים אחרים של סוכרת, כולל סוכרת מונוגנית (ראו בהמשך) וסוכרת מסוג 2[5]. אף על פי שכלי גנטי זה הצליח להראות הבדלים משמעותיים מבחינה סטטיסטית, עדיין נותרה חפיפה גדולה מדי בין קבוצות הסוכרת השונות, דבר שמנע אפשרות לשימוש קליני בשיטה זו. הכלי שודרג, כך שיכלול עוד גנים וגם גנוטיפים נוספים של HLA[6] הכלי המשודרג שנקרא GRS2 רגיש וספציפי יותר מקודמו. השימוש הקליני ב-GRS2 עדיין לא הוכח, אך נראה שיש לו פוטנציאל לעזור באבחון של חולים בהם האטיולוגיה של המחלה לא ברורה, כגון בחולים עם Latent Autoimmune of Adult (LADA) ובסוכרת מבוגרים המופיעה בנעורים (Maturity Onset Diabetes of the Young, MODY). עם זאת, גם לכלי המשודרג אין עדיין כוח סטטיסטי מספק על מנת לאפשר ניבוי של סוכרת מסוג 1 באוכלוסיות של ילדים בריאים.
סוכרת מסוג Type 2 diabetes (T2D) 2
לכ-90 אחוזים מהחולים בסוכרת יש סוכרת מסוג 2. מחלה זו מתאפיינת בכשל הדרגתי של תפקוד תאי הבטא באיי הלבלב, המלווה במקרים רבים בתנגודת בינונית או חמורה של הרקמות הפריפריות, בעיקר שריר ושומן לאינסולין. בעבר אובחנה המחלה בעיקר אצל חולים בני 40 ומעלה והתגלתה בצורה נדירה אצל חולים צעירים. אולם, מאז תחילת המאה ה-21, שכיחות הסוכרת מסוג 2 בקרב אנשים צעירים, בני נוער ואפילו ילדים גדלה באופן דרמטי, במיוחד במדינות המפותחות. עלייה זו מיוחסת בעיקר להשמנה מוגברת, שהיא תוצאה של שינויים באורח החיים, כולל תזונה לקויה והעדר פעילות גופנית.
מחקרים שבדקו את העלייה בסיכון לחלות בסוכרת מסוג 2 על רקע אנמנזה משפחתית של סוכרת או על רקע אתני הראו בבירור כי ההורשה ממלאת תפקיד חשוב בפתוגנזה של סוכרת מסוג 2 (טבלה 1). אולם, בניגוד לסוכרת מסוג 1 לא זוהה עד היום גן יחיד או אזור מסוים בגנום (Genetic locus) שיכול להסביר חלק גדול של ההורשה. למרות זאת, זוהו למעלה מ-150 אזורים שונים בגנום אשר כל אחד מאזורים אלה תורם עלייה קטנה בסיכון לפתח סוכרת מסוג 2. בעבר נחקרו בעיקר גנים שיש להם זיקה ידועה למנגנונים הקשורים לסוכרת (Candidate gene approach) מכיוון שמחקרים שדרשו כלים לחקר הגנום כולו כמעט ולא היו קיימים. מחקרים אלה הניבו הצלחה חלקית בלבד במבחני אסוציאציה הקשורים לסוכרת מסוג 2. בצורה זו זוהו הגנים PPARG, KCNJII ואחרים[7][8][9]. הניסיונות להשתמש בגישה של מחקרי זיקה כלל-גנומים (GWAS) על מנת להשיג תוצאות חוזרות נכשלו בעיקר כיוון שהמורכבות של המחלה לא הייתה אז מספיק מובנת[8][10][11].
ההבנות החדשות והכלים החדשים למחקר הגנטי מאפשרים להשתמש נכון בגישה של מחקרי זיקה כלל-גנומים GWAS על מנת לזהות את הגנים הקשורים לסוכרת מסוג 2. מחקרים אלו סוקרים את כלל הגנום ללא הטיה לכיוון גנים או אזורים ספציפיים בהם. רוב מחקרי ה-GWAS שנערכו, תוכננו לזהות וריאנטים נפוצים הקשורים לסיכון, שהופיעו בשלב מוקדם של ההתפתחות האנושית והתפשטו ברחבי האנושות כולה, או לפחות ברחבי כל אחת מהקבוצות האתניות שנחקרו. בשיטה זו זוהו כ-150 אתרים גנטיים לסיכון לפתח סוכרת מסוג 2[12], אך איתור אזור "חשוד" בגנום לא בהכרח מאפשר לזהות את הגן האחראי למחלה. רבים מהווריאנטים שזוהו אינם ממוקמים בתוך או אפילו קרוב לגנים כך שהמתאם התפקודי שלהם אינו ידוע. בדומה לכך, גם לגבי אלה הממוקמים סמוך לגנים ידועים, השפעת הווריאנטים החשודים על ביטוי או תפקוד הגנים אינה ידועה. בכל מקרה, גם יחד, כל מיקומי הסיכון הנפרדים הללו מסבירים רק חלק קטן מהתורשתיות הנצפית של סוכרת מסוג 2[8].
הפיתוחים הטכנולוגיים החדשים, במיוחד טכנולוגיות ריצוף בהספק גבוה במיוחד (Massively Parallel Sequencing) הידועות גם כ"דור הבא של הריצוף" (Next Generation Sequencing) אפשרו לעשות ריצוף של האזורים המקודדים לחלבון (Exome sequencing) או ריצוף של כלל העום Whole genome sequencing) WGS). שיטות אלו מתאימות יותר לזיהוי וריאנטים שיכולים להשפיע על התפתחות סוכרת מסוג 2, לזהות וריאנטים נדירים ואף לזהות גנים ספציפיים בהם קיימות מוטציות שמעלות סיכת לחלות בסוכרת[13].
מחקרים שנעשו, (GENES consortia-G0T2D and T2D) באוכלוסיות מגוונות מבחינה אתנית ובמרכזים שונים בעולם סיפקו מידע חדש על הארכיטקטורה של הגנטיקה של סוכרת מסוג 2[8]. מחקרים אלו בצעו ריצוף של כלל הגנום WGS של 2,657 פרטים ו-Exome sequencing של 12,940 חולי סוכרת מסוג 2 ואף הרחיבו את המדגם עד ל-111,548 משתתפים[14][15].
| טבלה 1. הסיכון התורשתי לחלות בסוכרת סוג 1 וסוג 2 | ||
|---|---|---|
| סיכון מוערך ( אחוזים) | סוכרת סוג 1 | סוכרת סוג 2 |
| אוכלוסייה כללית | 0.4 | 5 |
| אב עם סוכרת | 8 | 15 |
| אם עם סוכרת | 3 | 15 |
| גם אב וגם אם עם סוכרת | 30 | 70 |
| אח/ות עם סוכרת | 6 | 10 |
| מתאים לשני אללי HLA | 13 | (-) |
| מתאים לאלל HLA אחד | 5 | (-) |
| שאינו מתאים ל-HLA | 2 | (-) |
| תאומים זהים, התאמה | 50-30 | 90 |
| תאומים לא זהים, התאמה | 10 | 10 |
המסקנות ממחקרי ענק רב לאומיים אלו הן:
- רוב הקשרים הגנטיים שנמצאו באמצעות מחקרים אלו נובעים מצורה ווריאנטים שכיחים יחסית <1 אחוז) שרובם כבר זוהה במחקרים מוקדמים יותר
- אללים נדירים תורמים חלק קטן מהסיכון הגנטי לפתח סוכרת
- נמצאה העשרה של וריאנטים נדירים בגנים שמעורבים ב-MODY (כפי שתואר למטה). ממצא זה מאשר את החשיבות של גנים אלו להתפתחות סוכרת מסוג 2. ההשפעה של וריאנטים אלו הייתה קטנה והפנוטיפ הסוכרתי של חולי סוכרת נשאים לווריאנטים האלה לא הייתה שונה מחולי סוכרת מסוג 2 שאינם נשאים לווריאנטים אלו, ולא מדובר בחולה MODY שאובחנו בטעות כחולי סוכרת מסוג 2
אולם, למרות כל המאמץ המחקרי המסיבי שנעשה, המידע שהתקבל ממחקרים אלו מסביר רק חלק מהתורשה של T2D. הסיבה לכך יכולה להיות נעוצה בכך שישנם גורמים אפיגנטיים והאינטראקציה בין שינויים גנטיים ספציפיים וגורמים סביבתיים שעדיין לא הובררה דיה.
שינויים אפיגנטיים: על אף שהבקרה העיקרית של ביטויי גנים נשלטת על ידי רצף הדנ"א באזורי הבקרה, התברר שלשינויים לא גנטיים יש השפעה עצומה על בקרת ביטוי גנים. שינויים כגון מתילציה של דנ"א ושינויים בחלבוני הכרומטין האורזים את הדנ"א, הידועים באופן כולל בשינויים אפיגנטיים (Epigenetic) משחקים תפקיד מכריע בבקרת ביטוי גנים. חלק משינויים אלה שמופיעים בתחילת ההתפתחות של העובר כתוצאה משינויים גנטיים או בהשפעת הסביבה יכולים להתפזר בתאים שונים בגוף ובכך יכולים לתרום להעלאת הסיכון לפתח סוכרת מסוג 2. לכן, שינויים אפיגינטיים שזוהו לפני תחילת ביטוי הפנוטיפ הסוכרתי יתרמו לחזות את הסיכון הכולל לסוכרת מסוג 2[16][17][18][19].
תגובות גומלין בין גנים ובין הגן והסביבה: רובם המכריע של המחקרים שפורסמו, חקרו את הקשר שבין מיקום בודד (Single locus) והסיכון לסוכרת, מבלי לקחת בחשבון תגובת גומלין אפשרית בין מיקומים (Loci) שונים או בין מיקומים וגורמים אחרים. לדוגמה, וריאנט יכול להעלות את הסיכון למחלה רק במקרה וקיים וריאנט נוסף וגורם סביבתי כמו עודף משקל או עישון. נעשו ניסיונות להתייחס לנושא זה אולם מגבלות חישוביות, הגבילו את המסקנות לתגובת גומלין דו-כיוונית בין מיקומים בגנום הידועים כמגבירים את הסיכון או בין מיקום בודד וגורם סביבתי ידוע. בניתוחים סטטיסטיים אלו נמצאו תגובות גומלין משמעותיות, אף הם לא שינו יכולתנו להעריך אה הסיכון הגנטי לחלות בסוכרת. מבוצעים מחקרי GWAS בסדר גודל רחב מאוד ואנו מצפים שיחד עם השיטות החישוביות החדשות נגיע להבנה טובה יותר של יחסי הגומלין שיש בין אתרים הגנטיים שנמצאו במחקרי ה-GWAS הרחבים האלו והגורמים הסביבתיים.
תאוריית פלטת הצבעים: הסקירה של Mark McCarthy[20] שהתפרסמה, בונה תיאוריה בה סוכרת מסוג 2 אינה מחלה אחת אלא מהווה ספקטרום רחב של מחלות. McCarthy טוען שיש טווח של שונות בתכונות כפי שמתואר בתמונה מספר 2. בתאוריית זו McCarthy מדמה את הספקטרום לערכה של סדרת צבעים כמו זו של צייר (פלטה של צבעים) שמייצגים מגוון תכונות. בתמונה מספר 1 ישנם 6 מסלולים שונים לפתח סוכרת מסוג 2 וארבעה פרטים. מתוכם 3 חולים בסוכרת מסוג 2 ופרט אחד שיישאר בריא אף על פי שהוא חולק מספר תכונות הקיימות גם אצל הפרטים שחולים בסוכרת אך בדרגת חומרה פחותה. ההבדל בין הבריא לחולים לדעת McCarthy הוא ספקטרום שונה ודרגת חומרה שונה של התכונות "הרעות". במודל זה פרטים ממחקרים גדולים יכולים להשתלב במגוון שילובים בתוך הטווח של התכונות. לכן, עבור כל אדם ספציפי, המחלה עלולה להיגרם על ידי פגם חזק בתכונה אחת או שתיים או שילוב של פגמים קלים במספר תכונות שונות. אצל חלק מהחולים, הידע שמתקבל מאנליזה זו חשוב, כי הוא עשוי לאפשר לרופאים להתאים את התרופות בצורה טובה יותר לחולה המסוים[20].
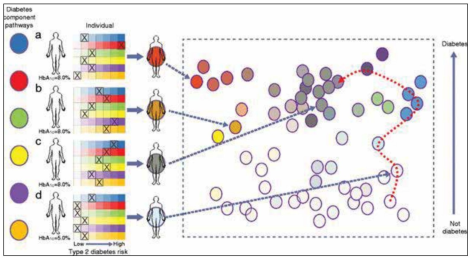
Bayesian nonnegative matrix factorization: נעשה ניסיון להשתמש בשיטה זו כדי לאחד לקבוצות חדשות את הווריאנטים הגנטיים שנמצאו ב-GWAS שנעשו ביחס לתכונות השונות הקשורות לסיכוי לפתח סוכרת מסוג 2[9]. בעזרת שיטה זו, שהיא שיטת גמישה יותר מהשיטות הקודמות, הוגדרו חמש קבוצות חדשות שמאגדות אתרים (loci) ספציפיים בגנום של חולי סוכרת מסוג 2. נמצאו שתי קבוצות שקשורות לחסר באינסולין ושלוש שקשורות לתנגודת לאינסולין. נמצא שקבוצות חדשות אלו מועשרות בצורה ייחודית בסוגים שונים של Enhancers (אזורים בגנום שמגבירים ביטוי גנים) ובסוגים שונים של Promoters (אזורים שמהווים את תחילת ביטוי הגן) ברקמות הרלוונטיות. השונות הזאת מרמזת למנגנון מולקולרי שונה שגורם לסוכרת בקבוצות השונות. בהתאם, נמצאה שונות גנטית בתאי הבטא של קבוצות חולים בעלי ירידה בתפקוד תאי הבטא ובחולים עם תנגודת היקפית נמצאו וריאנטים גנטיים ייחודיים ברקמת השומן. שיטה זו מאפשרת לייחד חולים לקבוצות השונות בהתייחס למנגנון השונה הגורם להתפתחות הסוכרת בכל קבוצה בהתאמה. ובעצם מספקת לראשונה את הרקע הגנטי לסוגי החולים השונים המרכיבים את הקבוצה ההטרוגנית של חולי סוכרת מסוג 2. שיטה זו אף מחברת לראשונה בין הרגישות הגנטית למנגנון שגורם למחלה וייתכן שתאפשר פיתוח של טיפול ייחודי, שונה ומותאם אישית לחולים בקבוצות השונות.
LADA
החולים בסוכרת מסוג Latent Autoimmune of Adult) LADA) מציגים פנוטיפ שנראה כמו טווח ביניים בין סוכרת מסוג 1 ל-2. חולים אלו בדרך כלל אינם שמנים והם מציגים בהתפרצות המחלה מופע סוכרת מתון יחסית-אשר מתקדם לסוכרת תלוית אינסולין מהר יותר מאשר טיפוסי אצל חולים עם סוכרת מסוג 2. חולים בסוכרת מסוג LADA מציגים לעיתים נדירות חמצת והם בדרך כלל שומרים על רמות פפטיד C מדיד בדם גם שנים רבות לאחר האבחון הראשוני של המחלה. בנוסף, ניתן למצוא בדמם של חולי LADA נוגדים עצמיים (Autoantibodies) הקשורים לסוכרת מסוג 1 בעת האבחון הראשוני של המחלה וקצב ההחמרה של תסמיני המחלה עומד בקורלציה עם מספר הנוגדים העצמיים (autoantibodies) שנמצאו אצל אותו החולה[21][22].
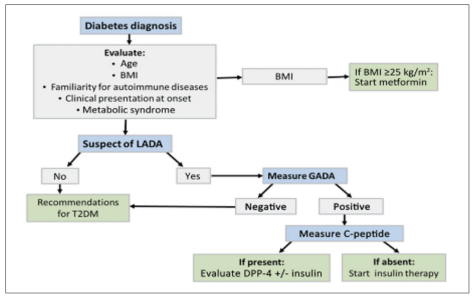
הושלם ה-GWAS הראשון של LADA שהראה רמות סיכון גנטי דומה לאלה שמוצאים בסוכרת מסוג 1[23]. נמצא שה-HLA-הפלוטיפ של LADA שונה במקצת בהשוואה לזה שמשויך לסוכרת מסוג 1. עובדה זו יכולה להציע שהמתקפה האימונית על תאי הבטא של חולי LADA פחות חמורה - דבר, שיכול להסביר את המופע היחסית מאוחר ואת הקצב האיטי של התפתחות הסוכרת בחולים אלו. המודעות להימצאות סוג זה של סוכרת נמוכה יחסית, וכאין עדיין קריטריונים ברורים שעוזרים להחליט מי הם החולים שצריכים להיבדק להימצאות המחלה. העובדה שהתהליך האוטואימוני איטי יותר בחולי LADA מאפשרת חלון זמן רחב יותר לטיפול להאטת התפתחות המחלה או אפילו למנוע את הפתופיזיולוגיה, המשך של הרס האמונולוגי, של תאי הבטא. לכן, זיהוי מוקרם ונכון של המחלה וטיפול מוקדם באינסולין עשויים לשמור על תפקוד תאי הבטא ולמנוע את התקדמות המחלה. בנוסף, גילוי עתידי של טיפולים ביולוגיים שמטרתם לשעת את התהליך האוטואימוני בסוכרת מסוג 1, עשוי להיות מתאים במיוחד לטיפול ב-LADA, דבר המחזק את החשיבות בהעלאת המודעות לנוכחות המחלה ואת הצורך בעלייה בשיעור גילויה[21], האבחון של LADA קשה ואחוז גבוה של חולי LADA לא מאובחנים. ההערכה היא שכ-5 אחוזים עד 10 אחוזים מהחולים בסוכרת מסוג 2 אובחנו באופן שגוי והם למעשה חולי LADA. אבחון וטיפול נכון של סוג זה של סוכרת מושתת על הגישה של "רפואה מותאמת אישית" שתאפשר לשמור על מטבוליזם תקין יותר למנוע את סיבוכי הסוכרת ואולי אפילו לשמור את תפקוד תאי הבטא הנותרים. הוצע אלגוריתם לאבחון וטיפול ב-LADA (תמונה מספר 2) המשלב תרופות פומיות המשמשות להורדת רמות הגלוקוז כמו Dipeptidyl peptidase peptide 4 (DPP-4 inhibitors) ואגוניסטים לרצפטור של 1-GLP[24].
סוכרת הילוד
סוכרת הילוד מוגדרת כסוכרת המאובחנת לפני גיל 6 חודשים. סוכרת אוטואימונית (סוכרת מסוג 1) נדירה מאוד לפני גיל שישה חודשים. סוכרת שמאובחנת לפני גיל זה היא כמעט תמיד מונוגנית. כ-50 אחוזים מהמקרים מציגים מחלה חולפת (TNDM), שבה הסוכרת עוברת באופן ספונטני בטווח של 3–18 חודשים. ברוב מקרי סוכרת הילוד החולפת, המחלה נגרמת כתוצאה משינויים גנטיים שונים על כרומוזום 6q24. אצל חלק מהחולים הסוכרת מופיעה שוב בשלב מאוחר יותר בחיים לעיתים קרובות במהלך או בצמוד להתרחשותה של מחלה אחרת. ל-50 אחוזים מחולי סוכרת הילוד יש מחלת קבועה (PNDM) הנגרמת על ידי מוטציות בגנים שונים (בטבלה 2 ניתן למצוא רשימה חלקית של הגנים). מבחינה קלינית, החשובים מבין הגנים אלה הם KCNJII ו-ABCC8 המקודדים שתי תת-יחידות של תעלת KATP של תאי בטא[25]. מוטציות דומיננטיות מאקטבות בגנים אלו גורמות לתעלה להישאר פתוחה ללא קשר לרמת הגלוקוז סביב התא. הפרשת האינסולין נחסמת לחלוטין, אולם תאי הבטא שורדים, לפחות לזמן מה. במרבית המקרים, התעלה המוטנטית שומרת על התגובה לתרופות ממשפחת Sulfonylurea (SU) כך שטיפול בעזרת תרופות אלו מתקן את הפגם הראשוני. אף על פי שהטיפול בעזרת SU לא משחזר את בקרת הגלוקוז על התעלה, מסלולי ההגברה במורד מסלול האיתות מבוקרים באופן נורמאלי כך שבאופן כללי הוויסות מתווך על ידי חומרי תזונה ואינקרטינים (incretins) כמשפיעים על הפרשת האינסולין המשוחזר באופן כללי. כתוצאה מכך, חולים אלה יכולים להשיג איזון סוכר טוב למדי כאשר הם מטופלים בעזרת SU בלבד. בחולים שאינם מטופלים בעזרת SU, נראה שיכולת תאי הבטא לתפקד מידרדרת לאורך הזמן, כך שהתגובה לטיפול מרשימה הרבה פחות בחולים שטופלו באינסולין שנים רבות לפני האבחון הגנטי. על כן, אבחת וטיפול מוקדמים הכרחיים למניעת תלות ארוכת טווח באינסולין.
הגורם השני בשכיחותו ל-PNDM הוא מוטציות בגן אינסולין[26]. מוטציות אלו גורמות לשינויים מבניים בחלבון המביאים לקיפול לא תקין שלו, מה שמצית את התגובה לחלבון לא מקופל, עקה של הרשת האנדופלסמטית (Endoplasmic reticulum, ER) ולבסוף מוות התא. על אף שאין טיפול ספציפי לחולים אלה, מחקרים במעבדה ובבעלי חיים מציעים שאנלוגים של 1-GLP יכולים לשפר את יכולת תאי בטא להתמודד עם העקה של ה-ER ועל כן לשרוד ולתפקד זמן ארוך יותר[27].
סוכרת הילוד יכולה להופיע כחלק מסינדרום אחר הפוגע בתפקוד של איברים אחרים כגון פגיעה בלב (ממוטציה GATA6), מיקרוצפליה (מוטציה 1ER31P1), פגיעה בתפקוד כיס מרה ואטרזיה של המעי (מוטציה בגן RFX6), מחלות אוטואימוניות סינדרום IPEX, כשל כבד ואנומליה בעצמות (סינדרום Woicott-Rallison), אי ספיקת לבלב (מוטציה ב-1 PDX) תסמונת וולפרן (מוטציה WFSI, WFS2). לגבי חולים אלו חשוב מאוד לדייק בהבחנה כדי לתת טיפול נאות[28].
| טבלה 2. סוכרת של הילוד | |||||||
|---|---|---|---|---|---|---|---|
| תת סוג | גן | מיקום (כרומוזום) | הורשה | גן סוכרת סוג 2 | תפקיד | אחוז | פגם תפקודי |
| תעלת KATP | KCNJ11 | 11p15.1 | דומיננטי/רצסיבי (נסגני) | כן | תעלת יון (Ion) | 30 | תעלה פתוחה |
| תעלת KATP | ABCC8 | 11p15.1 | דומיננטי/רצסיבי | כן | תעלת יון | 10 | תעלה פתוחה |
| אינסולין | INS | 11p15.5 | דומיננטי | כן | הורמון | 12 | קיפול שגוי |
| גלוקוקינאז (Glucokinase) |
GCK | p7 | דומיננטי | כן | אנזים | 4 | Glucose threshold |
| PDX | PDX1 | q13 | רצסיבי | לא | TF | נדיר | תא ביתא |
| Other+X | 40 | ||||||
סוכרת מבוגרים המופיעה בנעורים (Maturity Onset Diabetes of the Young, MODY)
קבוצת מחלות המוגדרת קלאסית בסוכרת שאינה תלוית אינסולין, המופיעה בדרך כלל באדם ללא עודף משקל מתחת לגיל 25, עם רקע משפחתי של שלושה דורות לפחות של מחלה דומה קלינית[29][30][31][32]. התסמונת נגרמת ממוטציה אוטוזומלית דומיננטית באחד ממספר גנים (טבלה 3). מסד הנתונים OM1M) Online inheritance in Man) מפרט 13 צורות של MODY, הנגרמות כל אחת על ידי מוטציה אוטוזומלית בגן אחר. מתוך אלו, שלוש (1–3 MODY) מהוות את הרוב המכריע של המקרים. מצאו שיש חולי MODY שאינם עומדים בקריטריונים הקלאסיים בכך שחלקם סובלים מהשמנת יתר; אבחנת המחלה מתעכבת מעבר לגיל 25; ובכך שזיהו מקרים ללא היסטוריה משפחתית עם מופע של מוטציות חדשות. ממצאים אלו מציעים שהשכיחות הכוללת של MODY יכולה להיות גבוהה מכפי שחשבו בעבר. בשנת 2018 בוצע מחקר בו רצפו את הגנום של 488 חולים צעירים ושמנים שאובחנו בסוכרת מסוג 2 לחיפוש מוטציות אופייניות ב-MODY. מצאו שב-4.5 אחוזים מהחולים הללו היה אבחון שגוי והם בעצם חולים ב-MODY[33]. מכאן, ש-MODY יכול להופיע גם באוכלוסיית ילדים שמנים ויש צורך לקחת את זה בחשבון בזמן האבחון.
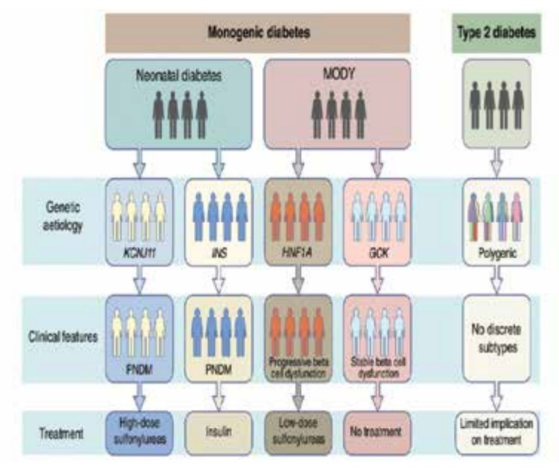
לאבחנה הנכונה של סוג ה-MODY יש השלכות קליניות משמעותיות מכיוון שצורות שונות גורמות לפנוטיפים שונים עם תחזיות (פרוגנוזות) שונות וטיפול שונה. לדוגמה, חולי MODY2 (גלוקוקינאז glucokinase) סובלים באופן טיפוסי מהיפרגליקמיה בצום במידה קלה עם או בלי עלייה קלה ברמות גלוקוז לאחר ארוחה ו-HbA1c. במרבית חולים אלה המחלה קלה ואינה מידרדרת והסיבוכים ארוכי הטווח נדירים. על כן, על אף ההמלצה לשינוי הרגלי חיים והתועלת האפשרית לחלק מהחולים מטיפול בעזרת מטפורמין, נדיר שמומלץ טיפול באינסולין או במעודדי הפרשת אינסולין. בניגוד חד, חולי 1 MODY או 3 סובלים ממחלה חמורה ומדרדרת יותר ואבחנה מוקדמת היא קריטית. חולים אלה יכולים להיות רגישים מאוד למינונים קטנים של סולפונילאוריאה (SU) ויכולים לפתח היפוגליקמיה בתגובה למינון הרגיל. עבור מרבית החולים, איזון רמת הסוכר בעזרת SU טוב יותר מאשר בעזרת אינסולין, לפחות בשנים הראשונות. MODY וסוכרת של הילוד מהווים סוגים נדירים של סוכרת ולכן ישנם מקרים לא מבוטלים של אבחון שגוי של חולים אלו עם סוכרת מסוג 1 או 2. בנוסף, הכלים הקליניים המבוססים על גיל האבחון <25 שנה, משקל תקין וללא טיפול באינסולין מאבחנים פחות ממחצית מחולי ה-MODY. כדי להקל על האבחון פותח מחשבון שניתן להוריד מהאינטרנט ללא תשלום (www.diabctesgcncs.org). התוכנה פשוטה להפעלה בטלפון סלולרי מסוג אנדרואיד ומאפשרת חישוב מהיר של הסיכוי ל-MODY. מחשבון זה מתאים במיוחד לחולים שלא מטופלים באינסולין. בחולים המטופלים באינסולין יש לבחון, בנוסף, המצאות נוגדנים כנגד איי הלבלב ורמות של פפטיד C. מחשבון זה מהווה צעד חשוב לכיוון אבחון מדויק של סוכרת (Precision diagnosis). הפיתוחים הטכנולוגיים החדשים ובעיקר Next generation sequencing מאפשרים לבחון את כל המוטציות הידועות של MODY בו זמנית ובכך מקטינים בצורה משמעותית את האבחון השגוי אך יש צורך לשלב את הבדיקות הגנטיות יחד עם הממצאים הקליניים כדי לקבל אבחון מדויק של סוגי ה-MODY. הסכמה הבאה (תמונה מספר 3) מדגימה את הגישה של "Precision diagnosis" בה כלים של גנטיקה מולקולרית בשילוב עם ממצאים קליניים מגדירים תת-קבוצות של MODY שיש להן פרמטרים קליניים שונים וטיפול תרופתי שונה[28].
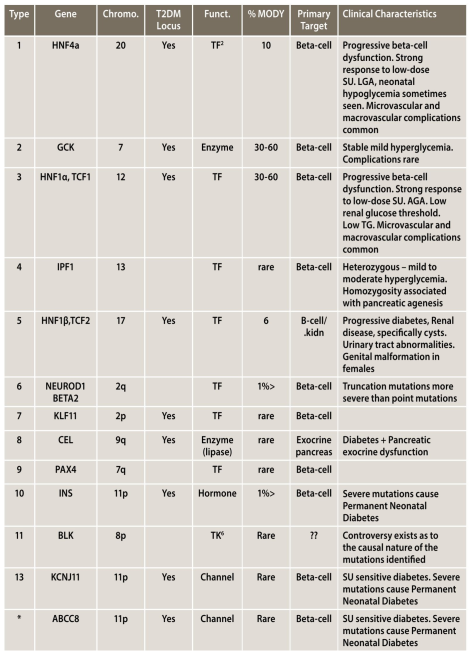
| פגם תפקודי בעברית | פגם תפקודי וקליניקה | Primary target | MODY אחוזים | תפקיד | T2DM Locus | מיקום (כרומוזום) | גן | סוג |
|---|---|---|---|---|---|---|---|---|
| הפרעה מתקדמת בתפקוד תאי ביתא. תגובה חזקה למינון נמוך של סולפונילאוריאה. עובר גדול לגיל ההיריון (LGA, Large for Gestational Age). לעיתים נראית היפוגליקמיה נאונטלית. שכיחים סיבוכים מיקרו ומאקרו-וסקולריים | Progressive beta-cell dysfunction. Strong response to low-dose SU1. LGA3. neonatal hypoglycemia sometimes seen. Microvascular and macrovascular complications common | תא ביתא | 10 | TF (Transcription Factor) | כן | 20 | HNF4a | 1 |
| היפרגליקמיה קלה ויציבה. סיבוכים נדירים | Stable mild hyperglycemia. Complications Rare | תא ביתא | 30-60 | אנזים | כן | 7 | GCK | 2 |
| הפרעה מתקדמת בתפקוד תאי ביתא. תגובה חזקה למינון נמוך של סולפונילאוריאה. עובר ממוצע לגיל ההיריון (AGA, Average for Gestational Age). ערך סף נמוך להפרשת גלוקוז בכליה ( Low renal glucose theshold), טריגליצרידים (Triglycerides) נמוכים. שכיחים סיבוכים מיקרו ומאקרו-וסקולריים | Progressive beta-cell dysfunction. Strong response to low-dose SU1 . AGA4 . Low renal glucose theshold. Low TG5 . Microvascular and macrovascular complications common | תא ביתא | 30-60 | TF | כן | 12 | HNF1a tCF1 |
3 |
| הטרוזיגוטיות - היפרגליקמיה קלה עד בינונית. הומוזיגוטיות קשורה בהתפחות לקויה של הלבלב (Pancreatic agenesis) | Heterozygous – mild to moderate hyperglycemia. Homozygocity associated with pancreatic agenesis | תא ביתא | נדיר | TF | 3 | IPF1 | 4 | |
| סוכרת מתקדמת, מחלה כלייתית, במיוחד ציסטות. אי תקינות במערכת השתן (Urinary tract abnormalities). מלפורמציות גניטליות בנשים | Progressive diabetes, Renal disease, specifically cysts. Urinary tract abnormalities. Genital malformation in females | תא ביתא/כליה | 6 | TF | כן | 17 | HNF1B TCF2 |
5 |
| מוטציות חיתוך (Truncation) חמורות יותר ממוטציות נקודתיות | Truncation mutations more severe than point mutations | תא ביתא | <1 אחוזים | TF | 2q | NEUROD1 BEtA2 |
6 | |
| תא ביתא | נדיר | TF | כן | 2 | KLF11 | 7 | ||
| סוכרת + הפרעה בתפקוד הלבלב האקסוקריני | Diabetes + Pancreatic exocrine dysfunction | לבלב אקסוקריני (Exocrine) | נדיר | אנזים ליפאזה (Lipase) | כן | 9q | CEL | 8 |
| תא ביתא | נדיר | TF | 7q | PAX4 | 9 | |||
| מוטציות חמורות גורמות לסוכרת קבועה של הילוד | Severe mutations cause Permanent Neonatal Diabetes | תא ביתא | <1 אחוזים | הורמון | כן | 11p | NS | 10 |
| קיימת מחלוקת לגבי האקראיות (Casual nature) של המוטציות שזוהו | Controversy exists as to the causal nature of the mutations identified | ?? | נדיר | TK (Tyrosine Kinase) | 8p | BLK | 11 | |
| סוכרת רגישה לסולפונילאוריאה. מוטציות חמורות גורמות לסוכרת קבועה של הילוד | SU sensitive diabetes. Severe mutations cause Permanent Neonatal Diabetes | תאי בטא | נדיר | Channel | כן | 11p | ABCC8 | (*) |
| סוכרת רגישה לסולפונילאוריאה. מוטציות חמורות גורמות לסוכרת קבועה של הילוד | SU sensitive diabetes. Severe mutations cause Permanent Neonatal Diabetes | תאי בטא | נדיר | Channel | כן | 11p | KCNJ11 | (*) |
(*) Although ABCC8 and KCNJ11 have not been designated as MODY by OMIM, families have been identified with MODY phenotype associated with mutations in these genes.
סיכום
סוכרת מסוג 1 וסוכרת מסוג 2 הן מחלות גנטיות מורכבות אשר הסיכון להן מוגדר על ידי מספר גדול של גורמי סיכון גנטיים המגיבים עם גורמים סביבתיים לא-גנטיים לגרימת המחלה. על אף ההתקדמות המשמעותית בהבנתנו את הגנטיקה של שתי מחלות נפוצות אלו, הידע הנוכחי אינו מאפשר לנו להשתמש בבדיקות גנטיות לניבוי המחלה, התחזית או התגובה לטיפול. עם זאת, מחקרים גדולים רבים נערכים וייתכן ומצב זה ישתנה בעתיד, ככל שנלמד יותר על המנגנונים הקובעים את הסיכון למחלה.
בניגוד חד, לצורות החד-גנית של סוכרת, על אף נדירותן, מנגנון מחלה ייחודי מאוד אשר משפיע במידה רבה על הניהול הקליני. על כן, ישנה חשיבות עליונה שהרופא המטפל ישקיע את המאמצים לזהות חולים נדירים אלה כך שתבוצע אבחנה גנטית מסודרת וניתן יהיה לתת לחולה את הטיפול המותאם לתת-הסוג של המחלה. עבור הרופא העסוק, זיהוי תת-סוגים נדירים של מחלות נפוצות הוא אתגר משמעותי אולם במקרה זה, ההשפעה הקלינית של הגעה לאבחנה מולקולארית של סוכרת חד-גנית היא מהותית והופכת את המאמץ למשתלם.
אלגוריתם אבחנתי
- אבחנת סוכרת נעשית לפי קריטריוני ADA (American Diabetes Association) או WHO (World Health Organization)
- לקביעת הסיכון הגנטי לסוכרת מסוג 1 או 2 יש לקבל מהמטופל אנמנזה מלאה כולל גיל האבחנה, היסטוריה משפחתית של סוכרת, היסטוריה אישית ומשפחתית של השמנת יתר והיסטוריה אישית של טיפול תרופתי מגביר סיכון-לסוכרת (כגון גלוקוקורטיקואידים)
- יש לבצע בדיקה גופנית מלאה כולל גובה, משקל, BMI וכן סימנים המעידים על סוכרת משנית, לדוגמה תסמונת קושינג, אקרומגליה (acromegaly) או סוכרת תסמונתית כגון תסמונת וולפראם ו-IPEX. אם הסוכרת אובחנה לפני גיל 6 חודשים בדיקה גנטית לאבחנת סוכרת של הילוד היא מחויבת, ללא קשר לגיל החולה כעת
- LADA: חולים שאינם שמנים עם סימנים ותסמינים של סוכרת מסוג 2 יכולים להיות חולים ב-LADA, במיוחד אם אין להם היסטוריה משפחתית חזקה של סוכרת מסוג 2. חולים אלו צריכים להיבדק לנוכחות של נוגדים עצמיים (autoantibodies) הקשורים לסוכרת מסוג 1 במיוחד נוגדים כנגד GAD
- בחולים עם סוכרת מסוג 2 שהופיעה בצעירותם (<25 שנים), חולים ללא השמנת יתר עם סוכרת מסוג 2 קלינית וחולים עם היסטוריה משפחתית המרמזת למחלה אוטוזומלית דומיננטית יש לשקול הערכה למוטציות בגנים ל-MODY. עם זאת, דווחו מוטציות חדשות (דה-נובו) כך שהיעדר היסטוריה משפחתית אינו שולל לחלוטין MODY. יתר על כן, השמנת יתר גם היא לא שוללת MODY. עם העלייה בהיארעות של סוכרת מסוג 2 רב-גנית קלאסית בצעירים הסובלים מהשמנת יתר, הבדלת MODY מסוכרת מסוג 2 קלינית יכולה להיות קשה מאוד. בחולים עם ממצאים המרמזים על MODY, יש לעקוב אחר האלגוריתם הבא:
- יש לקבל אנמנזה ולבצע בדיקה גופנית דקדקנית תוך התמקדות על חומרת המחלה, התקדמותה, היסטוריה משפחתית וסימנים ותסמינים הקשורים לתסמונות כגון אי ספיקה לבלב אקסוקרינית, מחלת כליה
- חולים עם היפרגליקמיה קלה עד בינונית בצום, תגובת אינסולין טובה לאתגר גלוקוז או ארוחה וללא עדות להידרדרות המחלה צריכים להיבדק לנוכחות מוטציה בגן גלוקוקינאז (GCK-MODY או 2 MODY)
- חולים עם מחלה חמורה יותר ומידרדרת צריכים להיבדק בתחילה לנוכחות מוטציות בגן MODY 3) HNFia) ואם לא זוהו מוטציות יש לבדוק את גן MODY 1) HNF4a)
- חולים עם עדות לסוכרת תסמונתית (לדוגמה אי ספיקה של הלבלב אקסוקרינית או חסר חיסוני) צריכים לעבור הערכה למוטציות בגנים הקשורים לתסמונת הספציפית
- הטכנולוגיה החדשה שקיימת מאפשרת לבצע ריצוף של מספר גנים בו זמנית במחיר נמוך יחסית. לכן, אם התמונה הקלינית אינה ברורה ולא ניתן לאתר ממצא מספיק ספציפי ל-MODY, מומלץ לשלוח DNA מהחולה לאחת מהמעבדות המתמחות בריצוף גנים אלה. לדוגמה ניתן להשתמש בשירותים של המרכז לרפואה גנטית של אוניברסיטת אקסטר שבאנגליה (www.diabetesgenes.org). מעבדה זו עושה ריצוף של 16 גנים של MODY בו זמנית ובכך מוזילה את מחיר הבדיקה ומאיצה את האבחנה של המחלה באופן משמעותי מאוד
חשוב לזכור - גנטיקה של מחלת הסוכרת
- זיהוי חולים עם צורות חד-גניות של סוכרת הוא קריטי כיוון שיכולות להיות לו השפעות ניכרות על הטיפול והפרוגנוזה
- כיוון שחולים עם סוכרת חד-גנית יכולים להציג תמונה קלינית הדומה מאוד לזו של חולי סוכרת רב-גנית, חשוב לשמור על רמת חשד גבוהה במטרה להגדיל את הסיכוי להנעה לאבחנה הנכונה
- כל חולי סוכרת מסוג 1, כולל מבוגרים, צריכים להישאל מתי אובחנה המחלה לראשונה והתשובה צריכה להיות מתועדת במקום בולט ברשומה הרפואית, כיוון שלמעשה "כל" חולי הסוכרת שהופיעה לפני גיל 6 חודשים סובלים מסוכרת חד-גנית. ברבים ממקרים אלה, הנעה לאבחנה הנכונה תשפיע רבות על הטיפול והפרוגנוזה
- LADA: לחולים שאובחנו ב-LADA בהתבסס על המופע הקליני ובשילוב של המצאות נוגדנים עצמיים (autoantibodies) יש להתייחס בזהירות עקב האפשרות של החמרה מהירה של היכולת לשמור על רמות סוכר תקינות שיכולות להידרדר במהירות לחמצת. בניסיון לשמר את מסת תאי בטא, הטיפול הראשוני עשוי לכלול מטפורמין, מעכבי 4-DPP או אנלונים של 1-GLP. טיפול ב-SGLT2 צריך להיעשות בזהירות רבה, בשל הסיכון בחמצת. הרופא והחולה צריכים להיות מוכנים להוסיף טיפול באינסולין ברגע שמתברר שהתרופות האחרות אינן מספיקות כדי לשמור על משקל תקין
- חולי סוכרת מסוג 2, ללא השמנת יתר/תנגודת אינסולין או עם היסטוריה משפחתית המתאימה להעברה אוטוזומלית דומיננטית של המחלה צריכים להיחשב כחולי MODY אפשריים. יש לקבל אנמנזה מדוקדקת ולקבל החלטה האם יש מקום לבצע בדיקות גנטיות לאישור או לשלילת האבחנה.
ניתן לעזר במחשבון ייחודי MODY Calculator כדי להחליט את מי להפנות לאבחון גנטי
ביבליוגרפיה
- ↑ King, H., Aubert, R. E" and Herman, W. H. (1998) Global burden of diabetes, 1995-2025 prevalence, numerical estimates, and projections. Diabetes care 21,1414-1431
- ↑ Zimmet, P., Alberti, K. G" and Shaw, J. (2001) Global and societal implications of the diabetes epidemic. Nature 414,782-787
- ↑ Kawasaki, E., Matsuura, N., and Eguchi, K. (2006) Type 1 diabetes in Japan. Diabetologia 49,828-836
- ↑ Pociot, F" and Lernmark, A. (2016) Genetic risk factors for type 1 diabetes. Lancet 387,2331-2339
- ↑ Patel, K. A., Oram, R. A., Flanagan, S. E., et al. (2016) Type 1 Diabetes Genetic Risk Score: A Novel Tool to Discriminate Mono- genic and Type 1 Diabetes. Diabetes 65,2094-2099
- ↑ Sharp, S. A., Rich, S. S., Wood, A. R., et al. (2019) Development and Standardization of an Improved Type 1 Diabetes Genetic Risk Score for Use in Newborn Screening and Incident Diagnosis. Diabetes care 42, 200-207
- ↑ American Diabetes, A. (2015) Classification and diagnosis of diabetes. Diabetes care 38 Suppl, S8-S16
- ↑ 8.0 8.1 8.2 8.3 Fuchsberger, C, Flannick, J., Teslovich, ד. M., et al. (2016) The genetic architecture of type 2 diabetes. Nature 536,41 -47
- ↑ 9.0 9.1 Udler, M. $., Kim, J., von Grotthuss, M., Bonas-Guarch, S" et al. (2018) Type 2 diabetes genetic loci informed by multi-trait associations point to disease mechanisms and subtypes: A soft clustering analysis. PL0S Med 15, e1002654
- ↑ Permutt, M. A., and Hattersley, A.T. (2000) Searching for type 2 diabetes genes in the post-genome era. Trends in endocri- nology and metabolism: TEM 11, 383-393
- ↑ Permutt, M. A., Wasson, J. C., Suarez, B. K., et al. (2001) A genome scan for type 2 diabetes susceptibility loci in a genetically isolated population. Diabetes 50,681-685
- ↑ Scott, R. A., Scott, L. J., Magi, R" et al. (2017) An Expanded Genome-Wide Association Study of Type 2 Diabetes in Europeans. Diabetes 66, 2888-2902
- ↑ Steinthorsdottir, V., Thorleifsson, G., Sulem, P., et al. (2014) Identification of low-frequency and rare sequence variants asso- dated with elevated or reduced risk of type 2 diabetes. Nature genetics 46, 294-298
- ↑ Albrechtsen, A., Grarup, N., Li, Y., Sparso, T., et al. (2013) Exome sequencing-driven discovery of coding polymorphisms associated with common metabolic phenotypes. Diabetologia 56,298-310
- ↑ Lohmueller, K. E., Sparso, T" Li, Q., Andersson, E., et al. (2013) Whole-exome sequencing of 2,000 Danish individuals and the role of rare coding variants in type 2 diabetes. American journal of human genetics 93,1072-1086
- ↑ Bansal, A., and Pinney, S. E. (2017) DNA methylation and its role in the pathogenesis of diabetes. Pediatric diabetes 18,167- 177
- ↑ Bernstein, D" Golson, M. L" and Kaestner, K. H. (2017) Epigenetic control of beta-cell function and failure. Diabetes research and clinical practice 123,24-36
- ↑ Golson, M. L., and Kaestner, K. H. (2017) Epigenetics in formation, function, and failure of the endocrine pancreas. Molecular metabolism 6,1066-1076
- ↑ Ling, C., and Ronn,T. (2019) Epigenetics in Human Obesity and Type 2 Diabetes. Cell metabolism 29,1028 1044
- ↑ 20.0 20.1 20.2 McCarthy, M. I. (2017) Painting a new picture of personalised medicine for diabetes. Diabetologia 60, 793-799
- ↑ 21.0 21.1 Buzzetti, R., Zampetti, S., and Maddaloni, E. (2017) Adult-onset autoimmune diabetes: current knowledge and implications for management. Nat Rev Endocrinol 13,674-686
- ↑ Pieralice, S" and Pozzilli, P. (2018) Latent Autoimmune Diabetes in Adults: A Review on Clinical Implications and Manage- ment. Diabetes Metab J 42,451-464
- ↑ Cousminer, D. L, Ahlqvist, E., Mishra, R" et aL (2018) First Genome-Wide Association Study of Latent Autoimmune Diabetes in Adults Reveals Novel Insights Linking Immune and Metabolic Diabetes. Diabetes care 41,2396-2403
- ↑ 24.0 24.1 Pozzilli, P., and Pieralice, S. (2018) Latent Autoimmune Diabetes in Adults: Current Status and New Horizons. Endocrinol Metab (Seoul) 33,147-159
- ↑ Gloyn, A. L., Pearson, E. R., Antcliff, J. F., et al. (2004) Glibenclamide treatment in permanent neonatal diabetes mellitus due to an activating mutation in Kir6.2. J Clin Endocrinol Metab 89,5504-5507
- ↑ Stoy, J., Steiner, D. F" Park, S. Y" et al. (2010) Clinical and molecular genetics of neonatal diabetes due to mutations in the insulin gene. Rev Endocr Metab Disord 11,205-215
- ↑ Florez, J. C. (2017) Pharmacogenetics in type 2 diabetes: precision medicine or discovery tool? Diabetologia 60, 800-807
- ↑ 28.0 28.1 28.2 Hattersley, A. T., and Patel, K. A. (2017) Precision diabetes: learning from monogenic diabetes. Diabetologia 60,769-777
- ↑ Fajans, S. S., and Bell, G. I. (2011) MODY: history, genetics, pathophysiology, and clinical decision making. Diabetes care 34, 1878-1884
- ↑ Naylor, R., and Philipson, L. H. (2011) Who should have genetic testing for maturity-onset diabetes of the young? Clinical endocrinology 75,422-426
- ↑ Shields, B. M" McDonald, T. J., Ellard, S" et al. (2012) The development and validation of a clinical prediction model to deter- mine the probability of MODY in patients with young-onset diabetes. Diabetologia 55,1265-1272
- ↑ Vaxillaire, M., and Froguel, P. (2008) Monogenic diabetes in the young, pharmacogenetics and relevance to multifactorial forms of type 2 diabetes. Endocrine reviews 29, 254-264
- ↑ Kleinberger, J. W., Copeland, K. C, Gandica, R. G., et al. (2018) Monogenic diabetes in overweight and obese youth diag- nosed with type 2 diabetes: the TODAY clinical trial. Genetics in medicine : official journal of the American College of Medical Genetics 20,583-590
המידע שבדף זה נכתב על ידי פרופסור בנימין גלזר, השירות לאנקודרינולוגיה ומטבוליזם, האגף לרפואה פנימית, המרכז הרפואי אוניברסיטאי הדסה, ירושלים וד"ר שרה צנגן, היחידה לכבד, האגף לרפואה פנימית, המרכז הרפואי אוניברסיטאי הדסה, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק