הליקובקטר פילורי - Helicobacter pylori
| הליקובקטר פילורי | ||
|---|---|---|
| Helicobacter pylori | ||
| ||
| ICD-9 | 041.86 | |
| MeSH | D016481 | |
| יוצר הערך | מיקי דובלין | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הליקובקטר פילורי
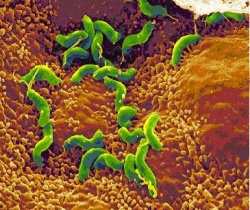
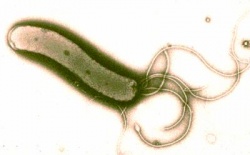
הליקובקטר פילורי (Helicobacter pylori) התגלה לראשונה באוסטרליה בשנות ה–80 של המאה ה-20, על ידי Professor Barry Marshall ו-Doctor Robin Warren. שמו, כפי שניתן לו על ידם, היה "Campylobacter pylori".
לחיידק זה יתרון התפתחותי ניכר על חיידקים אחרים במערכת העיכול, ומכאן פגיעתו הקשה. בניגוד לחיידקים אחרים, הוא מצליח לשרוד במיצי הקיבה ומתיישב שם, וזאת בזכות יכולתו לפרק שתנן (Urea) וליצור Ammonia, שהוא חומר בסיסי הסותר את חומציות הקיבה. החיידק נצמד לתאי האפיתל (Epithelia) בקיבה, יוצר סביבו תגובה דלקתית וגורם לפגיעה בתאי הקיבה מסביב. כתוצאה מכך התאים נפגעים ומסולקים על ידי תאי דלקת שהגוף מזרים - דבר היכול ליצור נגע הולך וגדל. התהליך הדלקתי גורם למעשה לפצע בקיבה שהולך וגדל - Ulcer (אולקוס), ובעברית: "כיב". רוב הכיבים נרפאים מעצמם, אך כמו בכל פצע נוצרת הצטלקות הגורמת לנזק במבנה מערכת העיכול, ובמיוחד בתריסריון – שינויי צורה בתריסריון גורמים לתופעות קשות אותן אנו חשים כצרבת קשה. חלק מהכיבים אף עלולים להתנקב ולגרום למוות. דלקת כרונית של הקיבה יכולה לגרום (בצירוף של גורמים נוספים) לסרטן הקיבה.
כ-10 שנים לאחר גילויו של החיידק וכאשר הובנו פגיעותיו הרבות, נוצר צורך בהשמדתו, ואז שונה שמו ל-Helicobacter pylori. הטיפול המשולב בחיידק זה הוא יעיל מאוד, ואכן מונע היווצרות כיבים ומוריד בצורה ניכרת את שכיחות הופעתו שלסרטן הקיבה.
אפידמיולוגיה
החיידק שכיח מאוד באוכלוסייה ובמיוחד בגיל המבוגר. אפשר למצוא אותו ב-90 אחוזים מהאנשים מעל גיל 65. הוא שכיח יותר בתנאי צפיפות ובארצות מתפתחות: בארצות המערב, 40 עד 50 אחוזים מהאוכלוסייה נושאים את החיידק, ואילו בארצות מתפתחות יותר מ-90 אחוזים משמשים לו פונדקאים. לא כל נשא מפתח מחלה חודרנית של החיידק.
חיידק זה פחות שכיח בילדים. רק כ-10 אחוזים מכלל הילדים מתחת לגיל 12 הם נשאים של חיידק זה. עם זאת השכיחות הולכת ועולה עם השנים כך שמדי שנה נוספים כ-1 עד 1.5 אחוזים של נשאים בקבוצת גיל זו. מחלה זו שהייתה בעבר נחלתם של מבוגרים בלבד, הולכת וגולשת בהתמדה לגיל הילדות עם הופעת כיבים פפטיים (Peptic) קלאסיים בגיל הילדות המוקדמת.
בני אדם הם המקור העיקרי של חיידק זה וההדבקה חלה מאדם לאדם. מקורות הדבקה אחרים כגון מקורות מים, חתולי בית וחרקים הוצעו בספרות אך אמיתותן של תאוריות אילו לא הוכחה עדיין. גורמי הסיכון להדבקות הם: מגורים עם אדם הנושא את החיידק, צפיפות מגורים גדולה, מחייה במדינות מתפתחות ותנאים סוציו-אקונומיים (Socio-economic) ירודים.
ההדבקה היא משפחתית בדרך: Fecal–oral - בעזרת מגע עם הפרשות צואתיות של אדם המודבק בחיידק. עדיין לא ברור כיצד ואיך כל כך הרבה אנשים נדבקו ממנו, אבל יודעים שאם החיידק מדביק את אחד מבני המשפחה, במקרים רבים נמצא חיידק זה גם בשאר בני הבית. בתנאי היגיינה לקויה ההדבקה תהייה מהירה יותר בין בני הבית, אך לא נמצא קשר בין הדבקת כל בני הבית להתפתחות מחלה חודרנית. במקרים בהם כן מתפתחת מחלה חודרנית באחד מבני הבית אנו מוצאים בדרך כלל התפתחות כיבים בשאר בני המשפחה.
שכיחות המצאות החיידק אצל אנשים שיש להם כיב בתריסריון היא גבוהה מאוד. ב-95 עד-99 אחוזים מהסובלים ממחלה חודרנית מוצאים את החיידק. וכן אצל 90 אחוזים מהאנשים שיש להם תסמינים קליניים של כיב קיבה. עד לגילוי החיידק והקשר שלו לכיב קיבה ותריסריון, הישנויות של הכיב לאחר הטיפול היו מאד שכיחות. לאחר הכחדת החיידק, מספר ההישנויות פחת משמעותית, חלק בלתי נפרד מהטיפול בכיב הקיבה כולל את הכחדת החיידק דבר שהוריד את מקרי ההישנות ב-85 אחוזים. יש לזכור כי החיידק לא גורם לכיב בעצמו, אלא מחיש את התהליך שנגרם מחומציות הקיבה ומהאנזימים בקיבה, כמו ה-Pepsin, על ידי הגברת רגישות הקיבה לגורמים אלו דבר המחייב אותנו לטיפול משולב אנטיביוטי (Antibiotic) ובבתרופות המורידות את רמת החומציות בקיבה/תרסריון.
פתוגנזה
Helicobacter pylori שהגיע לקיבה יכול לעבור קולוניזציה (Colonization, התיישבות) בדופן הקיבה, ולשם כך הוא נעזר בארבע תכונות ייחודיות המאפשרות לו לעשות זאת: פעילות האנזים (Enzyme) Urease, Flagella, המבנה המיוחד של החיידק ו-Adhesins. ה-Urease, שמפרק Urea ליוני (Ions) Ammonia, מנטרל את הסביבה החומצית של הקיבה ומאפשר לחיידק לשרוד ולהתרבות בחלל הקיבה. צורתו המיוחדת של ה-Helicobacter pylori יחד עם ה-Flagella שלו מקנים לו תנועתיות, וזו אחראית במידה רבה על יכולתו לחדור את שכבת ה-Mucin בדופן הקיבה.
ההידבקות של החיידק אל התאים האפיתליאליים (Epithelial) שבדופן הקיבה מתבצעת על ידי כ-20 צמתנים (גורמי הדבקה) שונים. הקשר עם ה-Mucin של הקיבה נוצר על ידי היצמדות לחומצה סיאלית. החיידק מכיל לפחות שישה סוגים של צמתנים לחומצה סיאלית (Sialic acid), ובנוסף לכך ישנם חלבונים נוספים שנמצאים על פני התא של החיידק שיכולים גם כן להשתתף בתהליך ההתיישבות. בהמשך, החיידק משחרר אנטיגנים (Antigens) שמושכים תאים מסוג PolyMorphoNuclears) PMN) והתאים האפיתליאליים מפרישים Ilnterleukin 8 (IL-8) ו-Chemokines אחרים שתורמים למשיכת PMN.
בהמשך התהליך, תאים מציגי אנטיגנים כמו Macrophages, מציגים אנטיגנים של החיידק לתאים באיברים לימפטיים (Lymphatic), דבר הגורם לשפעול ומשיכה של תאי Plasma ולימפוציטים (Lympocytes) מסוג B ו-T לאזור הדלקת. בשלב זה החיידק מקבל את צורתו הכדורית בתנאים האנאירוביים (Anaerobic) של המעי הדק, ועובר בליעה פעילה על ידי תאים Dendritic שב-Peyer's patches שבמעי הדק. זהו כנראה האתר בו מתרחש שפעול של תאי T ייחודיים מסוג CD4+ על ידי אנטיגנים של Helicobacter pylori.
קליניקה
רוב החולים סובלים מצריבה ושריפה באזור הוושט, שבדרך כלל מחמירה לאחר ארוחות גדולות ושכיבה במאוזן לאחר האוכל. הצרבות נגרמות בעקבות עלייה של מיצי חומצה לוושט, ובדרך כלל הן מפריעות עד מאוד. לעיתים דומה התחושה ללחץ בבית החזה המרכזי היכול להדמות לכאב תעוקתי.
לא הוכח קשר סיבתי בין זיהום בחיידק לבין הופעת צרבת, ובמקרים רבים אף נמצא כי באנשים הסובלים מצרבת נמצאה שכיחות נמוכה יותר של זיהום בחיידק לעומת אנשים שאינם סובלים מצרבת. יש לזכור כי באנשים שמנים עם Reflux ושטי קיבתי, יהיו תופעות זהות של צרבת ללא כל זיהום עם Helicobacter pylori.
Dyspepsia – מצב שבו קיימים תסמינים של כאבי בטן חוזרים עם הרגשת אי נוחות בבטן. יכולים להתלוות לכך גם בחילה, תפיחות בטנית, הרגשת שובע מוקדם וחוסר תיאבון, ולעיתים אף הרגשת סלידה מאוכל. לפעמים הכאבים דומים לאלו שנגרמים בעקבות כיב קיבה, אך בניגוד לכאבי כיב הקיבה, בכאבים אלו לא מוצאים שום כיב ולא כל פתולוגיה או מחלה אחרת הנראית לעין, לא בקיבה ולא בכל שאר חלקי מערכת העיכול. תופעה זו שכיחה מאד, ויוחסה בחלקה גם לזיהום של הקיבה ב-Helicobacter pylori. במחקר אקראי גדול, הודגם שבהכחדת החיידק יש השפעה חיובית מועטה ביותר על התלונות, כך שהוא אינו הגורם העיקרי לתופעת ה-Dyspepsia. (25 אחוזים מהנבדקים חשו הטבה לאחר הכחדת החיידק, לעומת 7–21 אחוזים מהנבדקים שחשו הטבה לאחר טיפול ב-Omeprazole בלבד). המסקנה היא שכנראה המקור ל-Dyspepsia הוא Reflux ושטי קיבתי.
הנזקים לקיבה
Atrophic gastritis היא ביטוי היסטולוגי (Histologic) למצב בו רואים את רירית הקיבה במצב של Gastritis (דלקת כרונית) Atrophic תחת המיקרוסקופ (Microscope). הממצאים כוללים תמונה של דלקת כרונית של הרירית והיעלמות של הבלוטות המפרישות את החומצה ברירית, שנמצאות שם בדרך כלל. Atrophic gastritis מאוד שכיחה לאחר שימוש כרוני (Chronic) (במשך שנים) בתרופות המפחיתות את יצירת החומצה בקיבה, כדוגמת Losec או Omepradex, וכן יכולה להיגרם גם על ידי יצירת נוגדנים עצמוניים שהגוף מפריש כנגד רירית הקיבה.
אבחנה
מבחן אוראז מהיר מבוסס על פעילותו של אנזים ה-Urease שבחיידק המפרק Urea, ויוצר Ammonia ו-Bicarbonate שמשנים את ה-PH של ערכת (Kit) הבדיקה ובעקבות כך משתנה צבע ה-Kit שמהווה סמן לנוכחות החיידק. למרות שמדובר בבדיקה אמינה, רגישה וספציפית, השימוש הרב באנטיביוטיקה ובסותרי חומצה מקבוצת PPI (Proton Pump Inhibitor) גרם לכך שישנו אחוז גבוה של False negative בקבוצת חולים זו. ההתפלגות הלא אחידה של החיידק בקיבה ונוכחות Intestinal metaplasia, מקטינים עוד יותר את מהימנות הבדיקה, ולכן יש צורך בהפסקת PPI למשך 1–2 שבועות וכן הפסקת אנטיביוטיקה או תרופות מקבוצת Bismuth; 4 שבועות לפני בדיקת מבחן Urease. אם תרופות אלו לא הופסקו מומלץ לקחת במקום - או בתוספת לבדיקת Urease מהיר - גם ביופסיות (Biopsies) לבדיקה היסטולוגית לגילוי נוכחות של Helicobacter pylori.
בין השיטות הלא פולשניות, שתי השיטות המקובלות ביותר הן: בדיקת הנשיפה וגילוי Antigen בצואה. שתי השיטות הללו אמינות גם לשם גילוי החיידק וגם לווידוא השמדת החיידק. מאחר שגם בבדיקות אלו שימוש באנטיביוטיקה וב-PPI יכולים להביא לתוצאות שליליות כוזבות, הרי שמומלץ להפסיק PPI כשבוע ימים לפני הבדיקה ואנטיביוטיקה ו- Bismuth; 4 שבועות לפני הבדיקה. נראה שההשפעה של סותרי חומצה שלא מקבוצת PPI על מהימנות בדיקות אלו פחותה הרבה יותר, אך בכל אופן מומלץ להפסיקן 24–48 שעות לפני הבדיקה.
- ניתן לאבחן את החיידק במספר שיטות, שלכולן רגישות גבוהה
- ביופסייה של רירית הקיבה ואיבחון פתולוגי (תחת מיקרוסקופ) של החיידק. דורשת ביצוע של Gastroscopy
- תבחין Urease נעשה על ידי ביצוע ביופסיה של רירית הקיבה. דורשת גם כן ביצוע Gastroscopy
- בדיקת נוגדנים לחיידק – נוכחות הנוגדנים נבדקת בבדיקת דם פשוטה,עם רגישות גבוהה. (המצאות נוגדנים בדם אינה מעידה על המצאות מחלה פעילה אלא רק על חשיפה לחידק בזמן כלשהו במהלך החיים) תשובה שלילית שוללת כמעט לחלוטין המצאות או חשיפה ל-Helicobacter pylori. תשובה חיובית אינה משמעותית מבחינה טיפולית
- תבחין נשיפה – יתרון שיטה זו היא בכך שהשיטה אינה פולשנית. החסרון הגדול – טיפול תרופתי המעכב הפרשת חומצה ויכול לגרום לתוצאה שלילית למרות קיום החיידק. אי לכך, לפני מבחן הנשיפה יש להפסיק טיפול ב-Losec, Controloc וכדומה לפחות למשך 7 ימים
- בדיקת אנטיגן של החיידק בצואה
- יש לבדוק
- אנשים שלהם יש קרוב משפחה מדרגה ראשונה שחלה בסרטן קיבה/Lymphoma של הקיבה
- אנשים שחלו בעבר או כעת בכיב תריסריון או קיבה וטרם נבדקו
- אנשים המטופלים לאורך שנים בתרופות המדכאות את יצירת חומציות הקיבה, כגון Omepradex או Losec
- אנשים הסובלים מחוסר כרוני בוויטמין Vitamin) B12)
- אנשים הסובלים מתופעות של Dyspepsia
יש לחזור על הבדיקות לאחר סיום הטיפול התרופתי. מומלץ לוודא חיסול מלא של החיידק אצל כל החולים שטופלו. מומלץ לוודא השמדה מלאה אצל חולים עם כיב פפטי, חולים דיספפטיים (Dyspeptic) שממשיכים להיות תסמיניים למרות הטיפול, Lymphoma של הקיבה וחולים שעברו כריתת קיבה בגלל Carcinoma.
טיפול
- יש לטפל
התשובה לשאלה זו מורכבת ואינה אחידה. מאחר שמדובר בחיידק שתואר כגורם לסרטן עוד בשנת 1994, הרי שישנם עדיין הסבורים כי כדאי לבדוק את כל האוכלוסייה ולבצע אירדיקציה (Eradication) מלאה אצל כל אלו שנמצאו חיוביים. גישה מחמירה זו אינה מקובלת, וההמלצה המקובלת היא לבדוק ולטפל בחיידק זה רק את החולים הסובלים מהאבחנות הבאות:
- כיב פפטי מוכח בתריסריון או בקיבה (פעיל או בעבר)
- Atrophic gastritis
- לאחר ניתוח משני לסרטן קיבה
- קרובים מדרגה ראשונה של חולי סרטן קיבה
- Functional dyspepsia
- שימוש ממושך ב-PPI
- שימוש ממושך ב-Nonsteroidal anti-inflammatory drugs) NSAIDs)
- אנמיה (Anemia) מחסר ברזל מסיבה לא ידועה
- Idiopathic Thrombocytopenic Purpura) ITP)
- חולים עם Helicobacter pylori, ללא קשר להתוויה שבגינה נבדקו, וזאת לאחר התייעצות עם הרופא המטפל
טיפול תרופתי
החיידק עמיד לטיפולים אנטיביוטיים, ולכן הטיפול הטיפול הראשוני ב-Helicobacter pylori הוא טיפול משולש הכולל PPI, Clarithromycin ו-Amoxicillin או Metronidazole למשך 14 ימים. בגלל אחוזי העמידות הגבוהים יותר ל-Metronidazole (37-25 אחוזים) העדיפות היא ל-Clarithromycin (עמידות: 13-10 אחוזים). לחלופין, ניתן לטפל בטיפול מרובע הכולל PPI, Bismuth, Tetracycline ו-Metronidazole למשך 10–14 ימים. טיפול רציף (Sequential therapy) שתוצאות הארדיקציה שלו טובות יותר מאשר הטיפול המשולש, כולל Amoxicillin ו-PPI למשך 5 ימים שבהמשכו החולה מקבל Clarithromycin, Tinidazole ו-PPI ל-5 ימים נוספים. טיפול זה יכול לשמש כטיפול ראשוני. הוויכוח לגבי משך הטיפול המשולש לא בא על פתרונו גם בהמלצות הנוכחיות. קבוצת Maastricht מציינת אף היא שהטיפול במשך 14 ימים יעיל בקרב 7 אחוזים ועד 17 אחוזים יותר מאשר טיפול של 7 ימים. עם זאת ההבדל בין טיפול למשך 10 ימים לעומת שבועיים אינו משמעותי. בישראל רופאים רבים נוקטים בפשרה ומטפלים במשך 10 ימים.
הטיפול המומלץ לחולה שנכשל בטיפול המשולש
טעות נפוצה היא לחזור על הטיפול המשולש הלא יעיל ויש להימנע מכך. הטיפול המומלץ במקרים אלו הוא טיפול מרובע על בסיס Bismuth בתוספת PPI ושתי אנטיביוטיקות שלא נרשמו בטיפול המשולש הקודם. משך הטיפול המועדף הוא בין 7–14 ימים.
פורסמו עבודות אודות שילובים שונים במטרה למצוא טיפול קל ויעיל יותר מאשר הטיפול המרובע. בין הטיפולים הללו שניים נראים כמבטיחים יותר:
- שילוב של Levofloxacin עם Amoxicillin ו-PPI. המינון המומלץ של ה-Levofloxacin ומשך הטיפול משתנה בעבודות שפורסמו ונע בין 500 מיליגרם ליום ל-1000 מיליגרם ליום למשך 7–10 ימים. שתי עבודות סקירה שפורסמו ב-2006 הראו שטיפול משולש הכולל Levofloxacin כקו טיפול שני, יעיל יותר מהטיפול המרובע עם פחות תופעות לוואי
- Rifabutin עם Amoxicillin ו-PPI. Rifabutin היא אנטיביוטיקה שימושית בשחפת, וניתנת במינון של 150 מיליגרם ליום פעמיים ביום. תופעות הלוואי העיקריות שלה הן פריחה, תופעות במערכת העיכול כמו בחילה, דיספפסיה, הקאות ושלשול
Helicobacter pylori ופרוביוטיקה
הרציונל להוסיף פרוביוטיקה (Probiotic) לטיפול ב-Helicobacter pylori. נבע משני טעמים: ראשית כדי להעלות את אחוזי האירדיקציה, ושנית כדי להפחית תופעות לוואי הקשורות בטיפול האנטיביוטי. כבר בתחילת שנות האלפיים פורסמו עבודות על ההשפעה האנטימיקרוביאלית (Antimicrobial) הטובה של זני חיידקים פרוביוטיים מסוימים, כמו זני Lactobacillus, על ההחלמה מ-Helicobacter pylori. ברור כי טיפול פרוביוטי לבדו אינו יכול להביא לארדיקציה מלאה של Helicobacter pylori. לעומת זאת, המסקנה מסקירה גדולה שפורסמה על ידי Tong וחבריו על ההשפעה של פרוביוטיקה בארדיקציה של Helicobacter pylori, הראתה שתוספת פרוביוטיקה יכולה לשפר אחוזי ארדיקציה (83.6 אחוזים לעומת 74.8 אחוזים) וכן להפחית תופעות לוואי – בעיקר בהפחתת שלשולים בצורה משמעותית (24.7 אחוזים לעומת 38.5 אחוזים).
פרוגנוזה
Helicobacter pylori וסרטן קיבה
הדלקת הכרונית הנגרמת על ידי Helicobacter pylori מובילה בסופו של התהליך להתפתחות Adenocarcinoma של הקיבה. תהליך זה עובר דרך מספר שלבים טרום סרטניים הכוללים Atrophic gastritis, Intestinal metaplasia, Dysplasia ולבסוף Carcinoma של הקיבה. תהליך זה נמשך עשרות שנים והוא מושפע מגורמים גנטיים (Genetic) וסביבתיים נוספים בנוסף לחיידק זה, הכוללים: עישון, צריכת אלכוהול, מזון עשיר בניטרטים (Nitrates) ומזון מלוח.
עבודות שונות שחקרו את השלבים בהתפתחות סרטן קיבה הגיעו למסקנה שמתוך 100 חולים עם מחלה חודרנית של Helicobacter pylori, כולם יפתחו Gastritis כרונית (דלקת כרונית של רירית הקיבה), 50 אחוזים יפתחו Atrophic gastritis (נזק ניווני כרוני של רירית הקיבה), 40 אחוזים Intestinal metaplasia (שינויים בצורת התאים), 8 אחוזים Dysplasia (שינויים טרום סרטניים) ואחוז עד שני אחוזים Carcinoma של הקיבה.
Correa, שתיאר שרשרת התפתחויות זו עוד לפני עידן ה-Helicobacter pylori, עמד לא פעם בפני השאלה מהו הגורם המתחיל את כל התהליך הזה ומביא לGastritis כרונית. גילוי החיידק בשנת 1983 פתר חידה זו. מהרגע שהייתה הסכמה על שרשרת השלבים המביאה להתפתחותו של סרטן קיבה, נעשו מאמצים גדולים לקבוע מהו שלב ה"אל חזור" - אותו שלב שבו ארדיקציה של ה-Helicobacter pylori לא תוכל עוד להחזיר את הגלגל לאחור ולמנוע התפתחות סרטן קיבה. מקובל שארדיקציה בשלב ה-Atrophic gastritis ולא בשלב מאוחר יותר (שהוא Intestinal metaplasia) יכולה למנוע התפתחות סרטן קיבה.
Helicobacter pylori נחשב כגורם סיכון משמעותי ביותר בהתפתחות סרטן קיבה ו-Lymphoma מסוג B. בארצות המערב הסיכון לפתח סרטן קיבה שלא באזור ה-Cardia הוא פי 6 עד 8 גדול יותר בקרב החולים עם Helicobacter pylori לעומת אלו ללא החיידק. ממצאים אלו הובילו למחשבה האם ניתן להקטין את השכיחות של סרטן קיבה שלא ב-Cardia על ידי ארדיקציה של החיידק, זאת בעיקר בארצות המזרח ויפן, שם שכיחות סרטן זה גבוהה בצורה משמעותית בהשוואה לארצות המערב. העבודה הגדולה ביותר בנושא זה פורסמה על ידי You וחבריו שגייסו מעל 3,000 חולים כדי לענות על שאלה זו. לאחר 7 שנות מעקב, שכיחות סרטן קיבה בקרב החולים שעברו ארדיקציה הייתה 2.4 אחוזים לעומת 1.7 אחוזים אצל אלו שלא עברו ארדיקציה. לאכזבת כולם הבדלים אלו לא היו משמעותיים, ולא ניתן להסיק מסקנות פסקניות מעבודה זו ויש צורך בעבודות נוספות עם מעקב ממושך יותר על מנת לראות האם הרג החיידק אכן יביא להקטנה משמעותית בשכיחותה של מחלה קשה זו.
לגבי Lymphoma של הקיבה התוצאות מעודדות יותר. ארדיקציה של החיידק הוא הטיפול הראשון שיש לתת לכל חולה הסובל מ-Lymphoma מסוג B ו-Helicobacter pylori בקיבה. טיפול זה כשלעצמו יכול להביא לריפוי החולה ללא צורך בטיפולים נוספים. פורסם שחולים מסוימים עם Lymphoma של הקיבה הגיבו לטיפול אנטיביוטי גם בהיעדר הוכחת הימצאותו של ה-Helicobacter pylori.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק