ויטמין - Vitamin - B12
| מדריך בדיקות מעבדה | |
| ויטמין B12 | |
|---|---|
| Vitamin B12 | |
| שמות אחרים | cobalamin, cyanocobalamin |
| |
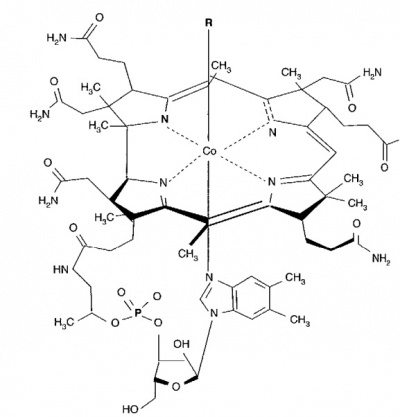
מבנה של ויטמין B12: שייר ה-R יכול להיות methyl-CH3 או adenosyl באדם.
| |
| מעבדה | כימיה/המטולוגיה בדם |
| תחום | רמת ויטמין בדם בתרחישים המטולוגיים/נוירולוגיים |
| יחידות מדידה | פיקוגרם למיליליטר |
| טווח ערכים תקין | ביילודים: 160-1,300; בילדים ומבוגרים -200-835; בבני 60 שנה ומעלה-110-770 |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
גילוי חסר ב-B12 כסיבה לתרחיש של אנמיה ממאירה בנבדקים עם ממצאים המטולוגיים (חולשה, אנמיה מקרוציטרית, מקרוציטוזיס אובלי, נויטרופילים עם היפר-סגמנטציה, לויקופניה/תרומבוציטופניה) או ממצאים נוירולוגים (איבוד זיכרון, תחושת קהיון - numbness, עקצוץ, איבוד של תחושה ויברטורית בגפיים), ממצאים המחשידים לחסר בוויטמין זה. מדידת ויטמין B12 מתבצעת גם לאבחן חסר בחומחצה פולית, לברר היפר-סגמנטציה של גרעין תאים גרנולוציטים, מצבי MCV מעל 100 פמטוליטר, מצבים של אנמיה מגלובלסטית, מצבים של מפגעי ספיגה במעי, באלה עם מחלת קרוהן או צליאק, בפרט בנבדקים שעברו ניתוחי מעקף jejuno-ileal. מדידת B12 תתבצע באלה עם היפר-הומוציסטאינמיה.
בסיס פיזיולוגי
ויטמין B12 משחק תפקיד חשוב במעגלי מטבוליזם מרכזיים בכל תא בגוף, בעיקר בתחום וויסות סינתזת DNA, אך גם בסינתזה של חומצות שומניות ומשק האנרגיה בגוף. יחד עם זאת, חלק מהשפעות B12 ניתן להמיר על ידי כמויות מספיקות של חומצה פולית (ויטמין B9), כיוון ש-B12משמש ליצירה מחודשת של folate בגוף. לכן, רוב התסמינים של חסר ויטמין B12 משקפים למעשה תסמיני חסר ב-folate, כולל ההשפעה על יצירת אנמיה ממאירה או אנמיה מגלובלסטית, הנגרמות על ידי חסר בסינתזת DNA כאשר קיים בגוף חסר ב-folate הנחוץ ליצירת תימין.
היסטוריה
כבר במחצית המאה ה-19 תוארה אנמיה ממאירה, אך רק בשנות ה-20 של המאה הקודמת, התגלה שמרק כבד או נתחי כבד מסייעים בהבראה ממחלה זו. הדמות הדומיננטית בשנות ה-20 בניסויים בכלבים שהושרתה בהם אנמיה, ונרפאו בעזרת תמציות כבד, הייתה זו של George Whipple שאף זכה בשנת 1934 בפרס נובל לרפואה על ממצאיו אלה. אך בהמשך נמצא שבעוד שהגורם בתמציות הכבד שריפא אנמיה בכלבים היה היסוד ברזל, נמצא שבבני אדם היה גורם אחר שסייע במצבי אנמיה ממאירה, והיה זה הכימאי Edwin Cohn שבשנת 1928 בודד מתמצית כבד חומר שהיה פעיל פי-70יותר מאשר תמצית הכבד הניטראלית בטיפול באנמיה זו, אך רק בשנת 1948 Shorb ו-Folkers בארה"ב ו-Todd באנגליה הביאו לגילוי המולקולה המנוקה של B12, כאשר בשנת 1956 הצליחה הקריסטלוגרפית Dorothy Hodgkin לקבוע סופית את מבנה הוויטמין, ועל כך זכתה בפרס נובל ברפואה בשנת 1964. רק בשנת 1973 השלים בכיר הכימאים האורגניים של המאה ה-20, Robert Woodward, את הסינתזה המלאה של ויטמין B12 במעבדה.
מבנה B12 כולל טבעת corrin המורכבת מ-4 יחידות pyrrole דומות לטבעת הפורפירין המופיעה ב-heme, בכלורופיל ובציטוכרום. טבעת ה-corrin, בדומה לפורפירין ב-heme, מסונתזת מ-δ-amino levulunic acid. כאן האטום המרכזי הוא של היסוד קובלט, כאשר אחד מתוך אתרי הקואודינציה, החיוני מאוד לפעילות הוויטמין אינו קבוע, והוא יכול להכיל שייר ציאנו (-CN), שייר הידרוקסילי (-OH), שייר מתילי (CH3) או שייר ’5-דאוקסיאדנוזיל, כאשר אטום ה-’C5 שלו קשור קו-וולנטית עם אטום ה-Co. משקלו המולקולארי של B12 הוא 1,355 דלטון. באדם, מתיל קובלמין ואדנוזיל קובלמין הן שתי צורות הויטמר הטבעיות.
צמחים או בעלי חיים אינם מסוגלים לייצר בעצמם B12, ורק סוגי חיידקים מסוימים מכילים את האנזימים הנדרשים לסינתזה זו. בין השאר מדובר בחיידקים ממשפחת Acetobacter ,Agrobacter ,Azotobacter ,Bacillus ,Clostridium ,Flavobacter ,Nocardia ,Mycobacterium Proteus ,Pseudomonas ,Rhizobium ,Salmonella ,Serratia ,Streptomyces ,Streptococcus ועוד. לכן ייצור תעשייתי של הוויטמין הוא בתהליכי תסיסה של מיקרואורגניזמים, כאשר שנים רבות שימש Streptomyces griseus מקור ליצור הוויטמין. בהווה משמש חיידק מהונדס גנטית מסוג Pseudomonas denitrificans, למטרה זו.
- ציאנוקובלמין
ויטמר זה אינו תוצר טבעי אלא תוצר לוואי של העובדה שנגזרים אחרים של קובלמין, קושרים בזיקה גבוהה ציאניד המצוי באבקת הפחם הפעיל המשמש כשלב הסינון של הוויטמין המיוצר על ידי חיידקים בתהליך ייצורו התעשייתי. כיוון שצורת ציאנו-קובלמין ניתנת בקלות לגיבוש, ואינה רגישה להתחמצנות באוויר, היא משמשת באופן שגרתי כקובלמין הניתן כתוסף מזון או בתכשירי המולטי-ויטמינים.
- הידרוקסיקובלמין
צורת ויטמר פרמקולוגי נוסף שאינו נמצא באופן טבעי בגוף האדם. צורת ויטמין זו מיוצרת על ידי חיידקים, ומותמרת לציאנוקובלמין בתהליך הייצור. כיוון שהידרוקסיקובלמין הוא בעל זיקה גבוהה ליון ציאניד, השתמשו בו כאנטידוט בהזרקה במקרי הרעלת ציאניד. נגזרת זו של קובלמין מותמרת לצורות היותר פעילות של הוויטמין בגוף, מתילקובלמין ואדנוזילקובלמין, ביתר קלות מאשר הציאנוקובלמין, וכיוון שעלותה אינה גבוהה משמעותית ויש לה תקופת מחצית חיים ארוכה יותר בגוף, היא משמשת כתחליף ויטמין בתרחישים בהם פעילות הוויטמין נדרשת. מתן הידרוקסיקובלמין בהזרקה מועדף בילדים עם מחלה מטבולית על רקע חסר ויטמין, או במקרים של אנמיה ממאירה עם נוירופתיה אופטית.
המסלול הפיזיולוגי של ויטמין B12 בגוף מורכב ביותר ולכן הוא נחשף למפגעים ברקמות שונות העלולים לגרום לחסר בוויטמין זה. B12 המגיע במזון קשור לחלבונים, חייב להיות משוחרר מתאחיזה זו על ידי פעילות פרוטאזות הקיבה ובמעי הדק. חומצת הקיבה מסיעת לשחרור B12 מחלקיקי המזון, לכן תכשירים נוגדי חומצה (בעיקר מעכבי משאבת המימן, PPIs, עלולים להפריע לספיגת הוויטמין. הירידה בחומציות הקיבה בגיל המתקדם היא סיבה משמעותית לרמות B12 נמוכות בקשישים.
חלבונים קושרי-B12 ידועים כ-R-proteins, ושני המוכרים ביניהם הם haptocorrin ו-cobalophilin, המיוצרים בבלוטות הרוק. כאשר B12 משתחרר מתאחיזתו בחלבוני המזון על ידי פעולת פפסין בקיבה, הוא נקשר ל-haptocorrin המיוצר גם על ידי התאים הפרייטאליים בקיבה, כדי להיות מוגן מפרוק בסביבה החומצית של הקיבה. כמות משמעותית של B12 הקשורה ל-haptocorrin מופרשת גם במרה. חלבון נוסף הקושר B12 הוא הגורם האינטרינזי (intrinsic factor או IF), גליקופרוטאין המסונתז בתאים הפריאטליים בדופן הקיבה, והמופרש בתגובה לנוכחות מזון בקיבה ולהפרשת היסטמין, גסטרין ופנטה-גסטרין.
בתריסיון פעילות פרוטאוליטית מפרקת את haptocorrin ומשחררת B12, הנקשר מיידית ל-IF שאנו מתפרק על ידי אנזימים אלה. הקומפלקס IF-B12חיוני כדי שהוויטמין ייקשר לקולטנים שלו על פני תאים אנטרוציטים במעי העקום (ileum) הטרמינלי של המעי הדק, קולטנים המזהים רק את הקומפלקס IF-B12. קולטנים אלה על פני ה-ileum מורכבים משני חלבונים, cubilin ו-amnionless, והם ממוקמים בקטע שאורכו 80 ס"מ של ה-ileum. תפקיד אחר של ה-IF הוא להגן על הוויטמין מפני הידרוליזה על ידי חיידקי המעי. בחסר של IF יש הפחתה מובהקת בספיגת B12, וזה מצב אופייני לאנמיה ממאירה, בה חסר IF נובע מפגיעה אוטו-אימונית של נוגדנים בתאים הפרייאטליים מה שגורם ל-atrophic gastritis. לחילופין, יכולים גם להיווצר נוגדנים המכוונים כנגד IF, הנקשרים אלין ומנטרלים את יכולתו לקשור B12. באלה עם אטרופיה של התאים הפרייטאליים יופרשו בצואה 80-100% של B12 הנלקח באופן פומי, בהשוואה לאלה עם רמה תקינה של IF בהם תופרש רק 30-60% מכמות הוויטמין הנלקח פומית.
כאשר הקומפלקס IF-B12 נקשר לקולטניו ב-ileum, הוא מועבר לצירקולציה הפורטאלית לאחר אנדוציטוזה ומועבר בנסיוב קשור לטרנסקובלמין, כאשר קומפלקס זה ידוע כ-holotranscobalamin. הוויטמין מועבר ל-טרנסקובלמין-II המשמש כטרנספוטר של הוויטמין בפלזמה ומשמש להעברת קובלמין לתאים. לצורך העברת B12 מתא לתא, נקשר הוויטמין לטרנסקובלמין I. קיימים פגמים גנטיים ביצירת טרנסקובלמין או הקולטנים שלו מה שעלול לגרום בתינוקות לאנמיה מגלובלסטית, למרות רמות תקינות של הוויטמין בדם. בתוך התאים טרנסקובלמין II מתפרק בתוך הליזוזום, ו-B12 חופשי משתחרר בציטופלזמה. טרנסקובלמין I קושר כ-85% מכלל הוויטמין בפלזמה, בעוד טרנסקובלמין II קושר בין 12-15%. ישנו גם טרנסקובלמין III (1-2% מכלל הוויטמין) ולא קיים ידע מבוסס על תפקידו. טרנסקובלמין I ו-III מיוצרים על ידי לויקוציטים, ואילו טרנסקובלמין II מסונתז בכבד.
הכמות הכוללת של B12 הנאגרת בגוף נעה בין 2-5 מיליגרם במבוגרים, כאשר מחצית כמות זו נאגרת בכבד. כ-0.1% מכמות B12 בגוף אובדת מדי יום על ידי הפרשה בצואה. רוב הוויטמין המופרש במרה, מתמחזר בצירקולציה האנטרו-הפאטית, מה שגורם לאגירה היעילה שלו בכבד שאמורה להספיק לתקופה של 4-5 שנים גם בחסך של B12 במזון, וזו גם הסיבה שחסר תזונתי בוויטמין זה נדיר יחסית. במבוגרים עם מאגרים נמוכים של הוויטמין בכבד, התופעות הקליניות יכולות להופעות תוך כשנה מתחילת החסך התזונתי, בעוד שבתינוקות סימני אלה יופיעו תוך חודשים בודדים או אף פחות.
ויטמין B12 מסיס מים, וחשיבותו בעיקר לתפקוד התקין של המוח ומערכת העצבים והמערכת ההמאטופויאטית. במבנהו B12 הוא בעל המולקולה הגדולה והמורכבת ביותר, והוא מכיל קבוצה של מספר ויטמרים הדומים במבנה, המכילים את היסוד הנדיר מבחינה ביוכימית, קובלט. הביו-סינתזה של B12 יכולה להתבצע רק על ידי חיידקים, אם כי ההסבה מנגזרת אחת שחל הוויטמין לנגזרת אחרת יכולה להתרחש בגוף האדם. צורת הציאנו-של B12 אינה מתקיימת בטבע, אך היא שולטת כתוסף פרמצבטי, או בתור תוסף מזון בגלל יציבותו ומחירו הזול. בגוף ציאנוקובלמין מוסב לצורות הפיזיולוגיות של הוויטמין, בתחילה להידרוקסיקובלמין, אשר מוסב למתילקובלמין ולאדנוזילקובלמין.
בגוף האדם חשיבות קובלמין קריטית בשני סוגים של ריאקציות ביוכימיות:
- פעילות האנזים isomerase המזרז שינוי קונפורמציה במולקולה, העוברת מצורת איזומר אחד לאחר ללא שינוי בנוסחה הכימית, אלא על ידי שינוי מבנה הקשרים בתוכה, ואת המבנה המרחבי התלת ממדי שלה.
- פעילות האנזים methyltransferase, להעברת שייר מתיל (-CH3) בין שתי מולקולות. נגזר הקובלמין 5'-deoxyadenosylcobalamin (או AdoB12), הוא קו-פקטור של האנזים Methylmalonyl Coenzyme A mutase (להלן MUT), ואילו methylcobalamin (להלן MeB12) הוא קו-פקטור של האנזים 5-methyltetrahydrofolate-homocysteine methyltransferase (להלן MTR). הפרעה לפרוק של חומצות שומן "אי-זוגיות" עלולה לגרום לפגיעה בממברנת המיאלין של תאי עצב, ולתופעות נוירולוגיות ופסיכיאטריות.
יש לציין יחד עם זאת, שלמרות ש-MMA מוגבר ב-90-98% מהנבדקים חבר ב-B12, הוא גם מוגבר ב-20-25% ממבוגרים מעל גיל 70 שנה, כאשר רק בשליש מבין האחרונים יש חסר בוויטמין. בנוסף, חומצה מתיל מלונית מוגברת גם במצבים של כשל כליות. מסיבה זו מדידת MMA לבירור חסר ב-B12, אינה מומלצת כבדיקה רוטינית. יחד עם זאת, באותם מקרים בהם רמת B12 נמצאת תקינה, אך ישנם תסמינים קליניים המחשידים לחסר בוויטמין זה, מדידת MMA חיונית.
האנזים MTR הידוע גם כ-Methionine synthase, מקטלז את המרת הומוציסטאין בחזרה ליצירת מתיונין, במה שידוע כמסלול הרה-מתילציה. בחסר B12 תיחלש ריאקציה זו מה שיביא לרמת הומוציסטאין מוגברת, אך גם בעקיפין לחסר בחומצה פולית, שכן B12 עוזר גם ליצירה מחדש את צורת THFאו tetrahydrofolate, שהיא הצורה הפעילה של חומצה פולית. בחסר של B12, פולאט נותר כ-5-methyl-folate, ממנו לא ניתן ליצור THF אלא אם כן ריאקצית MTR מביאה להגבת 5methyl folate עם הומוציסטאין, ליצירת מתיונין ו-THF, ובכך מפחיתה את הצורך למקורות חדשים של THF מהמזון. THF מותמר ל-5-10methylene-THF בריאקציה שאינה תלויה ב-B12, והתוצר האחרון משתתף בסינתזה של תימין.
תרחיש זה מכונה "מלכודת הפולאט" או Methylfolate "trap" hypothesis. חסר B12 ותת פעילות האנזים MTR והצטברות 5methyl foalte, תגרום בסופו של תהליך להפחתת הייצור של החומר '2-דאוקסי-תימידין-'5-פוספאט (dTMP), שהוא חומר המוצא ליצירת הנוקלאוטיד תימין, וכאן ההפרעה לייצור תקין של DNA. חסך זה ביצירת DNA, תפחית יצירת תאים עם פעילות חלוקות מוגברת, בעיקר תאי דם, אך גם תאי מערכת העיכול. פגיעה ביצירת תאי דם היא הגורמת לאנמיה ממאירה, וההשפעות הנלוות ביצירת אנמיה מגאלובלסטית, יכולות להיפטר ברמה מספקת של חומצה פולית. מסתבר אם כן, שהפעילות התפקודית המוכרת ביותר של B12 הקשורה לסינתזת DNA, לחלוקת תאים ולאנמיה, היא למעשה פעילות המסתייעת על ידי B12 בהמרת פולאט לצורתו הפעילה, החיונית ליצירה יעילה של DNA.
הנזק למיאלין המיוחס לחסר B12, נובע כנראה מהריאקציה של האנזים MUT המסבה methylmalonyl CoA לסוקציניל קואנזים-A. אנזים זה דרוש למטבוליזם של חומצות שומניות עם מספר לא זוגי של פחמנים, ולמטבוליזם ש חומצות שומניות מסועפות שרשרת, ולהסבה של חומצה מתיל מלונית לסוקציניל קואנזים A שיעבור חילוף חומרים במעגל קרבס. ההצטברות של MMA בכשל של ריאקציה זו שנובע בין היתר מחסר B12, גורמת להפחתת היציבות של ממברנת המיאלין. עודף MMA מונע סינתזה תקינה של חומצות שומן, בין השאר כיוון שחומצה מתיל מלונית עצמה תשתרבב לחומצות השומניות במקום חומצה מלונית, מה שיגרום לשבירות-יתר של מיאלין, ודה-מיאלינציה. תרחיש זה עומד כנראה בבסיס נוירופתיות המזוהות עם חסר B12 גם כאשר רמת חומצה פולית תקינה ואין ממצאים של אנמיה.
אך גם ריאקציות הקשורות לאנזים MTR התלוי ב-B12 יכולות להיות רלוונטיות להשפעות נוירולוגיות באופן עקיף. חומצת האמינו מתיונין מגיעה מהמזון, אך גם נוצרת מחדש מרה-מתילציה של הומוציסטאין, חיונית ליצירת S-adenosylmethionine (להלן SAMe), מטבוליט החיוני למתילציה של פוספוליפידים במיאלין. פרט לכך SAMe קשור גם ליצירת מספר קטכולאמינים, נוירוטרנסמיטורים ובמטבוליזם במוח. חסר בנוירוטרנסמיטורים עלול להיות כרוך במצבי דיכאון המוכרים בחסר B12. המתילציה של פוספוליפידים במיאלין תלויה גם בפולאט, וזה האחרון תלוי באנזים MTR, המושפע מרמת B12.
ויטמין B12 נמצא במאכלים שמקורם מן החי: בשר (בעיקר בכבד בקר), במוצרי חלב, ביצי תרנגולת, דגים, פירות ים, רכיכות, צדפות וסרטנים. ברוב מוצרי החלב תהליך הפסטור מפחית את רמת הוויטמין הטבעית, לכן הם מועשרים בהם בצורה מלאכותית ובאופן מבוקר לאחר התהליך.
כמויות של ויטמין B12 במזון (בערכים של מיקרוגרם ל-100 גרם): כבד בקר- 83.1 ; חלקים פנימיים של תרנגול הודו-33.2; נקניק מכבד חזיר-20.1; צדפות לא מבושלים-16.0; חלקים פנימיים של תרנגולת- 9.4; גבינה צהובה עתירת שומן-3.4; בשר בקר (Sirloin) לא מבושל-1.2; ביצה לא מבושלת- 0.9; חלב פרה מלא-0.45; חזה עוף לא מבושל-0.2. מנה יומית מומלצת של הוויטמין היא: 1.0-3.0 מיקרוגרם. דיאטה ממוצעת יומית מכילה 3-30 מיקרוגרם של B12, כאשר רק 1-5 מיקרוגרם מתוך כמות זו נספגת באנשים בריאים.
מאכלים שונים לעיתים מועשרים ב-B12 מתאימים לצמחונים, כגון: דגני בוקר, שמרי מאכל, חטיפי אנרגיה, משקאות אנרגיה ומשקאות קלים מסוימים, לחם, מוצרי סויה וטופו (דוגמת חלב סויה), שמרים מועשרים, ומוצרים המשמשים כתחליפי בשר דוגמת שניצל תירס והמבורגר צמחי, מאכלים שעובדו בהתססה כגון טמפה או מיסו ואצות.
הקצובה היומית המומלצת לאוכלוסייה בריאה: עד 6 חודשים-0.5 מיקרוגרם, 6 חודשים עד שנה-1.5 מיקרוגרם, 1-3 שנים-2.0 מיקרוגרם, 4-6 שנים- 2.5 מיקרוגרם, מעל לגיל 7 שנים-3.0 מיקרוגרם, נשים הרות או מיניקות-4.0 מיקרוגרם. המינון עבור הלוקים בחוסר של ויטמין B12 גבוה בהרבה, ויכול להגיע בתחילת הטיפול (לפי מינון של רופא) עד ל-2,000 מיקרוגרם ביום.
סיבות לרמה מוגברת של B12 בדם: כשל כרוני של הכליות, כשל חריף או כרוני של הכבד כגון במקרים של הפאטיטיס, צמקת הכבד (צירוזיס), או במצב של hepatic coma, או בסוגי קרצינומה אחדים עם גרורות לכבד, כאשר במצבים אלה תיתכן הפרשה מוגברת של B12 כתוצאה מציטוליזה כבדית, או ממיעוט פינוי הוויטמין על ידי הכבד. רמת B12 נמצא לעתים בסוכרת, במצבי המוליזה, באי-ספיקת לב חמורה, במטופלים עם רמה גבוהה של טרנסקובלמין, ב-ALL וב-CLL, בשליש מהמקרים של CLL, בלוקמיה גרנולוציטית כרונית, במקרים אחדים של לויקמיה מונוציטית, בלויקוציטוזיס, ב-polycythemia vera, באריתרו-לויקמיה (כאשר רמת הלויקובלסטים והנורמובלסטים גבוהה), כאשר במצבים אלה רמה מוגברת של החלבון הקושר B12-haptocorrin. רמת B12 מוגברת ניתן למצוא גם במצבי כולסטאזיס מושרה על ידי תרופות, בדיאטה עניה בחלבונים, לעתים במצבי השמנת יתר, וב-COPD. לעתים מוצאים במעבדה רמות גבוהות משמעותית של B12 בנסיוב, הנובעות מצריכת יתר של תוספי ויטמין זה.
סיבות לרמה נמוכה של B12 בדם
אנמיה ממאירה (pernicious anemia) מחסר גורם אינטרינזי כתוצאה מפגיעה בתאים הפריאטליים בקיבה או כתוצאה מנוגדנים עצמיים ל-IF, (וכן מצב נדיר של חסר מולד של IF), ב-achlorhydria, מהסרה חלקית או מלאה של הקיבה, במצבי atrophic gastritis בגיל מתקדם, בתרחישי ספיגה לקויה (מהסרה של חלקי מעי דק מסיבות של מחלת קרוהן או בחלק מהליך ניתוחי להפחתת משקל), ileitis, במחלת צליאק, בכרסת טרופית (tropical sprue), באי-ספיקה אקסורינית של הלבלב-חסר בהפרשת אנזימי עיכול, בצמיחת יתר של חיידקי מעי, בחסך תזונתי כמו בצמחונים ועוד יותר מכך בטבעונים, במפגעים מולדים כגון orotic acuduria, בחסר נדיר של transcobalamin II, בתסמונת Immerslund-Grösbeck, בשלבי הריון מתקדמים בעיקר בשליש האחרון. גם נטילת גלולות למניעת הריון יכולה לגרום לרמה נמוכה יותר של B12.
אנמיה ממאירה עלולה להיגרם גם על ידי כמה מחלות אוטואימוניות, כמו מחלות בלוטת התריס, בהקת (vitiligo) או מחלת אדיסון (אי ספיקה של בלוטת האדרנל). בחלק מהמחקרים נמצא קשר בין הימצאות החיידק הליקובקטר פילורי שגורם לכיב קיבה לבין חוסר בוויטמין B12. מחסור בוויטמין B12 עלול להתרחש במחלות שונות, שבהן קיימת תנועתיות איטית של מעבר מזון דרך המעיים, כמו סוכרת, הצרויות של המעיים ומחלות רקמות חיבור. במצב כזה מתפתחות מושבות חיידקים מרובות בחלק העליון של המעי הדק. החיידקים האלה הצורכים את הוויטמין לשם גדילתם.
תסמינים קליניים של חסר ויטמין B12
תסמיני מחסור בוויטמין B12 מתפתחים באיטיות, ולא תמיד מזוהים מיידית. כשיש מחסור ניכר בוויטמין עלולים להופיע כמו בכל אנמיה, עייפות, סחרחורת, דופק מואץ, קוצר נשימה, לשון לבנה וחלקה (גלוסיטיס) וצורבת, בחילות או תיאבון ירוד, אובדן משקל, שלשולים וגוון צהבהב של העור ובלובן העין.
רמות ויטמין B12 נמוכות לאורך זמן עלולות לגרום נזק בלתי הפיך לתאי העצב, דבר שעלול לגרום להפרעות זיכרון, דיכאון, הפרעות פסיכוטיות, אי שקט, חולשת שרירים ובעיות מוטוריות. אכן, מחקרים רבים תיעדו בחסר ממושך של B12 קהות חושים, עקצוץ בגפיים, נוירופתיה היקפית, חולשה בשרירים, היפר-רפלקסיה, שיגשון (אטקסיה), איבוד תחושת עומק (proprioception), הפרעות בקואורדינציה, שינויים בהתנהגות רגשית. נוצרים מוקדים של פגיעות במיאלין הגורם לניוון של רקמה בעמודות האחוריות והצדדיות של חוט השדרה. התופעות הנוירולוגיות עלולות להתקיים גם ללא אנמיה מגלובלסטית. מתן של חומצה פולית לבדה, לא יפתור כלל את התופעות הנוירולוגיות. תופעות במערכת העיכול העלולות להיווצר בחסר של B12 הן תת ספיגה במעי הדק, שלשולים, אובדן תיאבון.
בבדיקה מיקרוסקופית של תאי דם אדומים מוצאים לעתים תכופות אנמיה מאקרוציטית או מגלובלסטית עם ערכי MCV בין 110 ל-150 פמטוליטר. ניתן למצוא anisocytosis (רב גוניות בגודל), poikilocytosis (צורות לא תקינות), macroovalocytes (תאים גדולים סגלגלים). בתאי הדם הלבנים ניתן להבחין בחלוקת יתר של הגרעין. וכאשר גרעין התא מכיל לפחות 6 אונות - יש לחשוד באנמיה מגלובלסטית.
במצב של אנמיה מגלובלסטית חריפה - אנמיה מגלובלסטית המתפתחת תוך מספר ימים, כגון עקב חשיפה לגז הצחוק. בספירת דם, עדיין לא רואים אנמיה, אבל ניתן להבחין בהתמעטות תאי הדם הלבנים וטסיות הדם. במוח העצם מופיעים שינויים אופייניים לאנמיה מגלובלסטית. יש לציין שהעדר מצב של אנמיה מגלובלסטית איננו יכול לשלול מצב של חוסר ויטמין B12. בדרך כלל נדרשת גם בדיקה של רמת חומצה פולית, כדי לאבחן או לשלול חוסר חומצה פולית שסימניה דומים מאוד לחוסר של ויטמין B12. רמה תקינה 6 - 20ננוגרם למיליליטר פלזמה נחשבת תקינה, ואילו רמת חומצה פולית מתחת ל-4 אבחנתית לחוסר חומצה פולית. בדיקה חדישה ורגישה היא זו של holotranscobalamin או HoloTC, המייצגת את הפרקציה הפעילה של B12 היכולה לחדור לתאים לצורך סינתזת DNA.
טיפול
טיפול בגורמים למחלה רלוונטי רק בחלק קטן מהמקרים, כגון: אנטיביוטיקה נגד חיידקים המתחרים על ויטמין B12 במעי הדק, וכדומה. ברוב המקרים, כגון במצבים של אנמיה ממארת או תת-ספיגה במעי הדק מסיבות אחרות - הטיפול הוא בזריקות חוזרות לשריר של ציאנוקובלמין או הידרוקסיקובלמין, עד להעלמות התופעות הקליניות. לאחר מכן - מתן ציאנוקובלמין תת-לשוני. לחלופין - מינון גבוה מאוד של ויטמין B12 בבליעה - יכול לגרום לספיגה של ויטמין B12 במעי הדק, אף ללא פקטור פנימי. טיפול זה נדרש בדרך כלל לכל החיים. הוספת חומצה פולית במקרים של מחסור חמור - יכולה להקל על האנמיה, ואף למנוע פגמים מולדים, אבל נדרשת זהירות רבה, כי חומצה פולית לא מקילה כלל על התופעות הנוירולוגיות והפסיכיאטריות.
השפעת תרופות שונות על רמת ויטמין B12 על ידי הפחתת ספיגת הוויטמין
- צריכת אלכוהול ממושכת העולה על שבועיים ברציפות;
- חומצה 4–אמינו-סליצילית (הידועה גם כ- PAS) וכן cycloserine. תרופות אנטיביוטיות ותיקות אלה לטיפול בשחפת מפחיתות במחצית את ספיגת הוויטמין, כחלק מהשפעתן על ספיגה באופן כללי. נטילה ממושכת של PAS במינונים יומיים של 8 גרם גורמת לשינויים מגלובלסטיים ומדי פעם התגלתה אנמיה, לכן מומלצת מדידת רמת B12 בחולי שחפת מטופלים בחומצה אמינו-סליצילית;
- נוגדי פרכוסים דוגמת phenytoin ,phenobarbital ו-primidone מפחיתים ספיגת B12 במעי בחלק מהמטופלים. בכך ניתן אולי להסביר השפעות לוואי נוירו-פסיכיאטריות שנצפו במטופלים בתרופות אלה. מומלץ למטופלים בנוגדי פרכוסים אלה לנטר מדי פעם את רמות B12 וחומצה פולית בדמם;
- תכשירים כמו colestipol או cholestyramine לקשירת חומצות מרה והפחתת רמת כולסטרול, יכולים להפחית ספיגת B12 אם כי באופן מתון;
- הקרנת קובלט-60 לאזור המעי הדק.
- קולכיצין במינון יומי של 2-4 מיליגרם יכול לפגוע בתפקוד תקין של רירית המעי, ולהפחית את כושר הספיגה של ויטמין B12, בדרך כלל אחרי 2-3 שנים של שימוש בתרופה זו;
- תכשירי אשלגן בשחרור איטי יכולים להפחית ספיגת B12, יותר עם KCl מאשר עם אשלגן ציטראט;
- התכשיר לטיפול במלריה pyrimethamine;
- תכשירים היפו-גליקמיים ממשפחת ה-biguanides כגון metformin ו-phenformin, מפחיתים רמת B12 ב-30% מאלה הצורכים אותם, אם כי לא באופן משמעותי קלינית. ניתן לתקן חסר זה בוויטמין על ידי נטילה פומית של סידן;
- הנתונים לגבי השפעת תכשירים הורמונאליים פומיים למניעת הריון על רמת B12 שנויים במחלוקת, בין נתונים המצביעים על הפחתה קלה, לבין אלה שאינם מוצאים כל השפעה גם לאחר צריכה של תכשירים אלה לתקופה של 6 חודשים לפחות;
- טיפול ממושך בתכשירים אנטי-בקטריאליים דוגמת neomycin, אמינוגליקוזידים, pentamidine ו-trimethoprim דווח כמפחית ספיגה של B12. יחד עם זאת יש לציין ששגשוג מוגבר של חיידקי מעי יכול להביא לספיחת הוויטמין לחיידקים אלה, מה שמפחית ספיגתו במעי הדק. לכן טיפול ב-metranidazole עשוי דווקא לשפר את רמת B12, אם כי לתנודות ברמת הוויטמין כתוצאה משינוי ברמת חיידקי המעי אין בדרך כלל השפעות קליניות;
- תכשיר דיורטי כגון triamterene;
- methotrexate;
- תכשירים אנטגוניסטים של הקולטן H2 כגון cimetidine, famotidine, nizatidine ו-ranitidine. הפחתת ההפרשה של חומצת קיבה של האנזים פפסין, כתוצאה מחוסמי H2 אלה, יכולה להפחית את ספיגת הוויטמין המגיע במזון קשור לחלבונים שנחוץ שחרורו מתאחיזה זו בעזרת חומציות הקובה ופפסין, אך אין לה השפעה על תכשירי B12 נקי;
- מעכבי משאבת מימן (PPIs), דוגמת omeprazole, lansoprazole, rabeprazole, pantoprazole ו-esomeprazole, מפחיתים את חומציות הקיבה והשפעתם על חסר B12 אף שכיחה יותר מאשר משימוש בחוסמי H2 שכן הם יותר יעילים בגרימת achlorhydria. יחד עם זאת, אלא אם כן השימוש ב-PPIs נמשך מעל שנתיים ברציפות, הסיכון נמוך לתופעות קליניות מחסר B12;
- צריכה ממושכת של גז הצחוק (N2O) למטרת abuse עד כדי הרעלה עם גז זה, מביאה לחסר תפקודי של B12, גם כאשר רמות הוויטמין הנמדדות בדם תקינות. הגז N2O מחמצן את יון הקובלט, ומתילקובלמין מאבד את פעילותו.
- נטילת גלולות למניעת הריון מפחיתה לעתים את ספיקת הוויטמין.
מבחן Schilling
ידוע גם בשמו האחר Vitamin B12 absorption test מיועד לאלה עם חסר הוויטמין, ומטרתו העיקרית לברר אפשרות של אנמיה ממאירה. זהו מבדק בעל ארבעה שלבים: בשלב I הנבדק שותה B12 רדיואקטיבי (בדרך כלל איזוטופ 57Co או Co58, כאשר שעה אחת לאחר מכן הוא יוזרק לתוך השריר עם מנת B12 לא רדיואקטיבית שאין בה למלא את מאגרי הגוף לוויטמין זה. בפעולה זו מרווים באופן זמני את הקולטנים של B12 בכבד, כדי למנוע את קשירת הוויטמין הרדיואקטיבי בכבד באופן שכאשר החומר הרדיואקטיבי נספג במעי הוא יעבור ישירות לשתן. לאחר איסוף של 24 שעות שתן כדי לברר כמה מהחומר הרדיואקטיבי הופרש בשתן. באופן נורמאלי, הוויטמין הרדיואקטיבי יופרש ברובו בשתן באופן שבאיסוף 24 השעות הראשונות 8-40% מהוויטמין הרדיואקטיבי יופרשו בשתן. לעומת זאת, בנבדקים עם אנמיה ממאירה, וספיגה לקויה של הוויטמין במעי, פחות מ-5% מהרדיואקטיביות יופרש לשתן.
בשלב II אם תוצאה בלתי תקינה התקבלה בשלב I, חוזרים על הבדיקה 3-7 ימים מאוחר יותר, הפעם בתוספת גורם אינטרינזי (IF) וויטמין רדיואטקטיבי, שניהם במתן פומי. שלב II יספק מידע האם רמת B12 נמוכה בדמו של הנבדק נובעת מבעיות בקיבה המונעות יצירת IF. אם תוצאת שלב II תקינה דהינו למעלה מ-5% מהרדיואקטיביות תתגלה בשתן באיסוף 24 שעות, משמע מדובר אמנם באנמיה ממאירה וחוסר יכולת של הקיבה להפריש IF. לעומת זאת, תוצאה בלתי תקינה של שלב II דהינו תוצאה הנמוכה מ-5% רדיואקטיביות בשתן, משמעותה שהבעיה היא בספיגת הוויטמין במעי שיכולה להיגרם ממחלת צליאק, ממפגע בכיס המרה, ממחלת Whipple, מדבקה בתולעת הדגים (Diphyllobothrium latum), או כתוצאה ממחלת כבד.
תוצאה לא תקינה של שלב II תוביל לביצוע שלב III של המבדק, בו מנסים לאבחן נבדק עם רמה ניכרת של חיידקי מעי העלולים להביא לרמת B12 נמוכה. כאן הזרקת הוויטמין הרדיואקטיבי נעשית לאחר נטילת אנטיביוטיקה במשך שבועיים. על פי תוצאת שלב III נקבע אם להמשיך לשלב IV של מבחן שילינג, בו נבחנת אפשרות של אי-ספיקה של בלוטת הלבלב. שלב IV כולל מתן אנזימי לבלב למשך 3 ימים ולאחריו שתייה של קובלמין רדיואקטיבי. תוצאה נורמאלית של השלב הרביעי מעידים אמנם על אי-ספיקה של הלבלב. שכיחות הביצוע של מבחן שילינג ירדה באופן חד בשנים האחרונות, הן כיוון שהשיווק של הוויטמין רדיואקטיבי פחת באופן ניכר, ביקר כתוצאה מהנטייה ההולכת וגוברת להימנע ממבדקים רדיואקטיביים בעשייה הרפואית. רופאים ואף מטופלים נוטים לא לעבור מבדק רב-שלבי הזה הכרוך בהיענות ניכרת מצד מטופלים בשל סרבולו והתמשכותו.
הוראות לביצוע הבדיקה
אין צורך בצום, אך בדיקה זו מבוצעת בדרך כלל עם בדיקת חומצה פולית המתבצעת בצום של 8-12 שעות. הדם נלקח במבחנה כימית (פקק אדום או צהוב), או במבחנת ספירת דם (EDTA, פקק סגלגל) או במבחנת ציטראט (פקק תכול). יש להימנע ממבחנת הפארין, שכן חומר זה נוטה לקשור ויטמין B12. יש להקפיא את הדגימה אם ביצוע הבדיקה מתעכב מעל 8 שעות, תוך הימנעות ההקפאות והפשרות חוזרות. יש להגן על הדגימה מחשיפה לאור.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 