הטיפול הכימי וההורמונלי בסרטן השד - Chemotherapy and hormonal therapy for breast cancer
הופניתם מהדף טיפול כימותרפי בסרטן השד לדף הנוכחי.
עקרונות בכירורגיה
מאת ד"ר צבי קויפמן
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של השד | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – טיפול הורמונאלי חליפי, מעכבי ארומטאז, סרטן השד
הטיפול בסרטן השד הוא רב צדדי, וכולל טיפול מקומי (כירורגיה ורדיותרפיה) וטיפול מערכתי (כימותרפיה וטיפול הורמונלי). העובדה ששיעור החזרות המקומיות במחלה מדרגה 1 הוא 25% ל-10 שנים, ואילו במחלה מדרגה 2 כ-75% ל-10 שנים, מעידה על כך שהמחלה, בזמן אבחנתה, מפושטת מעבר לאזור השד, בחלק לא קטן של החולות. הממצא בולט יותר בחולות שבהן נמצאו בלוטות נגועות. כאשר 3-1 בלוטות נגועות, שיעור חזרת המחלה הוא 65%, ואילו כאשר 4 בלוטות ויותר נגועות שיעור חזרת המחלה עולה ל-88%. בעבר ייחסו ממצאים אלה לטכניקה כירורגית לקויה, הגורמת לפיזור השאת, או להשארת רקמה שאתית באזור המנותח. כיום ברור שכישלון הטיפול הכירורגי מקורו בכך, שבעת קביעת האבחנה והטיפול המקומי הראשוני קיים כבר פיזור גרורתי, כך שאין ביכולתו של הטיפול המקומי, ככל שיהיה נרחב, לטפל בבעיה סיסטמית.
באופן תיאורטי, סרטן מתחיל במוטציה של תא אחד. התא מתחלק בצורה בלתי מבוקרת עד שהוא מגיע לידי ביטוי קליני. תא שאת צריך לעבור לפחות 30 חלוקות כדי שיגיע לגודל של 1 ס"מ, שהינו שאת הניתנת לזיהוי קליני. לאחר 10 חלוקות נוספות השאת מגיעה למסה קריטית של 1012 תאים, שזהו מצב שבו החולה מוכרע על-ידי המחלה. מכאן ברור, שבזמן גילוי השאת היא כבר עברה חלק ניכר מתהליך גדילתה. היא זקוקה לאספקת דם סדירה ולניקוז לימפתי, כך שפוטנציאל ההתפשטות של השאת גדול. התאים שפוזרו מהשאת מתיישבים ברקמות אחרות ומתחילים להתחלק. הם זקוקים לכ-30 חלוקות על מנת לבוא לידי ביטוי קליני. משך הכפלת המסה נע בין 40 ל-380 יום, ולכן הביטוי הקליני יכול להופיע בין שנתיים ל-20 שנה לאחר הפיזור הגרורתי. כאשר מגלים סרטן ראשוני, קיימת הסתברות גבוהה להימצאות פיזור גרורתי מיקרוסקופי תת קליני בגודל שבין תא אחד ל-109 תאים, אשר אליהם ניתן להגיע רק בטיפול כימי סיסטמי.
יעילות הטיפול הכימי מותנית בעומס תאי השאת. ככל שהעומס גבוה יותר, הסיכוי לרפא את החולה נמוך יותר, ולכן יעילות הטיפול הכימי, בשלבים התת קליניים, היא גבוהה יותר. הוכח שככל שמסת הגידול קטנה יותר השפעת הטיפול רבה יותר. הסיבה לכך היא, שמהירות התחלקות התאים גדולה יותר ככל שהמסה קטנה יותר, כך שבזמן נתון, אחוז גדול יותר מהתאים מתחלקים במסה קטנה יותר. מכיוון שמרבית התרופות הכימותרפיות פוגעות בתאים מתחלקים, הרי השפעתם על מסה קטנה היא רבה יותר ולהיפך. ככל שהמסה קטנה יותר אספקת הדם לכל חלקיה טובה יותר, ולכן החומר הכימי מגיע אליה בריכוזים גבוהים יותר. התרופות משמידות את התאים לפי קינטיקה מסדר ראשון, כלומר כמות מסוימת של תרופה תפגע בשיעור (אחוז) מסוים קבוע של תאי שאת, ולא במספר קבוע. כל מנה נוספת תהרוס רק אותו שיעור מהתאים, כך שבאופן תיאורטי לא ניתן להגיע לאפס תאי גידול, אולם במצב של תאים בודדים כנראה הגוף מסוגל להגיב טוב יותר מבחינה אימונולוגית, ולכן פירוש הדבר ריפוי. כדי להקטין את עומס התאים, מתחת למסה הקריטית, יש צורך להוציא את מסת הגידול על-ידי כריתה כירורגית ולהמשיך את הטיפול על-ידי כימותרפיה. לכן, בכל חולה שבה עלולות להימצא גרורות מיקרוסקופיות, יש להתחיל טיפול כימי מוקדם ככל האפשר.
טיפול מסייע - Adjuvant therapy
כימותרפיה מסייעת לטיפול בסרטן שד בשלבים מוקדמים (Adjuvant chemotherapy)
סרטן שד בשלבים I ו-II, הקרוי גם סרטן שד מוקדם, הוא סרטן שד שניתן לריפוי. ב-70% מהחולות סילוק השאת מהשד (מקומית-אזורית) בלבד היא הטיפול היחיד הנדרש להשגת ריפוי. 30% יפתחו גרורות וימותו מהמחלה. גורמים המנבאים הישנות כוללים: נגיעות בלוטות בית השחי, גודל בשאת הראשונית בשד, דרגת בשלות השאת, רמת הקולטנים להורמונים, נוכחות גורמי צמיחה, הפרופיל הגנטי של השאת והפלואידיות של השאת. למצב בלוטות הלימפה בבית השחי חשיבות מכרעת: ככל שמספר הבלוטות הנגועות בבית השחי גבוה, כך שיעור ההישנות גבוה יותר. כישלון מערכתי זה הוא תוצאה של פיזור תאי שאת בתקופה פרה-קלינית, הנודדים מהשד בדרך הלימפה או כלי הדם, ומתיישבים באיברים שונים בגוף. המקומות המועדפים הם: השלד, הריאות, הכבד והרקמות הרכות. מושבות אלה סמויות, לא ניתנות לאבחון ומוכרות כמיקרו-גרורות. טיפול כימי מסייע, המוכר גם כטיפול משלים או אדג'וונטי (Adjuvant), מיועד לחסל מיקרו-גרורות ולמנוע את הפיכתן למאקרו-גרורות. מטה-אנליזה שכללה מעל 75,000 חולות, הראתה בין השאר, שמתן משלבים של תרופות כימותרפיות הניב תוצאות טובות יותר מאשר תרופות בודדות. יתרון נוסף למשלבים הוא, שאפשר בחלקם להקטין את מינון התרופות ולכן גם את הרעילות שלהן. משלב כזה שעשה מהפכה ראשונה בטיפול בסרטן השד היה ה-CMF.
CMF (Fluorouracil ,Methotrexate ,Cyclophosphamide): ב- Milan national cancer institute trial השוו שתי קבוצות של חולות לאחר כריתת שד, שלהן בלוטות נגועות; האחת קיבלה CMF והשנייה לא. המעקב נמשך 9 שנים. נמצא שחולות שקיבלו את הטיפול היו חופשיות מהמחלה לטווח ארוך יותר מאלה שלא קיבלו את הטיפול. גם כאן עיקר הנהנות היו נשים לפני גיל הבלות (66% / 43% - Placebo / CMF). בהשוואה בין ה-CMF לבין Fluorouracil עם Melphalan (L-PAM) לא נמצא כל הבדל בין השניים.
מהפכה שנייה שחלה הייתה השילוב של האנטראציקלינים (Anthracyclines) כמו: Doxorubicin (Adriamycin), Epirubicin ואחרים בטיפול בסרטן השד. מתן תרופות אלה, על אף הטוקסיות שלהן - במיוחד הלבבית, הביא לשיפור משמעותי בהיוותרות בחיים ללא מחלה ובהישרדות של חולות סרטן שד בשלב 2. לכן, תרופה זו הפכה להיות התרופה הכימית המחוייבת בכל משלב של טיפול כימי מסייע. המשלב המקובל היה AC (Adriamycin עם Cyclophosphamide) ב-4 עד 6 מחזורים אחת לשלושה שבועות. המשלב עם אנטראציקלינים מקנה יתרון נוסף של 5%-4% בהישרדות, בהשוואה לטיפולי כימותרפיה אחרים. יעילות האנטראציקלינים ניכרת במיוחד בתת קבוצה של החולות עם Her2 חיובי ונוכחות של Topoisomerase2a.
המהפכה השלישית היא הופעת תרופות מקבוצה חדשה - הטקסנים (Taxanes). מקור התרופה היה בקליפת עץ, אולם כיום היא מיוצרת באופן סינתטי. דרך פעולת ה-Paclitaxel (Taxol) שונה מזו של תרופות כימותרפיות אחרות. מכאן, חשיבותה של התרופה במקום שבו החולה לא הגיבה לתרופות האחרות. כאשר תאים נורמלים מתחילים להתחלק, נוצרות צורות הנקראות מיקרוטובולים (Microtubules). אותם מיקרוטובולים נשברים או נהרסים כאשר התאים הנורמלים חדלים להתחלק. במקרה של תאי סרטן, ה-Paclitaxel מפסיק את הריסתם של המיקרוטובולים. תאי הסרטן נחסמים על ידי המיקרוטובולים, ולכן אין ביכולתם להתרבות ולגדול. מחקרים הראו ששילוב 4 מחזורים של AC, שלאחריו נתנו טקסנים ב-12 מנות שבועיות, שיפר את אחוזי התגובה הקליניים (25% במעקב חציוני של 30 חודשים ), אבל במיוחד את אחוזי החולים שבהם דווח על היעלמות מלאה פתולוגית של תאי השאת בטיפול טרום ניתוחי (34% לעומת 16%). עבודות מחקר חדשות הראו שמשלב של טקסנים עם Cyclophosphamide (TC) נתן תוצאות דומות ל-AC בתוספת טקסנים, עם רעילות נמוכה יותר וסבילות גבוהה יותר, אפילו בנשים מאוד מבוגרות. ממצאים אלה מעלים את השאלה בצורך באנטראציקלינים בטיפול המשלים בסרטן השד.
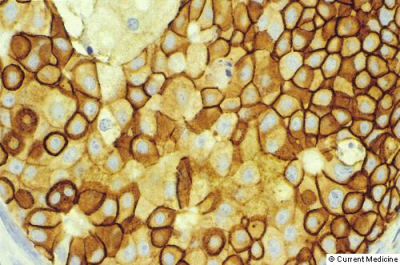
המהפכה האחרונה היא פיתוח תרופות הנקראות תרופות ביולוגיות. קבוצה אחת, הקרויה בשם הגנרי Trastuzumab, מיוצגת אצלנו בשם המסחרי Herceptin. Trastuzumab משתייך לקבוצה חדשה של תרופות נגד סרטן הנקראים נוגדנים חד שבטיים. פעולתו מתבצעת על ידי התערבות באחד מהמנגנונים שבאמצעותם תאי סרטן שד מתחלקים. תאי סרטן שד מקבלים גירוי להתחלק, כאשר חלבון שהוא גורם גדילה (Human epidermal growth factor) נצמד לקולטן שנמצא על ממברנת התא ולו קטע (Domain) חוץ ממברנלי אליו נקשר גורם הגדילה וקטע פנים ממברנלי המגיב בשרשרת פעולות ביוכימיות בציטופלסמה לקשירה החוץ תאית. קולטן זה נקרא Her2 (לפעמים נקרא CerbB2). קיימים ארבעה קולטנים מסוג זה היכולים לפעול בזוגות או כבודדים. Trastuzumab בולם פעולה זו על ידי כך שהוא נקשר ל-Her2 וחוסם אותו מבלי להפעילו. כך, גורם הגדילה לא יכול לפעול על תאי סרטן השד, ונעצרת החלוקה וההתפשטות של התאים. ה-Trastuzumab פועל גם בכך שהוא מושך אליו את תאי המערכת החיסון, כדי שיסייעו להרוס את תאי הסרטן. פעולת ה-Trastuzumab תלויה ברמת הקולטן על ממברנת התא - ככל שהרמה גבוהה יותר, כך הפעולה משמעותית יותר. לכן, תרופה זו מוגבלת רק לחולות המוגדרות כ- Her2 חיוביות. מדידת הרמה של חלבון Her2 יכולה להתבצע על חומר טרי או ישן מקובע מניתוחים קודמים. הבדיקה הראשונה המתבצעת היא בדיקת צביעה בשיטת האימונו-היסטו-כימיה (IHC)(תמונה 61.12).
אם בצביעה נצבעים מעל ל-30% מהתאים היא נקראת +3 חיובית. אם הקריאה היא נמוכה, הרי היא מוגדרת +1 או 0. בין קבוצות אלה יש קבוצת ביניים המוגדרת +2, המחייבת ביצוע בדיקה נוספת בשיטת FISH (Fluorescence in situ hybridization). אם היא חיובית, החולה מוגדרת +3. מחקרים הראו שרק נשים עם ביטוי חזק של Her2 (+3) מגיבות לטיפול ב-Trastuzumab, המתבטא בירידה בשיעורי הישנות המחלה ובעליה בהישרדות. באישה אחת מתוך ארבע חולות סרטן שד נמצא קולטני Her2 חיובים. ה-Trastuzumab ניתן בשילוב עם AC ו-Paclitaxel, כאשר השיטה המועדפת היא מתן המשכי של Trastuzumab לשנה לאחר מתן ה-ACT בדרך שתוארה קודם לכן. Trastuzumab נמצא יעיל גם בחולות סרטן שד מתקדם כתוספת לטיפול טרום ניתוחי מקובל באנטראציקלינים בשילוב עם טקסנים. נמצא שתוספת זו מעלה את שיעורי היעלמות השאת קלינית ופתולוגית בצורה משמעותית. תופעות הלוואי הקשורות בתרופה הן: תסמינים דמויי-שפעת, תגובה אלרגית, כאבי גוף קלים, שלשול, כאבי ראש והשפעות על תפקוד הלב. ה-Bevacizumab (Avastin, Anti-VEGF) הוא למעשה נוגדן מונוקלונאלי הנוגד איזופורמים של VEGF-A(Vascular endothelial growth factor). התרופה נמצאת היום בתהליך מחקר, שבו משווים מתן Paclitaxel עם Bevacizumab לעומת Paclitaxel בלבד. תוצאות ראשוניות מראות יתרון ברור ל-TA. תרופה נוספת ביולוגית הנכנסת לשוק התרופות היא ה-Lapatinib, הגורמת לדיכוי Tyrosine kinase ופועלת בחולות העמידות ל-Bevacizumab שלהן ביטוי יתר של Her2. תרופה זו מאושרת כיום לחולות עם שאת גרורתית.
בכנסים האונקולוגים האחרונים, הוצגו עבודות ראשונית המראות כי ניתן לוותר על האנטראציקלינים ולתת לחולות משלבי של טקסנים עם Cyclophosphamide או Capecitabine (Xeloda) ואחרים.
תחנה נוספת בהתפתחותו של הטיפול המסייע היא השימוש ב- Dose dense chemotherapy. משמעותה של שיטה זו היא מתן מנות של אותה כימותרפיה במרווחי זמן קצרים יותר. המחיר של שיטה זו הוא רעילות יותר גבוהה בעיקר המטולוגית כמו נויטרופניה ועייפות. יתרון השיטה הוא בהשגת תוצאות טובות יותר - 80% מהחולות שורדות ללא הישנות במעקב של שלוש שנים. גישה אחר היא מתן Dose intensity, מינון גבוה של התרופה לפעמים עד פי 6 מהמינון המקובל הגורם להרס של השורה המיאלואידית של מוח העצם ולכן דורש השתלת תאי אב (מוח עצם) לאחר הטיפול. שיטה זו יעילה רק בפלח קטן יחסית של חולות סרטן שד, וסיבוכיה רבים כולל תמותה משמעותית.
לגבי זמן התחלת הטיפול, העבודות מצביעות על כך שהתוצאות הטובות ביותר הן כאשר מתחילים את הטיפול סמוך ככל האפשר לניתוח. כריתת השאת והקטנת מסת השאת גורמים להאצת הגדילה של הגרורות המיקרוסקופיות, כלומר רוב התאים מתחלקים מהר יותר, ולכן יש לתת את הטיפול מוקדם ככל האפשר, ובמינון גבוה, בשלבים הראשונים של הטיפול.
לגבי מנת הטיפול, כעיקרון, ככל שהמנה גדולה יותר הישגי הטיפול טובים יותר. כאשר עומס השאת קטן, קיים סיכוי להצליח גם במנות קטנות. בעומס שאתי רב, רק מנה מירבית יש בכוחה להשמיד את תאי השאת. בטיפול המשולב יש לשקול את המינון של כל תרופה. לדוגמה, הורדה קטנה במינון ה-Cyclophosphamide תוריד את יעילות התרופה במידה ניכרת. לעומת זאת, הורדת המינון של ה-Fluorouracil מורידה את היעילות בצורה מתונה בלבד.
משך הטיפול הכימי המסייע, אותו יש לתת, אינו ברור. יש להמשיך בטיפול תקופה ארוכה יחסית מאחר שזמן הכפלת תאי הסרטן ארוך. עבודות מצביעות על כך שייתכן שהפעולה העיקרית מבחינת הרס התאים מתרחשת בעיקר בששת החודשים הראשונים לטיפול, ולכן כנראה אין טעם לתת טיפול מעבר לטווח זה. בדרך כלל נותנים מחזור טיפול אחת ל-3 שבועות, ומכיוון שזמן הכפלת המסה הממוצע הוא 69-56 ימים, הרי הסכנה, שתוך מחזור טיפול זה יצמחו תאי שאת - קטנה.
קיימים לבטים לגבי הסדר שבו יש לתת את הטיפולים השונים לחולות העוברות כריתת גוש בשד (למפקטומיה). האם יש לתת קודם את הכימותרפיה ולאחר מכן את ההקרנות או להפך. בעבודות שבדקו את השאלה הזו נמצא ששיעור החזרות המקומיות של חולות שקיבלו קודם כימותרפיה ואחר הקרנות, היה גבוה יותר אך שיעור הגרורות המרוחקות היה נמוך יותר. כאשר החולות קיבלו קודם הקרנות ולאחר מכן טיפול כימי המצב היה הפוך: יותר גרורות מרוחקות ופחות חזרות מקומיות. לכן ההמלצה כיום היא להתחיל בטיפול כימי ולאחר מכן בטיפול קרינתי. השילוב בין השניים קשה לחולות, מה עוד שחלק מהתרופות מגבירות את השפעת הקרינה על העור (Radiosensitizer) ומחמירות את הנזק הקרינתי.
טיפול הורמונלי מסייע
Tamoxifen: בפרוטוקול של 09-NSABP-B נבדקה השפעת ההוספה של Tamoxifen לטיפול מונע כימי (Melphalan ו- Fluorouracil). נמצא שהוספת ה-Tamoxifen שיפרה בהרבה את ההיוותרות בחיים של חולות בעלות קולטני אסטרוגן חיוביים שקיבלו את הטיפול המשולב. בחולות בעלות קולטנים שליליים לא נמצא שיפור בפרוגנוזה. בחולות בנות 50 שנה ומעלה ההיוותרות בחיים היתה טובה יותר מאשר בחולות צעירות יותר. בחולות בנות 50 שנה ומטה, בעלות קולטנים שליליים, נעלם היתרון המושג על-ידי מתן תוספת טיפול הורמונלי. ככל שמספר הבלוטות גדול יותר התוצאות המושגות טובות יותר.
לסיכום, מפרוטוקולים קליניים מבוקרים נמצא שתוספת Tamoxifen לטיפול הכימי המסייע היא יעילה. היא קשורה בגיל וברמת הקולטנים להורמונים: בתקופת הבלות היא יעילה, ויעילותה עולה עם כמות הקולטנים החיוביים. ניתן להשיג תועלת מעטה גם כאשר אין קולטנים להורמונים. בתקופת הפוריות, לעומת זאת, מתן Tamoxifen הביא תועלת רק כאשר נמצאו קולטנים להורמונים.
הוריות (אינדיקציות) לטיפול מסייע
השאלה הנשאלת היא מי מבין החולות בסרטן בשד זקוקות לטיפול מסייע? ההמלצות הן:
- כל החולות המוגדרות כשלב 3.
- חולות בשלב 2:
- ללא קולטנים לאסטרוגן או עם Her2 חיובי, עם או ללא בלוטות נגועות תקבלנה טיפול כימי מסייע.
- חולות בגיל הבלות שלהן קולטני אסטרוגן ופרוגסטרון חיוביים תקבלנה טיפול אנטי-אסטרוגני מסייע.
- חולות ללא בלוטות נגועות עם קולטנים חיוביים אולם עם מרכיבים פרוגנוסטיים גרועים כמו: שאתות הגדולות משלושה ס"מ, דרוג פתולוגי 3, צעירות מגיל 35 ועוד.
- כל החולות עם קולטנים חיובים לאסטרוגן שקיבלו טיפול כימי מסייע יקבלו טיפול אנטי-אסטרוגני לחמש שנים לפחות.
- חולות בשלב 1 : חולות אלה עם קולטנים חיובים לאסטרוגנים תקבלנה טיפול מסייע אנטי אסטרוגני. חולות עם גורמים פרוגנוסטיים גרועים תקבלנה טיפול כימי מסייע, שלאחריו טיפול אנטי אסטרוגני לחמש שנים. כיום הנטייה היא להאריך טיפול זה ל- 10-7 שנים.
בדיקה חדשה המסייעת כיום לפלח חולות לקבוצות שתקבלנה או לא טיפול מסייע כימי היא האונקוטייפ (Oncotype DX) והממפרינט (Mammaprint). הבדיקות הללו מבוססות על הפרופיל הגנטי של הגידול ומסוגלות לזהות פרופילים "טובים" או "רעים". פרופילים רעים הם הפרופילים שבהם נמצאו הרבה שינויים ברמה הגנטית, ואילו פרופילים טובים הם אלה שבהם נמצאו מעט שינויים. במסגרת המחקר הצליחו לבודד מספר מצומצם של גנים שלהם חשיבות בקביעת הפרופיל הגנטי של השאת. האונקוטייפ בוחנת את הפרופיל הגנטי באמצעות ניתוח של רמת הפעילות של 21 גנים הנמצאים על שבב, ואילו הממפרינט בוחנת את הפרופיל הגנטי של הגידול באמצעות ניתוח של רמת הפעילות של 70 גנים מתוך דגימה של הגידול. לצורך בדיקת האונקוטיפ, ניתן להשתמש ברקמה שעברה שיקוע בפרפין (לא טריה), ואילו לממפרינט דרושה דגימה רקמה טריה המקשה מבחינה טכנית על לקיחתה. האונקוטיפ נמצאה מאוד מדוייקת בחיזוי הישנות המחלה והצורך במתן טיפול כימי מסייע בחולות עם קולטנים חיובים לאסטרוגן וללא בלוטות נגועות. בדיקה זו מהווה כיום בדיקה שגרתית בחולות שהגדרנו, והיא מסייעת בהחלטה האם החולה תקבל טיפול כימי מסייע או אנטי-אסטרוגני בלבד. מחקרים חדשים ביותר מראים שגם בחולות עם קולטנים לאסטרוגנים שליליים ניתן לפלח בעזרת הממפריט לקבוצות עם סיכויי הישנות גבוהים ונמוכים. ההשערה היא שהקבוצה בעלת הסיכוי הנמוך לפתח גרורות לא זקוקה לטיפול כימותרפי. עבודות דומות נעשות היום בניסיון לזהות קבוצות עם בלוטות חיוביות שלא יהנו מכימותרפיה.
הטיפול המסייע הכימי או האנטי אסטרוגני מהווים יסוד בטיפול בסרטן השד אולם הם מעוררים שאלות חשובות במיוחד בחולות עם סרטן שד מוקדם. נשאלת השאלה האם הטיפול אכן משפר את ההישרדות בחולות אלה? התשובה לכך בחולות סרטן שד מוקדם אינה ברורה, וכנראה שלא. הטיפול כן משפר את תקופת תסוגת המחלה. המחיר הנדרש מבחינת החולה הוא גבוה, שכן הטיפול הכימי המסייע כרוך בסיבוכים כולל תמותה, לעומת הסיבוכים הקלים יחסית והנסבלים של הטיפול האנטי-אסטרוגני, שאין חולק כיום שיש לתת אותו לכל החולות עם קולטנים חיובים לאסטרוגן. המחיר הכללי הוא עצום ומגיע למאות מליוני דולרים בשנה בארה"ב ובמחיר של 50 -100 חולות שימותו מהסיבוכים. לכן, כל הניסיונות לפלח את החולות לכאלה שייהנו מהטיפול ולכאלה שלא שוות את ההשקעה.
Tamoxifen כטיפול בסרטן השד
ה-Tamoxifen הינו תרכובת Triphenylethylene אשר פותח במסגרת מחקרים שעסקו בחיפוש אחר אנטגוניסטים לאסטרוגן שישמשו כמונעי הריון (Contraceptive) בתחילת שנות החמישים והשישים. התוצר הראשון שיוצר אז היה ה-Ethamoxytriphetol (ה-MER-25) אשר לא הוכנס לשימוש עקב פעילותו הנמוכה ורעילותו הגבוהה. מאז פותחו מספר תכשירים אנטי-אסטרוגנים מאותה קבוצה: Nafoxidine, Tamoxifen, ו-Clomifene, אשר נמצאו יעילים כאנטי-אסטרוגנים ואשר רעילותם נמצאה נמוכה, במיוחד זו של ה-Tamoxifen.
Jensen וחבריו ב-1967 הם הראשונים המדווחים בספרות על השימוש ב-Tamoxifen כתכשיר אנטי-אסטרוגני לטיפול בסרטן השד. מאז דיווח זה רבו הפרסומים על יעילות ה-Tamoxifen בטיפול בסרטן השד. העבודה הראשונה שהדגימה יעילות זו היה מחקר של NATO (Novadex adjuvant trial organisation) אשר הראה בעבודה אקראית גדולה עם מעקב ארוך שיפור משמעותי סטטיסטי בהיוותרות בחיים ל-5 שנים בחולות שטופלו ב-Tamoxifen למשך שנתיים. ממצאיה של עבודה זו אושרו גם בעבודות רבות אחרות שהתפרסמו בספרות. ה-Tamoxifen פותח כתכשיר אנטי-אסטרוגני הפועל ישירות על הקולטן לאסטרוגן התוך תאי ומונע על-ידי כך את קשירת האסטרוגן לקולטן ואת תגובת השרשרת המטבולית הנוצרת בעקבות קשר זה. מחקרים הראו שפעילות ה-Tamoxifen היא יותר מורכבת ממה שנראה מהמודל הפשוט שהוצג. עבודות מצביעות על כך שה-Tamoxifen פועל גם דרך פקטורי הגדילה (Growth factors). במיוחד מושפע על-ידי ה-Tamoxifen ה-TGF-beta (Transforming growth factor beta), אשר בעיקר מעכב צמיחת תאי סרטן שד בתרבית רקמה ופרוליפרציה של לימפוציטים, אולם מעודד צמיחה של פיברובלסטים ותאי אנדותל. בתאי סרטן שד מסדרה 7-MCF ניתן להראות עיכוב בגדילה על-ידי Tamoxifen, ובמקביל עלייה של פי 27 ברמות ה-TGF-beta, וזה האחרון יכול לעכב צמיחת תאי סרטן שד שהם קולטנים שליליים לאסטרוגן (-ER). עבודות אחרות מצביעות על הקשר שבין ייצור פקטור הגדילה TGF-alpha לבין ייצור פיברובלסטים ברקמת השד. ממצא זה מסביר מדוע ה-Tamoxifen משפיע על שאתות מזנכימליות. ל-Tamoxifen יש גם דרכי פעולה אחרות כפי שמדווח בספרות כמו עיכוב ה- Calmodulin mediated cell proliferation ובדרך זו מעכב צמיחת תאים.
בשנים האחרונות נמצא של-Tamoxifen גם השפעה אסטרוגנית על איברים אחדים בגוף. חולות שקיבלו Tamoxifen הראו פחות ספיגת עצם בהשוואה לקבוצת ביקורת שלא קיבלה Tamoxifen. כנראה ה-Tamoxifen משפיע על האוסטאוקלסטים ומאט את פעולתם ומשפיע גם על האוסטאובלסטים דרך פקטור הגדילה.
תוצאות הטיפול המשלים ב-Tamoxifen למשך חמש שנים בשאתות עם קולטנים חיוביים להורמונים, מראים כי הטיפול מוריד לחצי את אחוז החזרות של המחלה בזמן הטיפול. תוצאה זו נשמרת מספר שנים לאחר הפסקת הטיפול. התוצאה של הטיפול היא עוד יותר מרשימה מבחינת תמותה: התמותה יורדת בערך בשליש לאחר מעקב במשך 15-10 השנים הבאות. הטיפול המשולב (כימותרפיה + חמש שנים Tamoxifen) יותר יעיל לעומת טיפול כימותרפי בלבד, כדי למנוע חזרה של סרטן השד ותמותה ממנו. Tamoxifen הניתן לחמש שנים מוריד את הסיכון השנתי למוות ב-26% וזאת ללא הבדל בין נשים צעירות למבוגרות, וללא קשר עם כן או לא קיבלו כימותרפיה. השפעת ה-Tamoxifen עולה ביחס לריכוז של קולטני האסטרוגן בשאת. בנשים עם רמות גבוהות של קולטנים, הירידה המדווחת היא של 60%, בעוד שבריכוז קולטנים נמוך הירידה היא בכ-43%. בחולות ללא קולטנים אין כמעט תגובה ל-Tamoxifen. משך המתן המומלץ הוא חמש שנים. במחקר ה-ATLAS, שבו חולקו נשים באופן אקראי למתן Tamoxifen לחמש או עשר שנים, נמצא בנתונים שפורסמו ב-2007 שמסתמן יתרון לקבוצה שהמשיכה עשר שנים לעומת חמש שנים.
מספר עבודות בדקו את יעילות ה-Tamoxifen למשך שנתיים וחמש שנים ומצאו שמתן ה-Tamoxifen ל-5 שנים מקנה תוצאות טובות יותר מאשר לשנתיים, בעוד שהמינון של 20 מ"ג או יותר אינו משנה. בשנים האחרונות, עקב השימוש הנרחב יותר ב-Tamoxifen, נבדקו גם השפעות לוואי אחרות שלו. נמצא שנשים שקיבלו Tamoxifen הראו נטייה לספיגת עצם מופחתת בהשוואה לקבוצת הביקורת. התמותה ממחלות קרדיווסקולריות פחתה בצורה משמעותית בקבוצת ה-Tamoxifen וכן נמצאה ירידה משמעותית בתמותה שלא מסרטן בקבוצה זו. נמצאה ירידה בשכיחות נגעים ממאירים בשד השני בנשים שקיבלו Tamoxifen. תוצאות מחקר ה"אטלס" שפורסמו הראו שטיפול אדג'ובנטי בטמוקסיפן ל-10 שנים יעיל יותר בהשוואה ל- 5 שנים, ומוריד את הסיכון לתמותה מסרטן שד ב-50% לעומת 31%. הסיכונים מהארכת הטיפול לסרטן האנדומטריום ולתופעות טרומבואמבוליות היה נמוך. כתוצאה ממחקר זה התקבלה המלצה להארכת הטיפול האדג'ובנטי בטמוקסיפן ל-10 שנים לאותן חולות המקבלות טמוקסיפן בלבד.
כל היתרונות הללו הביאו לפתיחת עידן חדש של ניסויים אשר מטרתם לבדוק את יעילות ה-Tamoxifen במניעת סרטן השד בנשים המוגדרות כנמצאות בסיכון גבוה. עבודות ראשוניות בנושא של Cusick וחבריו הראו שאכן ניתן להפחית את מספר החולות בסרטן השד על-ידי שימוש ב-Tamoxifen כטיפול מונע. בעקבות זאת בוצעו מחקרים שתמכו במסקנה זו ומתן Tamoxifen למניעה הפך למקובל (ראה פרק מניעת סרטן השד).
תופעות הלוואי עקב שימוש ב-Tamoxifen קלות בדרך כלל ושיעורן נמוך, אך אם יהיה שימוש נרחב בתרופה, ייחסו לתופעות הלוואי חשיבות רבה. התופעות השכיחות ביותר הן גלי חום (Hot flashes), בחילות והרגשה רעה, המופיעות בכ-25% מהחולות המטופלות, אולם רק לעתים רחוקות תופעות אלה מחייבות הפסקה של הטיפול. הפרעות במחזור, דימום לדני, הפרשות מהלדן וגרד בפות שכיחים פחות. יתר סידן בדם (היפרקלצמיה), בצקת פריפרית, דיכאון, חוסר תיאבון, כאבי ראש - מדווחים בשיעורים נמוכים. מיעוט טסיות (תרומבוציטופניה), מיעוט תאי דם לבנים (לויקופניה), היווצרות ירוד (קטרקט), שינויים בקרנית ופגיעה ברשתית (רטינופתיה) - מדווחים במספר עבודות, כאשר השכיחות המדווחת היא אחת ל-1000 מטופלות. העלייה בשכיחות התופעות התרומבואמבוליות מיוחסת לירידה באנטי תרומבין 3.
בסקירה רחבה של הספרות על מתן Tamoxifen לחולות הנמצאות בשלב מתקדם של סרטן השד מדווח על 11 חולות מתוך 1,122 חולות אשר פיתחו תופעות של דלקת וריד (Thrombophlebitis). בסדרות אחרות, קטנות יותר, מדווחים על מקרים של תסחיפים לריאה בעקבות טיפול ב-Tamoxifen. בנוסף מדווחים בספרות תיאורי מקרים של חולים שפיתחו פקקת של העורק המזנטריאלי העליון (Superior mesenteric artery), פקקת של המערכת הווורידית העמוקה, פקקת של אבי העורקים ותסמונת של קרישה מפושטת בתוך כלי הדם.
Raloxifene היא תרופה מקבוצה של המודולטורים לרצפטור לאסטרוגן, בדומה ל-Tamoxifen, אולם ללא השפעה על רירית הרחם ולכן לא גורמת לסרטן רירית הרחם. השימוש הראשון שלה היה למניעת אוסטאופורוזיס אולם עבודות בשנים האחרונות הראו שהיא גם יעילה במניעת סרטן השד. בהיותה סלקטיבית ה-Raloxifene מקטינה את רמת השומנים בדם ואת התופעות התרומבואמבוליות ולכן תחליף בעתיד את ה-Tamoxifen.
מעכבי ארומטאז (Aromatase inhibitor, AI)
תרופות מקבוצת מעכבי ארומטאז שייכות לקבוצה של התרופות האנטי-הורמונליות, והן מעכבות את יצור האסטרוגן. האנזים ארומטאז הוא אנזים חשוב בתהליך הפיכת הסטרואידים בכל תחנות היצירה של האסטרוגן (שחלות, אדרנלים ושד). אנזים הארומטאז הוא קומפלקס של אנזימים אשר אחראי למעבר מטבולי של טסטוסטרון ודומיו לאסטראדיול (E1, E2). עיכובו מוריד עד לרמות אפסיות את האסטרוגן במחזור הדם ועל ידי כך קולטן האסטרוגן אינו מופעל, ובעקבות זאת שרשרת התהליכים (Cascade) המטבולית שהוא מעורר אינה מופעלת. לכן, מתן מעכבי ארומטז מעקב את צמיחת התא השאתי. בנשים צעירות, רמת הארומטז גבוהה יחסית ולכן העיכוב של מעכבי הארומטז אינו טוב כשרמת האסטרוגן בדם גבוהה. קיימים מספר סוגים של מעכבי ארומטאז: מעכבים לא סטרואידליים הפיכים וסטרואידיים בלתי הפיכים. ה-Anastrozole וה-Letrozole שייכים לקבוצה הראשונה ו-Exemestane שייך לקבוצה השנייה. ל-Exemestane יש שני יתרונות:
- היא גורמת לחוסר פעילות של האנזים שלא דרך עיכוב תחרותי ובכך אינה מאפשרת את התאוששות הארומטז. מנגנון זה עשוי להתגבר על עמידות לתרופות מן הקבוצה הראשונה.
- היות והתרופה היא סטרואידית, יכולה להיות לה השפעה מיטיבה-ואנבולית על העצם ועל פרופיל השומנים, וזאת בניגוד לתרופות האחרות.
בתחילה הושוו מעכבי הארומטז מול תכשירי קו שני ונמצאו שיעורי תגובה טובים יותר ל-Letrozole על פני המגאסטרון, כולל יתרון בשיעורי ההישרדות. עבודות המשוות בין Tamoxifen בקו ראשון לבין מעכבי ארומטז בקו ראשון מראות תגובה טובה יותר בחולות עם סרטן שד מתקדם שטופלו במעכבי ארומטז. בחולות עם סרטן שד מוקדם המקבלות טיפול אנטי-אסטרוגני מסייע נמצא תגובה שווה ואף טובה יותר עם מעכבי ארומטז ולכן הם נכנסו היום לשגרת הטיפול המסייע בחולות סרטן שד בשלב מוקדם. מקובל לתת שנתיים Tamoxifen ושלוש שנים מעכבי ארומטאז. בשיטה זו, התוצאות המושגות זהות לחמש שנים של מעכבי ארומטז אולם תופעות הלוואי קטנות משמעותית. הירידה ברמת האסטרוגן קשורה במספר תופעות לוואי כמו ירידה במסת העצם מלווה אוסטאופורוזיס מתקדמת, כאבי שרירים ומפרקים. בגלל השימוש הקצר יחסית בתרופה לסרטן שד הניסיון המצטבר בתופעות הלוואי של התרופה הולך וגובר.
טיפול אנטי שחלתי כטיפול מסייע (Adjuvant) בסרטן שד בשלב מוקדם
האפשריות לטיפול אנטי שחלתי הן: כירורגית (כריתת שחלות), קרינה ותרופתית (Luteinizing hormone releasing hormone (LHRH) agonists). במטה אנליזה שכללה 12 מחקרים אקראיים נמצא שטיפול אנטי שחלתי אינו יעיל בנשים שלאחר הבלות. לעומת זאת, בצעירות יש יתרון ברור לאחר הוספת טיפול זה: ירידה בחזרת המחלה ב-25% וירידה של 25% בעודף תמותה (Odd ratio). הוספת כימותרפיה לחולות אלה לא הוסיפה על ההישגים של טיפול שחלתי בלבד. נכון להיום, ההמלצה לגבי נשים צעירות עם קולטני אסטרוגן חיוביים בשאת ובסיכון גבוה לחזרת המחלה להוסיף טיפול אנטי שחלתי פרמקולוגי למשך שנתיים, בנוסף לטיפול טיפול כימותרפי ו-Tamoxifen. בנשים בסיכון נמוך אפשר להסתפק בכריתת שחלות (Oophorectomy) בתוספת ל-Tamoxifen.
ראו גם
- לנושא הקודם: טיפול קרינתי בסרטן השד - Radiation therapy for breast cancer
- לנושא הבא: מניעת סרטן שד - Breast cancer prevention
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: כירורגיה של הטחול
- לפרק הבא: בקעים
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק