יחס בטא-עמילואיד - Beta-amyloid ratio
| מדריך בדיקות מעבדה | |
| יחס עמילואיד-בטא | |
|---|---|
| Beta-amyloid ratio | |
| Abeta 2lfm.jpg | |
| מעבדה | כימיה ב-CSF ובפלזמה. |
| תחום | מחלת אלצהיימר וניוון נוירונלי. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
סיוע בהערכה של מטופלים מבוגרים, בני 55 שנה ומעלה, בעלי הפרעה קוגניטיבית ונבדקים למחלת אלצהיימר. בדיקה זו אינה מיועדת להיות בדיקת סקר או בדיקה יחידנית. הבדיקה מודדת את היחס של beta-amyloid בנוזל השדרה (1-42/1-40). בדיקה זו מהווה עזר לנוכחות רבדים של עמילואיד, הנוצרים על ידי שקיעה מוגברת של beta-amyloid 1-42 במוח. הבדיקה מיועדת לבני 55 שנה ומעלה, ואינה מדווחת על ריכוזים אינדיבידואליים של בטא-עמילואיד 1-42 או 1-40.
מחלת אלצהיימר (להלן AD) היא הצורה השכיחה ביותר של שיטיון, ומהווה 60-80% מכל תסמיני השיטיון (Lane וחב' ב-Eur J Neurol משנת 2018) . המחלה מוגדרת נוירו-פתולוגית על פי הנוכחות של רבדי עמילואיד β- ושל סבכים (tangles) נוירו-פיברילריים של חלבון tau מזורחן-ביתר (Masters וחב' ב-Proc Natl Acad Sci USA משנת 1985, ו-Jack וחב' ב-Alzheimers Dement משנת 2018). בשנת 2018 פרסם המכון הלאומי להזדקנות ולמחלת אלצהיימר מספר סמנים לאבחון של AD, כולל רמה נמוכה של Aβ(1–42) ב-CSF והדמיית PET בקליפת המוח, רמה מוגברת ב-CSF של tau 181 מזורחן (להלן pTau181) רמה של סך tau ב-CSF, היפו-מטבוליזם של fluorodeoxyglucose-PET-[[F18] כסמנים של נוירו-דגנרציה (Hatashita וחב' ב-Eur J Nucl Med Mol Imaging משנת 2014). מספר האנשים עם AD גדל בצורה דרסטית בעשורים האחרונים. היפותזת הקסקדה העמילואידית מייחסת תפקיד חיוני לחלבון העמילואיד (Aβ) בפתוגניות של AD. כיוון שהתרחיש הפתולוגי העיקרי של AD הם הרבדים העמילואידיים, המכילים את הווריאנטים של 42 ו-40 חומצות אמינו (Aβ42 ו- Aβ40. הסמן Aβ42/40 ב-CSF נחקר באינטנסיביות והפך להיות כלי אבחוני ב-AD. היחס של Aβ42/40 ב-CSF מצוי בהתאמה טובה עם ממצאי PET חיוביים של עמילואיד טוב יותר מאשר תוצאה יחידנית של Aβ42 (Amft וחב' ב-Alzheimer's Res Ther משנת 2022).
מידע קליני
אחד המאפיינים הנוירופתולוגיים שמוצאים במוחות של מאובחנים עם AD היא הנוכחות של רבדים של beta-amyloid. שני הפפטידים הבטא-עמילואידיים הם 1-40 ו-1-42. בטא-עמילואיד 1-40 מופיע בריכוז פיזיולוגי גבוה יותר מזה של בטא-עמילואיד 1-42. ב-AD ההצטברות של בטא-עמילואיד 1-42, או כתוצאה מיצירת-יתר או בגלל פינוי נמוך יותר, מובילה להתגבבות שלו לתוך רבדים ולנוירו-טוקסיות. לעומתו, בטא-עמילואיד 1-40 נוטה פחות לאגרגציה עם רמות הנוטות להישאר ללא שינוי, כאשר משווים חולי AD לנבדקים בריאים. בנוזל השדרה (CSF) ירידה של בערך 50% בריכוזי בטא-עמילואיד 1-42, נמצאה בחולי AD בהשוואה לריכוזים שמוצאים באנשים עם קוגניציה נורמלית. נתון זה נחשד כתוצאה מהירידה בבטא-עמילואיד המסיס 1-42 בנוזל האינטרסטיציאלי במוח, כאשר פפטיד זה הופך יותר בלתי מסיס ויוצר מספר גדול של משקעים בצורת רבדים נויריטיים ודיפוזיים. בניגוד לבטא-עמילואיד 1-42, הערכים של בטא-עמילואיד 1-40 ב-CSF נותרים יציבים יחסית בבני אדם ללא קשר לפתולוגיה של העמילואיד (Dumurgier וחב' ב-Alzheimers Res Ther משנת 2015, ו-Gervaise-Henry וחב' ב-J Alzheimers Dis משנת 2017).
מחקרים שונים הראו שהשימוש ביחס של בטא-עמילואיד 1-42/1-40, מגדיל את הדיוק האבחוני של AD בהשוואה למדידה יחידנית של בטא-עמילואיד 1-42. היחס בין 1-42/1-40 של בטא-עמילואיד נמצא במתאם גבוה עם בדיקת positron emission tomography (להלן PET) כאשר מבדילים בין שקיעת עמילואיד כתוצאה מ- AD לעומת החלופה של פגיעה קוגניטיבית קלה או שיטיון שאינו AD. בנוסף, בדיקת היחס 1-42/1-40 של בטא-עמילואיד יכולה להקל באופן חלקי את השפעת ערפילנים קדם-אנליטיים שעלולים לשנות את התוצאות של בטא-עמילואיד 1-42 ב-CSF (Toombs וחב' ב-Alzheimers Dement משנת 2018). הערך הנורמלי של Beta-Amyloid Ratio (1-42/1-40) שווה או גדול מ-0.073 (Wiltfang וחב' ב-J Neurochem משנת 2007).
אינטרפרטציה
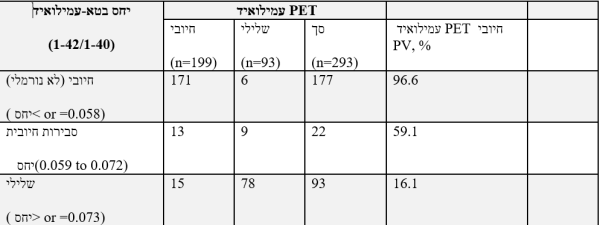
יחס נורמלי של בטא-עמילואיד (1-42/1-40) של 0.073 ומעלה, תואם תוצאה נורמלית-שלילית של סריקת PET. תוצאה זו מצביעה על סבירות מופחתת שהפגיעה הקוגניטיבית היא כתוצאה מ-AD. יחס בטא-עמילואיד (1-42/1-40) שבין 0.059-0.072 (שנראה חיובי) נראה במתאם טוב עם תוצאת סריקת PET חיובית. תוצאה שנראית חיובית זו אינה מבססת אבחון של AD או של מפגע קוגניטיבי אחר, ויש לה אי-ודאות מוגברת בהקשר של תוצאת עמילואיד חיובית ב-PET. יחס לא נורמלי של בטא-עמילואיד (1-42/1-40) שמתחת ל-0.058 נמצאת במתאם טוב עם תוצאת PET חיובית (לא נורמלית). גם תוצאה זו אינה מבססת אבחון של AD או של מפגע קוגניטיבי אחר. ההשוואה בין יחס בטא-עמילואיד (1-42/1-40) לתוצאת עמילואיד ב-PET מודגמת בטבלה למטה כערך ניבוי חיובי של amyloid PET תחת הביטוי המקוצר PV או Predictive Value.
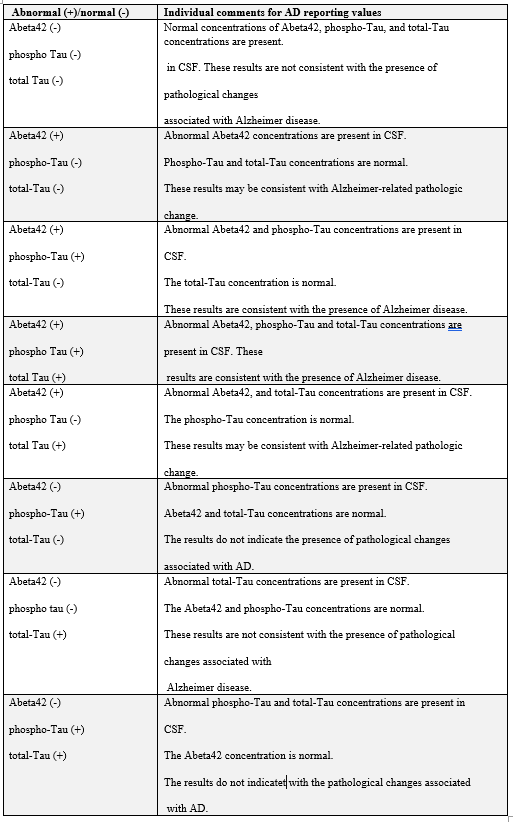
תוצאת בטא-עמילואיד (1-42; Abeta42) הגבוהה מ-834 פיקוגרם/מיליליטר תואמת תוצאה שלילית של סריקת PET של עמילואיד, המצביעה על אי-נוכחות או על נוכחות מועטה של רבדים נויריטיים, ומתאימה לאבחון נוירו-פתולוגי של AD. סך-Tau (t-Tau) ו-Tau מזורחן (p-Tau181) ב-CSF בריכוז הגבוה פי-2-3 מזה שמופיע ב-AD קלה עד מתונה בהשוואה לביקורת תואמת-גיל. ריכוז של t-Tau ו/או של p-Tau181, הנמוך או שווה ל-238 פיקוגרם/מ"ל, ונמוך או שווה ל-21.6 פיקוגרם/מ"ל, בהתאמה, מפחית את הסבירות שהבעיה הקוגניטיבית של המטופל נגרמה כתוצאה מ-AD.
בטא-42 הוא פפטיד בגודל של 4,000 דלטון המכיל 42 חומצות אמינו שנוצר כתוצאה מביקוע פרוטאוליטי של חלבון טרנס-ממברנלי הקרוי amyloid precursor protein. כתוצאה מהאופי ההידרופילי שלו, Abeta42 הוא בעל נטייה ליצירה של אגרגטים ואוליגומרים היוצרים פיברילים המצטברים ברבדים העמילואידיים. שינויים פתולוגיים אלה ב-Abeta42 משתקפים על ידי ירידה של ריכוזי Abeta42 ב-CSF והגברה במוח של נותבים ספציפיים הנראים ב-PET של בטא-עמילואיד. Tau מופיע כ-6 איזופורמים ברקמת המוח באדם. שלושה מהאיזופורמים נוצרים על ידי slicing חלופי של ה-pre-mRNA. בדיקת total-Tau מודדת את כל האיזופורמים הללו. השינוי הבתר-תרגומי הבולט ביותר הוא הזרחון של חלבון tau במהלך הניוון הנוירולוגי, זרחון בלתי נורמלי מוביל ליצירת tangles נוירו-פיברילריים תוך תאיים המורכבים מחלבון tau שעבר זרחון-יתר ויצר אגרגטים של חלבוני Tau מזורחנים ביתר המכונים p-Tau, אשר הזרחון שלהם מתרחש על חומצת האמינו תראונין 181. שינויים פתולוגיים הכרוכים ב-AD, באים לביטוי על ידי הגברה של ריכוזי t-Tau ו-p-Tau ב-CSF. הגברה של t-Tau ב-CSF משקפת את עוצמת הנזק הנוירונלי והאקסונלי והדגנרציה, ואת המעבר המהיר משלב ה-MCI (או mild cognitive impairment) למצב של AD. השימוש במדידת סמנים ביולוגיים יכול להיות מוכח בקבוצות המטופלים הבאות:
- מטופלים עם דעיכה קוגניטיבית סובייקטיבית הנמצאים בסיכון מוגבר ל-AD.
- מטופלים עם MCI עקבי, מתקדם ובלתי מוסבר
- מטופלים עם תסמינים המרמזים על אפשרות של AD.
- MCI או שיטיון המופיעים בגיל צעיר (מתחת ל-65 שנה)
- מטופלים עם קריטריוני ליבה קליניים המתאימים ל-AD בגיל אופייני להופעת המחלה
- מטופלים בהם התסמין הדומיננטי הוא שינוי התנהגותי המתאים ל-AD כגון תסמונת Capgras, אשליות פרנואידיות, הזיות בלתי מוסברות, תסמינים לוחמניים ודיכאוניות
ערכי נורמה של הסמנים הללו ב-CSF הם כדלקמן: בטא-עמילואיד (1-42) גבוה מ-834 פיקוגרם/מ"ל, t-Tau שווה או נמוך מ-238 פיקוגרם/מ"ל, 181 p-Tau שווה או נמוך מ-21.6 פיקוגרם/מ"ל, והיחס p-Tau/Abeta42 שווה או קטן מ-0.028.
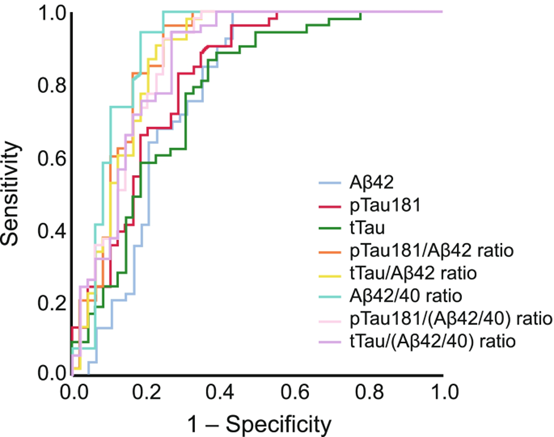
השימוש ביחס בין p-Tau181/Abeta42 מספק תאום טוב יותר עם סריקת amyloid-PET בהשוואה לשימוש יחידני ב-Abeta42, p-Tau181 ו-t-Tau. Cutofff של 0.028 מספק איזון אופטימלי בין אחוז הסכם שלילי (NPA) ובין אחוז הסכם חיובי (PPA) בהשוואה לתוצאות PET של עמילואיד. יחס p-Tau181/Abeta42 של 0.028 או פחות מכך, הוא בעל 92% NPA עם amyloid PET נורמלי. יחס הגבוה מ-0.028 הוא בעל 92% של PPA עם amyloid-PET לא-נורמלי. ריכוזים גבוהים של t-Tau ב-CSF מוצאים במחלות נוירו-דגנרטיביות אחרות כגון מחלת prion או מחלת Creutzfeldt-Jakob. במצב זה, ריכוז גבוה של t-Tau ויחס מוגבר של t-Tau/p-Tau הוא בעל ספציפיות מאוד גבוהה לאבחון מבדיל של AD. כאשר מודדים רכוזי Abeta42, p-Tai181 ו-t-Tau ב-CSF בשיטת ה-immunoassay של Elexys שעברה התאמה לשימוש באנלייזר של cobas e 411, ריכוזי Abeta40 נמדדו בשיטה לא-מסחרית של Youden, והאנליזות של ROC ושל AUC בוצעו בהשוואה ל-amyloid-PET. ההערכות של רגישות ושל ספציפיות של סמני ה-CSF והיחסים בין סמנים אלה לעומת amyloid PET נקבעו כ-0.93 ו-0.57 בהקשר של Abeta42 , 0.96 ו-0.69 בהקשר של p-Tau181/Abeta42, 0.92 ו-0.69 בהקשר של t-Tau/Abeta42, ו-0.94 ו-0.82 בהקשר של Abeta40. באשר ל-AUC - ההערכות הנקודתיות לעומת amyloid PET הן 0.78 בהקשר של Abeta42, 0.88 בהקשר של p-Tau181/Abeta42, 0.87 בהקשר של t-Tau/Abeta42, ו-0.90 בהקשר של Abeta42/40. הנוכחות של סמנים שונים קובעת את סטאטוס המחלה של כל מטופל, דהיינו כאשר המטופל הוא בעל שינוי אלצהיימרי פתולוגי בלבד, או אם הוא מוגדר כחולה ב-AD (Hansson וחב' ב-Alzheimers Dement משנת 2018). יש שתי שיטות לזיהוי in vivo של פתולוגיה של Abeta: ראשית, שיטת PET למדידת פתולוגיה של Abeta על ידי שימוש ב-tracers שונים של קישור Abeta כגון [18F]-flutenmetamol ו-[18F]-florbetapir (Pannee וחב' ב-J Neurochem משנת 2016). קיים מתאם גבוה בין ה-tracers השונים (Bittner וחב' ב-Alzheimers Dement משנת 2016), שעברו תיקוף כנגד פתולוגיה של Abeta הנמדדת על ידי גישה היסטו-פתולוגית (Shindler וחב' באותו כתב-עת משנת 2018, ו-Doecke וחב' ב-Alzheimers Res Ther משנת 2020). שנית, ניתן לזהות פתולוגיה של Abeta על ידי מדידת הריכוז של Abeta42 ב-CSF, שהיא שיטה אמינה, בעלת עלות-יעילות טובה ואף מהירה המהווה חלופה ל- amyloid-PET (Janelidze וחב' ב-Ann Clin Transl Neurol משנת 2016, Alcolea וחב' באותו כתב עת משנת 2019, ו-Albert וחב' ב-Alzheimers Dement משנת 2011).
מדידת סמנים של AD בפלזמה
הגישה של ניסיון זה נועדה לבחון את היחס של β42/Aβ40 ביכולת לנבא את הסטטוס של amyloid-PET. נלקחו שלוש דגימות של פלזמה בשלושה זמנים שונים: 176 דגימות לאחר 18 חודש מאבחון תסמיני המחלה, 169 דגימות לאחר 36 חודשים, ו-135 דגימות לאחר 54 חודש. בכל הדגימות נקבע היחס בין Aβ42/Aβ40 , ונמצא שיחס זה היה נמוך משמעותית במטופלים חיוביים ל-amyloid-PET בכל שלושת מועדי נטילת הדגימות (p<0.0001). התאמה לגיל, למגדר, לסטאטוס של APOE ε4 allele ולדירוג הקליני, משפיעה בבירור על משמעות התוצאות, כאשר ערכי p מופחתים, ורק השוואות בנקודת הזמן של 54 חודש שמרו על משמעות סטטיסטית (p = 0.006). ערכי AUC היו עקביים ביותר בשלושת נקודות הזמן, עם ערכים הנעים בין 0.880 לאחר 36 חודשים עד 0.913 לאחר 54 חודשים.
סריקות PET מייצגות מעמסה תקציבית כבדה, ועלולות לפגוע בזמינות הבדיקה. אנליזה של CSF יכולה להיות זולה משמעותית, אך ביצוע lumbar puncture מפחית את ההתאמה לאוכלוסיות רבות הנרתעות מביצועו. בעשור האחרון, תוצאות של בדיקות הראו שיחס נמוך יותר של Aβ42/Aβ40 בפלזמה, כרוך במעמסה עמילואידית קורטיקלית מוגברת (Rembach וחב' ב-Alzheimers Dement משנת 2014, Toledo וחב' ב-Acta Neuropathol משנת 2011, Devanand וחב' ב-Neurology משנת 2011, Lui וחב' ב-J Alzheimers Dis משנת 2010, Swaminathan וחב' ב-Alzheimers Dement משנת 2014, Perez-Grijalba וחב' ב-JPAD משנת 2019, Palmqvist וחב' ב-JAMA Neurol משנת 2019, ו-Yaffe וחב' ב-JAMA משנת 2011), בדעיכה קוגניטיבית גדולה יותר (Abdullah וחב' ב-Mol Med משנת 2009), ובהגברת הסיכון להתפתחות AD (Chouraki וחב' ב-Alzheimers Dement משנת 2015, Graff-Radford וחב' ב-Arch Neurol משנת 2007, ו-Lambert וחב' ב-Neurology משנת 2009).
חברת Araclon פיתחה בדיקת ELISA (ABtest, Araclon Biotech Ltd, Zaragoza, Spain) לקביעת רמות של סך Aβ40, של Aβ40 חופשי ושל Aβ40 קשור בפלזמה (Perez-Grijalba וחב' ב-J Alzheimers Dis משנת 2016). בדיקת ABtest מאפשרת לקבוע את TP42/40, ואת BP42/40. אכן נמצא שיחס נמוך יותר של Aβ42/40 בפלזמה היה כרוך במעמסה קורטיקלית גבוהה יותר של Aβ ובשיעורי הצטברות מהירים יותר.
הוראות לביצוע הבדיקה
הכנת המטופל לבדיקה: אין לצרוך מולטי-ויטמינים או תוספי מזון כולל ביוטין (ויטמין (B7 12 שעות לפני נטילת הדגימה. יש להוציא לפחות 750 מיקרוליטר נוזל לומבלי, בין החוליות L3/L4 או L4/L5 תוך שימוש בקנולה א-טראומטית, והנוזל נאסף למבחנות םוליפרופילן סטריליות. מיד לאחר איסוף ה-CSF הנוזל מסורכז במהירות של במהירות של 2,000 gלמשך 10 דקות בטמפרטורה של 4 מעלות צלזיוס, על מנת להרחיק תאים. נוזל השדרה לארח סרכוז מוקפא ונשמר בטמפרטורה של -80 מעלות צלזיוס . אין לדגום נבדקים בגיל מתחת 55 שנה. יש לפסול דגימת CSF שנראית מזוהמת עם דם. אין להשתמש במבחנות polystyrene שעלולות לגרום לתוצאות נמוכות כזובות של בטא-עמילואיד Abeta42 ב-20 עד 50% כתוצאה מספיחה של חלבון עמילואיד הדביק ךפני מבחנת פוליסטירן, ואף לשנות את היחס p-Tau181/Abeta 42. יש לפסול דגימות מאוד המוליטיות, ליפמיות או איקטריות. דגימות CSF הנשלחות למעבדה קפואות (מועדפות) יציבות למשך 90 יום, דגימות מקוררות יציבות למשך 14 יום, ואילו בטמפרטורת החדר הדגימות יציבות למשך 48 שעות. המדידה מתבצעת בשיטת chemiluminescent immunoassay. כאשר דגימת ה-CSF במבחנת bluETOP SARSTEDT מקוררת (מועדפת) היא יציבה למשך 14 יום, כאשר היא קפואה היא יציבה למשך 60 יום, ובטמפרטורת החדר הדגימה יציבה למשך 12 שעות.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק