מיקופלזמה - Mycoplasma
| מדריך בדיקות מעבדה | |
| מיקופלזמה | |
|---|---|
| Mycoplasma | |
| |
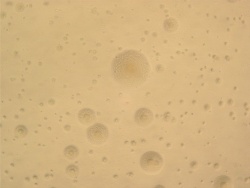
מושבות של מיקופלזמה במצע אגר.
| |
| מעבדה | מיקרוביולוגיה בדם |
| תחום | זיהוי דלקת ריאות בלתי אופיינית. |
| יוצר הערך | פרופ' בן-עמי סלע |
מיקופלזמה ו-ureaplasma הם זיהומים המוכרים באדם. המושג mycoplasma הופיע בשנות ה-50, ובא במקום הטרמינולוגיה הישנה של PPLO או pleuropneumonia‐like organisms. החיידק Mycoplasma pnumoniae (להלן Mp) אורכו 1–2 מיקרומטר ורוחבו 0.1–0.2 מיקרומטר, זאת בהשוואה למתג רגיל שאורכו 1–4 מיקרומטר ורוחבו 0.5–1.0 מיקרומטר. הנפח של Mp הוא פחות מ-5% מזה של מתג אופייני. מושבה טיפוסית של Mp על פלטות אגר, לא גדולה מ-100 מיקרומטר בקוטר. Mp הוא חיידק ללא דופן מה שהופך אותו בעיקרון לעמיד בפני תכשירים אנטי-מיקרוביאליים כגון beta-lactams הפועלים להרס דופן חיידקים, ולפיכך עלול MKp לגרום לספקטרום רחב של תסמינים קליניים.
ההיסטוריה של גילוי Mycoplasma pneumoniae
בשנת 1938, דיווח Reimann על 7 מטופלים עם צורה בלתי רגילה של tracheobronchopneumonia עם תסמינים חמורים (Reinmann ב-JAMA משנת 1938). חוקר זה האמין שהתמונה הקלינית של מחלה זו שונה מזו שבמחלות הנגרמות על ידי נגיפי influenza או על ידי חיידקים ידועים, ולכן כבר בשנות ה-40 המוקדמות דובר על מחלה הנגרמת על ידי פתוגן לא אופייני. בשנת 1944 Eaton וחב' זיהו גורם עיקרי לה שהוגדר אז כ-primary atypical pneumonia תוך ניסויים בחולדות, אוגרים ועוברי תרנגולות וזכה לכינוי "Eaton Agent" עליו דיווחו ב-J Exp Med משנת 1945. בהמשך הצליחו לתרבת את גורם Eaton בנוזל גידול נטול-תאים והוענק לו השם Mycoplasma pneumoniae (על פי Chanock ב-Science משנת 1963).
אפידמיולוגיה
הדבקות עם מיקופלזמה מתרחשות באופן ספורדי בכל עונות השנה, ועלולות לגרום להדבקות נרחבות בקהילה. החברה הנשימתית היפנית (JRS) מדווחת בשנת 2007 שהשכיחות של דלקת ריאות הנגרמת על ידי Mp בקרב מטופלים שנדבקו בקהילה נעה בין 5.2–27.4%. נראה אם כן ש-Mp הוא אחד הפתוגנים השכיחים ביותר הגורמים ל-community‐acquired pneumonia.
כמעט כל המטופלים עם דלקת ריאות מ-Mp הוגדרו ככאלה עם זיהום קל (85.5%) או מתון (14.0%) בהתבסס על מדרג החומרה A-DROP הכולל A, age; D, dehydration; R, respiration; O, orientation; P, blood pressure, שנקבע על ידי החברה הנשימתית היפנית. מדרג ה-A-DROP המרד את הזיהום כקל (דרוג 0), כמתון (דרוג 1–2), כחמור (דרוג 3) או כמאוד חמור (דרוג 4–5). מידת החום הבסיסית של מטופלים עם דלקת ריאות מ-Mp היא 1.0±37.7 מעלות צלזיוס. במחקר ביפן בין ינואר 2006 ונובמבר 2013, נסקרו 65 חולים, מתוכם hypoxemia אובחנה רק ב-12.8% מתוכם, וטמפרטורת הגוף הממוצעת בכל הנסקרים הייתה 37.9±1.3 צלזיוס. דרגת A-DROP של 3 ומעלה בכל הקבוצה הופיעה ב-0 מהנבדקים.
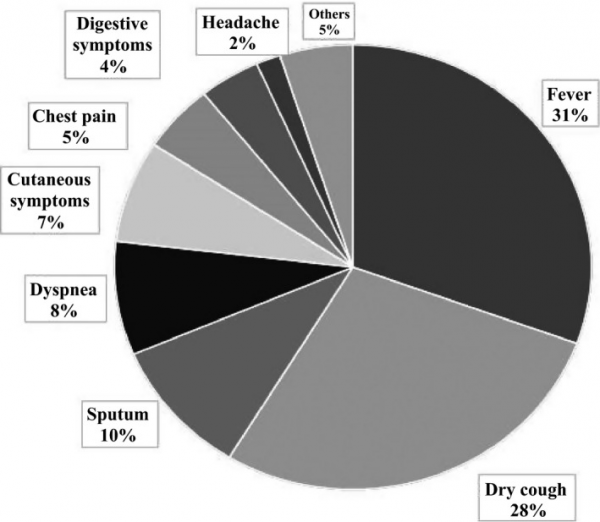
מחקר שנערך באוניברסיטת Kyorin בטוקיו על 54 מטופלים עם דלקת ריאות כתוצאה מ-Mp העלה את הממצאים בתמונה:
תסמינים חוץ-פולמונריים
בערך 70% מהחולים חווים חום ושיעול יבש, אך ב-7% מתוכם יש גם תסמינים עוריים, שיכולים להופיע כמו גם בתסמינים חוץ-פולמונריים אחרים גם בהיעדר תסמינים פולמונריים (Narita ב-J Infect Chemother משנת 2010). כפי שמופיע בתמונה למעלה, סיבוכי Mp עלולים להיות נוירולוגיים, קרדיו-וסקולריים, דרמטולוגיים, סיבוכי מערכת העיכול, תסמינים המטולוגיים, שריריים ושלדיים. הסיבוכים הנוירולוגיים כוללים אנצפליטיס, מנינגו-אנצפליטיס, מנינגיטיס אספטית, מייאליטיס, polyradiculitis ופסיכוזה. תסמיני CNS מתרחשים ב-1 מתוך 1,000 נגועים בחיידק, כאשר תסמונת Guillain‐Barré וכן נוירופתיה היקפית דווחו גם כן. תסמינים קרדיו-וסקולריים כוללים pericarditis ,endocarditis ו-myocarditis, ומתבטאים בהפרעות קצב, באי-ספיקה, בכאבי חזה, ובאי סדירויות ב-ECG. החיידק Mp בודד לעיתים מזומנות מהנוזל הפריקרדיאלי. באשר לתסמיני עור, תסמונת Stevens‐Johnson ו-erythema כרוכים עם הדבקת Mp. דווח גם על מעורבות נדירה יחסית של הכבד המתבטאת בספיקה לקויה 7–10 ימים לאחר הופעת החום. עם זאת, השכיחות של רמה מוגברת של האנזים GOT בנסיוב הייתה גבוהה יותר בילדים מאשר במבוגרים עם Mp, מה שיכול לשקף רבדומיוליזה כתוצאה ממעורבות שרירים. בין התופעות ההמטולוגיות, אנמיה המוליטית אוטו-אימונית היא התופעה השכיחה ביותר בין הממצאים החוץ-פולמונריים. ממצאים נוספים כגון תסמונת המופגוציטית המוכרת כמפגע של "סערה ציטוקינית", וכן נטייה מוגברת לקרישה במסגרת של DIC (או disseminated intravascular coagulation. תופעות אחרות כגון mucositis ,otitis media ו-glomerulonephritis גם כן מוכרות באופן ספורדי. מחלות שריר-שלד כגון arthritis ורבדומיאליטיס נדירות אך ניתן למצאן, כמו גם תרחישים אחרים כגון mucositis, otitis media וגלומרולונפריטיס.
הפתוגנזה של דלקת ריאות מ-Mp
החומרה של מחלה רספירטורית מהדבקה ב-Mp תלויה באופן בו מערכת החיסון מגיבה להדבקה, כמו שהודגם במודל של עכברים שהודבקו בחיידק (Saraya וחב' ב-Results Immunol משנת 2011, ו-Kurai וחב' ב-Inflammation משנת 2013). החיידק נקשר לתאי האפיתל הברונכיאליים בתיווך של מולקולת ספיחה על פני החיידק הידועה כחלבון P1. ל-Mp יש ליפופרוטאינים עם סגולות דלקתיות פוטנטיות, המוכרות על ידי מערכות חיסוניות של הפונדקאי כגון מקרופאגים אלבאולריים, דרך קולטנים דמויי-Toll כגון TLR2 ,TLR1 ו-TLR6 (Shimizu וחב' ב-Infect Immun משנת 2005). זוהה הטוקסין CARDS או community‐acquired respiratory distress syndrome כמעורב בפתו-פיזיולוגיה של מחלת Mp. הטוקסין נקשר ל- surfactant ההומני protein A ול-annexin A2 על פני תאי אפיתל בדרכי האוויר וחודר לתוך תאים אלה תוך גרימת נזק תאי (Becker וחב' ב-Proc Natl Acad Sci USA משנת 2015). עקה חמצונית משחקת אף היא תפקיד בנזק תאי זה. מספר מחקרים קבעו שהדבקה עם Mp יכולה להיות כרוכה בהחמרת תרחיש אסתמה בילדים (Biscardi וחב' ב-Clin Infect Dis משנת 2004), באופן בולט יותר מאשר במבוגרים. דווח גם שהחיידק Mp יכול להתגלות אפילו בדרכי האוויר של מבוגרים עם אסתמה כרונית ויציבה.
ממצאים פתולוגיים באדם מבדיקות של הנוזל הברונכו-אלבאולרי
מספר דיווחים דנו בטכניקות אבחוניות המבוססות על רקמת הריאה, כגון ביופסיה טרנס-ברונכיאלית, ניתוח ריאתי מונחה-וידאו ביופסיה ריאה פתוחה ואוטופסיה. דיווחים קודמים אחד המאפיינים של דלקת ריאות מ-Mp הוא תסנין עשיר של לימפוציטים באזורים הסב-ברונכו-וסקולריים עם הצטברות של מקרופאגים, נויטרופילים, ולימפוציטים באזורים האלבאולריים. יש מספר קטן של מחקרים המדגימים שתאים פולי-מורפו-נוקלאריים ולימפוציטים הם התאים הבולטים בהסננה זו. נמצא גם יחס מוגבר של CD4/CD8 בנוזל האלבאולרי.
מאפיינים קליניים
רוב המטופלים עם הדבקת Mp מסתמנים עם מחלת נשימה קלה, כולל פרינגיטיס ו-tracheobronchitis, וההדבקה בדרך כלל מתפוגגת מעצמה. רק 3–13% מהנדבקים עם Mp מפתחים דלקת ריאות. ההדבקה מתפשטת על ידי טיפות או תרסיסי פה ונשיפה בקרב משפחות עם תקופת דגירה של 2–4 שבועות. הנדבקים השכיחים ביותר הם בני 5–20 שנה. יש סברה שחסינות-עדר מתרחשת משך 4 שנים בממוצע, ואחרי תקופה זו אנשים שוב חשופים להדבקה עם Mp. נראה עם כך שחסינות-עדר היא רק חלקית. Goto במחקר ביפן, דיווח שכמעט כל המטופלים עם דלקת ריאות מ-Mp, היו בעלי הדבקה קלה (85.5%) או מתונה (14.5%) על בסיס מדרג החומרה A-DROP (בו P=blood pressure, O=orientation, R=respiration, D=dehydration, A=age) על פי ה-Japanees Respiration Society משנת 2006. לפי מדרג זה, ההדבקה קלה (score 0), מתונה (score 1-2), חמורה (score 3), או מאוד חמורה (score 4-5). הממצאים העיקריים במודבקי Mp הם אי-נוחות החזה (ב-42–69% מתוכם), תסמינים אפיים (ב-29–69%), שיעול (ב-93–100%), כאבי שרירים (ב-45%), חולשה (ב-74–89%), כאבי ראש (ב-60–84%), חום מוגבר (ב-96–100%), חרחורים ושורקנוּת בעת נשימה (ב-80–84%), אדמומיות בגרון (ללא תפליט) (ב-12–73%) בלוטות נפוחות בגרון, בייחוד בילדים (ב-18–27%), כאבי גרון (ב-53–71), תחושת צמרמורת (ב-58–98%).
מספר מנגנוני וירולנטיות של Mp אותרו, הכוללים מעורבות של ליפופרוטאינים/ליפופפטידים, מעורבות של הטוקסין של CARDS, ומעורבות של גורמים נוספים כגון hemolysin, רדיקאלים של superoxide ו-H2O2. ל-Mp יש ליפופרוטאינים/ליפופטידים עם סגולות דלקתיות המזוהות על ידי מערכת החיסון של תאים אפיתליאליים ברונכיאליים ושל מקרופאגים אלבאולריים דרך קולטנים דמויי-TLR2, TLR1 ו-TLR6. הטוקסין של CARDS זוהה כמעורב בפתו-פיזיולוגיה של מחלת Mp. הטוקסין נקשר ל-surfactant האנושי protein A ול-annexin A2 על פני תאי האפיתל של דרכי האוויר, ומופנם לתוך תאים אלה.
עמידות ל-macrolide של Mp-pneumonia להלן MR-Mp)
סוג זה של Mp העמיד למקרוליד החל מופיע לאחר שנת 2000 והתפשט במהירות במזרח אסיה (Liu וחב' ב-Antimicrob Agents Chemother משנת 2009, Wolff וחב' באותו כתב-עת משנת 2008, Suzuki וחב' באותו כתב עת משנת 2006, Li וחב' ב-Pediatr Infect Dis J משנת 2009, Peuchant וחב' ב-J Antimicob Chemother משנת 2009, ו-Ou וחב' ב-Hippokratia משנת 2015). הדבר בא לביטוי כאשר למעלה מ-48 שעות מתחילת הטיפול במקרוליד החום ותסמינים אחרים עדיין בתוקף. ביפן, 87% מכל ההדבקות ב-Mp הן MR-Mp (על פי Okada וחב' ב-Clin Infect Dis משנת 2012), בעוד ששכיחות ממצא זה במבוגרים היא 30–35%, והמוטציה הרלוונטית היא A2063G (על פי Myashita וחב' ב-BMC Infect Did משנת 2012). קשה לקבוע עמידות למקרוליד ללא בדיקה של TLR2, TLR1 ו-TLR6 (על פי Shimizu ב-J Immunol משנת 2005). הטוקסין CARDS או Community acquired respiratory disteress syndrome, זוהה כמעורב בפתו-פיזיולוגיה של Mp.
חום עיקש לפרק זמן של למעלה מ-48 שעות לאחר טיפול ב-macrolide עשוי לרמז על Mp העמידה לטיפול ב-macrolide. משך מחלת החום בנדבקים ב-Mp עמיד ל-macrolide ארוך משמעותית בהשוואה להדבקה עם Mp רגיש ל-macrolide, ונקבע כ-2.3±4.13 ימים לעומת 0.8±1.6 ימים (Suzuki וחב' ב-Anti Microb Agents Chemother משנת 2006). מחקר אחר הראה שמספר הימים בהם הנגוע קודח מחום (febrile illness) או ימי שיעול מתחילת הטיפול ב-macrolide, היו ארוכים יותר משמעותית באלה שנדבקו עם החיידק העמיד ל-macrolide בהשוואה לאלה שנדבקו בחיידק הרגיש לתרופה זו (בממוצע 4 ימים ו-11.4 ימים, לעומת 1.5 ימים ו-7 ימים) (Matsubara וחב' ב-J Infect Chemother משנת 2009). עם זאת, מחלה זו מסכנת חיים באופן נדיר ביותר.
משך מחלת החום במטופלים עם MR-Mp משמעותית ארוך יותר (בממוצע 4.1 ימים) מאשר בחולי Mp רגיש למקרוליד (MS-Mp) (בממוצע 1.6 ימים) (Suzuki וחב' ב-Antimicrob Agents Chemother משנת 2006). מחקר אחר הראה שמספר ימי החום או השיעול מתחילת הטיפול במקרוליד היה ארוך משמעותית במטופלים עם MR-Mp (בממוצע 4 ימים ו-11.4 ימים, בהתאמה), בהשוואה למטופלים עם MS-Mp (בממוצע 1.5 ימים ו-7 ימים, בהתאמה) (Matsubara וחב' ב-J Infect Chemother משנת 2009). מחלה מסכנת-חיים נדירה ביותר באלה עם MR-Mp ואין כל גורמי סיכון למהלך דוהר של המחלה (Izumikawa וחב' באותו כתב-עת משנת 2014).
המחקר הרב מוסדי הראשון והגדול ביותר הקיף 156 מכוני מחקר ביפן, שבחנו מקרים של דלקת ריאות לא-אופיינית, התקיים בשנים 2005–2008 (על פי Goto ב-J Infect Chemother משנת 2011). המחקר כלל 223 מטופלים עם Mp pneumonia שהתחלקו באופן שווה בין 2 המגדרים, והיו בגיל ממוצע של 38 שנה. Mp עמיד ל-macrolide בודד לראשונה מילדים ביפן בשנת 2000 (על פי Okazaki וחב' ב-Microbiol Immunol משנת 2001), וממבוגרים בשנת 2007, כשבכולם אותרה המוטציה 23S-rRNA. בשנות ה-2000, השכיחות של Mp עמידה ל-macrolide שהכילו או את המוטציה A2063G או את המוטציה A2064G, עלתה במהירות ביפן (Morozumi וחב' ב-J Infect Chemother משנת 2010) כמו גם במזרח אסיה עם קצב בידוד גבוה (92%) בסין (Saraya וחב' ב-Front Microbiol משנת 2014).
אנליזה מעבדתית
כ-25% מהמטופלים עם Mp מפתחים לויקוציטוזיס, כאשר בכל השאר ספירת לויקוציטים נמצאת בתחום הנורמה. במטופלים עם מפגע זה יכולה להופיע שקיעת דם מוחשת. בכיח מוצאים בעיקר תאים מונו-נוקלאריים ולא מוצאים חיידקים בצביעת Gram. בערך ב-75% מאלה עם הדבקת Mp מוצאים טיטר של cold agglutinins של לפחות 1:32 בשבוע המחלה השני, והם נעלמים לאחר 6–8 שבועות. זו אמנם לא בדיקה ספציפית להדבקה ב-Mp, אך ככל שטיטר ה-cold agglutinins גבוה מ-1:64 בנבדק עם דלקת ריאות נרכשת בקהילה, גדול הסיכוי שאגלוטינינים אלה נובעים מ-Mp. לא מוצאים אנומליות ספציפיות של תפקוד הכבד או הכליות (Cunha ב-J Clin Microbiol משנת 2003, ו-Parchuri ו-Cunha ב-Infect Dis Pract משנת 2006). לאישור הדבקה של מערכת הנשימה עם Mp, יש לבצע בדיקה בתרבית תאים, בחינה מולקולרית ו/או בדיקה סרולוגית.
אנליזה מולקולרית
השיטה הרווחת ביותר לזיהוי Mp היא על ידי PCR (על פי Beersma וחב' ב-J Clin Microbiol משנת 2003). מחקרים עדכניים מצביעים על כך שהגן לטוקסין CARDS רגיש יותר לזיהוי מולקולרי של Mp מאשר מבדקים המכוונים לגנים המקודדים לחלבון P1 או ל-אנזים ATPase (על פי Winchell וחב' ב-J Clin Microbiol משנת 2008). שתי בדיקות מולקולריות לזיהוי Mp אושרו על ידי ה-FDA: אחת מהן ידועה כ-illmigene Mycoplasma assay של חברת Meridian Biosciebces Inc, והיא בדיקת LAMP או loop-mediated isothermal amplification המאפשרת זיהוי של Mp ב-10 דגימות קליניות באופן סימולטני תוך שעה אחת לאחר מיצוי DNA שיטה שנייה ידועה כ-Multiplex Biofire Diagnostics FilmArray RP, מזהה חומצות גרעין במטושים אפיים או גרוניים של 20 פתוגנים של מערכת הנשימה כולל Mp, כאשר התוצאה מתקבלת תוך שעה אחת. כדי לקבל תשובה מעבדתית מדויקת יותר כדאי לשלב את הבדיקה המולקולרית עם בדיקה סרולוגית, אך יש לקחת בחשבון שבדיקות סרולוגיות גוזלות זמן ארוך לביצוע ולהשלמה.
בדיקות סרולוגיות
בדיקות אלה מתבצעות לרוב בשיטת ELISA ולא בשיטת קיבוע המשלים הרגישה פחות. כדי לדייק בזיהוי של נוגדנים מסוג IgM או IgG נוטלים 2 דגימות דם בהפרש של 2–4 שבועות. בחלק מהנבדקים רמת IgM יכולה להיוותר גבוהה עד מספר חודשים לאחר ההדבקה עם Mp, בעוד שבחלק אחר של נבדקים לא ניתן כלל לזהות IgM. אחד השיפורים המשמעותיים לזיהוי הדבקה ב-Mp במערכת הנשימה, הוא הפיתוח של בדיקות ELISA איכותיות ומהירות המתבצעות בדגימה בודדת, הניתנות לביצוע POC במשרד הרופא (Talkington וחב' ב-Clin Diagn Lab Immunol משנת 2004). שתי ערכות מסחריות זמינות הן Remel IgG/IgM Antibody Test System של חברת Thermo-Fisher המודדת באופן סימולטני נוגדני IgG ו-IgM, וערכת Meridian ImmunoCard, המודדת רק רמת IgM. היתרון של שיטות אלה היא בקבלת תוצאות תוך 10 דקות. אישור לאבחון המחלה עשוי להיות מבוסס על עלייה של פי-4 ברמת IgG בדגימות שנלקחו בין השלב החריף של המחלה לבין השלב ההחלמה ממנה (דהיינו מספר שבועות מהופעת התסמינים) (Waites ו-Talkington ב-Clin Microbiol Rev משנת 2004).
אף על פי שמציאות cold agglutinins אינה ספציפית, טיטר של למעלה מ-1:64 יכול לרמז על הדבקה ב-Mp. תרבית היא "מדד הזהב" לאבחון הדבקה זו. עם זאת, שיטה זו דורשת 1–2 שבועות עד לקבלת תוצאות ולכן אינה משמשת בשגרת המעבדות. שיטות סרולוגיות כגון צימות של חלקיקים, complement fixation, וערכות לאבחון מהיר בשיטת ®immunoCard, לקביעת mycoplasma immunoglobulin M זמינות מסחרית. ערכות מסחריות נוספות הן loop‐mediated isothermal amplification (LAMP) method ומבחן אנטיגני מהיר (Ribotest) ניתן לרכוש מחברת Asahi Kasei היפנית תוך שימוש במטושי גרון. אם הטיטר של complement fixation גבוה מ-1:64, או שהטיטר של צימות חלקיקים גבוה מ-1:320, ניתן לקבוע אבחון של הדבקה ב-Mp.
אף על פי שמספר מעבדות יכולות לבצע בדיקות PCR, הרגישות והספציפיות להדבקה ב-Mp הם 40.7%‐66.7% ו-88.8%‐98.5% בהתאמה, אך התוצאות משתפרות בשילוב עם בדיקה סרולוגית. בדיקת LAMP, היא שיטה חדשנית של אמפליפיקציה של חומצת גרעין, לזיהוי מהיר של Mp תוך שימוש במטוש גרון, הזמינה החל משנת 2010 ביפן באותן רגישות וספציפיות לגילוי Mp כמו בשיטת PCR. לעומת זאת מחקר אחר קובע שהרגישות והספציפיות הן 94.8% ו-91.9%, בהתאמה, ואילו ערכי הניבוי החיובי (ppv) והשלילי (npv) הם 91.1% ו-95.2%, בהתאמה. המשך הממוצע של pharyngeal carriage כפי שנמדד על ידי שיטת LAMP, הוא 9.5 ימים. כאשר שיטת LAMP הושוותה לשיטת rtPCR, הרגישות של בדיקת LAMP הייתה 88.5% כאשר נעשה מיצוי של חומצת הגרעין, ו-82.1% כאשר הבדיקה נעשתה עם דגימות קליניות ללא מיצוי. בהקשר זה, בדיקת LAMP תאפשר גילוי הדבקה עם Mp תוך מספר שעות בעלות נמוכה. הבדיקה בכיח עדיפה על זו הנעזרת במטוש נזו-פרינגאלי או oropharyngeal לזיהוי Mp על ידי אמפליפיקציה של חומצת גרעין בנבדקים מבוגרים (Loens וחב' ב-J Clin Microbiol משנת 2009).
שיטת Ribotest Mp שהיא ערכה לזיהוי מהיר של החלבון L7/L12 של Mp, תוך שימוש במבדק אימונו-כרומטוגרפי. הפכה זמינה ביפן בשנת 2013. נמצא שהסף לזיהוי Mp בשיטה זו הוא cfu/mL 1.1×104. עם זאת הרגישות האבחונית של בדיקת Ribotest בהשוואה לבדיקת PCR אינה גבוהה. נראה אם כן שהאבחון של דלקת ריאות מ-Mp צריך להתבסס על 6 גורמים שהוצעו על ידי החברה הנשימתית היפנית:
- גיל מתחת 60 שנה
- היעדר מחלת רקע נוספת
- שיעול עיקש
- ממצאים לא תקינים בהאזנה בעזרת סטטוסקופ
- היעדר כיח
- ספירת תאי דם לבנים בדם של פחות מ-10,000/ממ"ק
אם ארבעה או יותר גורמים מרשימה זו נמצאים, ניתן להבדיל דלקת ריאות מ-Mp מזו הנגרמת על ידי פתוגנים אחרים ברגישות גבוהה של 88.7% וספציפיות מתונה יותר של 77.5% (Yin וחב' ב-Respirology משנת 2012).
דווחו מספר גישות אבחוניות כגון ביופסיה טרנס-ברונכיאלית של הריאות (Nakajima וחב' ב-Kansenshogaku Zasshi משנת 1996, ו-Ohmichi וחב' ב-Nihon Kokyuki Gakkai Zasshi משנת 1998), ניתוח תורקוסקופי מכוון-וידאו (Chan וחב' ב-Chest משנת 1999), וביופסיה של ריאה פתוחה (Rollins וחב' ב-Arch Pathol Lab Med משנת 1986, Llibre וחב' ב-Clin Infect Dis משנת 1997, Ebnother וחב' ב-Virchows Arch משנת 2001, ו-Wachowski וחב' ב-Arch Dis Child משנת 2003). על פי נתוני דיווחים אלה, מאפיין בולט בדלקת ריאות מ-Mp היא הסננה מסיבית של לימפוציטים באזורים סב-ברונכו-וסקולריים, והצטברות של מקרופאגים, נויטרופילים ולימפוציטים באזורים אלבאולריים. אנליזה של נוזל ה-lavage הברונכו-אלבאולרי בתרחיש זה, העלתה שתאים פולי-מורפו-נוקלאריים (PMN) ולימפוציטים הוסננו יותר מאשר תאים אחרים, העלייה ביחס CD4/CD8 בנוזל ה-lavage הייתה בולטת (בין 2.1 ל-3.5) על פי Hayashi וחב' ב-Nihon Kyobu Shikkan Gakkai Zasshi משנת 1993).
בדיקה בתרבית
דגימות של המערכת הרספירטורית מתאימות לבדיקה בתרבית כוללות דגימת מטושים מהגרון, מהכיח, הפרשות טרכאליות, נוזל פלאורלי, נוזל lavage ברונכיאלי או נטילת ביופסיה ריאתית, בתלות במצב הקליני של המטופל. ל-Mp יש דרישות גידול בררניות וקשה לגדל חיידק זה בתרבית או שגידולו אטי. יש הנחיה לשמור את החיידק בטמפרטורה של מינוס 70 מעלות, אם אין אפשרות להעבירו למעבדה מיד לאחר איסופו. כאמור הגידול בתרבית אטי ונדרשות לעיתים 3 שבועות לזיהויו בתרבית.
הוראות לבצוע הבדיקה
בדיקה מולקולרית בשיטת PCR: הבדיקה ב-rapid-PCR עושה שימוש ב-Light Cycler & Fluorescent Resonance Energy Transfer או FRET. הדגימה צריכה להילקח משטיפות ברונכיאליות, מכיח, מהפרשות טרכאליות או מנוזל lavage ברונכו-אלבאולרי. הדגימה אמורה להיות מוכנסת למבחנה סטרילית מהסוגים M6, M4-RT, M5, M4 או UTM. מטוש אמור להיות מוכנס למבחנת BBL. כאשר מטוש דוגם את החומר הנבדק מהגרון, האף או מהלוע, המטוש צריך להיות עשוי מ-dacron (סוג של אריג) או מ-rayon (מֶשִׁי מְלָאכוּתִי) על חוטר של אלומיום או פלסטיק בנוזל Stuart או amies. את המטוש יש לאסוף לאחר שפשוף קל הלוך וחזור של רירית האזור הנדגם כדי לוודא דגימה של מקסימום תאים. כאשר הדגימה היא חומר ביולוגי נוזלי יש לוודא מבחנה סטרילית כאשר יציבות הדגימה בקירור (מועדף) או בהקפאה היא למשך 7 ימים. סיבות לפסילת הדגימה: המטוש על בסיס צמר גפן, כאשר החוטר עשוי מעץ, מזוהם בג'ל או ב-chacoal.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות שונות
- בדיקות מעבדה - מחלות בקטריאליות/ זיהום בקטריאלי-אלח-דם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק