נוגדנים מסוג IgG או IgM ל-Beta 2 glycoprotein 1
| מדריך בדיקות מעבדה | |
| נוגדנים מסוג IgG או IgM ל-β2-glycoprotein-1 | |
|---|---|
| שמות אחרים | נוגדנים מסוג IgG או IgM ל- Beta 2 glycoprotein 1, anti-β2 GP1, anti apolipoprotein H |
| מעבדה | המטולוגיה בדם |
| תחום | תפקודי קרישה, תסמונת אנטי פוספו-ליפידים |
| טווח ערכים תקין | מתחת ל-15 יחידות/מ"ל (תוצאה שלילית); בין 15.0-39.9 יחידות/מ"ל (תוצאה חיובית חלשה); בין 40.0-79.9 יחידות/מ"ל (תוצאה חיובית); מעל 80 יחידות/מ"ל (תוצאה חיובית חזקה). התוצאות ביחידות שְׁרִירוּתִיות מתייחסות לכל הגילים, וכן לערכי IgG ו-IgM. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכה של מטופלים חשודים לתסמונת אנטי-פוספוליפידים (APS) על ידי זיהוי של נוגדנים מסוג IgG כנגד β2 GP1. בירור נטייה לייצר קרישי דם. מרכיב בבירור הגורמים להפלות חוזרות.
מידע קליני
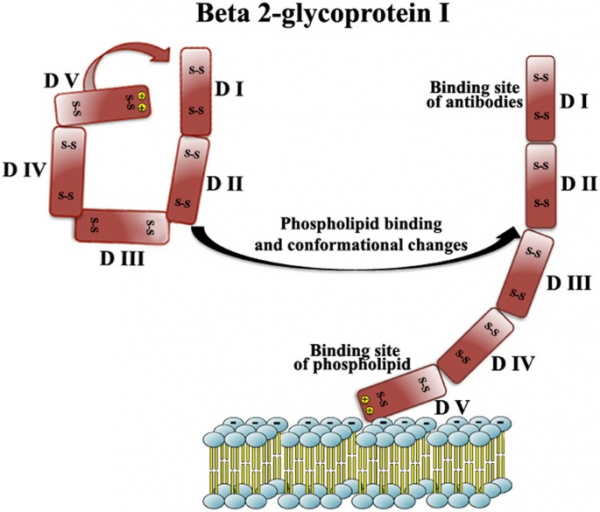
האנטיגן β-2 GP1 (הידוע גם כ-apolipoprotein H) הוא פוליפפטיד בעל 326 חומצות אמינו המסונתז על ידי הפאטוציטים, תאים אנדותליאליים ותאים טרופובלסטים. הוא מורכב מ-5 מקטעים הומוגניים של בערך 60 חומצות אמינו כל אחד (Caronti וחב' ב-Clin Exp Immunol משנת 1999, ו-Lozier וחב' ב-Proc Natl Acad Sci USA משנת 1984). מקטע 5, הממוקם בקצה ה-C טרמינלי, מכיל ליבה הידרופובית המוקפת על ידי 14 חומצות אמינו טעונות חיובית, המסייעות לאינטראקציה האלקטרוסטטית עם ממברנת התא על ידי אינטראקציה עם הפוספוליפידים הטעונים שלילית בממברנה. קומפלקסים של β2 GP1 ופוספוליפידים in vivo מגלים אפיטופים המגיבים עם נוגדנים עצמיים טבעיים (Kra-Oz וחב' ב-Clin Exp Immunol משנת 1995). פלזמה של אנשים בריאים מכילה רק ריכוזים נמוכים של נוגדנים עצמיים מסוג IgG כנגד β2 GP1 שהם בעלי זיקה מתונה ומגיבים עם אפיטופ הממוקם במקטע הראשון הסמוך לקצה ה-N טרמינלי של β2 GP1.
רמות פתולוגיות של נוגדנים ל-β2 GP1 מופיעות באנשים עם תסמונת אנטי-פוספוליפידית. APS כרוך במגוון של תסמינים קליניים כגון פקקת, סיבוכי היריון, סיבוכים עוריים בלתי מוסברים כגון livido reticularis או גם pyoderma gangrenosum, תרומבוציטופניה או אנמיה המוליטית, וכן אנדוקרדיטיס פקקתי לא-בקטריאלי. נוגדנים כנגד β2 GP1, מופיעים בתדירות עולה במטופלים עם מחלות ראומטיות סיסטמיות, ובעיקר ב-SLE. נוגדנים עצמיים ל-β2 GP1 מתגלים במעבדה הקלינית על ידי שיטות שונות הכוללות immunoassays ובדיקות תפקודיות של קרישה. Immunoassays לכימות נוגדנים ל- β2 GP1 יכולים להתבצע תוך שימוש במצע המורכב מ- β2 GP1 ופוספוליפידים אניוניים כגון cardiolipin או phosphatidylserine, אך גם עם מצע יחידני של β-2 GP1. כמה נוגדנים כנגד β2 GP1, מסוגלים לעכב יצירת קרישי-דם בבדיקות תפקודיות של קרישה, המכילות ריכוזים נמוכים של קו-פקטורים פוספוליפידיים. אל נוגדנים המתגלים על ידי בדיקות תפקודיות של קרישה מתייחסים כאל lupus anticoagulants.
האבחון של APS דורש קיום של לפחות קריטריון קליני אחד וקריטריון מעבדתי אחד (Wong וחב' ב-Pathology משנת 2008). הקריטריונים הקליניים כוללים פקקת וסקולרית ורידית או עורקית בכל איבר או רקמה, וסיבוכי היריון כגון מוות בלתי מוסבר של העובר ברחם, preeclampsia חמורה, לידה טרם עת, או אי-ספיקה שלייתית. התבטאויות קליניות נוספות יכולות להיות מחלת מסתמי לב, livedo reticularis, תרומבוציטופניה, נפרופתיה ותסמינים נוירולוגיים, שעלולים לעיתים להיות כרוכים עם APS אך אינם נכללים בקריטריונים האבחוניים. הקריטריונים המעבדתיים לאבחון APS הם נוכחות של lupus anticoagulant, נוכחות של נוגדנים מסוג IgG ו/או IgM כנגד קרדיוליפין, ו/או נוכחות של נוגדן מסוג IgG או IgM כנגדβ2 GP1. כל הנוגדנים הללו חייבים להיות מודגמים בשתי הזדמנויות או יותר המופרדים לפחות 12 שבועות זו מזו. מדידות ישירות של נוגדנים כנגד β2 GP1, דווחו כמעט ספציפיות יותר (אם כי רגישות פחות) לאבחון מחלה במטופלים עם APS (Audrain וחב' ב-Rheumatology משנת 2002). נוגדנים מסוג IgA כנגד קרדיוליפין או כנגד β2 GP1, אינם חלק מהקריטריונים המעבדתיים לזיהוי APS בגלל חוסר ספציפיות.
ההיסטוריה של נוגדנים ל-GP1 β2
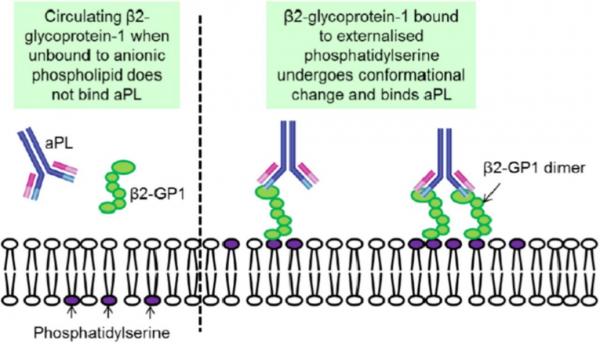
בשנת 1990 שתי קבוצות מחקר בלתי-תלויות דווחו שהקישור של נוגדנים כנגד קרדיוליפין לפוספוליפידים דורש את הנוכחות של קו-פקטור בפלזמה, שהתברר כחלבון פלזמתי במשקל מולקולרי של 50,000 דלטון, שזוהה כ- β2 GP1 (McNeil וחב' ב-Proc Natl Acad Sci USA משנת 1990, ו-Galli וחב' ב-Lancet משנת 1990). הגן המקודד ל- β2 GP1 ממוקם על כרומוזום 11 (Nonaka וחב' ב-Genomics משנת 1992). רצף חומצות האמינו של β2 GP1 נקבע על ידי Steinkasserer וחב' ב-Biochemical J משנת 1991. לאחר ניקוי מוצלח של חלבון זה, פותחו מספר ערכות מסחריות של ELISA לזיהוי נוגדנים כנגד חלבון זה, שבצורתו הטבעית נקשר β2 GP1 לנוגדנים כנגדו רק בזיקה נמוכה. אך כאשר β2 GP1 נקשר לאלמנטים טעונים שלילית על פני שטח תאים, הוא עובר שינוי קונפורמציה שמגביר את זיקתו לנוגדנים כנגדו. β2 GP1 קשור לפלטות microtitre שהוקרנו בקרינת γ בכל הערכות המסחריות הזמינות לבדיקת ELISA לגילוי הנוגדנים הנקשרים אליו. בדיקות אלה מיועדות למטופלים עם בעיות קרישה, ולאלה עם SLE. נמצא שתוצאה חיובית של IgG anti β2 GP1, כרוכה בנטייה לפקקת ורידית או עורקית (Voss וחב' ב-Lupus משנת 2001, Day וחב' ב-J Rheumatol משנת 1998, Arnout ו-Vermylen ב-Lupus משנת 1998 ו-Sanmarco וחב' ב-J Lab Clin Med משנת 1997).
ההכללה של נוגדנים כנגד β2 GP1 כקריטריון אבחוני נמנעה עד שנת 2000, בגין חסר של סטנדרט בינלאומי וכן בגלל קשיים טכניים. שיקול זה הביא את Ebeling וחב' מהלסינקי לבחון את תפקידם של נוגדנים אלה במצבי פקקת (Scand J Clin Lab Invest משנת 2003). דגימות של 5,367 מטופלים עם אירועי פקקת שונים, נשלחו למעבדת reference ארצית. נמדדו בשיטת ELISA רמות IgG anti β2-GP1 בנוסף ל-lupus anicoagulant ו-IgG anti cardiolipin כדי לסווג לקבוצות בהן ה-assay של IgG anti β2-GP1 עשוי להיות בעל ערך. מסך של 90 מטופלים, 2.2% מהדגימות היו חיוביות ל-anti β2-GP1, כאשר ב-51 מהדגימות anti β2-GP נמצא הסמן החיובי היחיד של נוגדנים כנגד פוספוליפידים, 20 מהנבדקים סבלו מפקקת ורידית ו-14 מהנבדקים סבלו מפקקת עורקית. ארבע מהנבדקות סבלו מסיבוכי היריון, ובעוד 2 מהנבדקים נמצאה תרומבוציטופניה. בנבדקים צעירים יחסית עם אירועים צרברו-וסקולריים איסכמיים, תוצאת בדיקת anti β2-GP1 הייתה התוצאה החיובית היחידה. החיוביות של בדיקת anti β2-GP1 נותרה בעינה ב-23 נבדקים. מסקנת בעלי המחקר הייתה שבדיקת IgG anti β2-GP1 היא בעלת פוטנציאל של תוספת אבחונית חשובה בבירורי המעבדה בחשד של תסמונת אנטי-פוספוליפידית.
תסמונת אנטי-פוספוליפידים ונוגדנים ל-GP1 β2
תסמונת האנטי-פוספוליפידים (APS) מופיעה במספר מפגעים אוטו-אימוניים, ובעיקר ב-SLE. דגימות נסיוב של מטופלים עם APS מכילות נוגדנים רב-שבטיים (polyclonal) הנקשרים לליפידים שונים וכן ליעדים על פני ממברנת התא כולל β2-GP1, פרותרומבין, ו-platelet factor 4 (McNeil וחב' ב-Proc Natl Acad Sci USA משנת 1990, Bajaj וחב' ב-Blood משנת 1983 ו-Sikara וחב' ב-Blood משנת 2010). נוגדנים כנגד β2-GP1 הם גורמי-סיכון בלתי תלויים לפקקת (Galli וחב' ב-Blood משנת 2003), ואילו lupus anticoagulant, נוגדנים לקרדיוליפין ונוגדנים anti–β2 GP1, מייצגים נוגדנים פולי-קלונליים כנגד פוספוליפידים במטופלים עם תסמונת APS. המנגנון בו נוגדנים לפוספוליפידים גורמים לתרחישים פקקתיים אינו ברור, ואחת ההשערות מצדדת בשפעול של טסיות דם על ידי הקומפלקס anti β2 GP1/β2 GP1הנקשר לקולטן של apolipoprotein E (Lutters וחב' ב- J Biol Chem משנת 2003).
האינטראקציה בין נוגדנים anti–β2 GP1 לבין הדימר של β2 GP1 ו-GPIb, מובילה לספיחה של טסיות-דם (Pennings וחב' ב- J Thromb Haemost משנת 2007), לשפעול של תאי אנדותל על ידי ההתקשרות של נוגדנים GP1 anti–β2 לקומפלקס GP1 β2- annexin 2 (על פי Zhang ו-McCrae ב-Blood משנת 2005), על ידי העיכוב של שפעול protein C על ידי הקומפלקס anti β2 GP1/ β2 GP1 (Safa וחב' ב-Blood משנת 2005), על ידי השיבוש על ידי נוגדנים אנטי-פוספוליפידים בפוטנציאל של annexin V בתפקידו כאנטי-קואגולנט (Rand וחב' ב-Blood משנת 2004), החלשה של פיברינוליזה על ידי נוגדנים אנטי-פוספוליפידים הכרוכה בתאי אנדותל (Patterson וחב' ב- Br J Haematol משנת 2006), וכן החשיפה של האפיטופ הסמוי הממוקם על מקטע I של β2 GP1, מה שמאפשר ליצירה של הקומפלקס GP1/ β2 GP1β2-anti (על פי Agar וחב' ב-Blood משנת 2010).
כל התרחישים האפשריים האלה נובעים ממחקרים In vitro. במודלים בחיות של פקקת בתסמונת APS, נעשה שימוש בנסיוב מלא של מטופלים עם APS, עם פרקציית האימונוגלובולין (Pierangeli ו-Harris ב-Lupus משנת 2004, ו-Fischetti וחב' ב-Blood משנת 2005), או עם נוגדנים חד-שבטיים ממקור של מונוציטים של מטופל עם APS שעברו הַנְצָחָה (imortalization) (על פי Olee וחב' ב-Proc Natl Acad Sci USA משנת 1996, ו-Pierangeli וחב' ב-Thromb Haemost משנת 2000). אין עדיין הוכחה ישירה שנוגדנים עצמיים פולי-קלונליים המגיבים כנגד β2 GP1 שבודדו מהנסיוב של מטופלים עם APS גורמים מאו מחישים תהליכי פקקת במודלים של חיות. אף על פי כן, יש ראיות נסיבתיות המצביעות על האפשרות שנוגדנים כנגד β2 GP1 פתוגניים ב-APS, ויש ראיות קליניות בשפע שנוגדנים אלה עשויים להיות סמן של פקקת ושל הסיכון לפקקת. כאשר בודדו נוגדנים עצמיים כנגד β2 GP1 מנסיובים של אנשים מאובחנים עם APS, בעמודות זיקה בהן β2 GP1 אנושי היה קשור לעמודה, מצאו שהנוגדנים המבודדים בשיטה זו גרמו להגברה ביצירת פקקות במודל של עכברים.
המשמעות של שלושת האיזוטיפים של נוגדנים anti–β2-GP1: תחום של מחלוקת
נושא זה זכה לתשומת לב ניכרת בכינוס הבינלאומי על נוגדנים אנטי-פוספוליפידים בשנת 2010, והנחיות קונצנזוס בינלאומיות פורסמו בשנת 2012 (על פי Lakos וחב' ב-Arthritis Rheum משנת 2012). הנחיות אלו הגיעו למסקנה שהקשר החזק ביותר בין anti–β2 GP1 לבין APS הוא עם האיזוטיפ IgG, אך הוויכוח נמשך בפרט כאשר ראיות חדשות ממשיכות לעלות לגבי משמעותם של שלושת האיזוטיפים.
השימושיות של IgM anti β2 GP1
הערך של מדידת IgM anti β2 GP1 ב-APS, נתמך על ידי דיווחים על מטופלים בהם IgM anti β2 GP1 נמצא כאנטי-פוספוליפיד בלעדי. לדוגמה, במחקר באיטליה של 64 מטופלים עם APS שאובחנו על בסיס נתונים קליניים שבהם נתגלה רק איזוטיפ יחיד אנטי PL, נמצא שלמעלה מ-50% מתוכם היו חיו חיוביים ל- IgM anti β2 GP1. בערך שני שלישים מאלה עם IgM anti β2 GP1 בלעדי היו בעלי בעיות גניקולוגיות של APS (על פי Tincani וחב' ב-Lupus משנת 2010). לעומת זאת, רובם של מחקרים אחרים מצביע על קשר חזק יותר של GP1β2 IgG anti לבין ביטוי קליני של APS. באחד המחקרים הראשונים בסוגיה זו, לא נמצא קשר בין נוכחות של GP1β2 IgM anti לבין תרחישים אופייניים של APS, כולל פקקת ורידית או הפלות חוזרות, בהשוואה ל- IgG anti β2 GP1 (על פי Lakos וחב' ב-Clin Exp Immunol משנת 1999). מחקר נוסף בחן את היכולת של איזוטיפים שונים של anti β2-GP1 לְרַבֵּד (stratify) את הסיכון לפקקת במטופלים עם lupus anticoagulant, ונמצא שאלה עם IgG anti β2-GP1 היו עם השיעור הגבוה ביותר של פקקות, ולעומתם באלה עם איזוטיפ IgM anti β2-GP1 לא נמצא קשר לפקקות (Zoghlami-Rintelen וחב' ב-J Thromb Haemost משנת 2005).
מחקר ממערב אוסטרליה בחן את הפנוטיפ הקליני של 128 מאושפזים שאובחנו חיוביים לפחות לאיזוטיפ יחיד של anti-β2 GP1 (על פי Brusch וחב' ב-Pathology משנת 2014). נמצא שיעור גבוה יותר של מאושפזים עם היסטוריה של פקקות ורידיות או עורקיות בקרב אלה החיוביים ל-IgG anti β2 GP1 בהשוואה לאלה בהם לא נמצא איזוטיפ זה. מחקר זה מצא גם ש-IgM anti β2 GP1 היה האיזוטיפ עם הקשר הנמוך ביותר ל-APS פוטנציאלי. למעשה, קיימות אפילו עדויות לכך ש-IgM anti β2 GP1 עשוי אפילו לשחק תפקיד הגנתי מפני מחלה במצבים אחדים. במחקר שכלל כמעט 800 מטופלים עם SLE, נמצא שאלה מתוכם עם IgM anti β2 GP1, היו בעלי שיעור נמוך יותר של lupus nephritis, של יתר לחץ-דם ושל פגיעה בתפקוד הכליות. יתרה מכך, IgM anti β2 GP1 לא היה כרוך עם פקקת ורידית או עורקית בניגוד לשני האיזוטיפים האחרים, IgG anti β2 GP1 ו-IgA anti β2 GP1 (על פי Mehrani ו-Petri ב-J Rheumatol משנת 2011).
הקשר בין IgA anti β2 GP1 ל-APS
מבין שלושת האיזוטיפים, תפקידו של IgA anti β2 GP1 נותר השנוי ביותר במחלוקת. הדיווחים הראשונים על האפשרות ש-IgA anti β2 GP1 הוא בעל תפקיד פוטנציאלי ב-APS, החלו להופיע בשנות ה-90 המאוחרות (Abinader וחב' ב-Rheumatology משנת 1999, Yamada וחב' ב-Arthritis Rheum משנת 1999, ו-Fanopoulos ב-J Rheumatol משנת 1998). לאחר כמעט 20 שנה של מחקר המעורבות של IgA anti β2 GP1 בAPS ראשוני ושניוני לא הגיעה למסקנה מגובשת עם מגוון גדול של אפשרויות מעורבות זו שנע בין 14-72% (על פי Meijide וחב' ב-Autoimmun Rev משנת 2013). הבדלי שיטות מדידה במחקרים השונים, הבדלים בדמוגרפיה של הנבדקים כמו גם בפנוטיפים הקליניים (כגון הבדלים אתניים, APS ראשוני או שניוני, התבטאות פקקתית לעומת גניקולוגית), ואפילו מחקרים עם מדגם קטן מדי של נבדקים, מוסיפים מוּרכָּבוּת לאינטרפרטציה של הנתונים. אך לאחר דיווחים מוקדמים על המעורבות של IgA anti β2 GP1 התרחישים של APS, התגבר מספרם של דיווחים שפסלו מעורבות זו. מחקר שכלל 400 חולי SLE עם APS, לא מצא מעורבות כזאת בניגוד ל-IgG ול-IgM אנטי β2 GP1 (על פי Danowski וחב' ב-J Rheumatol משנת 2006). גם מחקר בחולים על APS ראשוני ו-SLE לא מצא מעורבות כזאת (Samarkos וחב' ב-Clin Rheumatol משנת 2006).
אחד המחקרים הגדולים ביותר שבחנו את השימושיות של מדידת IgA anti β2 GP1 כלל כמעט 6,000 נבדקים (Murthy וחב' ב-Arthritis Rheum משנת 2013). רוב הנבדקים במחקר זה (5,098) היו מטופלים שנבדקו בחשד ל-APS במעבדת reference לסטנדרטיזציה של אנטי-פוספוליפידים בטקסס. שאר 902 הנבדקים נבחרו מתוך מדגמים של חולי SLE. סך כל השכיחות של IgA בקבוצת הביקורת של נבדקים שליליים ל-SLE הייתה פחות מ-1%, לעומת בערך 20% בקבוצת הנבדקים החיוביים ל-SLE. השכיחות של IgA anti β2 GP1 בנבדקים השליליים ל-SLE הייתה נמוכה מ-0.5%, לעומת 5% בנבדקים החיוביים ל-SLE. מספר משמעותי של נבדקים עם IgA anti β2 GP1 סבלו מלפחות תרחיש קליני נוסף הכרוך עם APS קלאסי, כגון תרומבוציטופניה או livedo reticularis. ממצא מעניין בקבוצת הנבדקים עם SLE, הוא ש-IgA anti β2 GP1 היה כרוך משמעותית עם פקקת עורקית, אך לא עם פקקת ורידית. מחקר בספרד בקרב 156 מטופלים עם APS, גם כן דיווח על קשר חזק יותר עם פקקת עורקית בנוכחות של IgA anti β2 GP1 מאשר נוכחות של IgG anti β2 GP1 או IgM anti β2 GP1 (על פי Ruiz-Garcia וחב' ב-J Immunol Res משנת 2014).
APS גניקולוגי ו-anti β2 GP1
התרחישים של פקקות בכלי הדם בשליה וסיבות אחרות להפלות חוזרות, לידה טרם-עת ומפגעי היריון אחרים נחקרו רבות בהקשר של נוכחות נוגדנים anti β2 GP1. אחת האפשרויות לרלוונטיות של נוגדנים אלה, היא בקישורם לטרופובלסטים באופן הגורם לשינוי ביכולת תאים אלה לשגשג ולהתרבות. נוגדני anti β2 GP1 יכולים גם להיקשר ולהשפיע על תאי אנדומטריום ב-decidua מה שעלול לפגוע בתהליך ההשרשה. שפעול של המשלים והגברת אפופטוזיס של תאים עובריים ושל תאי השלייה, יכולים גם כן לשחק תפקיד במסלולים המוליכים להפלות חוזרות נשנות, למות העובר, ל-pre-eclampsia ולאי-ספיקה שלייתית (Meroni וחב' ב-Nat Rev Rheumatol משנת 2011). בהמשך, עלתה גם השערה שמטופלות עם APS גניקולוגי יכולות להיות מובדלות בפרופיל האנטי-פוספוליפידי שלהן, מנשים עם APS וסקולרי (De Jesus וחב' ב-Autoimmun Rev משנת 2014).
הנתונים הזמינים בעת כתיבת מאמר זה, ממשיכים להצביע על תוצאות סותרות לשימושיות של בדיקת anti β2 GP1 בהקשר של APS גניקולוגי. מטה-אנליזה של מחקרים המתייחסים לבעיות שלייתיות בהיריון, זיהתה 2 מחקרים גדולים בהם הודגם הקשר בין anti β2 GP1 לבין pre-eclampsia וכן להפלות בשלב היריון מתקדם (Faden וחב' ב-Eur J Obstet Gynecol Repr Biol משנת 1997, Abou-Nassar וחב' ב-Thromb Res משנת 2011, ו-Katano וחב' ב-Human Reprod משנת 1996). מחקר נוסף מצא קשר בין מציאות נוגדנים אלה לבין פיגור התפתחותי תוך-רחמי. לעומת זאת, היו 4 מחקרים מבוקרים שלא מצאו קשר זה (Lee וחב' ב-Obstet Gynecol משנת 2003, Valdes-Macho וחב' ב-Arch Med Res משנת 2002, ו-Vora וחב' ב-Eur J Obtet Gynecol Rep Biol משנת 2008). מחקר פרוספקטיבי רב-מוסדי גדול שכלל 600 מקרים של מות עובר לאחר למעלה מ-20 שבועות של היריון, מצא שרמות מוגברות של IgG anti β2 GP1 הגבירו פי-3 את הסיכון ל "לידה שקטה" ורמות מוגברות של IgM anti β2 GP1 הגבירו סיכון זה זו פי-2 (על פי Silver וחב' ב-Obstet Gynecol משנת 2013).
רוב המחקרים בתחום של APS גניקולוגי, כללו מדידה של IgG anti β2 GP1 ושל IgM anti β2 GP1. עם זאת, היו גם מחקרים אחדים שבחנו את הקשר בין IgA anti β2 GP1 לממצאי היריון ולידה, ובאופן לא מפתיע התוצאות של מחקרים אלה סותרות. לדוגמה, מחקר רטרוספקטיבי משנות 2000 המוקדמות מצא בנשים הרות עם APS, pre-eclampsia ומחלה אוטו-אימונית, רמות גבוהות בהרבה של IgA anti β2 GP1 בהשוואה לנשים עם הריונות נורמליים (Ulcova-Gallova וחב' ב-Int J Fertil Womens Med משנת 2001). מחקר אחר גם כן מצא רמות מוגברות של IgA anti β2 GP1 בקרב נשים עם הפלות ספונטניות נשנות ומות העובר (Lee וחב' ב-Am J Obstet Gynecol משנת 2001). לעומת זאת, מחקר שבחן נוגדנים anti β2 GP1 ב-84 נשים עם APS ראשוני, בעיות היריון בלתי מוסברות ו-SLE, מצא דווקא שכיחות נמוכה של IgA anti β2 GP1 וחסר של מפגעים קליניים באלה שבהם נמצא איזוטיפ מסוג IgA (על פי Carmo-Pereira וחב' ב-Ann Rheum Dis משנת 2003).
נוגדנים אנטי-β2 GP1 שלא במערכת APS: סוגיות של ספציפיות
כפי שכבר צוין, ההמצאות של נוגדנים אנטי-β2 GP1 בקרב מטופלים עם מחלות שונות, חיונית לדיון בדבר הספציפיות של נוגדים אלה. לדוגמה, מחקר בדרום אפריקה מצא נוגדנים אנטי-β2 GP1 ב-6-8% מהנבדקים עם HIV, עגבת ומלריה, ב-89% מהנבדקים עם צרעת, וב-30% מהנבדקים עם הפאטיטיס C (על פי Loizou וחב' ב-Ann Rheum Dis משנת 2003). באשר לקשר תחלואתי של האיזוטיפים השונים, נמצא ששכיחות מוגברת של IgA anti GP1, נמצאה במגוון של מפגעים כגון הפאטיטיס אוטו-אימונית (Gabeta וחב' ב-J Clin Immunol משנת 2008), מחלת צליאק ( (Mankai וחב' ב-Pathol Biol משנת 2012), תסמונת מטבולית (Borges וחב' ב-Arq Bras Cadiol משנת 2011), ובקרב חולים בדיאליזה עם מחלת כליות סופנית (Serrano וחב' ב-Kidney Int משנת 2012). המשמעות של נוכחות IgA anti β2 GP1 במפגעים כה שונים אינה ברורה, אם כי היא נכרכה בפרוגנוזה פחות טובה. לדוגמה, במקרה של מטופלים עם מחלת כליות סופנית העוברים דיאליזה, נמצא ש- IgA anti β2 GP1 גורם סיכון בלתי-תלוי לתמותה, ואכן רמת נוגדנים אלה פחתה לאחר השתלת כליה (Serrano וחב' ב-J Immunol Res משנת 2014).
אינטרפרטציה
תוצאות חיוביות חזקות של נוכחות נוגדנים ל- β2 GP1 (מעל 40 יחידות/מ"ל) מהוות קריטריונים אבחוניים מעבדתיים לזיהוי APS. רמות נמוכות יותר של IgG ושל IgM כנגד β2 GP1, יכולות להופיע במטופלים עם סימנים קליניים של APS, אך התוצאות אינן יכולות להיחשב אבחוניות. הגילוי של נוגדנים כנגד β2 GP1 אינו מושפע מטיפול בו זמנית עם תכשירים נוגדי קרישה.
הוראות לביצוע הבדיקה
אין צורך בשום הכנות מוקדמות לפני הבדיקה. יש ליטול דם במבחנה כימית (פקק אדום או צהוב וניתן גם להשתמש במבחנת ג'ל). לאחר הסרכוז יש לאחסן את דגימת הנסיוב המופרד בקירור (מועדף) או בהקפאה, אך יש להימנע מהפשרות והקפאות חוזרות. בטמפרטורת החדר הדגימה יציבה למשך 48 שעות, בקירור היא יציבה למשך שבועיים, ובהקפאה היציבות היא למשך שנה. יש לפסול דגימות פלזמה, או דגימות מאוד המוליטיות או ליפמיות, אך ניתן להשתמש בדגימות איקטריות באופן קל. הבדיקה מתבצעת בשיטת ELISA. יש לקחת בחשבון ש-immunoassay לזיהוי נוגדנים כנגד β2 GP1, אינם מבדילים בין נוגדנים עצמיים ונוגדנים המיוצרים בתגובה לגורמים זיהומיים או כתופעות בו-זמנית המופיעות לאחר תרחיש של פקקת. מסיבה זו תוצאה חיובית בבדיקה בודדת אינה מספיקה לקיים קריטריונים סרולוגיים לאבחון של APS. מחקרים השוואתיים של תוצאות בדיקה זו בין מעבדות שונות, העלו שונות גבוהה בשל שימוש בערכות בדיקה מסחריות ממקורות שונים.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק