נוירופתיה עמילואידית משפחתית - המחלה, גורמיה, מאפייני המחלה בישראל וטיפולים עדכניים - Familial amyloid neuropathy
הופניתם מהדף נוירופתיה עמילואידית משפחתית לדף הנוכחי.
| נוירופתיה עמילואידית משפחתית - המחלה, גורמיה, מאפייני המחלה בישראל וטיפולים עדכניים | ||
|---|---|---|

| ||
| ICD-10 | Chapter E 85.1 | |
| ICD-9 | 277.3 | |
| MeSH | D028227 | |
| יוצר הערך | פרופ' מנחם שדה | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – נוירופתיה
נוירופתיה עמילואידית משפחתית (נע"מ) (Familial Amyloid Neuropathy) היא אחת מתוך קבוצה של מחלות, שבהן בשל שינויים במבנה החלבון, הוא הופך לבלתי מסיס ושוקע כסיבים חוץ תאיים. הסיבים מסתדרים במבנה של beta-pleated sheet הקרוי עמילואיד. משקעי העמילואיד גורמים נזק לרקמה שבה האם שוקעים. עמילואידוזיס יכולה להיות גנטית או נרכשת.
הנוירופתיה העמילואידית המשפחתית השכיחה ביותר היא זו הקשורה לחלבון טרנסתירטין (transthyretin - TTR), והיא נושא הסקירה. TTR פועל כנשא של תירוקסין וויטמין A (רטינול) בדם. TTR מיוצר בעיקר על ידי הכבד ובמידה פחותה גם על ידי הפלקסוס הכורואידלי בחדרי המוח וכן על ידי הרשתית. הגן המקודד לחלבון נמצא בכרומוזום 18 ומכיל 4 אקסונים.
יותר מ-100 מוטציות תוארו בגן לטרנסתירטין. המוטציות גורמות לטטרמרים של החלבון להיות פחות מסיסים, והדבר מביא ליצירת מונומרים ששוקעים בתום תהליך מורכב כסיבי עמילואיד. הרקמות שנפגעות בצורה השכיחה ביותר הן העצבים הפריפריים, העצבים האוטונומיים (בעיקר במערכת העיכול) והלב. מאחר שהתלונות הראשונות של החולים הן בשל נוירופתיה פריפרית, המחלה כונתה נע"מ, אף על פי שהיא למעשה מחלה סיסטמית המזיקה לרקמות מרובות. המחלה מועברת בתורשה דומיננטית.
המחלה תוארה לראשונה בפורטוגל בשנת 1952[1], אך לאחר מכן נמצאו מוקדים אנדמיים גם בשוודיה[2] וביפן[3]. המוטציה שנמצאה בארצות אלו הייתה החלפת ואלין במתיונין בקודון 30 (Val30Met), אולם המחלה התגלתה גם בארצות נוספות רבות ובהן נמצאו מוטציות שונות רבות. מעריכים שכ-10,000 אנשים בעולם לוקים בנע"מ.
בישראל תוארה המחלה לראשונה בשנת 1983[4] אצל חולה ממוצא אשכנזי. מחלתו הייתה קשה והתחילה בגיל מאוד מוקדם, אלא שהתברר שהוא נושא שתי מוטציות בגן לטרנסתירטין[5]. המשפחה השנייה תוארה על ידי לוסוס וחב'[6] בשנת 2005. זו משפחה יהודית ממוצא תימני עם שלושה דורות חולים. המוטציה שנמצאה הייתה Ser77Tyr. זמן קצר לאחר מכן תוארה חולה נוספת[7] ממוצא יהודי איראני עם מוטציה נדירה - Val32Ala. בשנת 2012 תוארו שמונה חולים נוספים, שניים מהם השתייכו למשפחות שכבר תוארו[8].
גיל התבטאות המחלה, צורת ההתבטאות שלה וקצב התקדמותה שונים מארץ לארץ. כך למשל, בפורטוגל היא מסתמנת לראשונה באמצע שנות ה-30, ואילו בשוודיה בשנות ה-50.
להלן נסקור את המאפיינים של המחלה בישראל.
מאפייני המחלה בישראל
כמחצית מהחולים בישראל הם ממוצא יהודי תימני, והם משתייכים למספר משפחות. אצל כולם נמצאה אותה מוטציה - Tyr77Ser. החולים האחרים ממוצא אשכנזי, צפון אפריקאי או איראני. רק מקצתם נושאים את המוטציה השכיחה בקודון 30. אצל כל החולים התלונות הראשונות הן אלו של נוירופתיה תחושתית, והן כוללות רדימות, פרסטזיות וכאב נוירופתי בגפיים התחתונות. במרוצת הזמן ההפרעה התחושתית מתפשטת גם לגפיים העליונות בצורה של כפפות וגרביים האופיינית לנוירופתיה. הכאב הולך ומחמיר עם השנים והופך לקשה ולבלתי נסבל אצל רוב החולים. חולשה מתפתחת בתוך חודשים עד מספר שנים, תחילה דיסטלית ובהמשך גם בשרירים הפרוקסימליים, ומביאה את החולים לריתוק לכס גלגלים. סימני נוירופתיה אוטונומית קיימים אצל כמחצית החולים בתחילה. הם כוללים הפרעה בתפקוד המיני, עצירות, אי שליטה על מתן השתן, פה יבש, ואורתוסטטיזם עם התעלפויות. הנוירופתיה האוטונומית של מערכת העיכול מחמירה ועלולה לגרום לתסמונת אי ספיגת מזון, ירידה במשקל, קכקסיה, ולהוות גורם למוות.
מחוץ למערכת העצבים האיבר שנפגע בשכיחות הגבוהה ביותר הוא הלב. קרדיומיופתיה עמילואידית ניתנת לזיהוי באקוקרדיוגרם כנצנוץ גרנולרי. אי ספיקת לב אף היא מהווה אחת מסיבות המוות במחלה. יש מוטציות ספציפיות, כגון val121iso, אשר גורמות לקרדיומיופתיה, כמעט ללא נוירופתיה או מעורבות של איברים אחרים. מוטציה זו לא תוארה בישראל.
מהלך המחלה בישראל חמור יותר מזה השכיח בעולם. ברוב הארצות, ללא טיפול החולים נפטרים לאחר כעשר שנים. החולים שאותרו בארץ נפטרו לאחר 4–7 שנים מפרוץ מחלתם.
אבחון
אבחון נע"מ כולל ביצוע בדיקת הולכה עצבית בשלבים המוקדמים. הנוירופתיה האופיינית לנע"מ היא נוירופתיה סנסורימוטורית אקסונלית. כאשר אין סימנים מחשידים אחרים, יש לשלול סיבות מקובלות לנוירופתיה.
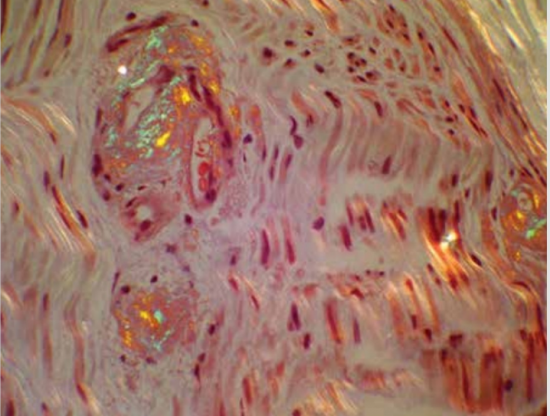
לאחר מכן, בחלק גדול של המקרים נערכת ביופסיית עצב. בביופסיה נמצאת נוירופתיה אקסונלית הכוללת הפחתה של מספר סיבי העצב עטופי המיאלין וחסרי המיאלין. אולם, בנוסף יש לחפש משקעי עמילואיד בצביעת congo red. המשקעים נצפים היטב בעזרת אור מקוטב כזוהרים בצבע "ירוק תפוח" (תמונה מספר 1). העדר משקעי עמילואיד אינו שולל את אבחנת נע"מ, היות שתיתכן טעות דגימה ובמקטע העצב שנלקח אין משקעים. במקרים אלה, כאשר קיים חשד גבוה לנע"מ, יש להמשיך בבירור גנטי.
חולים אשר יש להם נוירופתיה סנסורית ואוטונומית בתחילת מחלתם, במיוחד אם הם ממוצא יהודי תימני, חשודים כלוקים בנע"מ. ניתן להתקדם לבירור גנטי ללא ביצוע ביופסיית עצב, אשר היא פעולה פולשנית עם סיבוכים אפשריים. במקרה של יהודים ממוצא תימני מבצעים בדיקה ספציפית של המוטציה האופיינית לעדה, וככלל מבצעים סריקה של הגן TTR בחיפוש אחרי מוטציה.
חשוב לאבחן את המחלה בשלבים המוקדמים מאחר שקיים טיפול למחלה.
השתלת כבד בחולי נע"מ
הטיפול היחיד למחלה שהיה זמין, היה השתלת כבד. ההיגיון בהשתלה הוא הסרת המקור העיקרי לחלבון המוטנטי. במחקרים ביוכימיים נמצא שהשתלת כבד מפחיתה מאוד את ייצור החלבון הפגום, כיוון שהכבד המושתל מייצר חלבון TTR תקין. אם מבצעים את ההשתלה מוקדם במהלך המחלה, זמן קצר לאחר הופעת התלונות, המחלה מתקדמת הרבה יותר לאט ויכולה להאריך את תוחלת החיים של החולים ליותר מ-20 שנה. אולם, היות שהחלבון המוטנטי ממשיך להיות מיוצר במוח וברשתית, ההשתלה אינה מונעת את סיבוכי המחלה במוח ובעין. מאחר שקיימת שקיעה מסוימת גם של החלבון הלא מוטנטי, השתלת כבד אינה מונעת את הופעת הפרעות קצב לבביות.
ההשתלה מתבצעת בשיטה הקרויה "השתלת דומינו", כאשר הכבד של החולה מושתל אצל חולה אחר הלוקה באי ספיקת כבד. בדרך כלל, נע"מ לא מתפתחת אצל המושתלים בכבד החולה, כיוון שיש צורך בשנים רבות של הפרשת TTR מוטנטי כדי לגרום למחלה. אולם, תואר חולה שעבר השתלה מחולה נע"מ אשר המחלה הופיעה אצלו לאחר שמונה שנים מההשתלה. בישראל, עברו, נכון לכתיבת מאמר זה, שני חולי נע"מ השתלת כבד, ובהצלחה.
טיפול תרופתי
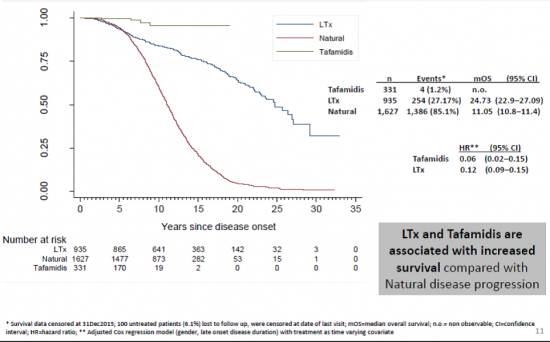
לפני מספר שנים הוכנסה לשימוש תרופה לטיפול בנע"מ בשם טפמידיס (Tafamidis meglumine). התרופה, ששמה המסחרי Vyndaqel, אושרה לשימוש על ידי האיגוד האירופאי כטיפול בנע"מ בשלבים המוקדמים (Stage 1 neuropathy). התרופה מתחברת לאזורי הקשירה של תירוקסין על הטטרמר של TTR ומונעת מעבר שלו למונומרים, אשר שוקעים כעמילואיד. במחקר מבוקר כפול סמויות נמצאה השפעה חיובית של הטיפול התרופתי על מהלך המחלה. השיפור המשמעותי ביותר נצפה באיכות החיים ובעלייה במשקל, אך גם בערכים של הנוירופתיה[9]. עם זאת, התרופה לא אושרה עדיין על ידי סוכנות התרופות והמזון (FDA - Food and Drug Administration) האמריקאית. מחקר זה, שהביא לאישור התרופה, נערך על חולים עם המוטציה השכיחה Val30Met, אך בהמשך התפרסם מחקר נוסף אצל חולים עם מוטציות שונות[10] ותוצאותיו היו דומות. מאז המחקרים נערך מעקב בן 10–15 שנים אחרי החולים שקיבלו את התרופה, והתברר שאצל חולים שקיבלו את הטפמידיס בשלבים מוקדמים של המחלה נמנע הצורך במקרים רבים בהשתלת כבד ומהלך המחלה היה אפילו טוב יותר מאשר זה של החולים שעברו השתלת כבד (תמונה מספר 2).
תרופה נוספת שנוסתה בטיפול בנע"מ היא Diflunisal. זוהי תרופה ממשפחת התרופות נוגדות הדלקת הלא סטרואידיאליות (NSAIDs - Non-Steroidal Anti-Inflammatory Drugs). היא מאטה את יצירת העמילואיד על ידי מניעת ההתפרקות ה-TTR המוטנטי. במחקר כפול סמויות אצל 130 חולים למשך שנתיים הוא נמצא יעיל, אלא שלמחקר זה היו מגבלות מרובות[11]. במעקב רטרוספקטיבי של החולים שקיבלו את התרופה נמצא שלמעלה ממחציתם הפסיקו את השימוש בשל תופעות לוואי[12].
בנוסף, התפתחה טכניקה פרמקולוגית חדשה של עיכוב RNA באמצעות RNA interference) RNAi). RNAi הוא מנגנון תאי לשליטה בהתבטאות של הגנים, אשר בו small interfering RNAs) siRNAs) מתווכים בתהליך ניתוק RNA שליח. ניתן להפוך siRNAs לתרופות ולגרום להפחתה בהתבטאות של גנים. חוקרים הצליחו להפוך siRNAs כנגד TTR לתרופה על ידי אנקפסולציה בעזרת ננוטכנולוגיה. פורסם מחקר[13] שבו נמצא כי מתן התרופה לחולי נע"מ ולבריאים הפחית את ייצור TTR המוטנטי והתקין ללא תופעות לוואי משמעותיות. יש לקוות שבהמשך הניסויים התרופה תוכח כיעילה בטיפול בנע"מ.
ביבליוגרפיה
- ↑ Andrade C. A peculiar form of peripheral neuropathy: familial atypical generalized amyloidosis with special involvement of the peripheral nerves. Brain 1952; 75: 408–27.
- ↑ Araki S, Mawatari S, Ohta M, et al. Polyneuritic amyloidosis in a Japanese family. Arch Neurol 1968; 18: 593–602.
- ↑ Andersson R. Familial amyloidosis with polyneuropathy. A clinical study based on patients living in northern Sweden. Acta Med Scand (Suppl) 1976; 590: 1–64.
- ↑ Pras M, Prelli F, Franklin EC, Frangione B. Primary structure of an amyloid prealbumin variant in familial polyneuropathy of Jewish origin. Proc Natl Acad Sci USA 1983; 80: 539-42.
- ↑ Jacobson DR, Buxbaum JN. A double-variant transthyretin allele (Ser 6, Ile 33) in the Israeli patient ‘SKO’ with familial amyloidotic polyneuropathy. Hum Mutat 1994; 3: 254-260.
- ↑ Lossos A, Soffer D, Steiner-Birmanns B, et al. Extended phenotype in the transthyretin Tyr77 familial amyloid polyneuropathy. Eur Neurol 2005; 53: 55-59.
- ↑ Kaplan B, Shinar Y, Avisar Ch, Livneh A. Transthyretin amyloidosis in a patient of Iranian-Jewish extraction: a second Israeli-Jewish case. Clin Chem Lab Med 2007; 45: 625-628.
- ↑ Leibou L, Frand J, Sadeh M, et al. Clinical and Genetic Findings in Eight Israeli Patients with Transthyretin-Associated Familial Amyloid Polyneuropathy. IMAJ 2012; 14: 662-665.
- ↑ Coelho T, Maia LF, Martins da Silva A, et al. Tafamidis for transthyretin familial amyloid polyneuropathy: a randomized, controlled trial. Neurology 2012;79:785-92.
- ↑ Merlini G, Planté-Bordeneuve V, Judge DP, et al. Effects of Tafamidis on transthyretin stabilization and clinical outcomes in patients with non-Val30Met transthyretin amyloidosis. J Cardiovasc Trans Res 2013; 6: 1011-1020.
- ↑ Berk JL, Suhr OB, Obici L, et al. Repurposing diflunisal for familial amyloid polyneuropathy: a randomized clinical trial. JAMA 2013; 310:2658–2667.
- ↑ Whelan CJ, Sattianayagam P, Dungu J, et al. Tolerability of diflunisal therapy in patients with transthyretin amyloidosis. XIIIth International Symposium on Amyloidosis; 6–10 May 2012. Abstract OP 56.
- ↑ Coelho T, Adams D, Silva A, et al. Safety and efficacy of RNAi therapy for transthyretin amyloidosis. N Engl J Med 2013; 369:819-29.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' מנחם שדה - מחלקה נוירולוגית, המרכז הרפואי ע"ש אדית וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק