ניטור דיגוקסין - Digoxin monitoring
הופניתם מהדף ניטור דיגוקסין לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| ניטור דיגוקסין | |
|---|---|
| Digoxin monitoring | |
| שמות אחרים | Lanoxin, Digitalis |

| |
| מעבדה | כימיה בדם |
| תחום | אי-ספיקת לב, הפרעות קצב. |
| טווח ערכים תקין | מתחת לגיל 16 שנה – תחומים תרפויטיים לא חושבו לבני 16 שנה ומטה לבני 16 שנה ומעלה – התחום התרפויטי 0.6-1.2 ננוגרם/מ"ל, ואילו ריכוזים טוקסיים ואף מסכני חיים הם מעל 4.0 נוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
ניטור התרפיה עם דיגוקסין.
מידע קליני
תרכובות במשפחת הדיגיטליס של גליקוזידים מורכבות מגרעין סטרואידי, טבעת לקטון, וסוכר.
הנוסחה האמפירית של דיגוקסין היא: C41H64O14, והמשקל המולקולרי שלו 780.938 גרם למול'.
הזמינות הביולוגית של דיגוקסין בנטילה פומית היא של 60 עד 80%, כאשר 16% מהמטבוליזם שלו מתבצעת בכבד. דיגוקסין משפר את העוצמה של כיווץ שריר הלב, מה שמגביר את ה-output הלבבי, מקטין את גודל הלב, מקטין את הלחץ הוורידי, ומקטין את נפח הדם. תרפיה עם דיגוקסין מייצבת ומפחיתה את קצב הדופק החדרי. השפעות תרפויטיות אלו נגרמות על ידי אינטראקציות ישירות ובלתי-ישירות על שריר הלב, על כלי הדם, ועל מערכת העצבים האוטונומית (Datta וחב' ב-Clin Biochem משנת 1996, ו-Joltani ו-Voldewc ב־Crit Rev Clin Lab Sci משנת 1997). בנטילה פומית דיגוקסין נספג היטב ברקמות ובעיקר בלב, בכליות ובכבד. מספר גורמים יכולים להשפיע על ספיגת החומר כולל חיידקים במעי, נוכחות של מזון במעי, פעילות גופנית עצימה. בליעה של quinine או quinidine וצריכה בו-זמנית של מגוון תרופות. ילדים אמורים להיות מטופלים עם כמויות דיגוקסין גבוהות יותר בהשוואה למבוגרים. לאחר נטילת דיגוקסין יש עליה מהירה ומוקדמת של רמתו בנסיוב, ולאחר 6-8 שעות מתקיים שיווי משקל בין רמתו בנסיוב וברקמות. לכן יש צורך להמתין פרק זמן זה מאז הנטילה האחרונה של דיגוקסין. חומר זה מופרש בעיקר בשתן, כאשר תקופת מחצית החיים של דיגוקסין היא 36–40 שעות, ויכולה להיות ארוכה יותר באלה עם מחלת כליות, מה שעלול להעלות את רמתו בדם וברקמות ולטוקסיות. תסמינים טוקסיים מחזקים לרוב את הפרעות קצב הלב ואי-ספיקת הלב. תסמינים טוקסיים אחרים כוללים השפעות על מערכת העיכול, כגון אנורקסיה, בחילה והקאות, כאבי בטן ושלשולים. כן יכולים להיות תסמינים נוירו-פסיכולוגיים, כגון עייפות, חולשה, טשטוש, ראייה מעורפלת ופוטופוביה, הזיות ראייתיות ושמיעתיות, תחושה פרנואידית, ודיכאון. טוקסיות של דיגוקסין יכולה לשקף מספר גורמים: לתכשיר יש חלון תרפויטי צר (דהיינו הבדל קטן מאוד בין הרמות התרפויטיות והטוקסיות שלו ברקמות). מטופלים הם בעלי יכולת שונה בתגובה לדיגוקסין, ורגישות המטופלים להשפעה הטוקסית שלו גדלה עם הגיל.
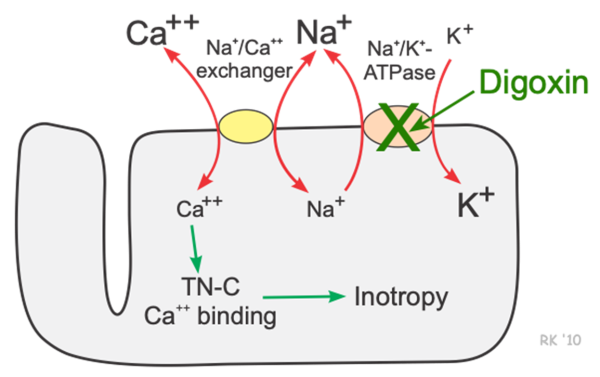
דיגוקסין היא תרופה קרדיולוגית עתירת שנים המשמשת לטיפול בהפרעת קצב, טכיקרדיה, וכן באי ספיקת לב. הוא שייך למשפחת הדיגיטליס שמוצו מהצמח purporea (אצבעונית ארגמנית), שזכה לשימוש כבר לפני מאות שנים, והגיע לשיא באמצע המאה ה-20, אם כי חלה ירידה בקרנו עם הכנסת תכשירים "מודרניים". מנגנון הפעולה העיקרי של דיגוקסין הוא בעיכוב משאבת נתרן-אשלגן, בעיקר בשריר הלב, מה שגורם לעלייה ברמת הנתרן התוך-תאית. במצב רגיל סידן אמור לצאת מחוץ לתא ובמקומו אמור להיכנס נתרן, אך בגלל העלייה ברמת הנתרן, פעולה זו לא מתרחשת ובמקומה עולה בתא רמת הסידן, הנגיש לתאים. כתוצאה מכך עולה כוח ההתכווצות של שריר הלב.
התרופה ניתנת בדרך כלל במינון שיגרום לעיכוב מתון בפעולת 'המשאבה' של 20-40%. אפקט אינוטרופי חיובי מתקבל במנה שהיא 50–60 אחוז מן המנה הטוקסית.
לטיפול בדיגוקסין יש שתי מטרות טיפוליות עיקריות
- הפרעות קצב מהירות, טכיאריתמיות: אחד השימושים הקלאסיים בדיגוקסין הוא בליקויי המערכת החשמלית של הלב, המביאים להפרעות קצב מהירות. בניגוד לתרופות אנטי-אריתמיות הנוגדות הפרעות קצב אחרות, הדיגוקסין אינו מיועד להפסיק את ההפרעות ולהחזיר ללב את קצב הסינוס הטבעי שלו, אלא להאט את מספר ההתכווצויות בפועל של החדרים, להבדיל ממספר האותות החשמליים בדקה.
אפקט זה מושג בפעולת הדיגוקסין על ה"קשרית העלייתית-חדרית" (Atrio-Ventricular Node), שמאריכה את משך הזמן בו אינה מאפשרת העברה של אותות חשמליים לחלקים התחתונים של מערכת ההולכה. כתוצאה מכך מושגת האטה ניכרת בהפרעות הכרוכות במספר גבוה ביותר של גירויים על-חדריים, כפרפור, ורפרוף פרוזדורים. עם זאת, יאמר כי התרופה אינה משפיעה לטובה אלא על המערכת החשמלית העל-חדרית, לכן אין להשתמש בה לטיפול בהפרעות קצב חדריות. - אי ספיקת לב: מנגנון פעולתו הכימי הייחודי והמורכב של הדיגוקסין מקנה לו אפקט נדיר בקרב התרופות האנטי-אריתמיות. לרוב התרופות הללו אין רק אפקט כרונוטרופי שלילי בהורדת קצב הלב, אלא הן גם בעלות אפקט אינוטרופי שלילי: הן מחלישות את עצמת ההתכווצות של הלב. הדבר מסבך את השימוש בהן עבור חולים עם ירידה ניכרת בתפקוד הלב. בשונה מכל התרופות האחרות, הדיגוקסין מביא לאגירה מוגברת של סידן ברשתית הסרקופלסמית, ולפיכך מגדיל את עצמת פונקציית ההתכווצות של החדרים. בה בעת שהוא מוריד את תדירותה. קיימים מספר תנאים להתוויית-נגד מוחלטת במתן דיגוקסין: א) תסמונת wolff-parkinson-white: בתסמונת זו קיים חיבור חשמלי עודף ובלתי נחוץ, המאפשר העברת אותות ישירים בין העליות לחדרים (בלי שיעברו דרך ה"צומת").
חסמי הולכה בדרגה גבוהה: ברור כי חלק ניכר מהחולים המאובחנים עם אי-ספיקת לב סובלים לא רק מירידה בתפקוד הסיסטולי של חדר שמאל, אלא גם מירידה בתפקוד הדיאסטולי שלו, היינו - ירידה ביכולת השריר להרפיה בין ההתכווצויות. תוצאה זו מביאה לכך שחולים עם התכווצות תקינה של החדר וערכי מקטע פליטה תקינים לכאורה, יסבלו מאותם סימפטומים של אי ספיקת לב המאפיינים אי-ספיקה סיסטולית "קלאסית", וזאת משום שכשהשריר אינו מתרפה כראוי, יש פגיעה במילוי החדר ונוצרת אי-ספיקה. חולים כאלה לא יצאו נשכרים מטיפול בתרופה, שתגביר עוד יותר את עצמת התכווצות החדרים.
היריון והנקה אינם מהווים התווית נגד לנטילת דיגוקסין. להפך, קבוצת הנשים הצעירות, אשר בחלק מהמקרים מקבלות דיגוקסין בשל הפרעת קצב עצמאית ממחלת לב אורגנית, נחשבת לאוכלוסייה אידיאלית לטיפול בתרופה זו, בשל הסיכון הנמוך לסיבוכים, ותינוקות בריאים רבים נולדו לאחר הריונות מלווי-דיגוקסין. עד סוף המאה ה-20, הדיגוקסין היה ברירת מחדל לטיפול בחולי לב רבים, בין אם בשל תפקוד ירוד, בשל פרפור פרוזדורים או בשתי האינדיקציות גם יחד. מאז השימוש בדיגוקסין פחות נפוץ, וחלק ניכר מהרופאים לא נוטים להרבות בו, מהסיבות הבאות:
האפקט הפרו-אריתמי: נוסף על האפקט הרצוי של התרופה, יכול הדיגוקסין לעודד את הפעילות של מוקדים אקטופיים, וכך להביא להיווצרות הפרעות קצב חדריות, בקרב אוכלוסייה שבמקרים רבים היא פגיעה לכך ממילא.
האטת יתר: השפעת הדיגוקסין על הקשרית העלייתית-חדרית עשויה שלא להיעצר ברף הרצוי, אלא לשתק אותה לפרקי זמן ארוכים מהרצוי והדרוש, עד כדי חסימתה החלקית למעבר אותות חשמליים מלמעלה. כתוצאה מכך עלולות להיגרם ברדיקרדיות שאף הן עשויות להיות מסוכנות. אפקט זה אינו בלעדי לדיגוקסין, והוא עלול להופיע, אם כי פחות, עם כל תרופה הפועלת על ה"צומת" - בין אם מדובר בחוסמי β או חוסמי תעלות סידן.
החלון התרפויטי הצר: אכן, לדיגוקסין נטייה הידועה לגרום להרעלה, לעיתים אף לגרום מוות. כך שבאופן אבסורדי, הסיכוי להרעלה גבוה יותר ככל שהחולה זקוק יותר לתרופה. חולים אלה, הסובלים בדרך כלל מאי ספיקת לב (להלן אס"ל) מתקדמת (NYHA 3-4), זקוקים לטיפול בדיורטיקה (בדרך כלל פוסיד), העלולה לדלדל את רמות האשלגן שלהם, וכך להגביר את רעילותו הפוטנציאלית של הדיגוקסין, כי הוא מתקשר-מתחרה עם יוני אשלגן על משאבת הנתרן-אשלגן (Na+/K+ ATPase).
סיבוך נפוץ של אס"ל מתקדמת הוא אי ספיקת כליות שמאריכה את זמן פינויו של הדיגוקסין מהגוף, מגבירה את ריכוזו בדם ומעלה את הסיכוי להרעלה. נוסף לכך, בעלי תפקוד סיסטולי ירוד במיוחד נחשבים לחשופים ביתר-שאת להפרעות קצב חדריות קשות ואף קטלניות: בעבר שלטה בטיפול באס"ל גישה שהתמקדה בטיפול בסימפטומי המחלה, היינו בצבירת נוזלים (באמצעות דיורטיקה) ובירידה ביכולת התפקודית. מאז העשור האחרון של המאה ה-20 התפתחה בטיפול באס"ל, פרדיגמה חדשה "נוירו-הומוראלית", השמה את הדגש על מעורבותם של חומרים כימיים בדינמיקה הפתולוגית של אס"ל. לפי פרדיגמה זו, הטיפול הרצוי באס"ל הוא כזה שמבודד ומנטרל את החומרים החיוניים לתהליך הסחרור ההרסני (קטכולאמינים, אנגיוטנסין/אלדוסטרון), ולא כזה שמטפל בתוצאת פעולתם. נמצא שטיפול כזה הוא בעל מתאם חיובי לסיכויי הישרדות משופרים אצל חולי אס"ל, בעוד שלדיגוקסין אין זיקה כזו. לפיכך, המגמה השלטת היא לדחות ככל האפשר את השימוש בדיגוקסין אצל חולי אס"ל, ולשמור אותו למצבים שבהם הטיפול בחוסמי ACE, חוסמי β ודיורטיקה במינונים אופטימליים אינו משחרר את החולה מסימפטומים.
מחקר DIG מצא כי אין שיפור באיכות החיים או בהישרדות של מטופלים הנוטלים דיגוקסין, אלא רק הפחתת אשפוזים בבתי החולים. דיגוקסין הוא גליקוזיד קרדיאלי שהשפעותיו יונוטרופיות, בנוסף להשפעתו על ה-output הלבבי. שימושיו העיקריים באי-ספיקת לב ובפרפור פרוזדורים. תכשיר זה נמצא מפחית אשפוזים, ללא השפעה על תמותה במטופלים עם אי-ספיקת לב. הטיפולים עם דיגוקסין פחתו לאור העובדה שיש לו אינדקס תרפויטי צר, הדורש ניטור קפדני. הוא אף עלול לגרום לתרחישים לא רצויים אחדים, כגון אינטראקציה עם תרופות ונטייתו להיות טוקסי. אך למרות אלה הוא עדיין משמש בתרפיה לבבית בגלל תכונותיו המסייעות ולא כתרופת קו-ראשון (Yancy וחב' ב-Circulation משנת 2013,ו-Fuster וחב' באותו כתב-עת משנת 2001). בשנת 1785, הכימאי-בוטנאי ורופא בריטי סר William Withering פרסם את ממצאו ש-digitalis purpurea היה יעיל בטיפול של cardiac dropsy (או אי ספיקת לב גדושה, להלן CHF). דיגוקסין היה בשימוש כמעט 200 שנה, אך זכה לאישור ה-FDA לטיפול באי ספיקת לב רק בשנות 1990 המאוחרות (Maron ו-Rocco ב-Pharmacol Congest Heart Failure משנת 2011). לדיגוקסין יש מספר שימושים off-label, כמו טכירדיה סופרה-חדרית, cor pulmonale, ויתר לחץ-דם פולמונרי. דיגוקסין פועל על ידי עיכוב משאבת sodium-potassium ATPase, ובכך הוא מסייע להֲמָרָה של נתרן בסידן, וזה גורם להעלאה של רמת הסידן התוך-תאי, ולהגברת יכולת הכיווץ של הלב. דיגוקסין הוא גם בעל תכונות פארא-סימפתו-מימטיות על ידי הגברת הטונוס של עצב הואגוס בצמתים הסינו-פרוזדורי (SA) והעלייתי-חדרי (AV) הוא מקטין את קצב הלב ואת המעבר החשמלי בקשרית העלייתית-חדרית (Ehle וחב' ב-Crit Pathw Cardiol משנת 2011).
על פי ההנחיות האחרונות, דיגוקסין יכול לשמש כטיפול נוסף לחוסמי-β או לחוסמי הקולטן של ACE, בהתנהלות של CHF. לדיגוקסין יש תכונות כרונוטרופיות שליליות ונמצא מפחית את התחלואה במטופלים עם פרפור פרוזדורים, ולפיכך יכול לשמש כטיפול נוסף במטופלים אלה שקצב ליבם אינו מווסת כהלכה על ידי חוסמי β בלבד. בגין השפעה היונוטרופית החיובית שלו, דיגוקסין יכול לייצר יתרונות ביתר לחץ-דם עורקי פולמונרי (Rich וחב' ב-Chest משנת 1998). CHF הוא ליקוי בתפקוד שריר הלב הנגרם על ידי כושר הכיווץ של הלב, ועל ידי ההרפיה החדרית ויכולת המילוי של הלב, מה שמפחית את ה-output הלבבי. דיגוקסין יעיל במטופלים עם CHF בגלל תכונותיו היונוטרופיות החיוביות. התפקיד של דיגוקסין ב-HF נקבע במספר ניסויים. ניסוי מבוקר וכפול-סמיות, של השפעת דיגוקסין ב-CHF, שנמשך 7 שבועות, בו נבדק תפקוד הלב על ידי מדידת מקטע הפליטה (EF), שנמצא משופר במטופלי דיגוקסין (Guyatt וחב' ב־Am J Cardiol משנת 1988). על פי הנחיות של ה-AHA לגבי התנהלות של HF, דיוגקסין משפר תסמינים ואיכות חיים, במטופלים עם HF קלה עד מתונה. המינון ההתחלתי של דיגוקסין הוא 0.125-0.25 ליום בנטילה פומית. יש להתאים את המינון תוך התחשבות בתפקוד הכליות, ובגיל. ריכוז היעד של דיגוקסין בנסיוב הוא 0.5-0.9 ננוגרם/מ"ל.
תחלואה ותמותה ב-HF
דיגוקסין נמצא יעיל בהפחתת תסמיני HF, והשפעתו על תחלואה ותמותה נמדדה גם כן. ניסוי אקראי, כפול-סמיות, בוצע על מנת לבחון תחלואה ותמותה באלה עם HF ו-EF של החדר השמאלי של פחות מ-45%. המעקב בניסוי זה נמשך 37 חודשים. הניסוי מצא 1,181 מקרי מוות בקבוצת מטופלים עם דיגוקסין, ו-1,194 מקרי מוות בקבוצת הפלצבו (34.8% לעומת 35.1%) כשמדובר בהבדל לא משמעותי. עם זאת, מספר קטן יותר של מטופלי דיגוקסין בהשוואה למטופלי פלצבו אושפזו (910 לעומת 1,180, בהתאמה, עם RR של 0.72, ו-p<0.001 ). כמו כן, הסיכון הכרוך במוות כתוצאה מהחמרה ב-HF, או שרמת האשפוז הייתה נמוכה יותר בקרב מטופלי דיגוקסין (1,041 לעומת 1,291, עם p<0.001). מסקנת ניסוי זה הייתה שאף על פי שדיגוקסין לא השפיע על רמת המוות בכללותה, הוא הפחית משמעותית את האשפוזים המיוחסים להחמרה ב-HF.
דיגוקסין ו-AF
AF היא הפרעת קצב שכיחה בה אימפולסים חשמליים לא סדירים עוברים בלב, וגורמים להתכווצויות לב לא מבוקרות ובלתי יעילות. כתוצאה מכך, מאגרי דם בלב, עלולים להגדיל את האפשרות של קרישי דם, העלולים להביא לאוטם שריר הלב או לשבץ מוחי. דיגוקסין מפגין את יעילותו ב-AF על ידי בקרה של קצב הלב. ניסוי רב-מוסדי, אקראי וכפול-סמיות העריך את התועלת של דיגוקסין לעומת פלצבו, ב-43 מטופלים עם AF פרוקסימלי (Murgatroyd וחב' ב-Circulation משנת 1999). משתתפי הניסוי היו בני 18 שנה ומעלה שבעברם אחת או יותר אפיזודה של AF בחודש. נקודת הקצה של הניסוי הייתה פרק הזמן עד להופעה של אפיזודה אחת או שתיים של AF. פרק זמן הממוצע שנדרש לשתי אפיזודות היה 13.5 יום למטופלי פלצבו, ו-18.7 יום למטופלי דיגוקסין (p<0.05). פרק הזמן הממוצע שנדרש לאפיזודה אחת היה 3.5 ימים למטופלי פלצבו, בהשוואה ל-5.4 יום בקרב מטופלי דיגוקסין (p<0.05). מחקר במדגם של 122,465 מטופלים בגיל הממוצע של 72 שנה שזוהו עם AF, מצא שיעור תמותה גבוה יותר בקרב מטופלי דיגוקסין, בהשוואה לאלה שלא טופלו (P <.001) (Turakhia וחב' ב־J Am Coll Cardiol משנת 2014). נראה שטיפול עם דיגוקסין היה מנבא בלתי תלוי בתמותה למרות ערפילנים כגון גיל, תפקוד כליות, הצמדות לטיפול, והיסטוריה של סיבוכים קרדיו-וסקולריים.
דיגוקסין ו-pulmonary arterial hypertension (להלן PAH)
PAH היא מחלה פרוגרסיבית בה שפיעת דם מוגבלת בעורקים הריאתיים גורמת להגברת התנגודת הוסקולרית הריאתית וכתוצאה מכך בסופו של דבר לאי-ספיקה לבבית (HF) ימנית. PAH מוגדר על ידי הגדלה של לחץ בעורקים הריאתיים של למעלה מ-25 מ"מ כספית במנוחה, או מ-30 מ"מ כספית בפעילות גופנית. חלופות טיפוליות עדכניות ב-PAH כוללות תרפיה תמיכתית ותכשירים כגון דיגוקסין, תכשירים משתנים (diurtics), קומאדין, וחוסמי תעלות הסידן. יתר לחץ-דם ריאתי לרוב כרוך בשפעול של הנוירו-הורמונים סימפתטיים, באופן שדיגוקסין יכול לשמש לטיפול בגלל תכונותיו הסימפתוליטיות. הנחיות עדכניות במקרי PAH מזכירות בקצרה את השימוש בדיגוקסין בגלל השפעותיו התועלתיות על ה-output הלבבי ועל ה-norepinephrin בצירקולציה. לפיכך, השימוש בדיגוקסין במטופלים עם PAH מבוסס על השיקול הקליני של הרופא (Turakhia וחב' ב-J Am Coll Cardiol משנת 2014), הטיפול עם דיגוקסין במטופלי PAH לא הוערך באופן גורף, ומנגנון השפעתו במקרים אלה אינו ידוע (Barst וחב' באותו כתב-עת משנת 2009). ניסויים פרוספקטיביים אקראיים לא נערכו (Humbert וחב' ב-N Eng J Med משנת 2004, ו-Steiner וחב' ב-West J Med משנת 1994). קיימת אזהרה לפיה מטופלים עם חסימה משמעותית בקשרית העלייתית-חדרית (AV block), אך אמורים להיות מטופלים עם דיגוקסין לפני שהם עוברים השתלת קוצב-לב. הטיפול בתכשיר זה אמור להינתן בזהירות אם הוא ניתן למטופלים בתכשירים אחרים שעלולים לדכא את תפקוד הקשרית העלייתית-חדרית, כגון חוסמי β, או עם nondihydropyridine CCBs.
הוראות לביצוע הבדיקה
ב-12 השעות שלפני הבדיקה אין לצרוך מולטי-ויטמינים או תוספי מזון המכילים ביוטין (ויטמין B7). את דגימת הדם יש לאסוף במבחנה כימית (פקק אדום או צהוב), והעדפה של מבחנה המכילה ג'ל, ואת הדגימה יש לסרכז לא יאוחר משעתיים לאחר הוצאת הדם, ואת הנוזל העליון יש להעביר למבחנת פלסטיק. את הבדיקה יש לבצע לאחר 6–8 שעות מהנטילה האחרונה של דיגוקסין. יש לפסול דגימה מאוד המוליטית. יציבות הדגימות היא כדלקמן: דגימה הנשמרת בקירור (הצורה המועדפת) יציבה למשך 7 ימים, ואילו דגימה קפואה נשמרת למשך 180 יום. שיטת הבדיקה: Electrochemiluminescent Immunoassay.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק