סרטן השד - טיפול - היבטים כירורגיים - Breast cancer - treatment - surgical aspects
עקרונות בכירורגיה
מאת ד"ר צבי קויפמן
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של השד | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
טיפול מרפא
טיפול מרפא ניתן להעניק לחולות מדרגה 1 ו-2. הטיפול בחולות מדרגה 3 ו-4 הוא מקל (פליאטיבי).
מועד הטיפול הכירורגי
בתחילת שנות ה-90 התגבשה הגישה של כירורגיה בשני שלבים (ביופסיה בשלב ראשון וטיפול כירורגי בשלב שני), דהיינו, שלב האבחנה מופרד משלב הטיפול. יתרונות השיטה הזו הם אנושיים, רפואיים וכלכליים. העדיפות היא לביופסיה מחטית ורק במידה וזו אינה מספקת יש לבצע ביופסיה פתוחה (ראה הגישה לברור גוש בשד).
- את הביופסיה ניתן לבצע באלחוש מקומי, דבר החוסך ימי אשפוז ומקטין את העומס על חדרי הניתוח
- ניתן למנוע את הסבל והסיכונים שבאלחוש כללי מ-2/3 הנשים המגיעות לביופסיות (ולא נמצאה בהן שאת ממארת)
- החולה יכולה לקבל אינפורמציה מדויקת על מהות מחלתה ולהחליט בשיתוף רופאיה ובני משפחתה על סוג הטיפול שהיא תקבל (כריתה מקומית והקרנות או כריתה רדיקאלית)
- גישה זו מאפשרת לבצע בדיקות עזר באופן סלקטיבי על מנת לקבוע את דירוג המחלה לפני הניתוח ולקבוע בהתאם את סוג הטיפול
החסרונות המצוינים בספרות לגישה זו הם: אפשרות של פיזור גרורתי בעקבות הביופסיה וזמן ההמתנה. דעה זו נשמעה על-ידי מספר מחברים שהראו שדחייה של שבועיים בטיפול מקטינה את סיכויי ההיוותרות בחיים. אולם בעבודות של השנים האחרונות ממצאים אלה לא הוכחו. מהספרות שהתפרסמה עד היום נראה שאין סיכון יתר בגישה הדו-שלבית.
בסקרים רטרוספקטיבים ארוכי טווח נמצא שעיכוב בטיפול למעלה מ-3 חודשים לאחר האבחנה היה כרוך בפרוגנוזה גרועה יותר. הסיבה העיקרית לכך היתה דירוג מתקדם יותר של המחלה בחולות אלה. הפרוגנוזה של חולות מאותה דרגה היתה דומה.
טיפול ניתוחי
Halsted, הנחשב לאבי כירורגיית השד המודרנית, חי בסוף המאה ה-19 ובתחילת המאה העשרים. הוא טען שהשאת הממארת בשד מתחילה כשאת מקומית המתפשטת מהשד בצורה צנטריפוגלית לבלוטות הלימפה המהוות מחסום בפני התפשטות השאת. העקרונות אותם תיאר היו:
- התפשטות השאת היא בצורה מסודרת ובהתאם לעקרונות מכניים.
- תאי השאת מגיעים לבלוטות הלימפה דרך כלי הלימפה.
- בלוטות לימפה נגועות הינן עדות להתפשטות השאת.
- בלוטות הלימפה משמשות כמחסום להתפשטות השאת.
- התפשטות דרך כלי הדם היא מיקטנית (מינימלית).
- השאת היא אוטונומית במאכסן.
- מכאן נובע העיקרון הכירורגי ששאת הניתנת לכריתה היא שאת מקומית או זו שהתפשטה לבלוטות הלימפה בלבד.
- מכיוון שהשאת הממארת היא מחלה מקומית הרי ככל שהניתוח הוא נרחב יותר סיכויי הריפוי טובים יותר.
העקרונות הכירורגיים אותם קבע Halsted היו:
- כריתה רחבה של עור השד, וכיסוי הפגם על-ידי שתל עור.
- כריתת שרירי החזה (פקטורליס), כחלק מכל טיפול ניתוחי בסרטן השד.
- כריתת בלוטות הלימפה בבתי השחי.
- כריתה נרחבת של כל רקמת השד כחטיבה אחת.
עקרונות אלה שימשו בסיס לניתוחי כריתת השד השונים.
כריתה נרחבת של השד - Radical mastectomy
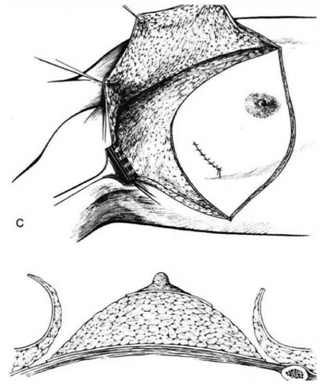
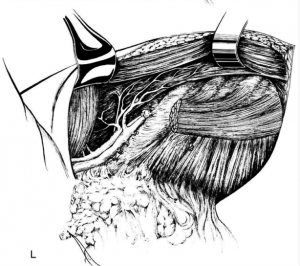
ניתוח זה תואר על-ידי Halsted כפתרון כירורגי לסרטן השד. בניתוח זה מבצעים חתך אליפטי רוחבי או אלכסוני סביב השד (איור 22.12),
כורתים את השד תוך הכנת שני מתלי עור (איור 23.12), עליון ותחתון, בעובי של כ-0.5 ס"מ, המיועדים לסגירת הפצע בגמר הניתוח. עובי המתלה נקבע על ידי קו ההפרדה שבין העור לשד. קו הפרדה זה הוא הפסציה השטחית של השד המפרידה בין העור לשד. למעשה, זוהי רקמת חיבור דקה עם מעט כלי דם העוברים בה ולכן הפרדה במישור זה יוצרת הפרדה אנטומית ומעט דימום.
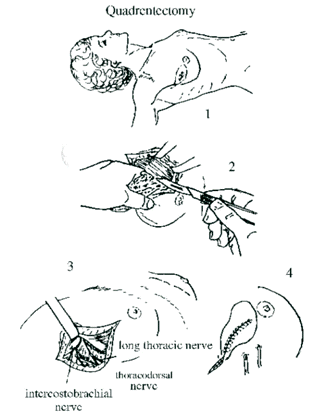
לאחר מכן כורתים את שריר החזה הגדול והקטן (Minor and major pectoralis). פותחים את בית השחי וכורתים את בלוטות הלימפה בשלושת האזורים של בית השחי (איור 24.12).
|
|
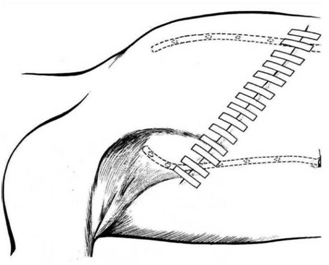
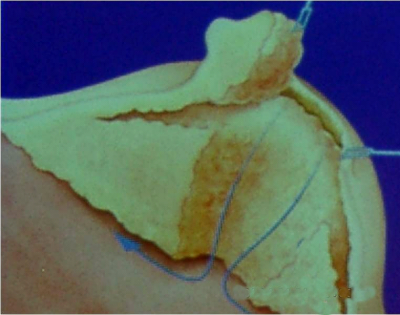
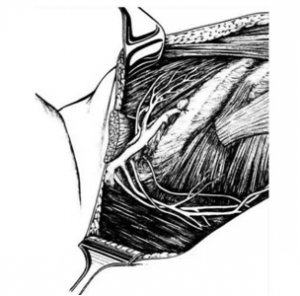
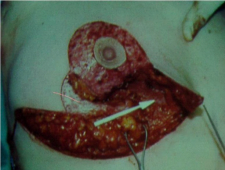
הגבולות האנטומיים של בית השחי, לצורך ניתוח זה, הם: מאחור - שריר הגב הרחיב (Latissimus dorsi) והשריר התת-שכמי (Subscapularis); מדיאלית - שריר המשור הקדמי (Serratus anterior) וצלעות בית החזה; מלפנים - שרירי הפקטורליס; ומעל - הווריד האקסילרי ממקום כניסתו לזרוע ועד האפקס של האקסילה שהוא אזור המעבר של הווריד האקסילרי מעל צלע 1 ומתחת לעצם הבריח. כל הבלוטות הנמצאות בתחום זה, כולל כלי הדם היוצאים מהווריד האקסילרי, נכרתות. בסיום כריתה זו מכסים את אזור הדיסקציה בשני מתלי העור, שהוכנו בזמן כריתת רקמת השד, ונתפרים ראשונית (איור 25.16 ותמונה 38.12).
אם חסר עור אפשר לבצע השתלת עור במקום. בחולות בעלות גרורות רחוקות, או גרורות שלא ניתן להוציאן בשלמות, אין לבצע ניתוח זה.
באמצע שנות החמישים קמו מנתחים שטענו שהניתוח שהוצע על-ידי Halsted אינו מספיק רדיקאלי, מכיוון שאינו כולל את הניקוז הלימפתי שלאורך ה-Internal mammary. הם הציעו לבצע את הניתוח שתואר על-ידי Urben ואחרים – ה-Extended radical mastectomy.
Extended radical mastectomy
בניתוח זה, בנוסף לכריתה המבוצעת ב-Radical mastectomy, מבצעים בנוסף פתיחת בית החזה דרך סחוסי הצלעות ומבצעים כריתה של בלוטות לאורך ה-Internal Mammary (איור 26.12). ניתוח זה אינו מקובל, מכיוון שניתן להקרין את הבלוטות האלה, ולקבל תוצאות דומות מבחינת ההיוותרות בחיים.
בשנות ה-60 של המאה ה-20 קמו מנתחים שערערו על הצורך בניתוחים רדיקאלים אלו. הם טענו שאין צורך בכריתת שריר הפקטורליס הגדול במסגרת הטיפול הכירורגי בסרטן השד. הם הציעו לאמץ את הניתוחים שתוארו על-ידי Patey- Madden, שנקראו ה-Modified radical mastectomy. לניתוח זה יתרונות קוסמטיים ותפקודיים. השארת הפקטורליס הגדול מאפשרת טווח תנועה תקין של היד בצד המנותח, ועיוות קטן יותר של דופן בית החזה.
כריתה נרחבת מותאמת של השד - Modified radical mastectomy
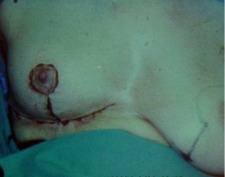
בניתוח זה, בניגוד ל-Radical mastectomy, לא כורתים את שריר הפקטורליס הגדול. הפקטורליס הקטן מנותק לפי שיטה אחת מהקורקואיד פרוסס, על מנת לאפשר גישה לאפקס של האקסילה - ניתוח על-שם Madden. בשיטה שנייה הפקטורליס הקטן נכרת לגמרי, יחד עם בלוטות הלימפה שבין שרירי החזה (אינטרפקטורליות) - ניתוח על-שם Patey. בנוסף כורתים גם את בלוטות הלימפה של בית השחי, כפי שתואר ב- Radical mastectomy (תמונה 38.12א').
בעבודות רבות הוכח שהתחלואה, התמותה, שכיחות החזרות המקומיות וההיוותרות בחיים, דומות בניתוח זה לאלה המושגות בשיטות היותר רדיקאליות. לכן ניתוח זה הפך למקובל בקרב מנתחים רבים.
|
|
כריתת שד פשוטה - Simple mastectomy
כריתת שד פשוטה היא כריתת רקמת השד בלבד, ללא כריתת השרירים של דופן בית החזה, וללא כריתת בלוטות בית השחי. ניתוח זה הוא בעל שיעור גבוה של חזרות בבית השחי מאשר בניתוחים הרדיקאליים יותר. כריתת שד פשוטה של חולות מדרגה 1 ו-2, המלווה בהקרנות לאחר הניתוח, משיגה תוצאות דומות לאלה של ניתוחים נרחבים יותר.
סיבוכי המסטקטומיה
- תמותה: שיעורי התמותה עקב הניתוח נמוכים. התמותה המקובלת היא 0.5%. רוב הסיבות לפטירת החולות נעוץ במחלות יסודיות אחרות מהן סובלות החולות.
- נמק מתלה העור: ניתן למנוע נמק של מתלה העור על-ידי הקטנת המתח במתלה העור והכנה נכונה שלו - רחב בבסיסו וצר בשוליו. אם לא ניתן לסגור את הפצע ללא מתח, יש לבצע השתלות עור.
- סרומות חוזרות שכיחות מאוד לאחר הוצאת נקזים במיוחד הוצאה מוקדמת. זיהומים באיזור הניתוח נדירים יחסית.
- הישנות מקומית (Local recurrence): הדעה שהישנות מקומית נגרמת כתוצאה מפיזור של תאי שאת בזמן הניתוח הראשון אינה מדויקת. Sternsward מדווח שב-97%-93% ממקרי ההישנות המקומיים נמצא גם פיזור גרורתי. בסדרה של 1,178 חולות ובמעקב של 20 שנה, נמצא שרק ב-4.3% מהחולות היתה הישנות מקומית שלא לוותה בפיזור כללי. הישנות מקומית, ברוב החולות, אינה ביטוי לכישלון הכירורגי, אלא ביטוי לפיזור גרורתי. סיבה אחרת לחזרה מקומית היא השארת רקמה שאתית באזור המנותח. ככל שהשאת גדולה יותר, שיעור החזרות המקומיות גבוה יותר. ככל שמספר הבלוטות הנגועות גדול יותר, כך גם שיעור החזרות המקומיות גבוה יותר. כאשר הבלוטות אינן נגועות שיעור החזרות המקומיות הוא 7% לעומת 26% בחולות שבהן הבלוטות נגועות.
- רוב החזרות בדופן בית החזה מתגלות תוך שנתיים לאחר הניתוח, אולם חזרות ניתן לראות גם לאחר 15 שנים. כאשר החזרה מתבטאת כגוש בודד קטן בדופן בית החזה ניתן לכרות אותו באופן מקומי ולאחר מכן להשלים את הטיפול בהקרנות ובכימותרפיה. אם המחלה מפוזרת בדופן, הטיפול הוא הקרנות מקומיות וכימותרפיה לאחר ביופסיה. חזרה מקומית היא אות מבשר לפיזור המחלה, ולכן נדרש בירור של נוכחות גרורות בעצמות, בריאות ובכבד.
- בצקת הגף (בצקת לימפטית, Lymphedema): בצקת של הגף בצד המנותח מופיעה ב-30%-10% מהחולות שעברו כריתה רדיקאלית של השד. בחלק מהחולות, עקב כריתת הניקוז הלימפתי האקסילרי, יש ירידה בסילוק הנוזל הלימפתי מהגף ולכן נוצרת בצקת בגף. לעתים הבצקת קלה, אולם היא מספיקה על מנת לחשוף את היד לדלקות, אשר גורמות לחסימה של דרכי הניקוז הלימפתי הנותרות, ולכן גורמות לבצקת ההולכת ומחמירה, וזו חושפת עוד יותר את הגף לזיהומים חוזרים. לכן, נשים אלה חייבות להגן על הגף מפני חבלות, פצעים או חתכים, ולטפל באופן אגרסיבי בכל סימן קל ביותר לנוכחות זיהום בגף.
- בנשים הלוקות בבצקת כרונית של הגף אפשר לטפל על-ידי הרמת הגף, חבישות אלסטיות של הגף, פיזיותרפיה מיוחדת לגף, ובמקרים חמורים יש לשאוב את הנוזל אל מערכת הלימפה על-ידי מכשיר הנקרא Lymphapress. מכשיר זה מפעיל לחץ גלי בכיוון הקריבני של הגף, וגורם לתנועה של הנוזל הבצקתי אל המערכת הלימפתית הנותרת.
- החולות, שלהן בצקת קשה של הגף, יזדקקו לניתוחים שמטרתם לחדש את הניקוז הלימפתי מהגף. (ראה פרק ורידים -בצקת לימפטית).
פיזיותרפיה
לאחר הניתוחים יש להקפיד על ביצוע פיזיותרפיה של הגף. יש להתחיל בתנועות פעילות (אקטיביות) מספר ימים לאחר הניתוח, כך שבתום 14 ימים החולה תבצע תנועה אקטיבית מלאה של הגף. יש לשחרר מהמחלקה את החולות, שעברו כריתת שד, עם תותבת שד זמנית, על מנת לאפשר מראה אסתטי וכיסוי הלקות.
כריתות מוגבלות של השד
לאור העובדה שלא נמצא כל הבדל בהיוותרות בחיים בין הניתוחים הרדיקאלים יותר לרדיקאלים פחות (גרף 8.12), הועלתה השאלה מה הסיבה לכך שלא נתקבל כל הבדל בין הניתוחים הללו?
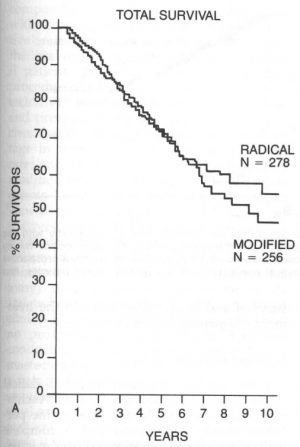
|
|
העובדה שב-25% מהחולות מדרגה 1, וב-75% מהחולות שלהן בלוטות לימפה חיוביות נמצאה עדות לגרורות בתום 10 שנות מעקב, מלמדת שכבר בשלב האבחנה המוקדם (שלב 1) קיים פיזור גרורתי שלא אובחן בהתחלה בשיטות המקובלות. עבודות בנושא הקינטיקה וזמן הכפלת המסה של שאתות, מלמדות שזמן רב לפני שהשאת ניתנת למישוש היא בעלת יכולת לשלוח גרורות. תא שאת בודד זקוק ל-30 הכפלות (106 תאים) על מנת להגיע לגודל של 1 ס"מ. בשלב זה אפשר למצוא ב-20% מהחולות גרורות נסתרות בבלוטות הלימפה.
השאת בשלב זה זקוקה ל-10 הכפלות נוספות על מנת להגיע לגודל קריטי שאינו ניתן לריפוי. זמן ההכפלה של השאת שונה משאת אחת לחברתה, והוא נע בין 40 ל-380 ימים. משמעות הדבר היא ששאת המתגלה בבדיקה קלינית נמצאת בגוף החולה בין שנתיים ל-17 שנים. מסתבר שהשאתות אינן גדלות ליניארית, אלא יש להן תקופות של גדילה מואצת ותקופות של רגיעה יחסית בגדילה. וזה מסביר את התצפיות של שאתות שלעתים מתחילות לצמוח במהירות יחסית. זמן הכפלת המסה של שאתות בחולות בעלות גרורות בבית השחי הוא קצר יותר מאלה שאין להן גרורות.
המסקנה הנובעת מהנתונים הללו היא שבזמן האבחנה התפשטה השאת של רוב החולות מעבר לשד, כלומר, מדובר במחלה סיסטמית. מכאן שאין טעם בניתוחים רדיקאלים מאוד כדי לטפל במחלה, שהיא באופן מעשי או פוטנציאלי מפושטת. גישה זו היתה מקובלת על Hirsch כבר בתחילת המאה, כאשר ב-1927 פרסם בגרמניה עבודה מדעית ראשונה על התוצאות הטובות יחסית שהשיג בטיפול מוגבל בסרטן השד. Vera Peters מטורונטו התחילה ב-1939 בטיפול מקומי בסרטן השד על-ידי כריתה חלקית של השד והקרנות. ב-1983 היא פרסמה את תוצאותיה, לאחר מעקב שנמשך עד 30 שנה אחר 800 חולות. היא לא מצאה כל הבדל בין הניתוחים הללו לניתוחים הרדיקאלים יותר בהשפעה על שיעור ההיוותרות בחיים.
לאור הממצאים האלה קבע פישר עקרונות חדשים להבנת סרטן השד:
- אין סדר קבוע להתפשטות תאי השאת.
- תאי השאת חודרים לבלוטות הלימפה על-ידי אמבוליזציה.
- נגיעות בלוטות הלימפה היא עדות ליחס שבין המאכסן לשאת המאפשרת התפתחות גרורות, ולאו דווקא הסיבה לגרורות מרוחקות.
- בלוטות הלימפה האזוריות אינן משמשות כחסימות להתפשטות השאת.
- בלוטות הלימפה הן בעלות חשיבות ביולוגית ולא אנטומית.
- מכאן נובע שכל שאת הניתנת לכריתה כירורגית היא מחלה סיסטמית.
- היקף הטיפול המקומי בסרטן השד אינו משפיע על ההיוותרות בחיים.
- נוכחות של שאתות רב מוקדיות אינה בהכרח עדות למחלה ממארת יותר.
כריתת בלוטות הלימפה משמשת בעיקר להערכה של השאת, ולא כחלק מהטיפול בסרטן השד. לאחרונה פורסמו מספר עבודות המראות שסילוק בלוטות הלימפה חשוב לטיפול בחולות הללו. חולות שהוצאו מהן בלוטות הלימפה פיתחו פחות גרורות מרוחקות יחסית לאלה שהושארו בהן הבלוטות, ולכן גם היוותרות בחיים שלהן היתה טובה יותר. עבודות אלה הן בודדות ומספר החולים בהן קטן, לכן אינן מאפשרות להסיק מסקנות לגבי הערך של כריתת בלוטות לימפה לריפוי חולות סרטן השד.
כריתה משמרת שד
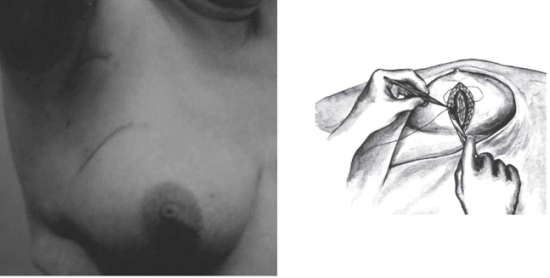
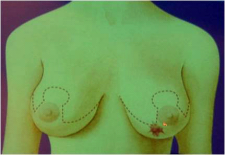
כריתה משמרת שד היא כריתה של חלק מרקמת השד בה נמצאת השאת הממארת עם רקמת שד בריאה סביבה (שוליים חופשיים). מרחב הכריתה הוא שנותן לפעולות אלה את שמם. כריתת גוש בשד (Lumpectomy) היא כריתה של השאת עם שולים יחסית צרים של מספר מילימטרים (איור 27.12 תמונה 39.12), ואילו כריתת רביע (Quadrentectomy) היא כריתה רחבה שאינה מתייחסת לגודל השאת והשולים אלא מסלקת כרבע שד סביב השאת (איור 28.12).
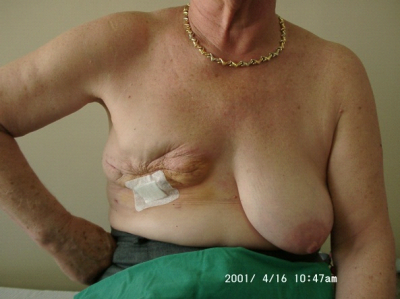
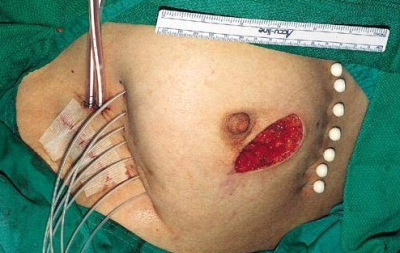
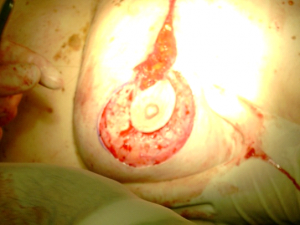
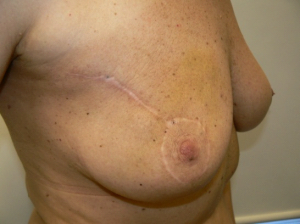
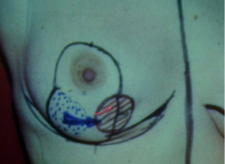
מבחינה טכנית יש לשלב שמירה על מראה ללא ויתור על מרחב הכריתה האונקולוגית. הכריתה הרחבה הנדרשת יוצרת חסר רקמה רצינית בשד וכל ניסיון לסגור את החסר יצור עיוות ניכר בשד. לכן, אין לנסות ולקרב את שולי הלמפקטומיה ואין לנקז אותה. יש להשאיר בסיס טוב לעור מעל החסר ולסגור אותו. נוזל המופרש על ידי הרקמות ממלא את החוסר ושומר על הצורה של השד. נוזל זה מוחלף תוך מספר שבועות ועד חודשים (תלוי בגודל החלל) על-ידי רקמת חיבור שבהתחלה היא נוקשה, אולם עם חלוף הזמן הולכת ומתעדנת. את החתך בעור יש לבצע בהתאם לקווי העור - בחלק העליון והתחתון קווים רוחביים ובצדדים קוים אורכיים. תפר בעור צריך להיות אסתטי רצוי תפר תת עורי ממושך במטרה למנוע את הפגיעה בעור כפי שיכול לקרות בתפרי Mattress בודדים או סיכות. לאחר מכן, דרך חתך נפרד בבית השחי בקו השערות נכנסים לשומן בית השחי לביצוע של כריתת בלוטת הזקיף או כריתת מכלול בלוטות בית השחי. חולות עם שאת מאחורי הפטמה או בסמוך לה או חולות עם מחלת פאג'ט של הפטמה יעברו כריתת מרכז השד (Central lumpectomy) (תמונה 70.12) הכוללת כריתת הפיטמה, השאת והרקמות סביבה.
|

|
הכנסת הלמפקטומיה כניתוח שגרתי לטיפול בסרטן השד מעוררת מספר שאלות:
- האם ההיוותרות בחיים של החולות שעברו ניתוחים מוגבלים שונה מזו של החולות שעברו ניתוחים נרחבים יותר (כריתת שד)?
- האם החזרה המקומית בניתוחים אלה גבוהה יותר מאשר בניתוחים הנרחבים יותר?
- האם לרב-מוקדיות של סרטן השד יש השפעה על שיעור ההישנות המקומית?
- האם התוצאות, מבחינה קוסמטית, מצדיקות את הניתוח?
- האם יש להוסיף כריתת בלוטות הלימפה בבית השחי?
- מה מקום הטיפול הקרינתי בהמשך לכריתה השמרנית?
היוותרות בחיים לאחר למפקטומיה
ביחס לשאלה הראשונה, בדבר ההישרדות בחיים של חולות עם סרטן השד לאחר טיפולים משמרים ורדיקאליים, התפרסמו עד 1985 כ-40 עבודות בספרות המערבית. בעבודות אלו מדווחים המחברים על כ-10,000 חולות שעברו כריתה מקומית. בכל העבודות, שרובן אינן מבוקרות, התוצאות דומות - אין הבדל בין תוצאות הכריתה הרדיקאלית לבין תוצאות הכריתה המקומית של השאת הממארת בשד.
חסרונן של כל העבודות הללו, על אף המעקב הארוך שלהן, היה בכך שהעבודות לא היו אקראיות ופרוספקטיביות, ולכן נטען נגדן שלא ניתן להשוות בין האוכלוסיות השונות ומכאן שאין להסיק מהן מסקנות.
Veronesi ממילאנו מדווח ב-1985 על תוצאות סקר מתוכנן פרוספקטיבי ואקראי שהחל ב-1973. החולות חולקו לשתי קבוצות, האחת עברה כריתת שד רדיקאלית והשנייה Quadrentectomy. עבודה זו כללה 701 חולות בעלות שאת הקטנה מ-2 ס"מ וללא בלוטות לימפה נגועות-קלינית. המעקב הממוצע היה 8 שנים. בסיכום המעקב נמצאו חופשיות מהמחלה 79% מהחולות לאחר כריתת השד, ו-80% מהחולות לאחר למפקטומיה. שיעור החזרות המקומיות היה זהה בשתי הקבוצות - 4%. מסקנתו היא שהתוצאות המושגות בכריתה חלקית של השד ובכריתה רדיקאלית הן זהות.
Fisher ב-1985 פירסם תוצאות מחקר דומה שהיווה חלק מהסקר של ה-NSABP. בסקר זה נכללו 1,843 חולות סרטן השד מדרגה 1 ו-2, ושגודל השאת שלהן היה עד 4 ס"מ. הנשים חולקו בצורה פרוספקטיבית אקראית ל-3 קבוצות. קבוצה אחת עברה כריתת שד שלמה (TM), קבוצה שנייה עברה למפקטומיה (SM) וקבוצה שלישית עברה למפקטומיה והקרנות (SM + RAD). בכל שלושת הקבוצות בוצעה כריתה של בלוטות הלימפה בבית השחי, והן קיבלו טיפול כימי כמקובל (התוצאות מופיעות בטבלה 11.12).
| טבלה 11.12: היוותרות בחיים ל-5 שנים ללא מחלה | ||
|---|---|---|
| חולות ללא בלוטות לימפה נגועות | חולות בעלות בלוטות לימפה נגועות | |
| TM | 82% | 63% |
| SM | 70% | 63% |
| SM + RAD | 90% | 67% |
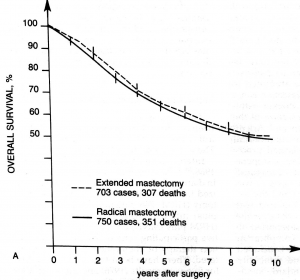
עבודה זו ורבות אחרות כמותה מראות שאין הבדל בתוצאות לטווח של 5 שנים, לפחות, בין הכריתה הרדיקאלית של השד לכריתה הסגמנטרית של השד בתוספת הקרנות. מעבודות אחרות בספרות אפשר ללמוד שגם לטווח יותר ארוך של 20 שנה מגמה זו אינה משתנית (גרף 9.12).
|
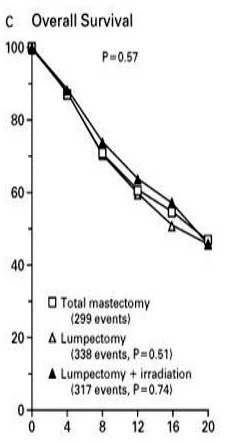
|
85% מכישלונות הטיפול המתרחשים ב-10 השנים הראשונות מתרחשים כבר ב-5 השנים הראשונות, ולכן מסקנות אלה תקפות גם לטווח ארוך יותר.
Bluming (1986) מדווח על תוצאות הסקר שנערך בלוס אנג'לס, שכלל כריתת השאת בשד, כריתת בלוטות הלימפה, הקרנה מקומית והשתלת מחטי אירידיום 192 באזור שבו נמצאה השאת בשד. התוצאות שנתקבלו היו דומות לאלה של הסדרות האחרות עם כריתה מקומית או רדיקאלית.
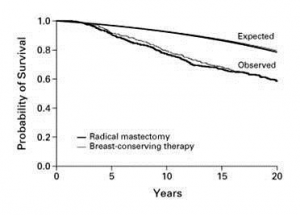
קיים כיום מספיק חומר עובדתי התומך בגרסה שההיוותרות בחיים של חולות שטופלו בכריתה מוגבלת ובהקרנות שווה לזו של החולות שטופלו בכריתה רדיקאלית של סרטן השד מדרגות 1 ו-2. ולכן, הפכה הכריתה המשמר שד לניתוח מקובל בטיפול בסרטן השד.
תוצאות קוסמטיות
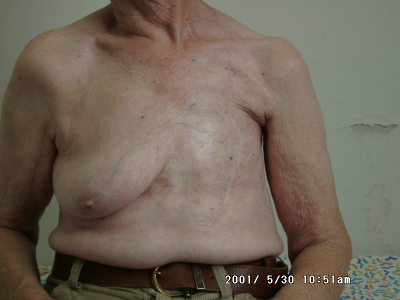
לגבי התוצאות הקוסמטיות, רוב המחברים טוענים שב-90% מהחולות התוצאות הן טובות, מותנות כמובן בכריתה נכונה של השאת. הקרנות במינון של 6500R-5000R גורמות, במידה מסוימת, לפיברוזיס, אולם ברוב הנשים השד נשאר רך וטבעי. יש לציין שהתוצאות הקוסמטיות נשארות זהות במעקב ל-5 שנים. לעומת עבודות אלה קיימות מספר עבודות המציינות תוצאות לא טובות בכריתה שמרנית עם עיוות השד ב-30% מהמטופלות. העיוות הנוצר הוא על רקע כירורגי או קרינתי. כנראה יש כאן השפעה לגישתו של המנתח לביצוע שמרני של היקף הניתוח ולשיטת ההקרנה. במרכזים שבהם נושא השד מרוכז ביחידות, שיעור הלמפקטומיות מכלל ניתוחי השד הוא גבוה והתוצאות הקוסמטיות טובות יותר.
הישנות מקומית
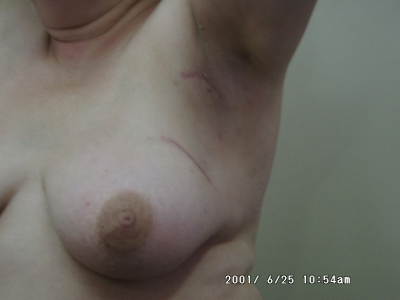
שיעור ההישנות המקומית, בחולים לאחר למפקטומיה או כריתה רדיקאלית, תלוי באם נמצאו בלוטות לימפה נגועות. שיעור ההישנות המקומית ל-20 שנה כפי שדווח בעבודות אקראיות נע בין 7% בעבודה של Veronesi וחבריו ל-14% בעבודה של פישר וחבריו. כאשר הבלוטות נגועות שיעור ההישנות המקומית הוא כ-20%, וכאשר הבלוטות אינן נגועות שיעור ההישנות הוא כ-4%. כאשר מוסיפים טיפול בהקרנות לחולות בעלות בלוטות נגועות השיעור של ההישנות המקומית יורד לכ-7% (תמונה 40.12).
חזרה מקומית לאחר כריתה משמרת שד שונה מזו שלאחר כריתת שד. השוני הוא בכך שהמחלה היא מחלה מקומית ברוב החולות שעברו כריתה משמרת שד. בכריתת שד שלמה, חזרה מקומית היא למעשה ביטוי לחזרה מערכתית ברוב החולות. הבדל זה מסביר מדוע למרות השיעור הגבוה יחסית של חזרות מקומיות בכריתה משמרת שד לעומת כריתה שד שלמה, אין הבדל בהישרדות לטווח ארוך, ובשיעור ההיוותרות בחיים ללא מחלה מרוחקת (גרורות) בין שתי השיטות.
רב מוקדיות של סרטן השד
שאתות השד לסוגיהן נוטות להיות רב מוקדיות. עבודות שונות, שפורסמו בנושא זה, הראו שעד 60% מהשאתות הן רב מוקדיות. Haggensen הראה שבמרחק של 4 ס"מ מהשאת המקורית עדיין ניתן למצוא מוקדי גידול נוספים ב-40% מהחולות, כש-80% מהן הם DCIS, שכשבודקים את כל השד הנכרת אפשר למצוא ב-60% שאתות נוספות, בעבודה קפדנית מאוד שכללה פריסת השד הנכרת לפרוסות דקות, ממוגרפיה של הרקמה ובדיקה היסטולוגית של האזורים החשודים, וכ-8% מהמוקדים מצויים מחוץ לרביע המנותח. Urban מדווח כי ל-10.5% מהשאתות הרב-מוקדיות יש מוקדים גם בשד השני. Chaudary מדווח כי 3% מהשאתות הן סינכרוניות ו-7.6% מהשאתות הן מטכרוניות. בנשים בנות 40 שנה ומטה שיעור השאתות המטכרוניות בשד השני גדול פי 3. שיעור הופעת שאת בשד שני, בחולות שבהן נמצאה שאת ממארת בשד אחד גדול פי 5.9 מהאוכלוסייה הכללית. עיקר החזרות המקומיות מתרחשות בחולות עם מעורבות של בלוטות הלימפה או בחולות צעירות.
הוכח בעבודות שונות שניתן להשיג נסיגה והיעלמות של סרטן השד על-ידי קרינה בלבד, במיוחד כשמדובר במוקדים קטנים מאוד או נידוסים של תאים בודדים. כנראה הקרינה אחראית להקטנת החזרות המקומיות לאחר כריתה מקומית של השד.
מעבודות (Level II) שעקבו אחר חולות שעברו כריתה משמרת שד או כריתת שד מלאה, ניתן להסיק, שלרב מוקדיות אין השפעה על ההישרדות לטווח ארוך, אולם יש לה השפעה על שיעורי החזרות המקומיות.
טיפול בהקרנות לאחר למפקטומיה
Fisher ב- 1985 ואחרים מדווחים, ש-92% מהחולות שקיבלו הקרנות היו חופשיות מהמחלה במעקב של 5 שנים, לעומת 72% מאלה שלא קיבלו הקרנות. במיוחד בולט ההבדל בחולות בעלות בלוטות לימפה נגועות.
רוב המטפלים בסרטן השד על-ידי למפקטומיה משלבים טיפול קרינתי במנות של 6500R-5000R ויותר, כאשר חלק מהם (2000R) ניתן במרוכז על איזור (בוסט). עבודות שלא כללו קרינה כלל, הראו תוצאות פחות טובות מאשר הניתוחים הרדיקאליים, ולכן נראה שתנאי להצלחת הניתוחים המשמרים, הוא הוספת טיפול קרינתי לפרוטוקול. עבודות חדשות הראו שהקטנת מנת הקרינה ומשכה לא השפיעו לרעה על התוצאות לטווח ארוך ולכן בחולות שניתן להגדיל את המנה ולהקטין את מספר ההקרנות יקבלו אותו מינון מחולק ל-16 פעמים. גישה חדשנית לטיפול הקרינתי היא קרינה תוך ניתוחית. הרעיון מבוסס על כך שרוב החזרות המקומיות היו בסביבת הלמפקטומיה, ולכן יש להקרין את אותו איזור ולא את כל השד. בשיטה זו לאחר סיום הלמפקטומיה ולפני סגירת העור החולה מקבלת מנת קרינה בחדר ניתוח למיטת הלמפקטומיה, תהליך שנמשך כ- 45 דקות, ובסיומו העור נסגר מעל החלל. דווחים ראשוניים מראים שאין הבדל משמעותי בין החזרות המקומיות בחולות שקבלו קרינה על כל השד לבין אלה שקבלו קרינה רק למקום הלמפקטומיה.
כדי למנוע נזקי קרינה מידיים כמו כוויות על העור ונזקים מאוחרים כמו פגיעה בריאות ובלב יש לתכן את הקרינה בצורה כזו שהאיברים החיוניים יוצאו עד כמה שאפשר משדה הקרינה וכניסת הקרינה דרך העור תהיה כל פעם דרך מקום אחר (תמונה 41.12 ו-38.12).
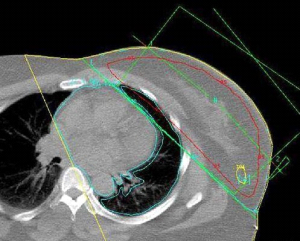
|
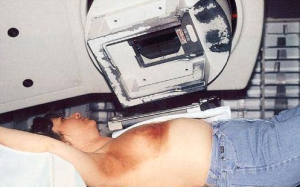
|
שיטה אחרת למתן קרינה מקומית היא על ידי בריכתרפיה שבה מוחדרות מחטים מיוחדות המכילות חומר רדיואקטיבי – מחטי אירידיום - לאיזור הלמפקטומיה ומושארות שם עד קבלת מנת הקרינה הרצויה (איור 42.12).
גישה אחרת להקרין את השד היא דרך הכנסת צינורית שבקצה בלון הניתן לניפוח לחלל הלמפקטומיה ותפירת העור מעליו. כעבור 7-10 ימים מחברים את הצינורית לגנרטור שמפעיל אלמנט בבלון וכתוצאה מכך מופקים גלי קרינה לחלל הלמפקטומיה והרקמה סביבו. התהליך מבוצע מספר פעמים ביום במשך שבוע ימים ואז הבלון מרוקן ונשלף מהחלל הלמפקטומיה.
שולי הכריתה
הלמפקטומיה הוגדרה ככריתה של רקמת השאת בשוליים בריאים. השאלה הנשאלת היא מהו רוחב השוליים הנקיים (ברקמה בריאה) הנדרשים על מנת להבטיח תוצאות מיטביות. בעבודות המשוות כריתה משמרת שד עם שוליים צרים וכריתת שד שלמה עם השוליים הכי רחבים שניתן להשיג, לא נמצא הבדל בהישרדות לטווח של 20 שנה בין הקבוצות. מכאן ברור שלרוחב השולים אין השפעה על ההישרדות. מאידך גיסא, לשוליים השפעה על החזרה המקומית. נמצא בעבודות רבות שבחולות עם שוליים המעורבים בתאי שאת ממארת, שיעורי החזרה המקומית הם גבוהים מאוד ומגיעים לכדי 60%. לכן קיימת הסכמה גורפת ששוליים נגועים מחייבים כריתה חוזרת במטרה להשיג שולים נקיים. לעומת זאת לא הוכח ששוליים של מילימטר הם פחות טובים משוליים של 2 מ"מ או 1 ס"מ כשמשווים את ההיוותרות בחיים ושיעור החזרות המקומיות לאחר קרינה. נמצא שבחולות עם שוליים קרובים שאינן מקבלות הקרנות שיעור החזרות יכול להגיע עד 30% ל-10 שנים, אולם שיעור זה פוחת לכדי 10%-7% לאחר קרינה. בחולות עם שוליים ברוחב שמעל סנטימטר סביב השאת, הקרינה תורמת רק מעט להקטנת החזרות המקומיות.
אונקופלסטיקה – Oncoplasty
האונקופלסטיקה היא טכניקה חדשה יחסית בכירורגיה של השד. טכניקה זו מאפשרת לבצע כריתות נרחבות מקומיות בשד, ללא צורך להתפשר על האסתטיקה של השד. התוצאה הקוסמטית האופטימאלית היא פשרה מאוזנת בין נפח הרקמה הנכרתת לבין שיעור החזרה מקומית. הבעיה בכריתות רחבות היא שהחלל הגדול שנוצר גורם לשקיעה של העור לתוכו ולעיוות קשה של השד (איור 29.12).
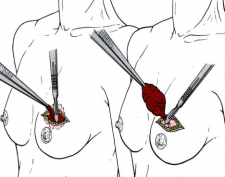
|
|
|
קיימים מספר גורמים המשפיעים לרעה על התוצאה הקוסמטית:
- ניסיון להשיג שולים רחבים מאוד.
- הערכה לא נכונה של גודל השאת לעומת נפח השד.
- טכניקה כירורגית.
- קרינה.
עד כמה הבעיה שכיחה? עבודות שבדקו את התוצאות הקוסמטיות של הלמפקטומיות דווחו על:
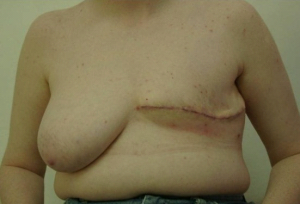
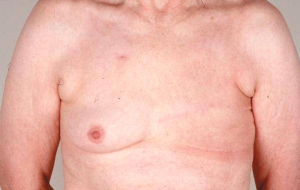
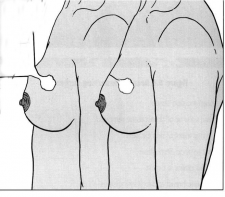
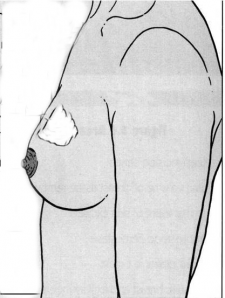
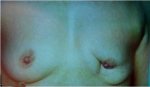
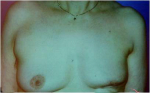
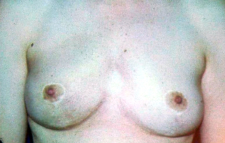
- 80% תוצאה טובה, כלומר האישה מרוצה והמראה ללא עוות ניכר (תמונה 43.12)
- 15% תוצאה בינונית, כלומר קיים עיוות מסויים אולם האישה מרוצה או חיה בשלום עם המראה (תמונה 44.12).
- 5% תוצאה גרועה, כלומר המראה אינו אסתטי והאישה אינה מרוצה עד כדי העדפה לעבור כריתת שד (45.12).
|
|
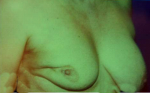
|
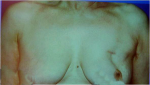
|
נשים שנותחו מדרגות את התוצאות הקוסמטיות כטובות יותר ביחס להערכות של המנתחים, שכן הללו ביקורתיים יותר.
האם ניתן להקטין את שעור התוצאות הבינוניות וגרועות?
התשובה היא חיובית. כדי למנוע תוצאות בינוניות או גרועות, מנתח השד צריך להשתמש בטכניקות לשימור אסתטיקה המקובלות בכירורגיה הפלסטית - אונקופלסטיקה. הצלחת הגישה האונקופלסטית דורשת תכנון פרטני של הטכניקה הניתוחית. על המנתח בזמן הניתוח להיות ער לאפשרות של היווצרות העיוות כאשר החלל גדול ובסיס העור דק, מצב שיגרום בסופו של דבר לעיוות השד. במקרים כאלה הוא צריך להיות מסוגל להשתמש באחת מהשיטות של אונקופלסטיקה על מנת לסגור את החלל ולמנוע את שקיעת העור. בהרבה מקרים הבעיה צפויה מראש, ואז יש לתכן את הניתוח מראש, כולל הזזת הפטמה אם יש בכך צורך. יש לסמן על העור נקודות חשובות על מנת לשמור על סימטריה. קיימות מספר שיטות למניעת העיוות. אלה מחולקות לרמה 1 ו-2. טכניקות רמה 1 הם טכניקות שכל מנתח שד חייב להכיר ולדעת להשתמש בהם. טכניקות ברמה 2 דורשות לרוב מיומנות בטכניקות של פלסטיקה או התערבות של פלסטיקאי מיומן על מנת לבצע את הניתוח.
עיצוב מחדש (Reshaping) של השד היא שיטה הנחשבת לרמה אחת, בה לאחר כריתת השאת בשוליים רחבים מבצעים הפרדה בין רקמת השד והעור שמעליו והפרדה בין רקמת השד לפאציה של שריר בית החזה (איור 29.12).
שחרור זה מאפשר לנייד את רקמת השד שבשולי החלל אל תוך החלל ובכך לסגור את החלל ללא גרימה של עיוות חיצוני בשד (איור 30.12). לעור יש בסיס לשבת עליו, לכן הוא אינו שוקע והתוצאה היא מראה אסתטי טוב של השד.
התוצאות המידיות והמאוחרות שלאחר ניתוח מוצגות בתמונה 46.12.
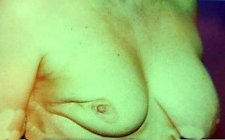
|
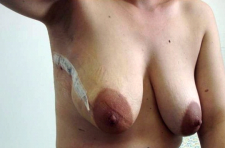
|

|
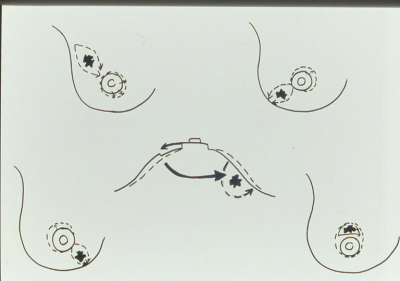
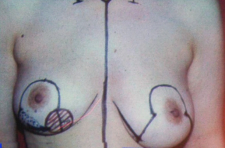
לעיתים יש כדי לשמור על הסימטריה יש להזיז את הפטמה בהתאם. איור 30.12 מראה את כיווני הזזת הפטמה בהתאם למקום השאת.
הטכניקה להזזת הפטמה דורשת, לאחר ההחלטה על מיקום הפטמה, לבצע דה-אפיתליזציה של העור לשם מתוכנן להעביר את הפטמה, וקיבועה במקום על ידי תפרים לשולים החדשים (תמונה 47.12).
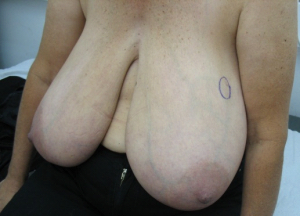
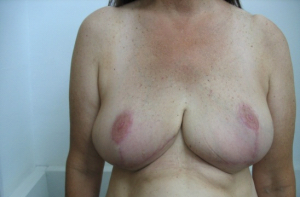
טכניקה אחרת שייכת לקבוצה 2, כלומר דורשת מיומנות גבוהה בטכניקות של פלסטיקה או שיתוף פלסטיקאי. היא טובה בחולות עם שד גדול יחסית ובה מנצלים את הטכניקת להקטנת השד (Reduction mammoplasty) לצורך כריתת קטעים גדולים מהשד, בנייתו מחדש תוך הקטנתו והקטנה מקבילה של השד השני במטרה להשיג סימטריה ואסטטיקה טובה של שני השדיים (תמונות 48.12, 49.12 ו- 50.12).
|
|
|
|
|
טיפול על-ידי הקרנות בלבד
ערך מורחב – טיפול קרינתי בסרטן השד - Radiation therapy for breast cancer
הקרנות הן שיטת טיפול לא מקובלת בשלבים מוקדמים של המחלה. לחולות מדרגה 1 ו-2 ההקרנות ניתנות במנות של 6000R-4500R, במשך 4-6 שבועות, ולאחר מכן השתלה של מחטי 192-Iridium, במינון של 3000R-1500R. שיעור הישנות המחלה, לאחר הקרנות, בחולות מדרגה 3 הוא גבוה ביותר ולכן שיטה זו לא מומלצת בעבורן. בכל החולות האלה יש לברר קיום נגיעות בבלוטות המידאקסילריות, על- ידי מישוש והוצאת דגימה, על מנת לקבוע את דירוג המחלה.
הקרנות, כטיפול בבלוטות לימפה נגועות ב-Internal mammary, משיגות תוצאות הדומות לאלה שמתקבלות לאחר ניתוחים שבהם נכרתות בלוטות אלה.
מחקרים חדשים מראים שקרינה לבית השחי של רמה 1 ו-2 מקנה אותם תוצאות כמו ביצוע דיסקציה אקסילרית של רמה 1 ו-2, ולכן בחולות שעברו כריתת בלוטת זקיף שנמצאה נגועה ולא עברו השלמה לכריתת בלוטות ברמה 1 ו-2 יקבלו במקום קרינה עם תוצאות דומות.
כימותרפיה טרום ניתוחית
ערך מורחב – הטיפול הכימי בסרטן השד
הטיפול בסרטן שד מתקדם מקומי הוא רב-תחומי ודורש שיתוף פעולה ותיאום בין גורמים רפואיים רבים וביניהם: רופאי הדמיה, כירורגים ואונקולוגים. מטרת הטיפול בסרטן שד מתקדם מקומית היא כפולה: 1. הקטנת השאת בשד ובבלוטות הלימפה האזוריות עד כדי יכולת לבצע ניתוח משמר שד וכריתת בלוטות. 2. חיסול גרורות או בחולות שבהן השאת דבוקה לשרירי הפקטורליס ומומלץ ללא טיפול טרום ניתוחי לבצע Radical mastectomy לגרום להקטנת השאת ודבקותה בשריר ולאפשר כריתה פחות רדיקאלית.
בדרגה 3, ללא טיפול כימי טרום ניתוחי, טיפול הבחירה הוא Modified radical mastectomy וכריתת בלוטות הלימפה האקסילריות. בחולות שבהן השאת אינה ניתנת לכריתה בשלמות אפשר לבצע רק כריתת שד שלמה (Toilet mastectomy) ולטפל בהמשך בהקרנות. טיפול כימי מסייע מומלץ בחולות שעברו כריתה מרפאת של השד. דרך נוספת לטיפול בחולות סרטן שד מתקדם מקומי (Local advanced) הוא מתן טיפול כימותרפי טרום ניתוחי (Neoajuvant chemotherapy). מטרת טיפול זה היא להקטין את נפח השאת לממדים אשר יאפשרו כריתה משמרת שד. ב-60% מחולות אלה, המועמדות לכריתת שד שלמה לפני הטיפול, אפשר לבצע כריתה משמרת שד לאחר טיפול כימותרפי טרום ניתוחי.
הרצף הטיפולי המוצע הוא טיפול כימי ראשוני למספר קורסים משתנה, בדרך כלל 4-6 קורסים, עם מעקב קליני והדמייתי צמוד. לאחר השגת תגובה קלינית מירבית, החולה מופנית לטיפול ניתוחי ובהתאם לתוצאות הפתולוגיות תמשיך את הטיפול האונקולוגי התרופתי והקרנתי. התשלובות לטיפול טרום ניתוחי הן תשלובות המכילות אנטרציקלינים (Anthracyclines) ו- Cyclophosphamide (AC) בארבעה מחזורים, שלאחריהם ניתנים טקסנים (Taxanes) במנה שבועית למשך כ-12 שבועות. טיפולים אלה הביאו לשיעורי תגובה קליניים גבוהים של 92% ושיעורי היעלמות קלינית של השאת בשד ב-60% וכן העלמות שלמה של השאת בפתולוגיה ב-25% (מחקר ה-NSABP B27). לחולות אלו אחוזי הישרדות גבוהים יותר בהשוואה לחולות שהגיבו חלקית. עבודות הראו שבחולות שלא הגיבו ל-AC, כ-55% מהן הגיבו לטקסנים. בחולות שהשאת שלהן מוגדרת Her2+3 תוספת של Trastuzumab (Herceptin) מעלה בצורה משמעותי את שיעורי התגובה.
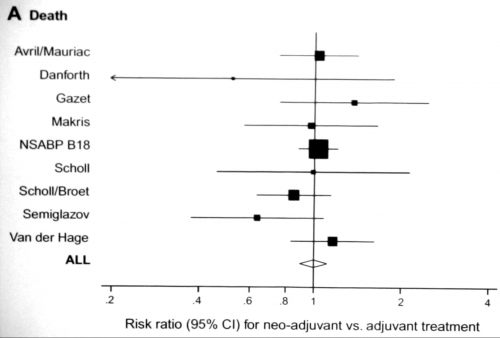
רוב העבודות לא הצליחו להראות שיפור בהישרדות של חולות שקבלו טיפול כימי טרום ניתוחי, אולם 60% מהם עברו כריתה משמרת שד מוצלחת (גרף 10.12). יתרון נוסף לשימוש בטיפול הכימי הטרום ניתוחי הוא היכולת ללמוד על הביולוגיה של השאת - האם היא מגיבה או לא לטיפול. בחולות שאינן מגיבות, ניתן לשנות את התרופות. עבודות ראשוניות הראו שאכן ניתן להשיג שיעורי תגובה גבוהים יותר בשיטה זו. יתרון נוסף הוא בחולות שהגיבו ואחר כך חזרה המחלה אפשר להשתמש באותן תרופות כדי להשיג הפוגה (רמיסיה). חולות שמתחילות לקבל טיפול כימי טרום ניתוחי צריכות לעבור סימון של מרחב הגידול על ידי קליפסים המוחדרים בהכוונת US או ממוגרפיה. המטרה בהחדרת קליפים אלה היא לסמן עבור המנתח את מרחב הכריתה הרצוי, בחולות שבהן השאת קטנה או נעלמה לגמרי.
בחירת הטיפול
טיפול הבחירה בחולות בעלות שאתות ממאירות בשד הוא: בדרגות 1 ו-2 כריתת שד שמרנית, כמו Lumpectomy וכריתת בלוטת הזקיף בתוספת קרינה לאחר הניתוח. אפשרות אחרת היא כריתת שד שלמה (Simple mastectomy) והוצאת בלוטת זקיף, או כריתת שד שלמה עם קטע משריר בית החזה כאשר השאת דבוקה לשריר. בחולות שבהן השאת חודרת לשריר הפקטורליס מומלץ לבצע Radical mastectomy. בדרגה 3 טיפול הבחירה הוא Modified radical mastectomy וכריתת בלוטות הלימפה האקסילריות. גם כאן, אם השאת דבוקה לפקטורליס, יש לבצע Radical mastectomy. דרך נוספת לטיפול בחולות סרטן שד מתקדם מקומי (Local advanced) הוא מתן טיפול כימותרפי טרום ניתוחי (Neoajuvant chemotherapy). מטרת טיפול זה היא להקטין את נפח השאת לממדים אשר יאפשרו כריתה משמרת שד. ב-60% מחולות אלה, המועמדות לכריתת שד שלמה לפני הטיפול, אפשר לבצע כריתה משמרת שד לאחר טיפול כימותרפי טרום ניתוחי. בחולות שבהן השאת אינה ניתנת לכריתה בשלמות יש לבצע רק כריתת שד שלמה (Toilet mastectomy) ולטפל בהמשך בהקרנות. טיפול כימי מסייע מומלץ בחולות שעברו כריתה מרפאת של השד.
| Stage 1 | |||
|---|---|---|---|
| 1. | Simple mastectomy + Sentinel node biopsy | ||
| a. | E.R. (+) - Observation, Tamoxifen, Aromatase inhibitors | ||
| b. | E.R. (-) - Chemotherapy (+Trastuzumab if Her2+3) | ||
| c. | Undifferentiated - Chemotherapy | ||
| 2. | Lumpectomy + Sentinel node biopsy + Radiation | ||
| a. | Radiation always | ||
| b. | Chemotherapy (?), Hormonal therapy | ||
| 3. | Radiation 5000-6500R + Iridium 1500R localy + Chemotherapy | ||
| Stage 2 | |||
| 1. | Simple mastectomy + Sentinel node biopsy + Chemotherapy or Hormonal therapy. Postoperative radiation if: | ||
| a. | Lymph nodes (+) | ||
| b. | Medial lesion | ||
| c. | Pectoralis muscle involvement | ||
| Hormonal therapy | |||
| a. | Postmenopausal E.R. (+ or -) - Tamoxifen, aromatase inhibitors | ||
| b. | Premenopausal | ||
| 1. Surgical or medical castration (?) | |||
| 2. E.R. (+) - Tamoxifen + Chemotherapy | |||
| 2. | Lumpectomy or Quadrentectomy + Sentinel node biopsy + Radiation | ||
| a. | Premenopausal - Chemotherapy | ||
| b. | Postmenopausal - Tamoxifen | ||
| Stage 3 | |||
| 1. | Simple mastectomy + Sentinel node biopsy or Axillary dissection + Chemotherapy + Radiation | ||
| 2. | Preoperative chemotherapy (stage IIIb) | ||
| 3. | High dose chemotherapy + Bone marrow transplantation (stage IIIb) | ||
| 4. | Premenopausal - Surgical or medical castration (?) |
שחזור השד
ערך מורחב – שחזור השד - היבטים כירורגיים - Breast reconstruction - surgical aspects
יש להציע לכל חולה מנותחת שחזור השד. שחזור זה ניתן לבצע מיד לאחר ביצוע ניתוח הכריתה (באותו ניתוח), או לאחריו.
כאשר אין מבצעים שחזור ראשוני יש להציע לחולות שחזור מאוחר יותר. יש הממליצים על שחזור רק כעבור שנתיים, תקופה שבה מרבית החזרות מתגלות. כיום קיימת נטייה לבצע הניתוח מוקדם יותר, כ-1/2 שנה לאחר ניתוח הכריתה, על מנת להקטין את החבלה הנפשית בחולות אלה.
מעניינת העובדה, שנשים המגלות התעניינות בשחזור לפני הניתוח ומיד לאחריו, מסרבות מאוחר יותר לעבור שחזור. לכן, מספר החולות העוברות שחזור שד לאחר הכריתה הוא קטן ביחס למספר המנותחות (פירוט יתר על שחזור השד - ראו בערך נפרד).
טיפול מקל - Palliative
טיפול זה נועד להקלת הכאבים ולמניעת כיבים בעור. האפשרויות הטיפוליות בגרורות מרוחקות מסוכמות בטבלה 12.12.
| 1. | Local radiation | |
| 2. | Radiation to painful metastasis | |
| 3. | Estrogen treatment (Diethylstilbestrol) | |
| a. | Postmenopausal (30% - 5 Year survival) | |
| b. | ER (+) (65%) | |
| c. | Soft tissue metastasis (30%) | |
| Contraindicated in: | ||
| * | Premenopausal | |
| * | Estrogen activity in vaginal smear | |
| 4. | Antiestrogen treatment (Tamoxifen) | |
| a. | Perimenopausal patients ER (+) (30%) | |
| b. | Vaginal smear (+) | |
| c. | Premenopausal ER (+) | |
| 5. | Androgen treatment (Testosterone) | |
| a. | Pre and perimenopausal patients (30%) | |
| b. | ER (+) (45%) | |
| c. | Bone metastasis | |
| d. | Nonresponders to Estrogen therapy | |
| 6. | Steroids treatment (15%) | |
| a. | Lung metastasis | |
| b. | Liver metastasis | |
| c. | Hypercalcemia | |
| d. | Jaundice | |
| e. | Brain metastasis | |
| 7. | Radiation or Surgical castration | |
| a. | Responders to estrogen treatment with relapse | |
| b. | Premenopausal | |
| c. | Slow growing tumors ER (+) | |
| d. | Combine with chemotherapy | |
| 8. | Adrenalectomy (surgical or chemical) | |
| a. | Same as castration | |
| b. | Combined with castration | |
| 9. | Hypophysectomy (surgical or radiation) same as adrenalectomy | |
| 10. | Chemotherapy | |
| 11. | Immunotherapy |
גרורות מרוחקות יכולות להופיעה במקומות שונים השכיחים שביניהם הם עצמות ריאות וכבד. בחולות עם שאת לובולרית אפשר למצוא גם גרורות למעי ולמוח. האיברים הנפגעים מופיעים באיור 33.12.
הקרנות
הקרנות יעילות בגרורות ברקמות הרכות או בעצמות שמקורן בשאת ממארת בשד.
טיפול הורמונלי
ערך מורחב – הטיפול הכימי בסרטן השד
טיפול באסטרוגנים: הטיפול באסטרוגנים יעיל רק בנשים בתקופת הבלות, וככל שמספר שנות חייהן לאחר הפסקת המחזור רב יותר, כך השפעת הטיפול טובה יותר. 56% מהנשים בגיל הפוריות יגיבו למתן אסטרוגנים בהתפשטות השאת, ולכן אין לתת להן אסטרוגנים במסגרת הטיפול. כמו-כן אין לתת טיפול זה לחולות בתקופת הבלות, אשר נמצאה אצלן עדות לפעילות אסטרוגנית, במשטחים שנלקחו מהלדן (נרתיק).
30% מהנשים בתקופת הבלות מגיבות לטיפול אסטרוגני, במיוחד נשים בעלות גרורות ברקמות הרכות. נוכחות קולטנים לאסטרוגן מעלה את אחוז התגובה ל-65%, בעוד אשר בקבוצה ללא קולטנים לאסטרוגן ניתן למצוא תגובה רק ב-9% מהחולות.
התכשיר המקובל הוא Diethylstilbestrol 5 מ"ג 3x ליממה. ההשפעה של הטיפול נצפתה בשבוע ה-4, אבל יש להמשיך אותו לפחות חודשיים לפני שמחליטים שאינו יעיל. משך התגובה הממוצע הוא 16 חודשים. ההיוותרות בחיים של חולות המגיבות לטיפול זה היא כפולה מזו של אלה שאינן מגיבות.
תופעות הלוואי השכיחות בעקבות הטיפול הן:
- חוסר תיאבון.
- בחילות והקאות אשר נעלמות מספר שבועות לאחר תחילת הטיפול.
לאחר שימוש ממושך ניתן לראות:
- פיגמנטציות בעור.
- הגדלת השדיים.
- אגירת מים ונתרן.
- דימומים מהרחם.
כאשר מופיעים דימומים שלא ניתן להשתלט עליהם יש להפסיק את האסטרוגנים. לפעמים יש לתת אנדרוגנים על מנת להפסיק את הדימומים.
טיפולים אנטי-אסטרוגניים: תרופות אלה מתחרות עם האסטרוגנים על הקולטנים הרקמתיים ועל-ידי כך חוסמות את השפעת האסטרוגנים. התרופות האנטי-אסטרוגניות המקובלות הן Tamoxifen, Nafoxidine ו-Clomifene. התרופה המקובלת ביותר היא ה-Tamoxifen, הניתן במינון של 20 מ"ג ליממה דרך הפה. רוב החולות המגיבות הן חולות בתקופת הבלות, אולם גם חלק מהחולות בתקופת הפוריות מגיבות.
בחולות בגיל הבלות עם קולטני אסטרוגן חיוביים ניתן לטפל במעכבי ארומטז. נמצא, שחולות המטופלות במעכבי ארומטז מגיבות בשיעור גבוה יותר בהשוואה לחולות המטופלות ב-Tamoxifen, וחולות שהשאת שלהן עמידה ל-Tamoxifen יגיבו לטיפול במעכבי ארומטז.
טיפול באנדרוגנים: טיפול זה ניתן לחולות בתקופת הפוריות, בעלות שאת ממארת מפושטת של השד. טיפול זה משפר את התגובה של חולות שעברו כריתת שחלות, או של חולות שלא הגיבו כלל לכריתת השחלות. בנשים לאחר תקופת הבלות, שבמשטחים הנרתיקיים שלהן נמצאה עדות לפעילות אסטרוגנית, אפשר לנסות טיפול אנדרוגני, אולם אחוז התגובה שלהן הוא נמוך - 15%.
התגובה של חולות בעלות גרורות בעצמות לטיפול אנדרוגני היא טובה יותר מאשר תגובתן לאסטרוגנים. בעבור חולות שאינן מגיבות לטיפול במשך 6 שבועות יש לחפש דרכי טיפול אחרות. 30%-25% מהחולות שעברו טיפול באסטרוגנים או כריתת שחלות, ואשר המחלה התלקחה אצלן מחדש, מגיבות לטיפול באנדרוגנים. 45% מהחולות בעלות קולטנים חיוביים לאסטרוגן מגיבות לטיפול, לעומת 8% מהחולות בעלות קולטנים שליליים. את הטיפול יש להמשיך עד אשר החולה נכנסת לתקופת רגיעה ואז להפסיק. ניתן לחדש את הטיפול כאשר החולה מראה סימנים של התלקחות מחודשת.
התכשירים המקובלים הם: Testosterone 100 מ"ג 3x לשבוע לשריר. Fluoxymesterone (Halotestin) אפשר לתת במינון של 40-20 מ"ג ליממה דרך הפה. טיפול הנמשך 3 חודשים נותן תוצאות מירביות, 80% מהחולות הסובלות מכאבים בעצמות מגיבות לטיפול זה. סיבוכי הטיפול כוללים:
- שעירות יתר (Hirsutism).
- זכרור (Masculinization).
- עלייה בליבידו.
- צרידות.
- נשירת שיער ואקנה (חטטת).
- בחילות והקאות.
- רעלת כבד.
- צבירת נוזלים.
לטיפול באסטרוגנים או באנדרוגנים אין השפעה על גרורות בכבד או בריאות.
סטרואידים - הטיפול בסטרואידים ניתן כאשר:
- לחולה יש גרורות בריאות.
- לחולה יש גרורות בכבד.
- החולה לוקה ביתר סידן בדם (היפרקלצמיה).
- החולה לוקה בצהבת.
- החולה במצב קשה ולא תעמוד בטיפולים אחרים.
התגובה לסטרואידים אינה מרמזת על תגובה גם לכריתת בלוטת יותרת הכליה (Adrenalectomy). משך ההקלה בחולות אלה הוא 6 חודשים בממוצע. 15% מהחולות המקבלות טיפול זה מספרות על שיפור בתיאבון ובהרגשה; בחלק מהחולות ניתן למצוא גם נסיגה של גרורות ברקמות הרכות והקלה במצוקה הנשימתית.
סיבוכי הטיפול הם: חשיפת יתר לזיהומים, הופעת כיבים פפטיים ודימומים ממערכת העיכול, יתר-לחץ-דם, סוכרת ובצקות.
בחירת הטיפול ההורמונלי
את הטיפול התרופתי יש להתאים לחולה:
- בחולות בתקופת הבלות הטיפול היעיל יותר בגרורות ברקמות הרכות, בגרורות בבית החזה ובריאות הוא על-ידי אסטרוגנים.
- בגרורות בעצמות - על-ידי אנדרוגנים.
- בגרורות בכבד ובמוח - על-ידי סטרואידים.
- כיום, בחולות בגיל הבלות, הטיפול בתכשירים אנטי-אסטרוגניים הוא טיפול הבחירה במחלה הגרורתית. רק לאחר כישלון טיפול זה עוברים לטיפול הורמונלי אחרת או לטיפול משולב.
טיפולים אנדוקריניים כירורגיים
כריתת השחלות
35% מהחולות בגיל הפוריות, שלהן גרורות או חזרה מקומית, מגיבות לכריתת השחלות. עוצמת התגובה תלויה בהימצאות קולטנים חיוביים לאסטרוגנים בשאת. חולות אשר לא מגיבות לכריתת השחלות אינן מגיבות גם לכריתת האדרנל. מבין אלה המגיבות לכריתת השחלות 50% מגיבות גם לכריתת האדרנל או לכריתת בלוטת יותרת המוח (Hypophysectomy). מאלה אשר אינן מגיבות לכריתת השחלות, רק 15% מגיבות לניתוחים אנדוקריניים אחרים. לא מקובל לבצע כריתת שחלות מניעתית. את כריתת השחלות אפשר לבצע באופן כירורגי או על-ידי הקרנות. חולות העוברות כריתת שחלות ומקבלות טיפול כימי מיד לאחר מכן, מגיבות ברגיעה ארוכה.
טיפול תרופתי המעכב הפרשת אסטרוגן מהשחלות הוא הטיפול באגוניסטים ל-GnRH (Gonadotropin-releasing hormone agonist) - Goserelin (Zoladex). כתוצאה ממתן תרופה זו יורדת הפרשת ה-LH (Luteinizing hormone) בצורה משמעותית ולכן הגירוי להפרשת אסטרוגן על ידי השחלות. התגובה למתן תרופה זו דומה לכריתת שחלות, ולכן הוא יכול להחליף את כריתת השחלות הטיפולית. השילוב של Goserelin עם Tamoxifen משפר את שיעורי התגובה בצורה משמעותית במיוחד בחולות לפני גיל הבלות או סביב גיל זה.
כריתת בלוטת יותרת הכליה (Adrenalectomy) ובלוטת יותרת המוח (Hypophysectomy)
30% מהחולות הלוקות במחלה מפושטת מגיבות לאדרנלקטומיה או להיפופיזקטומיה. חולות המגיבות למניפולציות הורמונליות או לכריתת שחלות מגיבות טוב יותר לניתוחים אלה. כללית עדיף לבצע אדרנלקטומיה, מכיוון שקל יותר לטפל מבחינה אנדוקרינית בחולות לאחר כריתת האדרנל מאשר לאחר כריתת ההיפופיזה. בנשים פוריות כריתת שחלות, המביאה לנסיגה של השאת, לא מחייבת לבצע אדרנלקטומיה. אולם אם המחלה חוזרת יש להוסיף גם אדרנלקטומיה. בנשים, בתקופת הבלות, אפשר לבצע כריתת השחלות והאדרנלים בניתוח אחד. יש מחברים הטוענים שגם בחולות פוריות יש לבצע ניתוח מאוחד מכיוון שתוצאות הניתוח המשולב הן טובות יותר.
ניתוחים אלה הם ניתוחים גדולים, מלווים בשיעור תמותה של 5% ובסיבוכים אנדוקריניים, ולכן יש לבחור בקפדנות את קבוצת החולות שיהנו מניתוחים אלה. חולות שלהן גרורות בעלות פוטנציאל גדילה איטי, וחולות המגיבות לטיפולים הורמונליים, נמצאו מגיבות טוב יותר לניתוחים אלה. חולות שלהן גרורות ברקמות הרכות, בעצמות ובקרום הריאה (Pleura) מגיבות טוב יותר מחולות בעלות גרורות בכבד או במוח. ככל שגיל החולות גבוה יותר, כך התגובה טובה יותר. 50% מהחולות בעלות קולטנים חיוביים לאסטרוגן מגיבות לאדרנלקטומיה, לעומת 8% מהחולות שלהן קולטנים שליליים. 30% מהחולות שלהן קולטנים גבוליים תגבנה לניתוח.
לפני ביצוע האדרנלקטומיה יש לנסות את האדרנלקטומיה הכימית, על-ידי מתן של Aminoglutethimide במינון של 1 גרם ליממה ובתוספת של 40 מ"ג Hydrocortisone. חומר זה מעכב את יצירת הסטרואידים באדרנל.
מקום האדרנלקטומיה בטיפול בסרטן השד איבד מחשיבותו בשנים האחרונות עקב הופעתן של התרופות האנטי הורמונליות, במיוחד מקבוצת מעכבי הארומטז אשר נמצאו יעילות כמו כריתת בלוטת האדרנל.
כימותרפיה
ערך מורחב – הטיפול הכימי וההורמונלי בסרטן השד - Chemotherapy and hormonal therapy for breast cancer
לחולות בעלות שאתות מתקדמות, או שאתות הגדלות מהר , יש לתת טיפול כימותרפי. שילוב של תרופות, היא השיטה המקובלת יותר. 87% מהחולות מקבלות את השילוב של Doxorubicin (Adriamycin), Cyclophosphamide ו-Fluorouracil. שילובים יותר עדכניים של AC עם Paclitaxel (Taxol) ובחולות שהן Her2 חיוביות הוספת Trastuzumab (Herceptin) מעלים את אחוזי התגובה וההישרדות בחיים של חולות גרורתיות.
השילוב של כימותרפיה עם טיפול הורמונלי לא הוכח כיעיל יותר מאשר הטיפול על-ידי כימותרפיה לבד.
התוספת של Paclitaxel ו-Trastuzumab לרשימת התרופות המאושרות לטיפול העלתה בצורה משמעותית את יכולת ההתמודדות עם סרטן השד.
נוזל ממאיר בחלל הצדר (Pleura)
במחצית מהחולות הנמצאות בשלבי מחלה מתקדמים ניתן למצוא נוזל המכיל תאים ממאירים בצדר. נוזל זה יש לנקז, ולאחר מכן לגרום להידבקויות של הצדר על-ידי הכנסת חומר סקלרוזנטי (Sclerosant) כמו טטראציקלין (Tetracycline) 500 מ"ג ב-30 סמ"ק של תמיסת מלחים איזוטונית (סליין) או טלק סטרילי. את החומר מחדירים לחלל הצדר, סוגרים את הנקז ל-6 שעות ומבקשים מהחולה להסתובב במיטה על מנת לפזר את החומר, ולאחר מכן פותחים את הנקז. תוך 5-4 ימים נוצרות הידבקויות בפלאורה ואז מוציאים את הנקז. למרות הטיפול, בחלק מהחולות מופיעה הצטברות חוזרת של הנוזל, ולכן יש צורך לחזור על הטיפול מספר פעמים. יש המכניסים לחלל הצדר ThioTEPA, אולם מכיוון שהיא גורמת בחילות עדיפה השיטה הקודמת.
היפרקלצמיה
היפרקלצמיה שכיחה בכ-10% מהשאתות הממאירות בשד. בחלק מהחולות הסיבה היא גרורות אוסטאוליטיות. בחלק אחר, לא נמצאו גרורות, אולם נמצא בהן פיטוסטרול אסטר (Phytosterol esters), שהוא בעל תכונות הדומות לויטמין D, כלומר משחרר סידן מהעצם. ההיפרקלצמיה הזו אינה מלווה בירידה בזרחן או עליה בהורמון הפאראתירואיד, כמו בהיפר פאראתירואידיזם.
במצבים הקלים יש לטפל על-ידי הידרציה טובה, להמשיך בפעילות גופנית ובדיאטה דלת סידן. במצבים חריפים יותר יש לתת כמות מרובה של נוזלים דרך הווריד עם משתנים, סטרואידים ונתרן גופרתי (Sodium sulfate), הקושר סידן ומופרש במהירות בשתן. במצבים חריפים אפשר לטפל גם במיטראמיצין שהיא תרופה אנטימיטוגנית, המעכבת את פעולת האוסטאוקלאסטים. טבלה 12.12 מסכמת את החלופות הטיפוליות בחולות עם גרורות מרוחקות.
| 1. | Local radiation | |
| 2. | Radiation to painful metastasis | |
| 3. | Estrogen treatment (Diethylstilbestrol) | |
| a. | Postmenopausal (30% - 5 Year survival) | |
| b. | ER (+) (65%) | |
| c. | Soft tissue metastasis (30%) | |
| Contraindicated in: | ||
| * | Premenopausal | |
| * | Estrogen activity in vaginal smear | |
| 4. | Antiestrogen treatment (Tamoxifen) | |
| a. | Perimenopausal patients ER (+) (30%) | |
| b. | Vaginal smear (+) | |
| c. | Premenopausal ER (+) | |
| 5. | Androgen treatment (Testosterone) | |
| a. | Pre and perimenopausal patients (30%) | |
| b. | ER (+) (45%) | |
| c. | Bone metastasis | |
| d. | Nonresponders to Estrogen therapy | |
| 6. | Steroids treatment (15%) | |
| a. | Lung metastasis | |
| b. | Liver metastasis | |
| c. | Hypercalcemia | |
| d. | Jaundice | |
| e. | Brain metastasis | |
| 7. | Radiation or Surgical castration | |
| a. | Responders to estrogen treatment with relapse | |
| b. | Premenopausal | |
| c. | Slow growing tumors ER (+) | |
| d. | Combine with chemotherapy | |
| 8. | Adrenalectomy (surgical or chemical) | |
| a. | Same as castration | |
| b. | Combined with castration | |
| 9. | Hypophysectomy (surgical or radiation) same as adrenalectomy | |
| 10. | Chemotherapy | |
| 11. | Immunotherapy |
פרוגנוזה של חולות סרטן השד
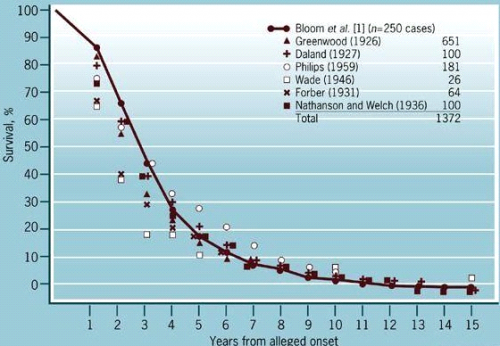
הפרוגנוזה תלויה בדירוג, בסוג הפתולוגי של השאת ובטיפול. 50% מהחולות שלא קיבלו כל טיפול נפטרות תוך 3 שנים לאחר האבחנה. 5% מהחולות חיות 10 שנים ללא טיפול (גרף 12.12).
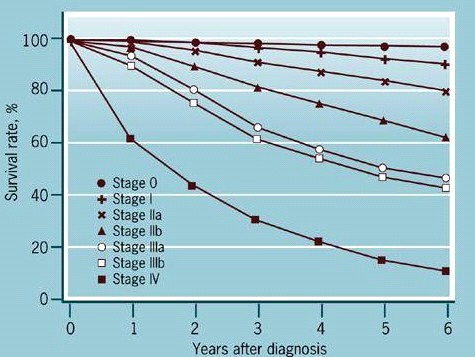
שיעור ההיוותרות בחיים ל-5 שנים של חולות סרטן השד שטופלו הוא - 63%, ולעשר שנים - 46%. שיעור ההיוותרות בחיים ל-5 שנים של חולות מדרגה 1 הוא 95%, מדרגה 2 - 75%, מדרגה 3 - 60% ומדרגה 4 - 18% (טבלה 14.12).
| שלב | 0 | I | II | III | IV |
|---|---|---|---|---|---|
| היוותרות בחיים | |||||
| 5 שנים | 98% | 95% | 75% | 60% | 18% |
| 10 שנים | 90% | 63% | 53% | 25% | 0% |
שיעור ההיוותרות בחיים ל-5 שנים, של חולות ללא בלוטות לימפה נגועות, הוא 90%-75% ול-10 שנים - 65%. לעומת זאת, שיעור ההיוותרות בחיים ל-5 שנים של חולות בעלות בלוטות לימפה נגועות יורד ל-60%-40%, ול-10 שנים ל-25%. ככל שמספר הבלוטות הנגועות רב יותר, כך ההיוותרות בחיים פוחתת. (גרף 13.12).
במעקב שנמשך 40 שנה, ובו נכללו חולות סרטן השד שהיו צעירות מגיל 40 בזמן האבחנה, נמצא שלכל אורך המעקב ההיוותרות בחיים של החולות הללו היתה גרועה יותר מזו של נשים באותן קבוצות גיל ללא סרטן השד. המסקנה מתצפית זו: חולה שחלתה בסרטן השד נשארת כל חייה בקבוצת סיכון גבוה למות מהמחלה היסודית.
השאתות ממאירות יותר בנשים צעירות ובחולות שבהן השאת ממוקמת ברביע פנימי. העובדה שההיוותרות בחיים ל-10 שנים נמוכה כל כך, מעלה את ההשערה, שבזמן האבחנה כבר קיימות גרורות מיקרוסקופיות אשר לא נראות באמצעי הגילוי השגרתיים הקיימים, המתפתחות עם השנים והורגות את החולות. לכן הרעיון של טיפול כימי מסייע כה מקובל בשנים האחרונות, והפך לסטנדרט טיפולי מקובל כך שכיום מעטות הן חולות סרטן השד שאינן מקבלות טיפול מסיע אנטי-הורמונלי או כימי או שילוב של שניהם, למרות שידוע שב-75% מהחולות הטיפול הזה לא ישנה את מהלך המחלה.
מכיוון שהטיפול מסובך וכולל הרבה תחומים הוא חייב להתבצע על-ידי מספר מומחים: כירורגים, אונקולוגים, רדיותרפיסטים ופסיכיאטרים. גישה רב תחומית זו הביאה להתפתחות של מרכזי שד במקומות שונים בעולם.
מעקב
המעקב אחר חולות סרטן השד חייב להיות לכל אורך חייהן. בתחילה המעקב הוא כל 4-3 חודשים, למשך 3 שנים, על מנת לגלות חזרות מקומיות בשלב מוקדם ובמטרה לזהות נוכחות של שאתות בשד השני.
לאחר תקופה זו, במשך חמש שנים, המעקב הוא כל חצי שנה. לאחר מכן ניתן לעבור למעקב שנתי.
ראו גם
- לנושא הקודם: סרטן השד - בדיקות סקר, בירור ואבחנה - Breast cancer - screening and diagnosis
- לנושא הבא: כריתת בלוטות הלימפה בסרטן השד - Lymph node dissection in breast cancer
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: כירורגיה של הטחול
- לפרק הבא: בקעים
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק