סרטן ערמונית לא גרורתי העמיד לסירוס - טיפול ב-Apalutamide
| סרטן ערמונית לא גרורתי העמיד לסירוס - טיפול ב-Apalutamide | ||
|---|---|---|
| ' | ||
| 250px | ||
| שמות נוספים | Erleada) Apalutamide) כסיכול בחולי סרטן ערמונית לא גרורתי העמיד לסירוס | |
| יוצר הערך | ד"ר דניאל קייזמן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן הערמונית
הערמונית היא בלוטה אצל הגבר המצויה מתחת לשלפוחית השתן ובעלת תפקיד בהפרשת חלק מנוזל הזרע. בלוטת הערמונית עלולה להיות המקור למספר הפרעות רפואיות אצל הגבר. ההפרעה השכיחה היא הגדלה שפירה של הערמונית המתרחשת אצל גברים רבים בגיל לאחר הפריון.
מצב זה גורם לעיתים להפרעה חסימתית במתן שתן. הפרעה אחרת שמקורה בבלוטת הערמונית היא סרטן הערמונית.
סרטן הערמונית הוא הסרטן השכיח בקרב גברים והגורם השני בשכיחותו לתמותת גברים מסרטן בעולם המערבי. גורמי הסיכון העיקריים להתפתחות סרטן הערמונית הם גיל מתקדם (סרטן הערמונית נדיר בגיל צעיר מ-40 ושכיחותו עולה בהתמדה בגיל מבוגר יותר), מחלה בקרובי משפחה מדרגה ראשונה (אך רק במיעוט המקרים הסיפור המשפחתי הוא חלק מתסמונת גנטית מזוהה כגון מוטציה בגן BRCA), העדר פעילות גופנית וצריכה מוגברת של אוכל שומני. בישראל, מאובחנים עם סרטן ערמונית כ-2,500 מקרים בשנה בקירוב, ואחד מכל תשעה עד שישה גברים יאובחן.
אבחון סרטן הערמונית
עקב בדיקת גילוי מוקדם על ידי מדידת הרמה בדם של הסמן PSA (Prostate-Specific Antigen), סרטן הערמונית מאובחן לרוב (90 אחוזים מהמקרים) בשלב מוקדם ללא גרורות ולעיתים ללא תסמינים. התועלת בגילוי מוקדם לא הוכחה חד משמעית וקיימים חילוקי דעות לגבי גישה זו. בחלק מהמקרים יאובחן הגידול בשלב מתקדם מקומית-אזורית או אף עם גרורות (כ-10 אחוזים מהמקרים). גרורות עלולות לגרום לתסמינים לפי האיבר המעורב. העצמות הן האיבר השכיח למעורבות גרורתית. תסמינים של סרטן ערמונית גרורתי כוללים כאב עצמות, ירידת משקל, ירידת תיאבון, חסימת דרכי השתן.
תהליך אבחון סרטן הערמונית כולל בדיקת רופא (ובפרט בדיקת אצבע להערכת הערמונית), בדיקת דם לרמת הסמן PSA (Prostatic Specific Antigen), ביופסיה של הערמונית ובדיקות הדמיה. הביופסיה תהיה לעיתים בהנחיית MRI (Magnetic Resonance Imaging) של הערמונית. בדיקות ההדמיה כוללות לעיתים MRI של הערמונית ובדיקת PET PSMA לאבחון או שלילה של קיום גרורות.
הגישה לסרטן ערמונית מוקדם לא גרורתי
סרטן ערמונית המתגלה בשלב מוקדם הוא בר ריפוי ורוב החולים לא ימותו ממחלתם. קיימות מגוון אפשרויות גישה ובפרט ניתוח כריתת הערמונית וטיפול קרינתי לערמונית (ולעיתים: אגן וכן בשילוב טיפול הורמונלי). בחלק מהחולים קיימת אפשרות להשגחה פעילה ללא מתן טיפול. טיפולים נוספים הניתנים לפעמים הם ברכיתרפיה (טיפול על ידי השתלת גרגירים רדיואקטיביים בערמונית), HIFU (High-Intensity Focused Ultrasound, הרס רקמת הגידול על ידי חימום), טיפול פוטודינמי (TOOKAD).
שיקולים המובאים בחשבון בקביעת הטיפול המתאים הם: גיל החולה, מחלות רקע, רמת הסמן PSA, מראה הגידול בביופסיה (ניקוד גליסון), ממצאי הבדיקה הגופנית ובדיקות ההדמיה, ולפעמים בדיקות גנטיות של רקמת הגידול.
בתום הטיפול הראשוני, יימשך לרוב המעקב התקופתי כולל בדיקה גופנית, בדיקת הסמן PSA וחזרה לפי צורך על בדיקות הדמיה.
הגישה לחזרת מחלה לאחר טיפול ראשוני
בשליש מהחולים (בקירוב) שטופלו לסרטן ערמונית שהתגלה בשלב מוקדם ללא גרורות, תיראה חזרת מחלה לאחר טיפול ראשוני. בשלב ראשון, חזרה זו מתבטאת לרוב בעליית רמת הסמן PSA, ללא עדות לגרורות בבדיקות הדמיה. מצב זה מכונה חזרה ביוכימית של סרטן הערמונית.
אפשרויות גישה למצב זה כוללות טיפול אחר שלא ניתן בעבר (למשל קרינה עם או בלי טיפול הורמונלי לאחר ניתוח כריתת ערמונית), מעקב בלבד, מתן טיפול הורמונלי, השתתפות במחקר קליני.
בחלק מחולים אלה, תתפתחנה בהמשך גרורות. בסופו של דבר, בכ-20 אחוזים מהחולים תתפתחנה גרורות בשלב כלשהו של מחלתם (באבחון מלכתחילה או בהמשך לאחר אבחון גידול ראשוני לא גרורתי).
אחת הגישות השכיחות לחולים עם חזרה ביוכימית (עליית PSA) של גידול ערמונית, ללא עדות לגרורות בבדיקות הדמיה, לאחר טיפול ראשוני, היא טיפול הורמונלי בזריקות LHRH אגוניסט או אנטגוניסט, לשם הפחתת רמת הטסטוסטרון לטווח הסירוס. רוב החולים יגיבו היטב לטיפול זה ותיראה ירידה ניכרת ברמת הסמן PSA. ברם, בחלק מהחולים שיטופלו בגישה זו יתפתח בהמשך מצב עמיד לסירוס ותיראה התקדמות הסמן PSA למרות טיפול הורמונלי וטסטוסטרון המצוי בטווח הסירוס. בתחילה, עליית PSA (התקדמות ביוכימית) תחת הטיפול ההורמונלי תהיה ללא עדות לגרורות בבדיקות הדמיה אך לבסוף, תיראה התקדמות מחלה והופעת גרורות בבדיקות הדמיה בחלק מהחולים.
סרטן ערמונית הוא הגורם השני בשכיחותו לתמותת גברים מסרטן בעולם המערבי. רוב מקרי המוות יקרו עקב התקדמות לסרטן גרורתי העמיד לסירוס. הופעת גרורות הן סיבה מרכזית לסיבוכים ולמוות בחולי סרטן ערמונית. גרורות יכולות להופיע במגוון אתרים כולל עצמות, קשריות לימפה, ריאות, עצמות. גרורות גרמיות גורמות לכאב, לשברים וללחץ על חוט השדרה. על כן, מניעת הופעת גרורות היא מטרה טיפולים מרכזית בחולי סרטן ערמונית.
הגישה לסרטן ערמונית עמיד לסירוס ללא עדות לגרורות בבדיקות הדמיה - non metastatic castrate resistant prostate cancer
בעבר, לא היה טיפול מאושר FDA (Food and Drug Administration) שהראה יעילות במניעת הופעת גרורות בקבוצת החולים עם סרטן ערמונית עמיד לסירוס, ללא עדות לגרורות בבדיקות הדמיה. גישות לא מוכחות שננקטו כללו בין השאר המשך טיפול הורמונלי ראשוני עד הופעת גרורות, והוספת טיפול הורמונלי פומי במעכב הקולטן לאנדרוגן (למשל התרופה קסודקס).
מאז סוף המאה ה-20, חל שיפור משמעותי בהבנת הביולוגיה של סרטן הערמונית, והידע שנצבר הוביל להתפתחות טיפולים חדשים המכוונים באופן מדויק נגד מנגנונים מולקולריים האחראים להתקדמות המחלה. שפעול הקולטן לאנדרוגן הוא תהליך מרכזי בסרטן הערמונית. במצב העמיד לסירוס, הקולטן לאנדרוגן רגיש מאוד לריכוז נמוך של אנדרוגנים. המקור לאנדרוגנים המשפעלים את הרצפטור לאנדרוגן במצב העמיד לסירוס הוא בלוטת יותרת כליה, ויצור מקומי בסביבת הגידול.
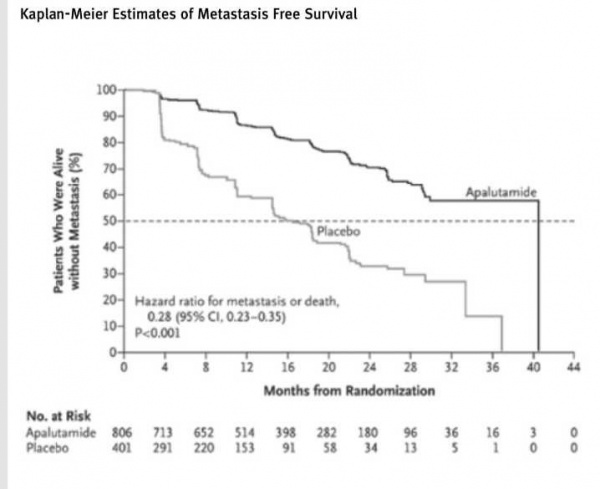
אפלוטמיד (Apalutamide, Erleada) הוא מעכב תחרותי של הקולטן לאנדרוגן. במחקר פרוספקטיבי, אקראי שפורסם (Smith MR et al, NEJM, 2018), טיפול באפלוטמיר (מול פלצבו) בקבוצה גדולה של מעל 1,200 חולים עם סרטן ערמונית עמיר לסירוס וללא גרורות, הוכח כיעיל ביותר במניעת הופעת גרורות עתידיות בבדיקות הדמיה.
הטיפול באפלוטמיד שיפר את פרק הזמן ללא התקדמות מחלה בבדיקות הדמיה (ללא הופעת גרורות) (הבדל יותר מכפול, 40.5 לעומת 16 חודשים, 0.28 HR (Hazard Ratio) להופעת גרורות או תמותה, 0.001>p, ראו איור), הביא להארכה משמעותית של פרק הזמן על התקדמות סימפטומטית של המחלה (0.001>HR 0.45, p).
במדד ה-PFS2, המתייחס למשך הזמן מתחילת הטיפול במחקר ועד להתקדמות גם עם הטיפול הראשון במחלה גרורתית (mCRPC) בכל אחד מהטיפולים המאושרים לשלב זה (כלומר משך הזמן על אפלוטמיד או פלצבו + משך הזמן על הטיפול הראשון ב-mCRPC), הודגמה הפחתה של 51 אחוזים בסיכון להתקדמות מחלה (לא הושג חציון בקבוצת האפלוטמיד, לעומת 39 חודשים בקבוצת הפלצבו).
בנוסף לרווח הקליני המשמעותי, הטיפול נסבל טוב יחסית, ורק מיעוט החולים (10.6 אחוזים) נאלצו להפסיק טיפול עקב תופעות לוואי. במאמר נוסף, אשר פורסם ב-Lancet Oncology ומרחיב לגבי תוצאות מדדי איכות החיים (HRQOL - Health Related Quality Of Life), כפי שנצפו במחקר, הודגמה יציבות במדדי איכות החיים בין שתי קבוצות המטופלים, זאת למרות הוספת הטיפול באפלוטמיד ושמירה על איכות החיים לכל אורך הטיפול.
התרופה אפלוטמיד נלקחת באופן פומי, במינון 240 מיליגרם פעם ביום (החולה נוטל בבת אחת 4 טבליות של 60 מיליגרם כל אחת).
בפברואר 2018 הטיפול באפלוטמיד אושר על ידי ה-FDA כטיפול בחולי סרטן ערמונית עמיד לסירוס ללא גרורות.
התרופה אפלוטמיד מכוונת כנגד מנגנונים מולקולרים מדויקים הקשורים לסרטן הערמונית, ומרחיבה את האופק הטיפולי בחולים עם סרטן עמיד לסירוס ללא גרורות. בנוסף, היא בעלת פרופיל תופעות לוואי קל יחסית (חלק מהחולים סבלו מתפרחת, עייפות, כאב מפרקים. תופעות לוואי אלו היו לרוב בררגה קלה 1–2). רק 11 אחוזים מהחולים נאלצו להפסיק טיפול עקב תופעות לוואי משמעותיות, ולכן יוכלו ליהנות מטיפול זה רוב החולים המתאימים לאינדיקציה זו (בסך הכל מספר החולים קטן יחסית).
לאור אישור התרופה על ידי FDA והנתונים בספרות הרפואית, הוגשה התרופה לאישור ועדת סל התרופות לשנת 2019 לאינדיקציה של חולים עם סרטן ערמונית לא גרורתי העמיד לסירוס.
התרופה נכנסה לשימוש בסל הבריאות בישראל ב-2019.
ביבליוגרפיה
- Smith MR et al, Apalutamide Treatment and Metastasis- Free Survival in Prostate Cancer. N Engl J Med. 2018
- Saad F et al, Etfect of apalutamide on health-related quality of life in patients with non-metastatic castration- resistant prostate cancer: an analysis of the SPARTAN randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2018
המידע שבדף זה נכתב על ידי ד"ר דניאל קייזמן - מנהל היחידה לגידולי דרכי השתן במערך האונקולוגי, מומחה לרפואה פנימית, מומחה לאונקולוגיה רפואית, בית החולים מאיר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק