סרטן ריאה - טיפול מותאם אישית - 2018 - Lung cancer - personalized therapy
הופניתם מהדף סרטן ריאה - טיפול מותאם אישית - 2018 לדף הנוכחי.
| סרטן ריאה - טיפול מותאם אישית - 2018 | ||
|---|---|---|
| Lung Cancer - Personalized therapy | ||
| 250px | ||
| שמות נוספים | תרופות לטיפול בסרטן ריאה | |
| יוצר הערך | פרופ׳ ניר פלד | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – סרטן ריאה, רפואה מותאמת אישית
סרטן הריאה אחראי לשליש ממקרי התמותה ממחלת הסרטן בישראל, וגורם לתמותה בשיעור סך התמותה הנגרם מסרטן שד, סרטן מעי וסרטן פרוסטטה ביחד. כ-2,500 חולי סרטן ריאה חדשים מאובחנים מדי שנה, 2,000 מהם נפטרים.
חלו תמורות מהותיות, אשר משנות את פני המחלה ומאריכות באופן מהותי את השרידות ממנה, כמו גם המטות את היחס בין מחלה מוקדמת למתקדמת. מבין השינויים המרכזיים, ניתן למנות: סקר לאבחון מוקדם ושימוש בטכנולוגיות מתקדמות, הן לאבחון המחלה והן לטיפול בה.
נתונים עיקריים
- סרטן הריאה אחראי לשליש ממקרי התמותה הסרטנית בישראל
- סרטן הריאה גורם לתמותה בדומה לסך התמותה הנגרמת מסרטן שד, מעי ופרוסטטה ביחד
- בישראל מאובחנים 2,500 חולי סרטן ריאה חדשים מדי שנה, מהם 2,000 סובלים ממחלה מתקדמת ונפטרים מהמחלה
- כ-80 אחוזים ממקרי סרטן הריאה נובעים מעישון
- סקר לאבחון מוקדם בקרב אוכלוסיית סיכון, מפחית את התמותה מהמחלה בלפחות 26 אחוזים סך הכל, ובנשים אף ב-40 אחוזים
- אבחון מוקדם, על ידי CT (Computed Tomography) נמוך עצמה שנתי, מופיע בכלל ההנחיות המקצועיות בתחום
- חציון החיים עלה משנה אחת לכשנתיים, ואף ל-3.5 שנים, בכשליש מהחולים
- רפואה מותאמת אישית מאפשרת הנגשת טיפולים מוכווני מטרה בקווי הטיפול השונים
- פריצת הדרך האימונולוגית (Immunologic) מאפשרת ריפוי במספר עולה של חולים, למרות אבחונם כלוקים במחלה גרורתית
הטיפול בחולים ב-NSCLC (Non-Small Cell Lung Cancer)
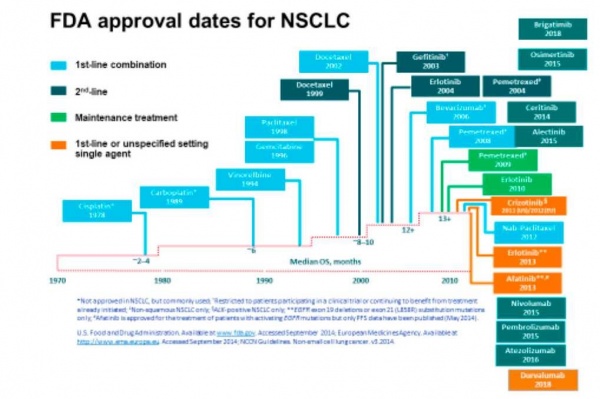
הטיפול השתנה מטיפול אחיד לכלל החולים, לטיפול המתבסס על התאמה אישית. מגוון הטיפולים תלויי ה-(פלטינום), פינה את מקומו לטיפולים מוכווני מטרה, לאלו המתאפיינים במוטציה אופיינית (כדוגמת: EGFR, ALK, ROS ואחרים) ולטיפולים אימונותרפיים (Immunotherapy) כתרופה בודדת או במשלב אימונו-כימי. הטיפולים החדשים לא רק ששיפרו את איכות החיים, הם גם מאריכים משמעותית את השרידות מהמחלה ואף מעניקים אפשרויות ריפוי בחלק מהמקרים, למרות היות המחלה גרורתית.
הראשון אשר הדגים יתרון בבחירת כימותרפיה על בסיס היסטולוגיה, היה פרופסור Scagliotti, אשר הדגים שיפור בשיעורי הישרדות במתן Pemetrexed לחולי Non squamous (שאינו קשקשי) בהשוואה למשלבי פלטינום אחרים. נקודת זמן נוספת, הייתה שילוב מעכבי יצירת כלי דם (Bevacizumab) כחלק מהמשלב הטיפולי בחולי סרטן ריאה שאינו קשקשי. משלב שכלל Avastin הביא לחציית שנת ההישרדות, לראשונה במחלה זו.
הבנת המנגנונים המולקולאריים והגנטיים בהתהוות הסרטן, הובילו לאיתור יעדי טיפול בסרטנים תלויי נוכחות מוטציות. שינוי הגישה הוביל להישגים משמעותיים בפרמטרים רבים: משך ההישרדות, שיעורי התגובה, זמן עד להתקדמות המחלה ושיפור באיכות החיים של המטופל.
פריצת הדרך הראשונה בטיפול המותאם אישית בסרטן ריאה, הייתה בגילוי תפקידו האונקוגני של ה-EGFR (Epidermal Growth Factor Receptor) ב-15 אחוזים מחולי סרטן ריאה מסוג תאים לא קטנים, הנושאים מוטציה בקולטן זה. חסימת מסלול ה-EGFR, באמצעות טיפול פומי, מאפשרת הארכת חיים באיכות חיים משופרת. המוטציות הגנטיות השכיחות ב-EGFR מטופלות באחת משלוש התרופות הזמינות בסל: Gefitinib, Erlotinib או Afatinib. טיפולים אלו משיגים כשנה ללא התקדמות מחלה, ושילוב קווי הטיפול השונים מוביל לחציון הישרדות של כ-3.5 שנים.
עם התקדמות המחלה, בכ-60 אחוזים מהחולים ניתן לאתר בגן EGFR מוטצית עמידות, T790M, הניתנת לחסימה מחודשת. האפיון המחודש ניתן לביצוע על ידי דגימת דם לאיתור DNA גידולי, וניתוחו בשיטות מולקולריות מתקדמות, הזמינות גם בחלק גדול מהמעבדות בישראל. החולים אשר אותרו בגידול מוטציה זו, יטופלו ב-osimertinib כטיפול קו שני, שהראה תגובה ממושכת של כ-10 חודשים (זמן חציוני), ללא התקדמות מחלה, ביחס ל-4.4 חודשים בקבוצת הביקורת- שטופלה בכימותרפיה מבוססת פלטינום. במחקר שפורסם (FLAURA) נמצא, כי חולים אשר טופלו ב-Osimertimb בקו הטיפול הראשון, השיגו כ-19 חודשים ללא התקדמות מחלה. התווייה זו היא בתהליך רישום והגשה לסל. באופן דומה, נמצאו תרופות ממוקדות מטרה עבור החולים הנושאים פגמים בגן ALK (Anaplastic Lymphoma Kinase).
גן זה (ALK) מייצר חלבון מוטנטי, אשר מגביר את פעילות התאים הסרטניים ומעודד את התפשטות הסרטן בגוף. כ-5 אחוזים מסרטני הריאה הבלוטיים נושאים מוטציה (איחוי) בגן ALK; אלו לרוב חולים צעירים, ללא קשר לחשיפה לעישון ועם פיזור מחלה נרחב כבר בתחילת המחלה. טיפול פומי ב-Crizotinib כקו ראשון הפך להיות שגרת הטיפול באוכלוסייה זו, עם התאמה מחודשת וקוד טיפול מאותה המשפחה כקו שני, שלישי ורביעי. הניסיון העולמי המצטבר, הביא לחציון הישרדות כולל של כ-7 שנים ואף יותר. במחקר אשר פורסם (ALEX) נמצא, כי הטיפול בתרופה Alectinib בקו טיפול ראשון השיג כ-35 חודשים ללא התקדמות מחלה, בהשוואה לטיפול שהיה מקובל כטיפול קו הראשון.
טיפולי קו שני, כוללים תרופות כגון: Alectinib ,Brigatinib, Ceritinib, המתאפיינים בחדירות מוחית טובה וביתרון מובהק, בהשוואה לחלופה כימותרפית - אשר תמיד קיימת. התאמת הטיפול נעשית על בסיס קליני, אם כי אפיון מנגנוני העמידות, באמצעות מוטציות נקודתיות בגן ה-ALK, מאפשרת התאמה מושכלת ויעילה המושתתת על תת-הקבוצה (Variant) של טרנסלוקציית (Translocation) ה-ALK ומוטציית העמידות הבולטת. לדוגמה: פיתוח עמידות במיקום 1,202 של הגן היא בעייתית במיוחד, ודורשת טיפולים שאינם נגישים עדיין באופן מסחרי, כדוגמת Loriatinib.
בגידולים בהם נמצא שינוי גנטי ב-ROSI, השכיח בכאחוז אחד מהאנשים עם סרטן ריאה מסוג תאים לא קטנים, Crizotinib הוכיחה יעילות ביחס לטיפול כימותרפי והוכללה בסל עבור חולים אלו. שינויים גנטיים אחרים ונדירים יותר בקרב חולי סרטן ריאה, כמו: מוטציה ב-BRAF, שמזוהה בעיקר עם סרטן העור מסוג מלנומה, ו-2-HER, שמזוהה בעיקר עם סרטן השד ונקשרו גם לסרטן ריאה, מטופלים בתרופות מוכוונות מטרה שונות.
פריצת דרך גדולה היא העצמת מערכת החיסון לטובת המלחמה הכוללת בתאי הגידול. גם במישור זה, התאמת הטיפול המיטבית היא אישית, כפי שיתואר בהמשך. שילוב מערכת החיסון הראה יעילות על פני טיפולים כימיים, כתרופה בודדת או במשלב עם כימותרפיה. משלבים אלו הביאו ליעלות טיפולית יוצאת דופן ואף לכדי ריפוי בחלק מהחולים, על אף מחלתם הגרורתית. הישג זה מרמז על תחילתו של עידן חדש בעולם סרטן הריאה, אשר פותח צוהר ותקווה לחולים, למשפחותיהם ולציבור המטפלים.
ביומרקרים (Biomarkers) ואימונותרפיה בסרטן ריאות
PDL1 (Phosphodiesterase Delta-Like protein) הוא חלבון המעכב את פעילות הלימפוציטים. לפיכך, הפרשתו על ידי תאי הגידול מרמזת, בעקיפין, על היות מנגנון התחמקות זה מרכיב מרכזי בשרידותו של הגידול. ואכן, תפיסת החלבון או הפרעה לקשירתו לתאי החיסון, משחררת את תאי החיסון בפעילותם כנגד הגידול.
בדומה לחלבון המיסוך, עומס השונות המוטנטית הוא מדד העומד במתאם תגובה לטיפולים אימונותרפיים. ככל שצפיפות המוטציות עולה, כך שונים תאי הגידול מרקמת המאכסן. שונות זו מזוהה על ידי מערכת החיסון ומהווה יעד לתקיפה. ואכן, עומס המוטציות TMB הוא סמן, המבשר תגובה למידת התועלת מהטיפולים האימונולוגיים.
שפעול מערכת החיסון על ידי תרופת ה-Pembrolizumab, אושר כתרופה בודדת בחולי סרטן הריאה המבטאים רמת PDL1 בשיעור של 50 אחוזים ומעלה. טיפול זה הציג הישרדות ושיעורי תגובה גבוהים במיוחד, אשר הגיעו לכדי 30 חודשים, וזמין בסל הבריאות בישראל. יתר חולי סרטן הריאה (תאים גדולים), הדגימו תועלת משמעותית משילוב אימונותרפיה עם כימותרפיה במשלבים שונים, כגון Pembrolizumab עם Carboplatin/ Pemetrexed (Keynote189) או Taxol לגידול קשקשי, או Carboplatin/Paclitaxel/ Avastin/Atezolizumab (IMPOWER150). משלבים אלו מאושרים על ידי ה-FDA (Food and Drug Administration), אך טרם זמינים בסל התרופות בישראל.
טיפולים אימונותרפיים כקו שני זמינים בישראל, במסגרת סל התרופות, לחולים אשר קיבלו כימותרפיה ולא יפורטו בסקירה קצרה זו.
מחלה מקומית מתקדמת
נפרץ הסכר בתחום המחלה המקומית המתקדמת. מחקר PACIFIC אשר בדק את הטיפול ב-Durvalumab, מעכב PDL1 ובחולים שאובחנו עם סרטן ריאה שלב III שאינו נתיח, הדגים משך זמן חציוני ללא התקדמות מחלה של 16.8 חודשים, לעומת 5.6 חודשים בקבוצת האינבו (Placebo). מחקר זה מהווה פריצת דרך בקבוצת אוכלוסייה זו, שכן לראשונה נראו תוצאות משמעותיות אשר מביאות לשיפור בשלב מוקדם של המחלה. גם תרופה זו נמצאת בתהליך רישום והגשה לסל. הטיפול זמין במסגרת תכנית חמלה רחבה.
סרטן ריאות מסוג תאים קטנים - SCLC (Small Cell Lung Cancer)
סרטן התאים הקטנים הוא גידול מרכזי, עם מעורבות גרורתית מוקדמת ושיעורי השרדות נמוכים במיוחד. מחלה זו מגיבה היטב לטיפול כימותרפי בקו טיפול ראשון (Platinum+ Etoposide), כ-84-68 אחוזי תגובה, אך במרבית המקרים המחלה נשנית. שיעורי התגובה בקו הטיפול השני נמוכים ועומדים על כ-15 אחוזים, ומשך ההישרדות החציוני עומד על כ-5 חודשים. הרוב המוחלט, יותר מכ-97 אחוזים מהמאובחנים ב- SCLC, חלו במחלה כתוצאה מהיותם מעשנים בהווה או בעבר.
הטיפול המקובל מבוסס על כימותרפיה, בשילוב טיפול קרינתי (במחלה מקומית) על בסיס פלטינום ו-Etoposide.
קרינה מוחית מניעתית מקובלת בתום הטיפולים הכימו-קרינתיים במחלה מקומית, אך ראויה לבחינה מחודשת לנוכח היות המחקרים בלתי מבוקרים וחסרי הדמיה מוחית ראשונית. נזקי הקרינה הכלל מוחית כוללים: ירידה קוגניטיבית, הפרעה בזיכרון לטווח ארוך ונשירת שיער. מעקב מוחי הדוק (MRI, Magnetic Resonance Imaging) מקובל במספר מרכזים בעולם כחלופה לקרינה מוחית, באותם מקרים בהם הדמיה ראשונית שוללת מעורבות מוחית גרורתית.
מגוון הטיפולים בסרטן ריאה מסוג זה מוגבל ביותר, וזכה לחידוש לנוכח שיעור תגובה בקו השני תחת טיפול משולב של Nivolumab+ Ipilimumab. שילוב זה בולט במיוחד באותם מקרים, המתאפיינים בעומס מוטציות גבוה במיוחד. לפיכך, נערכים מספר מחקרים קליניים שנועדו לבחון את היעילות והבטיחות של משלבים אימונותרפיים בקו טיפול ראשון ושני.
במחקר קליני מפאזה ראשונה/שנייה (CHECK 032 MATE) נמצא, שעבור חולים אשר טופלו בכימותרפיה ומחלתם נשנתה לאחר פרק זמן הקצר מ-6 חודשים, מתן של Nivolumab, עם או ללא Ipilimumab כקו טיפול שני, הדגים תוצאות טובות ומבטיחות מבחינת שיעורי תגובה ומשך הישרדות: 40 אחוזים מהחולים שקיבלו משלב (Miligram/Kilogram) Nivolumab 1mg/kg יחד עם Ipilimumab 3mg/kg נותרו בחיים לאחר שנה. עם זאת, עדכון אחרון שלל יתרון כולל של הישרדות במתן Nivolumab בתרופה בודדת. מחקר נוסף, אשר דיווח על תוצאות חיוביות ומבטיחות בקו ראשון הוא מחקר 133 IMPOWER, אשר הראה יתרון למשלב של Atezolizumab + Etoposide + Carboplatin הן מבחינת נתוני הישרדות והן מבחינת משך הזמן עד להתקדמות המחלה.
חלה התקדמות משמעותית בניסיון להיאבק במחלה מאתגרת וקטלנית זו, ואנו תקווה שפיתוחים אלו יובילו לפריצת דרך טיפולית ומשמעותית עבור החולים ב- SCLC.
סיכום
גישת הרפואה החדשנית, לפיה לכל מטופל ניתן טיפול התואם את הפרופיל הגנומי של מחלתו, מיושמת בטיפול בסרטן באופן כללי ובטיפול בסרטן ריאות בפרט. גישה זו הוכחה כיעילה, מאריכת חיים ומשפרת את איכות חייהם של המטופלים. השימוש בה מתאפשר הודות לטכנולוגיות מולקולריות חדשניות, ששמו להן למטרה לשנות את הטיפול בסרטן על ידי הבנה עמוקה של השינויים הגנומיים התורמים לגידול הספציפי של כל חולה. בשורת האימונותרפיה פותחת תקווה לחולי סרטן הריאה, ואנו מקווים שמגמה זו תמשיך ותביא לגילוי תרופות נוספות ומבטיחות שיסייעו במלחמה בסרטן הריאות.
ביבליוגרפיה
- אתר משרד הבריאות: https://www.health.gov.il/PublicationsFiles/cancer2015_29012018.pdf
- הרישום הלאומי לסרטן https://public.tableau.com/views/_5224/sheet2?:embed=y&:showVizHome=nhttps://public.tableau.com/views/_5224/sheet2?:embed=y&:־ 5howVizHome=no&:showTabs=y&:display_count=y&:display_static_image=y#%21
- G.V Scagliotti, et al. Phase III Study Comparing Cisplatin Plus Gemcitabine With Cisplatin Plus Pemetrexed in Chemotherapy-Naive Patients With Advanced-Stage Non-Small-Cell Lung Cancer, J Clin Oncol, 2008; 26:3543-3551
- A. Sandler et al. Paclitaxel-Carboplatin Alone or with Bevacizumab for Non-Small-Cell Lung Cancer, N Engl J Med 2006; 355:2542-50
- MokTS, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017; 376:629-40
- J.C. Soria, etal. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer, N Engl J Med 2018; 378:113-25
- Mok, T. S. et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N. Engl. J. Med. 2009; 361, 947-957
- Zhou, C. et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802]: a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12,735-742
- Kwak, E. L. et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N. Engl. J. Med.2010; 363,1693-1703
- Shaw, A. T. etal. Ceritinib in ALK-rearranged non-small-cell lung cancer. N. Engl. J. Med. 2014; 370, 1189-1197
- S. Peters, Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2017; 377(9):829-838
- Shaw, A et al. Lorlatinib in non-small-cell lung cancer with ALK or ROS1 rearrangement: an international, multicentre, open-label, single-arm first-in-man phase 1 trial. Lancet Oncol.2017; 18, 1590-1599
- Shaw, A. T. et al. Crizotinib in ROSI-rearranged non-small-cell lung cancer. N. Engl. J. Med. 2014; 371,1963-1971
- Reck M, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375:1823-1833
- L. Gandhi et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med 2018; 378:2078-2092
- M.A. Socinski et al. Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med 2018; 378:2288-2301
- Scott J. Antonia etal. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 2017; 377:1919-1929
- G. A. Lunal et al Treatment for small cell lung cancer, where are we now?-a review. Transl Lung Cancer Res 2016; 5(1 ]:26-38
- J. K. Sabaril et al. Unravelling the biology of SCLC: implications for therapy. Nat Rev Clin Oncol 2017; 14;549-561
- NCCN Clinical Practice Guidelines in Oncology: SCLC V2.2018
- S. J Antonia et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032]: a multicentre, open-label, phase 1/2 trial. Lancet Oncol 2016; 17: 883-95
המידע שבדף זה נכתב על ידי פרופ׳ ניר פלד, מנהל המערך האונקולוגי, מרכז לגסי הריטג' לאונקולוגיה ומכון לארי נורטון, המרכז הרפואי אוניברסיטאי סורוקה ואוניברסיטת בן גוריון, באר שבע
פורסם ב-חוברת סל הבריאות


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק