התבגרות מינית מוקדמת ומאוחרת - Precocious and delayed puberty
הופניתם מהדף עיכוב בהתפתחות המינית לדף הנוכחי.
| התבגרות מינית מוקדמת ומאוחרת | ||
|---|---|---|
| Precocious and delayed puberty | ||
| יוצר הערך | ד"ר ירדנה טננבאום-רקובר 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – התפתחות הילד
ירידה בגיל הופעת סימני התבגרות מינית מדווחת בעשורים האחרונים במדינות מפותחות וביניהן ישראל. התעלומה הגלומה בשאלה מה גורם לשינוי בתזמון ההתבגרות המינית, עדיין לא פתורה, אך קיימות עדויות מצטברות הקושרות התבגרות מינית מוקדמת לחשיפה למפרים הורמונליים סביבתיים (Endocrine disrupters chemicals - EDCs). הסברה היא שמפרים הורמונליים גורמים לעירור או להשתקה של גנים בציר היפותלמוס-היפופיזה-גונדות תלויי גיל. יש חשיבות רבה למחקר על הקשר בין הפרעות במערכת ההורמונלית למפרים סביבתיים, מכיוון שיש לכך השלכות מרחיקות לכת על עתיד האנושות.
בשנים האחרונות חלה פריצת דרך בהבנת המנגנונים הנוירופיזיולוגיים הגורמים לתחילת תהליך ההתבגרות, בעקבות חקר מולקולרי של משפחות עם היפוגונדיזם היפוגונדוטרופי ובהתאם ישנן תובנות חדשות בנוגע להתבגרות מינית מאוחרת מהיפוגונדיזם מונוגני.
מאז הגילוי הראשון של הגן KAL, האחראי על תסמונת קלמן, ב-1991, תוארו יותר מ-10 גנים בציר היפותלמוס-היפופיזה-גונדות. גנים אילו מסבירים רק 30% מהמקרים של היפוגונדיזם וב-70% האחרים האטיולוגיה עדיין לא ידועה. גילוי הגנים שאחראים על היפוגונדיזם תורשתי פתח צוהר להבנה מעמיקה יותר של מערכות הבקרה והוויסות של תהליך ההתבגרות ומערכת הפריון.
התבגרות תקינה
תהליך ההתבגרות המינית מתחיל מהפרשה של ההורמון ההיפותלמי GnRH (Gonadotropin Releasing Hormone), המעורר הפרשה פעימתית של הורמני יותרת המוח, LH ו-FSH. בעקבות זאת מתרחשת הפרשת הורמוני המין מהגונדות (טסטוסטרון בבנים ואסטרוגן בבנות). הסימן הראשון להתבגרות בבנות הוא האצה בגדילה והופעה של ניצני שדיים ובבנים הגדלה של נפח האשכים. תזמון הופעת ההתבגרות המינית מושפע הן מגורמים סביבתיים והן מגורמים גנטיים.
מחקרים בתאומים זהים הראו ש-80%-70% מהשונות בגיל הופעת ההתבגרות הם תורשתיים [1]. כמו כן, זהות בדגם ההתבגרות נצפתה בתורשה אוטוזומלית דומיננטית במשפחות [2] ומדווח על שונות רבה בגיל תחילת ההתבגרות באוכלוסיות שונות. כל אלו תומכים במרכיב תורשתי לתזמון של תחילת ההתבגרות. הגורמים הסביבתיים הידועים המשפיעים על תחילת תהליך ההתבגרות כוללים: גורמים תזונתיים, רקמת שומן קריטית, חשיפה לאור, מרחק מקו המשווה ועוד [3]. באופן תקין, הופעת סימני המין מתרחשת סביב גיל 10.5 בבנות וגיל 11.5 שנים בבנים. גיל ממוצע של הופעת המחזור בבנות (מנרכה) הוא 12.5 שנים.
התבגרות מינית מוקדמת
התבגרות מינית מוקדמת מוגדרת כהופעה של סימני מין משניים לפני גיל 8 בנקבה ולפני גיל 9 שנים בזכר. הגורמים להתבגרות מינית מוקדמת נחלקים לשתי קבוצות עיקריות: התבגרות מוקדמת מרכזית, הנגרמת מהבשלה מוקדמת של הציר היפותלמוס-היפופיזה-גונדות והתבגרות מוקדמת פריפרית, הנגרמת מעלייה בייצור אסטרוגנים או אנדרוגנים ממקור שחלתי, אדרנלי או אחר. 70% מהמקרים של התבגרות מוקדמת מתרחשים בבנות ולרוב מדובר באטיולוגיה לא ידועה (אידיופתית). מנגד, בבנים קיימת לרוב בעיה אורגנית, ולכן חשוב לאבחן את האטיולוגיה להתבגרות מוקדמת ולטפל בה בהתאם לממצאים.
ההשלכות הרפואיות של התבגרות מוקדמת הן גובה סופי נמוך ביחס לפוטנציאל הגנטי והפרעות נפשיות הנובעות מחוסר בשלות נפשית של הילדה וחוסר מוכנות לקבלת מחזור בגיל צעיר כל כך. ניתן לטפל בהתבגרות מוקדמת באמצעות טיפול בהורמון דמוי ההורמון ההיפותלמי (GnRH), המעכב את הפרשת הגונדוטרופינים מבלוטת ההיפופיזה. ההורמון ניתן בזריקה לתוך השריר כל ארבעה שבועות. טיפול זה קיים כבר כ-30 שנים והוכח כיעיל ובטוח.
בשנים באחרונות מדווח על מגמה של ירידה בגיל תחילת ההתבגרות בילדות בארצות מפותחות.
דיווחים בנוגע לירידה בגיל ההתבגרות המינית בעשורים האחרונים
ירידה בגיל הופעת ההתבגרות בילדות תוארה בשנים האחרונות כאשר הופעה של ניצני שדיים דווחה בממוצע בגיל 10 שנים בבנות לבנות ובגיל 8.9 שנים בילדות ממוצא אמריקאי אפריקאי [3], [4]. הירידה בגיל הופעת סימני מין משניים נצפתה בארצות מפותחות: באירופה דווח על גיל הופעת התבגרות צעיר יותר בארצות המרוחקות מהקוטב הצפוני בהשוואה לארצות צפוניות. מגמה זו נצפתה בבנות בלבד, ואילו בבנים לא נצפה שינוי משמעותי בגיל ההתבגרות[3].
בניגוד לדיווחים אלו, תוארה לאחרונה ירידה בגיל ההתבגרות באוכלוסיית בנים מדנמרק בהתאמה למדד מסת הגוף (Body mass index - BMI) [5]. היקף התופעה בישראל לא נחקר עד היום, אך התצפיות הקליניות מצביעות על כך שגם בישראל קיימת ירידה בגיל תחילת ההתבגרות בבנות בעשור האחרון.
ניתן לסכם שקיימת מגמה של ירידה בגיל הופעת סימני מין משניים בעשורים האחרונים. התעלומה הגלומה בשאלה מה גורם לשינוי בתזמון ההתבגרות המינית, עדיין לא פתורה, אך קיימות עדויות מצטברות הקושרות התבגרות מינית מוקדמת לחשיפה לגורמים סביבתיים.
גורמים סביבתיים לירידה בגיל תחילת ההתבגרות המינית
- מספר גורמים סביבתיים נקשרו לירידה בגיל ההתבגרות המינית
עלייה בשיעור ההשמנה בילדים, חשיפה לחלב סויה בינקות, אכילת מזון עשיר בפיטואסטרוגנים וחשיפה למפרים הורמונליים סביבתיים (Endocrine disrupters chemicals - EDCs).
- השמנה
בעשורים האחרונים קיימת עלייה בשיעור ההשמנה בקרב ילדים. התבגרות מוקדמת שכיחה יותר בילדות עם השמנת יתר. דווח לאחרונה על ירידה בגיל הופעת סימני מין משניים בבנים בדנמרק בהתאמה עם ערכי ה- BMI[5]. הורמונים כמו ליפטין ואינסולין, המופרשים ברמות גבוהות בשמנים, מעורבים בהפרשת גונדוטרופינים מיותרת המוח. בחולים עם פגמים גנטיים בליפטין ובקולטן שלו, דווח על היפוגונדיזם [6]. כל אלו תומכים בהיפותזה שקיים קשר בין העלייה בשיעור השמנה בילדים לירידה בגיל ההתבגרות בעשורים האחרונים.
- פיטואסטרוגנים
אחת הסברות שהועלו לגבי התבגרות מוקדמת, קשרה הזנה בחלב סויה לשנה הראשונה לחיים, והופעה של התבגרות מוקדמת בילדות [7]. מצד שני, הקשר בין סויה למוצרי סויה המכילים פיטואסארוגנים להתבגרות מוקדמת, לא הוכח במחקרים מבוקרים. כמו כן, השימוש הנרחב בסויה במזרח אסיה, ללא דיווח על הופעה של התבגרות מוקדמת באזורים אלו, גם הוא אינו תומך בהסבר זה.
- מפרים הורמונליים סביבתיים
מפרים הורמונליים סביבתיים הם כימיקלים המשבשים את הפעילות ההורמונלית התקינה. קיימים כימיקלים ממקור חיצוני (אקסוגניים) - משמשים כתוספים במוצרי פלסטיק, בבקבוקים, באריזות, בחומרי ניקוי, בקופסאות שימורים, במוצרי קוסמטיקה; חומרי הדברה ומפרים הורמונליים טבעיים - פיטואסטרוגנים (אסטרוגנים צמחיים), המצויים בירקות, בפירות ובפולי סויה.
ידועים כיום כ-100,000 כימיקלים בשימוש יום-יומי, שחלקם בעלי פעילות המשבשת את המערכת ההורמונלית ומערכת הרבייה [8].
הגילוי הראשון, שקשר כימיקלים ממקור חיצוני למערכת הרבייה, היה הגילוי שמתן התרופה Diethylstilbestrol (DES), שהייתה בשימוש בעבר למניעת הפלות, גרם לסרטן צוואר הרחם בשכיחות מוגברת בילדות של הנשים שטופלו ב-Diethylstilbestrol. גילוי נוסף היה ההשפעה השלילית של חומר ההדברה Dichlorodiphenyltrichloroethane (DDT), שהוכנס לשימוש נרחב בחקלאות בשנות ה-30, על יכולת הרבייה של מיני אוכלוסיות בר. בשני המקרים נמצא קשר בין הכימיקלים לפעילות דמוית ההורמון הנשי, אסטרוגן, ושיבוש המערכת ההורמונלית. רק 50 שנה מאוחר יותר התגלה בתנאי מעבדה הקשר בין החומר ביספנול A להופעה של התבגרות מוקדמת בחולדות מעבדה. נוסף על כך, נמצא שיבוש בתרבית גידול של תאים בעלי קולטנים לאסטרוגנים כתוצאה מחשיפה לצינורית פלסטיק עם מרכיב כימי בעל פעילות דמוית ההורמון אסטרוגן. תופעות אלו בתנאי גידול במעבדה העלו מחדש את קיום הקשר בין מפרים הורמונליים סביבתיים לשיבושים במערכת ההורמונלית.
כיום, קיימות עדויות מצטברות הקושרות מפרים הורמונלים סביבתיים לפעילות דמוית אסטרוגן ונוגדת את פעילות ההורמון הזכרי. הכימיקלים המפרים ההורמונליים פועלים במספר דרכים: חיקוי פעילות ההורמון, חסימה של קישור ההורמון לקולטן שלו, עיכוב או זירוז הפרשת הורמונים ושיבוש הפעילות של מתווכים תוך-תאיים. השיבושים ההורמונליים, שתוארו בגברים, כוללים ירידה בספירת הזרע ובאיכות הזרע ועלייה בהימצאות מומים מולדים של אברי מין חיצוניים, כגון: איבר מין קצר, אשכים טמירים ומומים נוספים הנגרמים מהיעדר חשיפה להורמון הזכרי ברחם. כמו כן, דווחה בגברים עלייה בשכיחות סרטן הערמונית. בנשים, נמצאה עלייה בהיארעות סרטן השד וירידה בגיל הופעת ההתבגרות המינית. לאחרונה, מיוחסת גם העלייה בהיארעות של השמנה לחשיפה לכימיקלים בעלי פעילות מגבירת יצירת רקמת שומן (Obesogens).
קיימת חשיבות לזמן החשיפה למפרים האנדוקריניים הסביבתיים, והתקופות הרגישות יותר הן בחיים העובריים, לאחר הלידה ובגיל ההתבגרות. השיבוש במערכת ההורמונלית יכול להתקיים מספר שנים לאחר החשיפה. לדוגמה, חשיפה למזהמים בבקבוקי פלסטיק לתינוקות דווחה כגורם אפשרי לשינוי בתזמון ההתבגרות מספר שנים רב לאחר החשיפה. כמו כן, חשיפה למפרים אנדוקריניים עלולה לגרום לנזק גם לצאצאים ולדורות הבאים, הן דרך שיבוש גנטי והן דרך בקרת ביטוי הגנים (אפיגנטית).
כיום, מקובלת ההנחה שחשיפה למפרים הורמונליים סביבתיים משבשת את המערכת הנוירואנדוקרינית במוח וגורמת לשפעול ההורמונים המעוררים את תחילת תהליך ההתבגרות המינית. השיבוש ההורמונלי גורם לתזמון מוקדם של התבגרות בבנות ושפעול גנים הקשורים בבקרת תהליכים תלויי גיל.
העובדה שהתבגרות מוקדמת נצפתה בעיקר בבנות ולא בבנים, תומכת בהיפותזה של חשיפה לחומרים בעלי פעילות דמוית אסטרוגן. שכיחות מוגברת של התבגרות מוקדמת תוארה בילדות מאומצות ממדינות מתפתחות. הימצאות רמה מוגברת של שרידי חומרי הדברה בדמן של ילדות אלו תמכה בהסבר אפשרי המתייחס לתהליך של גמילה מהכימיקלים שלהם נחשפו במדינות הולדתן [9].
- מסקנות
ייתכן שהירידה בגיל הופעת סימני מין משניים בעשורים האחרונים היא תוצאה של חשיפה למפרים הורמונליים סביבתיים הגורמים להשתקה או לעירור של ביטוי גנים בציר היפותלמוס-היפופיזה-גונדות תלוי גיל. הקשר בין הפרעות במערכת ההורמונלית למפרים סביבתיים עדיין לא נחקר דיו, ויש לו השלכות מרחיקות לכת על עתיד האנושות.
איסור על שימוש במפרים הורמונליים סביבתיים בתעשייה ובחקלאות ימנע הפרעות אנדוקריניות בהווה ושיבושים במערכת ההורמונלית ובמערכת הפריון בדורות הבאים.
התבגרות מאוחרת
התבגרות מינית מאוחרת מוגדרת כהיעדר סימני מין משניים לאחר גיל 13 בבנות ולאחר גיל 14 שנים בבנים. עד לשנים האחרונות לא ניתן היה להבדיל בין התבגרות מאוחרת מסוג Constitutional delay in growth and sexual development (CDGD) להיפוגונדיזם, והאבחנה התבצעה על סמך מעקב קליני ממושך ומבחני תגר (GnRH tests) חוזרים. היפוגונדיזם היפוגונדוטרופי (Hypogonadotrophic Hypogonadism) מוגדר כהיעדר סימני מין משניים, סימני מין חלקיים או עצירה בהתבגרות מינית בגיל 18 שנים בנוכחות רמות נמוכות של גונדוטרופינים ושל הורמוני המין.
בעשור האחרון חלה פריצת דרך בהבנת הבקרה על תהליכים הקשורים להתבגרות ולפריון באמצעות חקר משפחות עם היפוגונדיזם תורשתי. חקר המשפחות הביא לגילוי גנים חדשים ובעקבות כך לפריצת דרך בהבנת המנגנונים הנוירופיזיולוגיים שמביאים לתחילת תהליך ההתבגרות והבקרה על מערכת הפריון. היפוגונדיזם היפוגונדוטרופי מתחלק לשתי תת-קבוצות עיקריות: היפוגונדיזם בנוכחות תתרנות (אנוזמיה) והיפוגונדיזם בהיעדר תתרנות.
מאז הגילוי הראשון של הגן KAL ב-1991 ועד היום תוארו 10 גנים נוספים המשתתפים בבקרה ובוויסות של תהליך ההתבגרות ובמערכת הרבייה.
- תסמונת קלמן
תסמונת קלמן, המתבטאת בהיפוגונדיזם ותתרנות המורשת בתאחיזה לכרומוזום X, תוארה לראשונה על ידי קלמן בשנת 1944 בשלוש משפחות. ממצאים נוספים בחולים כללו: מומי קו האמצע כמו חך ושפה שסועים, עצמות מטקרפליות קצרות, חוסר היווצרות (אגנזיס) של הכליה, חירשות עצבית, סינקינזיס בימנואלית ואטקסיה צרברלית.
הגן KAL1, האחראי לתסמונת קלמן, תואר לראשונה ב-1991 בשני אחים עם חסר בזרוע הקצרה של כרומוזום X [10]. נמצא שהגן KAL1 מקודד לחלבון Anosmin, המופרש מהנוירונים של ה-Olfactory bulb and tract ותפקידו בבקרה של נדידת הנוירונים של ה- GnRH לגרעינים ההיפותלמיים. בהיעדר אנוזמין, הנוירונים הנוירואנדוקריניים נעצרים ב- Olfactory bulb והביטוי של פגם זה הוא היפוגונדיזם ותתרנות. הגילוי של הגן KAL1 בשני האחים הביא לעידן חדש בהבנה של הבקרה ההורמונלית של ההתבגרות ומערכת הפריון.
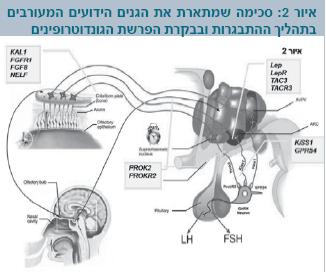
כ- 10 גנים שונים (לפי סדר גילויים) תוארו עד היום במשפחות עם היפוגונדיזם היפוגונדוטרופי, והם כוללים:
GNRHR (1991), NELF (2000), FGFR1 (2003), GPR54 (2003), KISS1 (2003), PROK2 (2003), PROKR2 (2003), FGFR8 (2008), TAC3 (2009), TACR3 (2009).
- GNRH-R (GNRH-Receptor)
הגן GNRH-R המקודד לקולטן ל-GNRH תואר לראשונה בשנת 1991 [11] בחולים עם היפוגונדיזם ללא תתרנות. עד היום תוארו כ-20 מוטציות שונות בגן GNRH-R. לדוגמא, בגבר ממוצא ערבי-מוסלמי, בן להורים קרובי משפחה שהופנה בילדותו לבירור מיקרופניס ואשכים טמירים נצפתה התבגרות ספונטנית חלקית עם רמות טסטוסטרון נמוכות, תגובה תקינה של גונדוטרופינים לתבחין GnRH ומיעוט תאי זרע עם תנועתיות ומורפולוגיה לקויים. בבדיקת רצף הגן GNRH-R נמצאה מוטציה הומוזיגוטית, שתוארה בעבר (Gln106Arg) בשרשרת הראשונה החוץ-תאית של הקולטן GnRH. בחולים אלו תוארה יצירת זרע תקינה באמצעות טיפולים הורמונליים, ולכן החולים כונו הסריס הפורה (Fertile eunuch)[12].
- FGFR1 (Fibroblast Growth Factor Receptor 1)
הגן FGFR1 תואר לראשונה בשנת 2003 [13] בחולה עם היפוגונדיזם ותתרנות. נמצא ש-FGFR1 מעורב בנדידה, בהבשלה ובשרידות של הנוירונים של ה-GNRH ומתבטא בהיפוגונדיזם עם או בלי תתרנות. בחלק מהמקרים היה ההיפוגונדיזם הפיך ובחלקם הביטוי של המחלה תואר בגיל מאוחר בגבר עם התבגרות ספונטנית. הביטוי הפנוטיפי הראה חומרה משתנה ממצב של CDGD למצב של היפוגונדיזם באותה משפחה.
- GPR54 G-Protein Coupled Receptor ו- KISS1
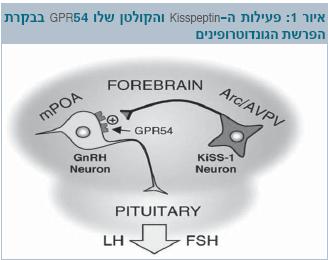
הגן GPR54 תואר לראשונה בבני אדם בשנת 2003 על ידי שתי קבוצות חוקרים בנפרד [14][15]. גילוי המוטציה בגן ל-GPR54 במשפחות עם היפוגונדיזם, הביא להבנת התפקיד של הקולטן GPR54 בבקרה של תהליך ההתבגרות. נמצא שהחלבון Kisspeptin הוא הליגנד שנקשר לקולטן GPR54. נוירונים המבטאים את החלבון Kisspeptin ממוקמים בגרעין ההיפותלמי Arcuate Nucleus) Arc) ובגרעין AVPV (Anteroventral Periventricular Nucleus). הקולטן GPR54 מבוטא על הנוירונים ההיפותלמיים המפרישים את ה-GnRH. הורמוני המין יוצרים משוב שלילי על הפרשת ה-Kisspeptin מגרעין Arc ומשוב חיובי על הפרשת ה-Kisspeptin מהגרעין AVPV. המשוב החיובי אחראי כנראה על שיא הפרשת ה-LH לפני הביוץ בנקבה (איור 1).
במשפחה ממוצא ערבי-מוסלמי עם נישואי קרובים שבה נמצאו חמישה נבדקים הומוזיגוטיים למוטציה חדשה (L102P) בגן ל-GPR54[16]. שלוש אחיות הופנו לבירור אל-וסת ראשונית, ושני בנים הופנו לבירור מיקרופניס ואשכים טמירים. המאפיין של הזכרים היה היפוגונדיזם ללא תתרנות, ובבדיקה נמצא של אשכים קטנים היפופלסטיים ובספירת זרע אזוספרמיה [16]. הממצאים במשפחה זו, מצביעים על מעורבות מנגנון ה-KISS1-GPR54 בחיים העובריים (בהתפתחות האשכים), בהתחלת תהליך ההתבגרות ובבקרת הפרשת הורמוני המין בבגרות.
- PROK2R (Prokineticin 2 Receptor) ו-PROK2 (Prokineticin 2)
גנים אלו תוארו לראשונה בשנת 2006 בהקשר לתנועתיות המעי, ולכן קיבלו את הכינוי Prokineticin. מאוחר יותר נמצא קשר בין הגנים לאנגיוגנזיס והמטופויזיס. בעכברים נמצא ביטוי של הגנים במערכת האולפקטרית ובגרעין ה- SCN (Supra-chiasmic nucleus). ביטוי של החלבונים ב-SCN העלה את המחשבה שהם מעורבים בבקרה של פעימתיות יומית ובמנגנוני שינה-ערות. הקשר למערכת הנוירואנדוקרינית התגלה בעקבות השתקת הגנים במודל של עכברים שבהם נמצאה אטרופיה של מערכת הפריון ושל המערכת האולפקטורית [17].
רק בשנת 2006 דווח לראשונה על מוטציות בגן ל-PROK2 ובקולטן שלו בהיפוגונדיזם משפחתי [18]. הנבדקים הראו שונות פנוטיפית רחבה, חלקם עם תתרנות ובמקרה אחד נצפתה השמנת יתר והפרעות בשינה.
- TACR3 (Tachykinin 3 Receptor) ו-TAC3 (Tachykinin 3)
מוטציות ב-TAC3 וב-TACR3 תוארו לראשונה בשנת 2009 בארבע משפחות ממוצא טורקי [19].
TAC3 מקודד לחלבון Neurokinin B המשמש כמעביר עצבי (נוירוטרנסמיטור) במערכת העצבים המרכזית ובמערכות נוספות, כמו תאי ליידיג באשך ובמערכת החיסון. חלבון זה מבוטא בגרעינים היפותלמיים המבטאים גם KISS1, וייתכן שהוא קשור בבקרה של מנגנון ה-KISS1-GPR54[20].
- מעורבות מולטיגנית
לאחרונה, דווח על תורשה מולטיגנית בחולים עם היפוגונדיזם. דווחו צירופים של שני גנים שונים באותה משפחה: FGFR1/NELF; FGFR1/GNRHR; PROK2/KAL1, GNRHR/GPR54, GNRHR/PROKR2, GNRHR/KAL1. צירוף של יותר מגן אחד במחלה תורשתית שהיא נדירה מלכתחילה, הוא לא כל כך נדיר באוכלוסייה עם ריבוי נישואי קרובים.
היחסים בין הגנים המעורבים בתהליך ההתבגרות לבין הגנים המעורבים בבקרת הפרשת הגונדוטרופינים מסוכמים באיור 2.
- היפוגונדיזם הפיך
לאחרונה מדווח על כך שהיפוגונדיזם יכול להיות הפיך, ולכן יש חשיבות למעקב ארוך טווח ולהמלצה להפסיק טיפול הורמונלי תחליפי כל מספר שנים, ולהעריך מחדש את האבחנה ואת הצורך בטיפול תחליפי [20][21].
מסקנות
כל הגנים שתוארו עד היום מסבירים 30% בלבד מהמקרים של היפוגונדיזם ועדיין ב-70% מהמקרים האטיולוגיה לא ידועה. קיימת חפיפה בפנוטיפ בחולים עם פגמים בגנים שונים. פגם בגן בודד יכול להתבטא בהיפוגונדיזם עם תתרנות או ללא תתרנות ופגם בגן בודד מתבטא בשונות פנוטיפית רחבה. היפוגונדיזם ו-CDGD הם טווח של אותו גורם אטיולוגי. היפוגונדיזם יכול להיות הפיך, ולכן חשוב לעקוב ולהעריך מחדש את האבחנה במהלך המעקב.
תורשה ביגנית או מולטיגנית מסבירה חלק מהמקרים, ואינה נדירה באוכלוסייה עם ריבוי נישואי קרובים.
ביבליוגרפיה
- ↑ Treloar SA, Martin NG. Age at menarche as a fitness trait: nonadditive genetic variance detected in a large twin sample. Am J Hum Genet 1990;47:137–148
- ↑ de Vries L, Kauschansky A, Shohat M, et al. Familial central precocious puberty suggests autosomal dominant inheritance. J Clin Endocrinol Metab 2004;89:1794-1800
- ↑ 3.0 3.1 3.2 Parent AS, Teilmann G, Juul A, et al. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev 2003;24:668-693
- ↑ Kaplowitz PB, Oberfield SE. Reexamination of the age limit for defining when puberty is precocious in girls in the United States: implications for evaluation and treatment. Drug and Therapeutics and Executive Committees of the Lawson Wilkins Pediatric Endocrine Society. Pediatrics 1999;104:936941
- ↑ 5.0 5.1 Sørensen K, Aksglaede L, Petersen JH, et al. Recent Changes in pubertal timing in healthy Danish boys: Associations with BMI. J Clin Endocrinol Metab 2010;95:263-270
- ↑ Farooqi S, O'Rahilly S. Genetics of obesity in humans. Endocr Rev 2006;27:710-718
- ↑ Zung A, Glaser T, Kerem Z, et al. Breast development in the first 2 years of life: an association with soy-based infant formulas. J Pediatr Gastroenterol Nutr 2008;46:191-195
- ↑ Gore AC, Krstevska-Konstantinova M. Endocrine distrupting compounds: recent advances in basic and clinical research. Endocrine News 2008;33:14-21
- ↑ Krstevska-Konstantinova M, Charlier C, Craen M, et al. Sexual precocity after immigration from developing countries to Belgium: evidence of previous exposure to organochlorine
- ↑ Legouis R, Hardelin JP, Levilliers J, et al. The candidate gene for the X-linked Kallmann syndrome encodes a protein related to adhesion molecules Cell 1991;67:423-435
- ↑ de Roux N, Young J, Misrahi M, et al. A family with hypogonadotropic hypogonadism and mutations in the gonadotropin-releasing hormone receptor. NEJM 1997;337:1597-1602
- ↑ הערה12
- ↑ Dodé C, Levilliers J, Dupont JM, et al. Loss-of-function mutations in FGFR1 cause autosomal dominant Kallmann syndrome. Nat Genet 2003;33:463-465
- ↑ Seminara SB, Messager S, Chatzidaki EE, et al. The GPR54 gene as a regulator of puberty. NEJM 2003;349:1614-1627
- ↑ de Roux N, Genin E, Carel JC, et al. Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54. Proc Natl Acad Sci 2003;16:10972-10976
- ↑ 16.0 16.1 Tenenbaum-Rakover Y, Commenges-Ducos M, Iovane A, et al. Neuroendocrine phenotype analysis in five patients with isolated hypogonadotropic hypogonadism due to a L102P inactivating mutation of GPR54. J Clin Endocrinol Metab 2007; 92:1137-1144
- ↑ Matsumoto S, Yamazaki C, Masumoto KH, et al. Abnormal development of the olfactory bulb and reproductive system in mice lacking prokineticin receptor PKR2 Proc Natl Acad Sci USA 2006;103:4140-4145
- ↑ Dodé C, Teixeira L, Levilliers J, et al. Kallmann syndrome: mutations in the genes encoding prokineticin-2 and prokineticin receptor-2. PLoS Genet 2006;20;2(10):175
- ↑ Topaloglu AK, Reimann F, Guclu M, et al. TAC3 and TACR3 mutations in familial hypogonadotropic hypogonadism reveal a key role for Neurokinin B in the central control of reproduction. Nat Genet 2009;41:354-358
- ↑ 20.0 20.1 Root AW. Reversible isolated hypogonadotropic hypogonadism due to mutations in the neurokinin B regulation of gonadotropin-releasing hormone release. J Clin Endocrinol Metab 2010;95:2625-2629
- ↑ Raivio T, Falardeau J, Dwyer A, et al. Reversal of idiopathic hypogonadotropic hypogonadism. NEJM 2007;30:357:863-873
קישורים חיצוניים
- התבגרות מינית: מה התחדש בעשורים האחרונים?, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר ירדנה טננבאום-רקובר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק