בדיקת רקמה לאבחון פרופיל גנומי בגידולים סרטניים - FoundationOne
הופניתם מהדף פאונדשיין לדף הנוכחי.
| בדיקת רקמה לאבחון פרופיל גנומי בגידולים סרטניים | ||
|---|---|---|
| FoundationOne | ||

| ||
| יוצר הערך | פרופ' איתן פרידמן עדכון הערך: ד"ר חגי ליגומסקי |
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – איתור ומניעת מחלות ממאירות, בדיקות גנטיות
מבוא
עד לתחילת המאה ה-21, סיווג הסרטן נעשה על פי האיבר בגוף שבו אובחן הגידול (ריאות, שד, מעי גס וכדומה) ומאפיינים פתולוגיים נוספים כמו גודלו של הגידול, צביעות אימונוהיסטוכימיות (Immunohistochemistry), מספר חלוקות תאים, דרגת התמיינות (Grading), האם מערב כלי דם או קשרי לימפה (Lymph nodes), האם מערב עצבים (Perineural Invasion) ומדדים נוספים אחרים. על בסיס נתונים אלה, חולים עם סרטן באותו איבר ובעל מאפיינים פתולוגיים דומים קיבלו אותו טיפול כימותרפי. הטיפול הכימי אינו ספציפי לתאי הסרטן ולכן טומן בחובו מגוון רחב של תופעות לוואי אשר לעיתים משפיעות לרעה על איכות חייו של המטופל ועל יכולתו לקבל טיפולים נוספים וכך גם על מהלך מחלתו.
מגבלה נוספת לשיטה זו היא ששני אנשים עם סרטן "דומה" המסווג על פי האיבר והמדדים הקליניים והפתולוגיים, יכולים להגיב בצורה שונה לאותו טיפול. אחת הסיבות המשמעותיות לכך הוא ההבדל בשינויים הגנומיים הקיימים בגידולים של שני האנשים.
השלמת פרויקט מיפוי הגנום האנושי על ידי ריצוף הדנ"א (DeoxyriboNucleic Acid, DNA) האנושי במלואו בסוף המאה ה-20 ותחילת המאה ה-21, היווה אבן דרך משמעותית בהבנת מחלות, בהן סרטן. נמצא, כי כחלק מהתפתחות התא הסרטני הוא עובר שינויים גנטיים שונים אשר חלקם מעודדים את שגשוג הגידול. עם זיהוי מאות גנים הקשורים להתפתחות סרטן, חוקרים הבינו כי קיימת שונות ברמה המולקולרית הבסיסית בין גידולים ובתוכם (בין הגידול הראשוני לגרורות ובין הגרורות עצמן), והחלו לקשר סוגי סרטן שונים לחתימה גנומית - לכל גידול ולכל צורה פתולוגית שונה של גידול מאותו איבר יש שינויים גנומיים סצפציפיים.
העבודה המעבדתית שנעשתה לצורך הבנת משמעותם של השינויים הגנטיים בתא הסרטני הובילה בהמשך להתפתחות של טיפולים חדשים – טיפולים ממוקדי מטרה, שתפקידם להתערב באותם תהליכים תאיים מעודדי סרטן ובכך למנוע או לעכב את שגשוג הגידול.
לדוגמה, נמצאו גנים שיש בהם שינויים גנומיים מסוג אמפליפיקציה (Gene Amplification) בסרטן השד ועל סמך זה פותחו תרופות המכוונות לטיפול בסרטן השד שמבטא ביטוי יתר של חלבון HER2 (Human Epidermal growth factor Receptor 2).
בתחילת המאה ה-21, פותחו טכנולוגיות לריצוף מלא מהדור החדש (Next Generation Sequencing - NGS) שמאפשרות לאתר במקביל מספר רב של שינוים גנומיים השכיחים בגידול מסוים. טכנולוגיית NGS, מעניקה פרופיל גנומי (דנ"א, DNA) מקיף (Comprehensive Genomic Profiling) של הגידול, ומאפשרת להתאים טיפול תרופתי ממוקד לשינויים שהתגלו ברקמת הגידול. עקרון זה מהווה את הבסיס לטיפול אונקולוגי מותאם אישית והביא להעלאת יעילות הטיפול והפחתת הרעילות תוך הפחתת השימוש בטיפול כימי עבור המטופלים שנמצאו מתאימים.
בדיקות FoundationOne הן בדיקות גנומיות מקיפות לאפיון פרופיל גנומי של גידולים סרטניים[1], שמטרתן להתאים טיפול אישי לחולה על פי הפרופיל הגנומי הייחודי שלו. בדיקות FoundationOne מספקות לרופא המטפל מידע מולקולרי וביולוגי הדרוש על מנת להתאים טיפולים ממוקדי מטרה המותאמים לשינויים הגנומיים בגידול שנבדק. בהתאם לתוצאות המתקבלות ב-FoundationOne ניתן להתאים את הפרופיל הגנומי של הגידול הייחודי של החולה לאפשרויות טיפול זמינות – תרופות ממוקדות מטרה הנמצאות בשימוש, גם אם להתוויות אחרות, ו/או לתרופות שנמצאות עדיין בשלב של מחקר. לעיתים, אפשרויות טיפול אלה לא היו נלקחות בחשבון לולא הבדיקה.
שינויים גנטיים
שינוי גנטי (מוטציה) הוא פגם ברצף הדנ"א. כל סוגי הסרטן מקורם בשינויים גנטיים בדנ"א של תאי הסרטן[2].
סוגי השינויים הגנטיים
שיטת ה-NGS בה הדנ"א של תאי הסרטן עובר ריצוף מאפשרת לגלות מספר רב של שינויים גנטיים מסוגים שונים:
- מוטציות - מוטציות הן החלפה של חומצת גרעין בודדת בחומצת גרעין מסוג אחר בדנ"א, שינוי שיכול להוביל לשינוי במבנה ותפקוד החלבון המתורגם מאותו גן[2]
- החדרת מקטעי דנ"א (Insertion) – תוספת של מספר חומצות גרעין באזור בדנ"א בו אינן אמורות להופיע. תוצאה של פגיעה במנגנוני תיקון דנ"א ואי יציבות גנומית המאפיינת תאים סרטניים. מקטעי דנ"א שנכנסים בגנים בהם לא אמורים להיות עלולים להוביל לשינוי במבנה ותפקוד החלבון המתורגם מאותו גן[2]
- מחיקות של מקטעי דנ"א (Deletions) – החסרה של מספר חומצות גרעין באזור בדנ"א בו הן אמורות להופיע. שינוי זה גם עלול להוביל לשינוי במבנה ותפקוד החלבון המתורגם מאותו גן[2]
- סידור מחדש (Rearrangements): תהליך בו הדנ"א נשבר ואז מתחבר מחדש למקטע דנ"א ממקום אחר בגנום. איחוי בין גנים (Gene Fusion) הוא דוגמה לתהליך של סידור מחדש של שני גנים ממקומות שונים בדנ"א העוברים איחוי לאחר שמקטע הדנ"א בו הם שוכנים נשבר וחובר מחדש ביחד[2]
- הגדלת מספר עותקים (Copy Number Alterations, CNA): עותקים של מקטעי דנ"א גדולים משוכפלים וכך משני עותקים של דנ"א בתא הדיפלואידי ניתן להגיע גם למאות עותקים בגנום של התא הסרטני. אמפליפיקציה של גנים (Gene Amplification) היא דוגמה ל-CNA בו גן שהיה ממוקם במקטע דנ"א שעבר שכפול קיים עתה במספר עותקים רב[2].
שינוי מורש לעומת נרכש
שינוי גנטי העובר בתורשה נמצא באדם מלידתו ולאורך כל חייו, ומצוי בכל תא ותא בגופו. כ־5 עד 10 אחוזים מכלל מקרי הסרטן נגרמים בשל שינוי גנטי תורשתי המתבטא קלינית בצבר מקרי סרטן במשפחה, בגיל אבחנה צעיר יותר של סרטן יחסית לאוכלוסייה הכללית, או במספר סוגי סרטן שונים אצל אותו אדם או באותה משפחה. כאמור, סרטן תורשתי הוא מצב יחסית נדיר בקרב חולי הסרטן.
שינוי גנטי נרכש הוא שינוי הנרכש לאורך החיים ואינו עובר בהורשה, ומתרחש רק ברקמה מסוימת - שינויים גנטיים סומטיים. שינויים אלה מתפתחים בעקבות נזק שנגרם לגנים בשל גורמים שונים כגון גיל, עישון, חשיפה לקרינה מייננת או חומרים קרצינוגנים אחרים ועוד[3][4][5]. שינוי גנטי מסוג זה משותף לכל סוגי הסרטן באשר הם והוא מתפתח בגנים בודדים, בתאים מסוימים, ולא בכל תא בגוף. התא הסרטני מאופיין באי יציבות גנומית וכך יש הצטברות של מוטציות סומאטיות בעשרות רבות של גנים בתהליך הדרגתי לאורך שנים - תהליך הנקרא התמרה סרטנית[2], תהליך זה הוא שגורם לתא הסרטני לצמוח ולשגשג בצורה לא מבוקרת ברקמה המקורית וגם מעניק לו את היכולת לשלוח גרורות לאברים מרוחקים. השינויים בגנים האחראים לתהליך הסרטני נקראים "מניעים" (Drivers) בעוד ששינויים גנטיים שנצברו בתא הסרטני משנית לתהליך הסרטני ואינם משפיעים בהכרח על תהליך זה נקראים "נוסעים" (Passengers)[2].
בדיקות גנומיות, המבוצעות לרוב על רקמת הגידול עצמו, מיועדות לחולי סרטן ומטרתן היא לאבחן את הפרופיל הגנומי הייחודי של הגידול הסרטני, כלומר לאתר את השינויים הגנומיים מסוג "מניעים" (Drivers) שהובילו להתפתחות הסרטן ולהתאים תרופות כנגד שינויים ייחודיים אלו.
הטכנולוגיה מאחורי בדיקות FoundationOne
עומק ריצוף
לצורך ביצוע NGS, הדנ"א שנאסף עובר חיתוך למקטעים (Fragmentation) מרובים לאורך האופטימלי של רצף לבדיקה. ריצוף המקטעים מתרחש במקביל וכל קטע של דנ"א עובר ריצוף מספר פעמים ממקטעים השונים הקיימים המכילים את הדנ"א[1]. מספר הפעמים שחומצת גרעין של דנ"א במיקום מסוים נקראת על ידי המכשיר מהווה את עומק הריצוף (Sequencing Depth). ככל שמקטע דנ"א מכוסה יותר טוב בבדיקה ונקרא יותר פעמים, כך עומק הריצוף גדל. ככל שעומק הריצוף גדל, כך החפיפה יותר טובה והרצף נקרא בצורה יותר מדויקת, מה שמעלה את הדיוק והביטחון בתוצאות.
בעוד שנוהגים לשאוף לעומק ריצוף של 30x-50x בריצוף של כל הגנום האנושי, עומק הריצוף בבדיקות FoundationOne גדול יותר בכמה סדרי גודל. למשל, עומק הריצוף החציוני בבדיקת FoundationOne CDx מרקמה הוא 500x, כלומר כל חומצת גרעין של דנ"א נקראת לפחות 500 פעמים, ואילו עומק הריצוף החציוני בבדיקת FoundationOne Liquid CDx עומד על 5000x, וזאת בשל העובדה שמדובר בריצוף של דנ"א חופשי מהדם.
איכות הבדיקה
אמינותן ויכולתן של בדיקות גנומיות מבוססות-NGS לחשוף במדויק את כל סוגי השינויים הגנומיים האפשריים תלויות בתכנון ותיקוף (Validation) של פלטפורמת הבדיקה. תיקוף של בדיקות גנומיות נחוץ על מנת לקבוע את תקפותן ואמינותן בבדיקת דגימות סרטניות. תיקוף של פרופיל גנומי משמעו כי קיימת הוכחה מתועדת שהבדיקה יכולה לאתר במדויק ובאמינות את כל השינויים הגנומיים הנמצאים בדגימה (ללא תוצאות שליליות שגויות (False negative), שהיא לא מזהה שינויים גנומיים שאינם נמצאים למעשה בגידול (ללא תוצאות חיוביות שגויות, False positive), וכי אותן תוצאות תתקבלנה בכל פעם ובכל מקום שתתבצע הבדיקה.
כאשר מרכיבי הבדיקה, כגון איכות הרקמה, בידוד חומצת הגרעין, אלגוריתמים של הבדיקה ועוד, אינם עוברים תיקוף עלולות להתקבל תוצאות שליליות שגויות או חיוביות שגויות. תוצאות כאלה יכולות לשנות את מהלך הטיפול בחולה ולמנוע ממנו קבלת טיפולים בעלי פוטנציאל להארכת חיים או לחשוף אותו לתופעות לוואי מטיפולים שאינם מתאימים לו.
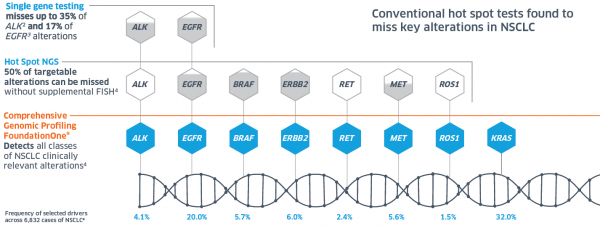
בדיקות מולקולריות שגרתיות, כגון FISH (Fluorescence In Situ Hybridization) ובדיקת אימונו היסטוכימיה IHC (Immunohistochemistry), מזהות רק גן אחד או מספר מצומצם של גנים והן יודעות לזהות סוג מסוים אחד בלבד של שינוי בגן (ארגון מחדש וביטוי ביתר או בחסר), אך בדיקות אלה לא תזהנה שינויים מסוגים אחרים כגון מוטציות נקודתיות. בדיקות מסוג נוסף, המכונות Hotspot, אמנם מבוססות NGS, אולם הן בודקות מספר מצומצם של גנים ומוטציות מוגדרות בגנים סרטניים, בחלקים מוגדרים מראש, שבהם ידוע על סבירות גבוהה למוטציה. מכיוון שבדיקות אלה יכולות למצוא מוטציות שכיחות, אך לא תזהנה מוטציות אחרות, עשויה להתקבל תשובה שלילית שגויה. לעומת זאת, בדיקה גנומית מסוג FoundationOne סורקת במקביל את הרצף המלא של מאות גנים הקשורים לסרטן, ובאופן ייחודי מזהה ברמת דיוק גבוהה את כל המוטציות הגנטיות האפשריות בגנים המניעים (Drivers) סרטן.
לדוגמה, בסרטן ריאות, בדיקה לאיתור גן יחיד לא תזהה עד 35 אחוזים של מוטציות בגן ALK (Anaplastic Lymphoma Kinase) ו- 17 אחוזים בגן EGFR (Epidermal Growth Factor Receptor)[5][6].
בדיקות גנומיות מבוססות NGS מסוג Hotspot לא תזהנה 50 אחוזים מהמוטציות אם לא תבוצע גם בדיקת פיש FISH לזיהוי הפרעות כרומוזומליות[7].מכיוון ש-FoundationOne לאבחון פרופיל גנומי מקיף עברה תהליך תיקוף מחמיר, הבדיקה מבטיחה דיוק ורגישות מרביים. בדיקה זו תאתר בבדיקה יחידה את כל סוגי השינויים הגנומיים הרלוונטיים מבחינה קלינית לסרטן ריאות[8].
בדיקות FoundationOne CDx ו-FounbationOne Liquid CDx מאושרות על ידי מנהל התרופות והמזון האמריקאי (Federal Drug and food Auturothy, FDA) לשימוש קליני לצורך זיהוי שינויים גנומיים שיכולים להוות מטרה לטיפול ממוקד.
סוגי בדיקות גנומיות מסוג FoundationOne
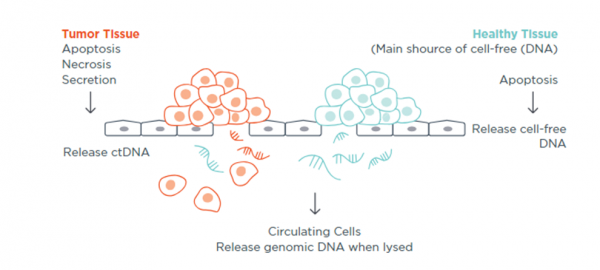
בדיקות גנומיות ניתן לבצע על רקמת גידול (בין אם הגידול ראשוני או גרורה שנדגמה) לאיתור שינויים סומטיים או באמצעות ביופסיה נוזלית (Liquid biopsy) שהיא תהליך של לקיחת דם פריפרי לצורך ביצוע בדיקת NGS. בביופסיה נוזלית נאסף דנ"א גידולי חופשי (Circulating tumor DNA) שמקורו בתאי גידול ועליו מתבצעת האנליזה הגנומית. תנאי הכרחי לצורך קיום הבדיקה שתאי הגידול יפרישו דנ"א לזרם הדם וישנה שונות בין סוגי הגידולים מבחינת היכולת לאתר דנ"א גידולי בזרם הדם.
בדיקה גנומית מרקמה עדיין מומלצת יותר מביופסיה נוזלית, עם זאת, ביופסיה נוזלית יכולה להוות מקור טוב, זמין ומהיר לביצוע אפיון גנומי מקיף במקרה שלא נותרה רקמה לבדיקה, או במקרה שלא ניתן לבצע ביופסיית רקמה אם מפני שהרקמה איננה נגישה לביופסיה או שהפרוצדורה מסכנת את המטופל.
בניגוד לביופסיה רגילה בה נדגמת רקמה מאתר אחד בין אם גרורה ובין אם הגידול הראשוני, בביופסיה נוזלית איסוף דנ"א גידולי חופשי מזרם הדם מאפשר לקבל תמונה גנומית מכלל אתרי המחלה ובכך להתמודד טוב יותר עם הטרוגניות הגידול וגם לאתר מנגנוני עמידות לטיפול ממוקד שנכשל.
הבדיקות FoundationOne CDx ו-FoundationOne Heme מתבצעות מדגימה קטנה של רקמה סרטנית השמורה בפאראפין ואין צורך ברקמה טרייה. במקרים בהם רקמה אינה זמינה, ניתן לבצע ביופסיה נוזלית לאפיון גנומי מקיף. במקרה זה יעשה שימוש בבדיקה מסוג FoundationOne Liquid CDx.
| שם הבדיקה | FoundationOne CDx | FoundationOne Liquid CDx | FoundationOne Heme |
|---|---|---|---|
| סוג הגידול | גידולים סולידיים. ללא תלות באיבר הרקמה. | גידולים סולידיים. | ממאירויות המטולוגיות מסוג לוקמיה, לימפומה ומיאלומה וגידולי סרקומה. |
| סוג הדגימה | בדיקת רקמה.
נעשית על גידול שהוסר כירורגית או דגימה מביופסיה שנלקחה באבחון הראשוני של הגידול, או בביופסיה חוזרת על פי הצורך. |
דגימת דם (ביופסיה נוזלית) | בדיקת רקמה.
נעשית על גידול שהוסר כירורגית או דגימה מביופסיה שנלקחה באבחון הראשוני של הגידול, או בביופסיה חוזרת על פי הצורך. |
| סוגי השינויים הגנטיים | כלל השינויים האפשריים | כלל השינויים האפשריים | כלל השינויים האפשריים |
| רשימת גנים | סריקה מקבילה של כל האזור המקודד של 324 גנים הידועים כמניעים של סרטן ואינטרונים מ-36 גנים הנוטים להתארגן מחדש או להשתנות בגידולים סולידיים. | סריקה מקבילה של 324 גנים הקשורים לסרטן. | סריקה מקבילה של 406 גנים הקשורים לסרטן ואינטרונים מ-31 גנים הנוטים להתארגן מחדש או להשתנות. בנוסף לריצוף ה-DNA, בדיקה זו מרצפת גם את ה-RNA (RiboNucleic Acid) לאורך 265 גנים על מנת לאתר איחויים במגוון רחב של גנים - שינוים גנומיים שכיחים בממאירויות המטולוגיות ובסרקומה (גידול המתפתח ברקמת חיבור או שריר). |
| ממדי תגובה לאימונותרפיה | MSI, TMB | MSI, bTMB | TMB |
| רמת דיוק | >99 אחוזים | >99 אחוזים | >99 אחוזים |
| למי מומלץ? | מאובחנים חדשים עם סרטן ריאה מסוג תאים שאינם קטנים ( Non-Small Cell Lung ) בדרגת מחלה שלב 4; גידול נדיר או לא שכיח, בשלב 4, ללא טיפול קיים או כאשר הטיפול מוגבל; חולים עם גידול סולידי אגרסיבי בשלב 4 שאינם מגיבים לטיפולים סטנדרטיים; חולים עם גידול ממקור לא ידוע- כאשר קיים קושי לבחור טיפול; חולים עם גידול סולידי שלב 4 אשר מיצו את כל הטיפולים הסטנדרטיים או הזקוקים לאבחון מולקולרי, אך משמרים רמת תפקוד סבירה. | חולים שאינם יכולים לבצע בדיקה גנומית באמצעות דגימת רקמה – לדוגמה, כאשר הרקמה שנלקחה בביופסיה הראשונית אינה מספקת או כשלא ניתן לדגום רקמה מהגידול. בדיקה זו משמשת גם למעקב אחר התקדמות המחלה בעקבות הטיפול (Disease monitoring). | מיועדת לאנשים עם גידולים המטולוגיים הקשורים למערכת הדם והלימפה (לוקמיה, לימפומה ומיאלומה) או סרקומה. |
ניתן לשלב בדיקת רקמה עם בדיקת ביופסיה נוזלית על מנת לוודא שההחלטה הטיפולית נעשית על סמך המידע המולקולרי המקיף ביותר. לאור המאפיינים השונים של הדנ"א המופק מרקמה לעומת זה המופק מהדם, הבדיקות FoundationOne CDx ו- FoundationOne Liquid CDx יכולות להשלים זו את זו, ולשקף את ההטרוגניות של המחלה בגוף. ביופסיות מרקמה עלולות להפסיד תת-אוכלוסייה שונה של תאי גידול ממקום אחר או אפילו מאותה גרורה, וביופסיה נוזלית עלולה לפספס תת-אוכלוסייה של תאי גידול שלא מפריש דנ"א לדם.
תוצאות הבדיקה והשלכות קליניות
עד להופעתן של הבדיקות הגנומיות, הטיפול העיקרי במחלות הסרטן השונות, בדגש על מחלות מתקדמות בשלב גרורתי (שלב 4), היה הכימותרפיה, טיפול רחב טווח, הגורם למגוון רחב של תופעות לוואי לא קלות. הטיפולים ממוקדי המטרה החדשים הביאו לתגובה וסבילות טובות יותר, כלומר הם איפשרו טיפול יעיל לתקופה ארוכה יותר ולמעשה שיחררו מטופלים רבים מהצורך בטיפול כימותרפי. בעשר השנים האחרונות, ככל שמפענחים יותר את משמעות השינויים הגנטיים, מפותחות יותר תרופות ממוקדות מטרה.
לאור זאת, השימוש הקליני בבדיקות לאפיון גנומי מקיף במסגרת הטיפול במגוון סוגי סרטן בשלב הגרורתי הולך ועולה, ואף מומלץ על ידי האיגודים המקצועיים כגון ה-NCCN (National Comprehensive Cancer Network), עם אבחנתם של סוגי סרטן גרורתיים כגון סרטן ריאה שאיננו תאים קטנים וסרטן שלפוחית ודרכי שתן.
פיענוח תוצאות הבדיקה
תוצאות FoundationOne מתקבלות באמצעות דו"ח מפורט הכולל את מרב המידע הדרוש לרופא המטפל על מנת לקבל החלטות טיפול המבוססות על הפרופיל המולקולרי של הגידול הספציפי:
- בעמוד הראשון של הדו"ח מתואר מקור הדגימה בין אם רקמה (ומאיזו רקמה) או דם.
- מדדי תגובה לאימונותרפיה ע"פ סוג הבדיקה:
- MSI - Microsatellite Instability – מדד לאי-יציבות גנומית הגורם ליצירת מוטציות מרובות, משנית לבעיה במנגנוני תיקון דנ"א מסוג MisMatch repair (MMR) בתאי הסרטן. מדד זה קיים בכל בדיקות FoundationOne. גידולים שיש בהם אי-יציבות גנומית מרובה נקראים MSI-H (MSI-High ) בניגוד לגידולים בהם אין אי יציבות גנומית הנקראים MSI-S (MSI-Stable). טיפול אימונותרפי הראה יעילות ומאושר על ידי ה-FDA לטיפול בגידולים שהם MSI-H בקווי טיפול שונים[9][10]
- TMB – Tumor Mutational Burden – מדד מספרי לעומס מוטציות בגידול. עומס מוטציות יכול לעלות בשל סיבות שונות, כגון חשיפה לקרינה מייננת במלנומה[3][4], עישון בסרטן ריאות[5], או בשל קיום אי-יציבות גנומית (MSI-H)[11][12][13]. מתקבל מספר כאשר גידולים עם TMB ≥10 נחשבים עם עומס מוטציות גבוה ואלו עם TMB 10 נחשבים עם עומס מוטציות נמוך[14]. אימונותרפיה יעילה ומאושרת על ידי ה-FDA לטיפול בגידולי ילדים ומבוגרים עם TMB ≥10 שהתקדמו על טיפול אחר. מדד זה קיים בבדיקות הרקמה מסוג FoundationOne CDx ו- FoundationOne Heme. בבדיקה מסוג FoundationOne Liquid CDx קיים מדד בשם bTMB (Blood TMB) אשר מתאר את עומס המוטציות בדנ"א הגידולי שנאסף בדם. מדד זה נמצא קשור עם תגובה לאימונותרפיה
- רשימת השינויים הגנומיים שנמצאו עם פירוט סוג השינוי בין אם מוטציה, איחוי, אמפליפיקציה וכדומה. יש לשים לב לשינויים בגנים הקשורים במחלות סרטן תורשתיות. אם קיים רקע משפחתי או אישי ונמצא שינוי בגן הידוע כקשור לתסמונת גנטית של סרטן יש לבצע ייעוץ גנטי מסודר
- המלצות על טיפולים – מתוארות תרופות מאושרות FDA או משלבי תרופות מאושרי FDA, להם המטופל עשוי להגיב כתוצאה מהשינוי הגנומי שנמצא בבדיקה. מתוארות תרופות מאושרות עם רווח קליני ידוע בטיפול באותו סוג סרטן עם אותם שינויים גנומיים, וגם תרופות עם רווח קליני במטופלים עם אותם שינויים גנומיים אך מאושרות לטיפול בסוג סרטן אחר
- רשימה של מחקרים קליניים פעילים בתרופות מחקר, להם החולה מתאים. מפורט מידע לגבי מחקרים להם החולה עשוי להתאים על סמך הפרופיל הגנומי של הגידול שלו. בנוסף, הרופא מקבל הנחיות כיצד לאתר מחקרים נוספים המתאימים לחולה
- בעמוד השני יש פירוט נרחב יותר של הממצאים, כולל תדירות השינויים הגנומיים, השפעתם הביולוגית וכיצד הם משפיעים על החולה
- MAF% (Mutant Allele Frequency Percentage) – מייצג את אחוז הרצפים שנקראו המכילים אלל עם השינוי שנמצא מסך כל הרצפים. MAF יכול להיות מושפע מגורמים רבים, ביניהם גם הטרוגניות הגידול ויכול להוות סמן לתגובה לטיפול. מדד זה מופיע בבדיקות FoundationOne CDx ו- FoundationOne Liquid CDx
- חלקו האחרון של הדו"ח כולל פרטים טכניים על הבדיקה ורשימה מלאה של הגנים שנמצאו בגידול, וכך ניתן לדעת באילו גנים לא נמצאו שינויים.
- בדיקת FoundationOne Liquid CDx נותנת עוד מדד גנומי נוסף:
%Tumor Fraction – הערכה של אחוז הדנ"א החופשי ממקור גידול מסך כל הדנ"א החופשי שנאסף בדגימה. מדד לכמות הדנ"א הגידולי בדגימה ויכול להשפיע על היכולת לזהות שינויים בדגימה. יכול לשמש כמדד למעקב אחר עומס מחלה.
מידע אודות TMB MSI, בשילוב עם פרופיל גנומי מקיף, מאפשר לרופא לנבא את תגובת החולה לאימונותרפיה, וכן לזהות טיפולים ממוקדים ותרופות מחקר המתאימים לחולה.
ביבליוגרפיה והערות שוליים
- ↑ 1.0 1.1 Frampton, GM et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing . Nat Biotechnol. 2013.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Stratton, M. R., Campbell, P.J. & Futreal, P. A. The cancer genome. Nature. 2009. 458;719-724.
- ↑ 3.0 3.1 Pfeifer, G. P., You, Y.-H. & Besaratinia, A. Mutations induced by ultraviolet light. Mutat. Res. 2005. 571; 19–31.
- ↑ 4.0 4.1 Hill, V. K., Gartner, J. J., Samuels, Y. & Goldstein, A. M. The genetics of melanoma: recent advances. Annu. Rev. Genomics Hum. Genet. 2013. 14;257–279.
- ↑ 5.0 5.1 5.2 Pfeifer, G. P. et al. Tobacco smoke carcinogens, DNA damage and p53 mutations in smoking-associated cancers. Oncogene. 2002. 21; 7435–7451,
- ↑ Ali S, Hensing T, Schrock A, et al. Comprehensive genomic profiling identifies a subset of crizotinib-responsive ALK-rearranged non-small cell lung cancer not detected by FISH. Oncologist.,2016.
- ↑ Schrock AB, Frampton GM, Herndon D, et al. Comprehensive Genomic Profiling Identifies Frequent Drug-Sensitive EGFR Exon 19 Deletions in NSCLC not Identified by Prior Molecular Testing. Clin Cancer Res. 2016. 13;3281-3285.
- ↑ Le, D. T. et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N. Engl. J. Med. 372, 2509–2520 (2015).
- ↑ Andre T. et al. Pembrolizumab in Microsatellite-Instability–High Advanced Colorectal Cancer. NEJM. 2020. 383;2207-2218.
- ↑ Le DT, Uram JN,WangH, Bartlett BR, KemberlingH, Eyring AD, et al. PD-1 blockade in tumors with mismatch-repair deficiency. NEJM. 2015.372:2509–20.
- ↑ Cancer Genome Atlas Research Network et al. Integrated genomic characterization of endometrial carcinoma. Nature. 2013. 497;67–73.
- ↑ Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature. 2012. 487; 330–337.
- ↑ Roberts, S. A. & Gordenin, D. A. Hypermutation in human cancer genomes: footprints and mechanisms. Nat. Rev. Cancer. 2014. 14; 786–800.
- ↑ Marabelle A, et. al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. The Lancet, 2020 Vol. 21;10 1353-1365.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ איתן פרידמן, מייסד ומנהל היחידה לאונקוגנטיקה במכון הגנטי במרכז הרפואי שיבא, פרופסור מן המניין במסלול חוקרים בחוג לרפואה פנימית ובחוג לגנטיקה וביוכימיה באוניברסיטת תל אביב, עדכון חלקי ינואר 2021 - ד"ר חגי ליגומסקי, המכון אונקולוגי, המרכז הרפואי תל אביב – איכילוב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק