פלזמלוגן - Plasmalogen
| מדריך בדיקות מעבדה | |
| פלזמלוגן | |
|---|---|
| Plasmalogen | |
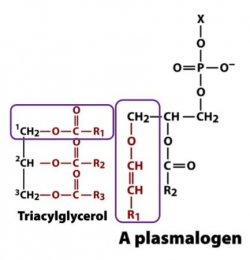
| |
| מעבדה | כימיה בדם |
| תחום | מפגעים פרוקסיזומליים |
| טווח ערכים תקין | *Hexadecanal-dimethylacetal (או C16:0 DMA) גדול או שווה ל-7 מיקרוגרם/מ"ל.
|
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
שימושית לאבחון של מטופלים עם מפגעים פרוקסיזומליים אפשריים, כגון מפגעי ביוגנזה של פרוקסיזומים (ספקטרום תסמונת Zellweger), ו-rhizomelic chondrodysplasia punctata (RCDP), כולל fatty acid deficiency CoA reductase. מטרה נוספת של הבדיקה היא בהערכה של תינוקות עם תוצאות בדיקות סקר יילודים בלתי תקינות בהקשר של X-linked adrenoleukodystrophy, וסיוע בקביעת התפקוד של ה-peroxisome.
היסטוריה
בשנת 1924 טבעו Feulgen ו-Voigt את השם plasmalogen לתאר תרכובת לא ידועה היוצרת אלדהיד בפלזמה לאחר טיפול חומצי (Snyder ב-Biochim Biophys Acta משנת 1999). בשנת 1957 תיארו Marinetti ו-Erbland באותו כתב-עת את המבנה של plasmalogen מלב חזיר, וקבעו שתרכובת האם של plasmalogen היא glycerophospholipid המכיל בעמדה sn-1 קבוצת vinyl ether לבילית לחומצה. האופי הכימי של קבוצת vinyl ether זו הוגדר כאלדהיד "מוסווה" על ידי Ford ב-Clin Lipidol משנת 2010. ניתן למצוא פלזמלוגנים בהרחבה בחיידקים אנארוביים, ובבעלי חיים חסרי ובעלי חוליות. היעדר פלזמלוגנים בחיידקים אארוביים, ברוב הפטריות והצמחים רומז על כך שהופעת מולקולות אלה, היעלמותן והופעתן המחודשת באבולוציה, מושפעת על ידי הבדלים עיקריים בביוסינתזה שלהן בחיידקים אנארוביים ובבעלי חיים עליונים (Goldfine ב-Prog Lipid Res משנת 2010).
הביוסינתזה של plasmalogen
ליפידים אתריים מסונתזים במסלול שכיח המתחיל באסוציאציה של אנזימי המטריקס הפרוקסיסומליים, glycerone phosphate O-acyltransferase (להלן GNPAT), ו- alkylglycerone phosphate synthase (להלן AGPS), בצידה הלומינלי של ממברנת ה- peroxisome (Brites וחב' ב-Biochim Biophys Acta משנת 2004). שלב הריאקציה ההתחלתי הוא אצילציה של dihydroxyacetone phosphate (להלן DHAP) בעמדה sn-1, על ידי GNPAT, וטרנספר של acyl-DHAP דרך אתרי האנזים הפעילים, מלווה על ידי תחלופה של שייר ה-acyl (חומצת השומן) בתמורה לשייר alkyl (אלכוהול שומני) על ידי AGPS (Van de Vet וחב' ב-J Lipid Res משנת 1999).
ראיות לכך ש-GNPAT ו-AGPS עוברים אינטראקציה נתמכות על ידי ניסויי הצלבה בתמציות של פיברובלסטים מאדם, שהראו קומפלקסים גבה-מולקולריים בגדלים התואמים את הסטויכומטריה של שתי מולקולות AGPS ומולקולה אחת של GNPAT (Biermann וחב' ב-Eur J Biochem משנת 1999). למרות שהאנזימים המונומריים שומרים על הפעילות שלהם ב-lysate של תאים שלמים, נדרשת כנראה יצירת הקומפלקס כדי לתעל את המצע בתוך ה-peroxisome על מנת להגדיל את יעילות הריאקציה (Hardeman ו-van den Bosch ב-Biochim Biophys Acta משנת 1989). בפיברובלסטים משוללי AGPS, יש ירידה ברמות GNPAT ובפעילות האחרון, מה שצפוי לאור הדרישה לחלבון AGPS על מנת לשמור על יציבות הקומפלקס. בניסוי בו נעשה שימוש בפיברובלסטים שנלקחו ממטופלים עם מוטציות missense שונות באלל של AGPS, נמצא שרק AGPS פעיל קטליטית יכול היה לסייע לפעילות האנזימטית של GNPAT, מה שמקנה תוקף לצורך של תיעול המצע בריאקציה זו.
הפיזור הרקמתי של plasmalogen
פלזמלוגן מהווה 15-20% מסך הפוספוליפידים בממברנות תאים, עם למעלה מ-50% מהתפקוד של GPEtn במוח, בלב, בנויטרופילים ובאאוזינופילים. וישנם אזורים במוח בהם פלזמלוגנים מהווים כמעט 90% מתפקוד ה-GPEtn. פלזמלוגנים עשירים גם בכליות, בריאות ובשריר השלד. הלב ושריר השלד כמו גם תאי זרע בשלים, מכילים יחסים גבוהים של PlaEtn ו-PlaCho. פלזמלוגנים מהווים גם מרכיבים משמעותיים של ממברנות תוך-תאיות, כולל ממברנות של גרעין התא, של הרטיקולום האנדופלזמי, של רשת הבתר-Golgi ושל המיטוכונדריה. עם זאת, לא נמצא plasmalogen בממברנת הפרוקסיזום (Honsho וחב' ב-Biochim Buophys Acta משנת 2008). פלזמלוגנים מרוכזים גם בממברנות ייחודיות כגון בסרקולמה ובמיאלין, וכן בממברנות מפרישות כגון בועיות (vesicles) סינפטיות, בגרנולות מפרישות ובסורפקטנטים. הכמויות הנמוכות ביותר של פלזמלוגן נמצאות בכבד, שכן למרות הסינתזה שלו בכבד. הוא עובר טרנספורט בליפוזומים לרקמות אחרות (Vance וחב' ב-Biochim Biophys Acta משנת 1990). רמות הפלזמלוגן קשורה גם לגיל האורגניזם, ואכן יילודים בריאים מכילים באריתרוציטים שלהם כמויות plasmlogen נמוכות משמעותית בהשוואה לילדים מבוגרים יותר (Labadaridis וחב' ב-Acta Pediatr משנת 2009). הכמות הכללית של פלזמלוגנים במוח, גדלה באופן דרמטי בשלב פאזת ההתפתחות של מיאלינציה, ומגיעה לרמה המקסימלית בערך בגיל 30 שנה (Nagan ו-Zoeller ב-Prog Lipid Res משנת 2001). לבסוף, תוכן ה-plasmalogen בדרך כלל בירידה בגיל מתקדם (Farooqui ו-Horrocks ב-Neuroscientist משנת 2001, ו-Maeba וחב' ב-J Atheroscler Thromb משנת 2007).
תפקידים ביולוגיים המיוחסים לפלזמלוגנים
הרוב של ליפידים בממברנות תאים הם גליקוליפידים. מבנית, הם עוזרים לשמור בממברנה על תכונות ה-bilayer (Farooqui וחב' ב-Chem Phys Lipids משנת 2000). פלזמלוגנים נחוצים גם לתפקוד נכון של חלבוני הממברנה וליצירה של second messengers של ליפידים. פלזמלוגנים מוסיפים תפקודים ייחודיים אחדים שהם תכונה ישירה של הקשר n-1 vinyl ether והעשרת חומצות שומן רב-בלתי-רוויות בעמדה sn-2.
הפוטנציאל החמצוני
בנוסף לשינויים בתכונות הממברנה, אטומי המימן הסמוכים לקשר של vinyl ether, הם באופן יחסי בעלי אנרגיות דיסוציאציה נמוכות, והם מחומצנים באופן מועדף בנוכחות diacyl glycerophospholipid כאשר הם נחשפים לרדיקלים חופשיים שונים או למולקולת חמצן (Broniec וחב' ב-Free Radic Biol Med משנת 2011). פלזמלוגנים מבוזבזים בריאקציה זו כנראה בצורך לייתר את החמצון של חומצות שומן רב-בלתי-רוויות. נראה אם כך ש-plasmalogen "מקריב" עצמו כמולקולה מתחמצנת. Sindelar וחב' דיווחו בשנת 1999 ב-Free Radic Biol Med, שתוצרי החמצון של plsmalogen אינם מסוגלים לייצר עוד פראוקסידציה של ליפידים, אם כי נותר לקבוע שתוצרי החמצון עצמם אינם מזיקים, ומדובר בתוצרים דוגמת אלדהידים חופשיים, 11-hydroxy-2-acyl--sn-GP, 1-formyl-2-acyl-sn-GPc, היפו-פּראוקסידים אלליים, אֶפּוקסידים ו-hemiacetals (Stadelmann-Ingrand וחב' ב-Free Radic Biol Med משנת 2001).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 