פלזמלוגן - Plasmalogen
| מדריך בדיקות מעבדה | |
| פלזמלוגן | |
|---|---|
| Plasmalogen | |
| |
| מעבדה | כימיה בדם |
| תחום | מפגעים פרוקסיזומליים |
| טווח ערכים תקין | *Hexadecanal-dimethylacetal (או C16:0 DMA) גדול או שווה ל-7 מיקרוגרם/מ"ל.
|
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
שימושית לאבחון של מטופלים עם מפגעים פרוקסיזומליים אפשריים, כגון מפגעי ביוגנזה של פרוקסיזומים (ספקטרום תסמונת Zellweger), ו-rhizomelic chondrodysplasia punctata (RCDP), כולל fatty acid deficiency CoA reductase. מטרה נוספת של הבדיקה היא בהערכה של תינוקות עם תוצאות בדיקות סקר יילודים בלתי תקינות בהקשר של X-linked adrenoleukodystrophy, וסיוע בקביעת התפקוד של ה-peroxisome.
היסטוריה
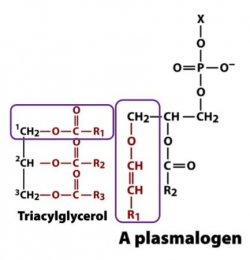
בשנת 1924 טבעו Feulgen ו-Voigt את השם plasmalogen לתאר תרכובת לא ידועה היוצרת אלדהיד בפלזמה לאחר טיפול חומצי (Snyder ב-Biochim Biophys Acta משנת 1999). בשנת 1957 תיארו Marinetti ו-Erbland באותו כתב-עת את המבנה של plasmalogen מלב חזיר, וקבעו שתרכובת האם של plasmalogen היא glycerophospholipid המכיל בעמדה sn-1 קבוצת vinyl ether לבילית לחומצה. האופי הכימי של קבוצת vinyl ether זו הוגדר כאלדהיד "מוסווה" על ידי Ford ב-Clin Lipidol משנת 2010. ניתן למצוא פלזמלוגנים בהרחבה בחיידקים אנארוביים, ובבעלי חיים חסרי ובעלי חוליות. היעדר פלזמלוגנים בחיידקים אארוביים, ברוב הפטריות והצמחים רומז על כך שהופעת מולקולות אלה, היעלמותן והופעתן המחודשת באבולוציה, מושפעת על ידי הבדלים עיקריים בביוסינתזה שלהן בחיידקים אנארוביים ובבעלי חיים עליונים (Goldfine ב-Prog Lipid Res משנת 2010).
הביוסינתזה של plasmalogen
ליפידים אתריים מסונתזים במסלול שכיח המתחיל באסוציאציה של אנזימי המטריקס הפרוקסיסומליים, glycerone phosphate O-acyltransferase (להלן GNPAT), ו- alkylglycerone phosphate synthase (להלן AGPS), בצידה הלומינלי של ממברנת ה- peroxisome (Brites וחב' ב-Biochim Biophys Acta משנת 2004). שלב הריאקציה ההתחלתי הוא אצילציה של dihydroxyacetone phosphate (להלן DHAP) בעמדה sn-1, על ידי GNPAT, וטרנספר של acyl-DHAP דרך אתרי האנזים הפעילים, מלווה על ידי תחלופה של שייר ה-acyl (חומצת השומן) בתמורה לשייר alkyl (אלכוהול שומני) על ידי AGPS (Van de Vet וחב' ב-J Lipid Res משנת 1999).
ראיות לכך ש-GNPAT ו-AGPS עוברים אינטראקציה נתמכות על ידי ניסויי הצלבה בתמציות של פיברובלסטים מאדם, שהראו קומפלקסים גבה-מולקולריים בגדלים התואמים את הסטויכומטריה של שתי מולקולות AGPS ומולקולה אחת של GNPAT (Biermann וחב' ב-Eur J Biochem משנת 1999). למרות שהאנזימים המונומריים שומרים על הפעילות שלהם ב-lysate של תאים שלמים, נדרשת כנראה יצירת הקומפלקס כדי לתעל את המצע בתוך ה-peroxisome על מנת להגדיל את יעילות הריאקציה (Hardeman ו-van den Bosch ב-Biochim Biophys Acta משנת 1989). בפיברובלסטים משוללי AGPS, יש ירידה ברמות GNPAT ובפעילות האחרון, מה שצפוי לאור הדרישה לחלבון AGPS על מנת לשמור על יציבות הקומפלקס. בניסוי בו נעשה שימוש בפיברובלסטים שנלקחו ממטופלים עם מוטציות missense שונות באלל של AGPS, נמצא שרק AGPS פעיל קטליטית יכול היה לסייע לפעילות האנזימטית של GNPAT, מה שמקנה תוקף לצורך של תיעול המצע בריאקציה זו.
הפיזור הרקמתי של plasmalogen
פלזמלוגן מהווה 15-20% מסך הפוספוליפידים בממברנות תאים, עם למעלה מ-50% מהתפקוד של GPEtn במוח, בלב, בנויטרופילים ובאאוזינופילים. וישנם אזורים במוח בהם פלזמלוגנים מהווים כמעט 90% מתפקוד ה-GPEtn. פלזמלוגנים עשירים גם בכליות, בריאות ובשריר השלד. הלב ושריר השלד כמו גם תאי זרע בשלים, מכילים יחסים גבוהים של PlaEtn ו-PlaCho. פלזמלוגנים מהווים גם מרכיבים משמעותיים של ממברנות תוך-תאיות, כולל ממברנות של גרעין התא, של הרטיקולום האנדופלזמי, של רשת הבתר-Golgi ושל המיטוכונדריה. עם זאת, לא נמצא plasmalogen בממברנת הפרוקסיזום (Honsho וחב' ב-Biochim Buophys Acta משנת 2008). פלזמלוגנים מרוכזים גם בממברנות ייחודיות כגון בסרקולמה ובמיאלין, וכן בממברנות מפרישות כגון בועיות (vesicles) סינפטיות, בגרנולות מפרישות ובסורפקטנטים. הכמויות הנמוכות ביותר של פלזמלוגן נמצאות בכבד, שכן למרות הסינתזה שלו בכבד. הוא עובר טרנספורט בליפוזומים לרקמות אחרות (Vance וחב' ב-Biochim Biophys Acta משנת 1990). רמות הפלזמלוגן קשורה גם לגיל האורגניזם, ואכן יילודים בריאים מכילים באריתרוציטים שלהם כמויות plasmlogen נמוכות משמעותית בהשוואה לילדים מבוגרים יותר (Labadaridis וחב' ב-Acta Pediatr משנת 2009). הכמות הכללית של פלזמלוגנים במוח, גדלה באופן דרמטי בשלב פאזת ההתפתחות של מיאלינציה, ומגיעה לרמה המקסימלית בערך בגיל 30 שנה (Nagan ו-Zoeller ב-Prog Lipid Res משנת 2001). לבסוף, תוכן ה-plasmalogen בדרך כלל בירידה בגיל מתקדם (Farooqui ו-Horrocks ב-Neuroscientist משנת 2001, ו-Maeba וחב' ב-J Atheroscler Thromb משנת 2007).
תפקידים ביולוגיים המיוחסים לפלזמלוגנים
הרוב של ליפידים בממברנות תאים הם גליקוליפידים. מבנית, הם עוזרים לשמור בממברנה על תכונות ה-bilayer (Farooqui וחב' ב-Chem Phys Lipids משנת 2000). פלזמלוגנים נחוצים גם לתפקוד נכון של חלבוני הממברנה וליצירה של second messengers של ליפידים. פלזמלוגנים מוסיפים תפקודים ייחודיים אחדים שהם תכונה ישירה של הקשר n-1 vinyl ether והעשרת חומצות שומן רב-בלתי-רוויות בעמדה sn-2.
הפוטנציאל החמצוני
בנוסף לשינויים בתכונות הממברנה, אטומי המימן הסמוכים לקשר של vinyl ether, הם באופן יחסי בעלי אנרגיות דיסוציאציה נמוכות, והם מחומצנים באופן מועדף בנוכחות diacyl glycerophospholipid כאשר הם נחשפים לרדיקלים חופשיים שונים או למולקולת חמצן (Broniec וחב' ב-Free Radic Biol Med משנת 2011). פלזמלוגנים מבוזבזים בריאקציה זו כנראה בצורך לייתר את החמצון של חומצות שומן רב-בלתי-רוויות. נראה אם כך ש-plasmalogen "מקריב" עצמו כמולקולה מתחמצנת. Sindelar וחב' דיווחו בשנת 1999 ב-Free Radic Biol Med, שתוצרי החמצון של plsmalogen אינם מסוגלים לייצר עוד פראוקסידציה של ליפידים, אם כי נותר לקבוע שתוצרי החמצון עצמם אינם מזיקים, ומדובר בתוצרים דוגמת אלדהידים חופשיים, 11-hydroxy-2-acyl--sn-GP, 1-formyl-2-acyl-sn-GPc, היפו-פּראוקסידים אלליים, אֶפּוקסידים ו-hemiacetals (Stadelmann-Ingrand וחב' ב-Free Radic Biol Med משנת 2001).
איתותים ליפידיים ומצבי מחלה
חוסר איזון של מסלולי איתות על ידי ליפידים, תורם להחמרת המחלה במצבי דלקת כרונית, תסמונת מטבולית, סוכרת type 2, וכן במחלות קרדיו-וסקולריות ונוירו-ניווניות. חמצון מוגבר של ליפידים, מלווה מצבים פתולוגיים אלה והוא כרוך בירידה ברמות plasmalogen. הערכה של LDL במטופלים מאוד שמנים, כאלה עם תסמונת מטבולית או כאלה עם סוכרת type 2, העלתה רמות מופחתות של PlaEtn ב-22% באלה עם תסמונת מטבולית, וב-49% בסוכרתיים, כמו גם פראוקסידציה מוגברת של ליפידים, ירידה ברמת cholesterol ester ורמה גבוהה של טריגליצרידים בהשוואה לביקורת (Colas וחב' ב-Diabetologia משנת 2011). האנזים myeloperoxidase בלויקוציטים, מייצר חומצה היפוכלורית (HOCl) ממי-חמצן וכלוריד גזי, כחלק ממנגנון ההגנה החיסונית. פלזמלוגנים, המועשרים בלויקוציטים, מהווים אחד מהיעדים הראשיים של HOCl, בגין הרגישות של קשר ה-vinyl ether למחמצנים. קבועי הקצב של מודיפיקציית פלזמלוגן הנגרמת על ידי HOCl, הם פי-10 גבוהים יותר בהשוואה להשפעת diacyl GP (Skaff וחב' ב-Biochemistry משנת 2008). התוצרים הישירים, α-chloro fatty aldehyde ו-1-lyso-2-acyl-sn-GP, יכולים לייצר משפחה של ליפידים שעברו כלורינציה, שיכולים לווסת את התגובות הדלקתיות. הסננה של מונוציטים לתוך דופן כלי הדם הטרשתיים, ולתוך אזורי אוטמים לבביים, כרוכה בהצטברות ברקמות אלו של α-chloro fatty aldehyde ושל 2-chlorohexadecanal. בדומה, דלקת עצבית גורמת להצטברות של 2-chlorohexadecanal בליפידים במוחות עכברים שטופלו עם אנדו-טוקסין (Ullen וחב' ב-Free Radic Biol Med משנת 2010). נראה אם כן שמצבים דלקתיים יכולים להפחית רמות plasmalogen.
באיסכמיה של שריר הלב, מתרחש שפעול מוקדם של PLA2 ספציפי ל-plasmalogen, מה שמוביל לאובדן של האחרון. אספקה של chimyl alcohol ללבבות מבודדים של חולדות, הפחיתה את נזק הזילוח מחדש (reperfusion) שלאחר איסכמיה, כפי שנמצא במדידה של תפקוד החדר השמאלי ופליטת הדם כמו גם של שפיעת הדם הכלילית, הפחתת האנזים CPK המשתחרר לדם, והפחתת הפראוקסידציה של ליפידים (Maulik וחב' ב-Ann NY Acad Sci משנת 1994). מחקר זה הראה שרמות plasmalogen מוגברות כתוצאה מאספקת chimyl alcohol, עשויה להגן מפני נזק איסכמי. יתרה מכך, ייתכנו ל-plasmalogen תפקודים נוספים בסרקולמה הלבבית, בה רמתו גבוהה. Ford ו-Hale דיווחו ב-FEBS Lett משנת 1996, על רה-קונסטיטוציה מועדפת של ה- exchanger trans-sarcolemmal exchamger הידוע כ-SLC8A1 בווסיקולות פוספוליפידיות המכילות פלזמלוגן, בהשוואה ל-diacyl GP לבדו, מה שמצביע על תפקוד מבני אפשרי של plasmalogen.
מפגע אחר, rhizomelic chondrodysplasia punctata (להלן RCDP), מאופיין על ידי קיצור הגפיים, על ידי יְרוד (קטרקט), חסמים אינטלקטואליים ופרכוסים, אם כי הוא עשוי להופיע בצורה מתונה יותר הכוללת רק ירוד ו-chondrodysplasia punctata (פגיעה בהתפתחות הסחוס והעצם בתינוקות). ישנם 5 סוגים קליניים של rhizomelic chondrodysplasia punctata: סוגים ,RCDP 1 ,RCDP 4 ,RCDP 3 ,RCDP 2 ו-RCDP 5. הסוג RCDP 1 היא הצורה הקלאסית המתבטאת בעוללים עם סממנים שלדיים כגון קיצורי גפיים, ירוד, פיגור התפתחותי ואינטלקטואלי חמור, הגורם למותם של ילדים אלה בדרך כלל מתחת לגיל 10 שנים. RCDP 1 הוא מפגע אוטוזומלי-רצסיבי הנגרם על ידי וריאנטים פתוגניים בגן PEX7. הסוגים RCDP 2 ו-RCDP 3 הם בעלי תסמינים קליניים דומים לאלה ב-RCDP 1, אך נבדלים ממנו בחסר של פלזמלוגן. הסוג RCDP 2 נגרם על ידי וריאנטים פתוגניים בגן GNPAT, והסוג RCDP-3 נגרם על ידי פגמים בגן AGPS. ילדים עם הסוג RCDP 5, לוקים בפנוטיפ מתון יותר, ורובם מסוגלים לאכול ללא עזרה, ולפתח כישורים ורבאליים מוגבלים. בסוג RCDP-5 יש רק חסר חלקי של פלזמלוגן, והוא נגרם על ידי פגם בגן PEX5 (Baroy וחב' ב-Hum Mol Genet משנת 2015). הפרופיל הביוכימי הטיפוסי ל-RCDP מראה רמת פלזמלוגן מופחתת, חומצה פיטנית מוגברת ורמה נורמלית של VLCFA. חסר של האנזים fatty acyl-CoA reductase (להלן FAR1) ידוע גם כ-RCDP-4, הוא מפגע פרוקסיזומלי אוטוזומלי-רצסיבי, הנגרם על ידי פגם בגן FAR1, הגורם בהופעה מוקדמת של אפילפסיה, מיקרוצפלי, ירוד, פיגור בגדילה, ופגיעה אינטלקטואלית (Buchert וחב' ב-Am J Hum Genet משנת 2014). לעומת זאת, בתינוקות עם FAR1, לא מופיעות אנומליות שלדיות, והפרופיל הביוכימי של חסר FAR1, כולל רמה מופחתת של פלזמלוגנים, רמה נורמלית של VLCFA ורמה נורמלית עד מוגברת של חומצה פיטנית (Braverman ו-Moser ב-Biochim Biophys Acta משנת 2012).
יְרודים קליפתיים מופיעים בשלב הנאו-נטלי. מחקרים היסטולוגיים של העדשה הראו שגשוג של תאי אפיתל גדולים ותפוחים שאינם יוצרים כל סיבי עדשה אמיתיים (Sugarman ב-Birth Defects Orig Artic משנת 1974). מוצאים גם תדירות מוגברת של cleft palate (שָׂפָה שְׁסוּעָה) כמו גם עיווגים לבביים וכלייתיים במטופלים עם RCDP (Braverman וחב' ב-GeneReviews משנת 1993, ו-White וחב' ב-Am J Med Genet משנת 2003). מתמעטת ההישרדות: 50% מהילדים שורדים עד גיל 6 שנים, והאחרים שורדים עד שנות הנעורים שלהם כתוצאה מהיפו-פלזיה פולמונרית (Oswald וחב' ב-Am J Med Genet משנת 2011), כאשר בגיל המתקדם הסיבה לתמותה נובעת ממצוקה נשימתית כרונית.
לסיכום, פנוטיפים אלה מצביעים על כל שפלזמלוגנים קריטיים במוח, בעדשה, ובהתפתחות העצם, וחסר שלהם אחראי לשפה השסועה, לעיווגים הלבביים והכלייתיים, ולמחלת הריאות.
Peroxisomes הם חלקיקים תאיים בהם מתבצעים תפקודים מטבוליים חיוניים רבים כגון β-אוקסידציה של חומצות שומן ארוכות-מאוד-שרשרת (VLCFA), α-אוקסידציה של חומצה פיטנית (phytanic acid) וביוסינתזה של חומצות מרה ושל plasmalogen. מפגעים ב-peroxisome כוללים אי-סדירות של ביוגנזה פרוקסיסומלית עם הַרְכָּבָה מלאה פגומה של הפרוקסיזום, ופגיעה בפעילות האנזימטית ובטרנספורט של תוצרי הריאקציה האנזימטית אל מחוץ לפרוקסיזום. אנומליות ביוכימיות במפגעי ביוגנזה של הפרוקסיזום יכולות לכלול הצטברות של VLCFA, חומצה פיטנית, חומצה פריסטנית (peristanic acid), חומצה פּיפּקולית (pipecolic acid), חומצות מרה ופלזמלוגנים. האבחנה המבדלת של סוגי פגמים אלה, מבוססת על הפנוטיפים הקליניים ועל סדרת בדיקות ביוכימיות המבוססות על התפקוד הפרוקסיזומלי ומבנהו. בדיקות אלו כוללות מדידה וקביעת היחסים בין VLCFA, חומצה פיטנית והמטבוליט שלה-חומצה פריסטנית, פרופיל חומצות שומן, חומצה פיפקולית, חומצות מרה ופלזמלוגנים. מפגעים של ביוגנזה פרוקסיזומלית כוללים את הספקטרום של תסמונת Zellweger, שהם בעלי מגוון קליני רחב החל מהתסמונת הקטלנית בתינוקות, עבור למהלכים קליניים משתנים כמו adrenoleukodystrophy (להלן ALD) ביילודים ומחלת Refsum בתינוקות. ילדים פגועים סובלים באופן טיפוסי מהיפטוניה, אכילה דלה, תווי פנים אופייניים, פרכוסים, ואי-תפקוד כלייתי. מפגעים אחרים יכולים לכלול דיסטרופיה רטינופתית, איבוד שמיעה, אפיזודות של דימום, ופיגור התפתחותי.
אינטרפרטציה
ישנם דיווחים על הריכוזים של פלזמלוגנים המכילים חומצות שומן C18:0, C16:0 ו-C18.1, וכן את היחס בין C16:0 ל-C18:0 בפלזמלוגנים. פרופיל של רמת פלזמלוגנים מופחתת ורמה לא נורמלית של VLCFA, בנוסף לאפשרות של אנומליות בחומצה פּיפּקולית ובחומצות מרה, יכולים להצביע על אבחנה של מפגע בביוגנזה של פרוקסיזומים (ספקטרום תסמונת Zellweger). לעומת זאת, פרופיל של רמת פלזמלוגנים מופחתת, רמה מוגברת של חומצה פיטנית, ורמה נורמלית של VLCFA, יכולים להצביע על rhizomelic chondrodysplasia punctata, מהסוגים RCDP type 1 או RCDP type 2, או על חסר FAR1, או על סוגים אחרים של RCDP.
חסר של plasmalogen במצבי מחלה
מפגעים תורשתיים בסינתזה של plasmalogen: הסיבות התורשתיות הידועות היחידות של חסר plasmalogen הם מפגעי ה-peroxisome הידועים כ-Rhizomelic Chondrodysplasia Punctata (להלן RCDP) והספקטרום של Zellweger. בעוד שחסר plasmalogen תורם לפתולוגיה של ספקטרום Zellweger, חסר זה הוא הסיבה הישירה והעיקרית ל-RCDP. סך התחלואה של RCDP היא בערך 1 ל-100,000. רוב המקרים של RCDP הם כתוצאה ממוטציות בגן המקודד לטרנספורטר של החלבון הפרוקסיסומלי PEX7 (ב-RCDP type 1), ושאר המקרים נגרמים מפגמים בגנים המקודדים ל-2 אנזימים פרוקסיסומליים הדרושים לאתחל את הסינתזה של plasmalogen: אנזימים אלה הם GNPAT שפגמים בו גורמים ל-RCDP type 2, ו-AGPS שפגמים בו גורמים ל-RCDP type 3. למרות שהטרנספורטר PEX7 דרוש למיקום של AGPS ,PhyS ו-thiolase ב-peroxisome, רק חסר של AGPS קובע את הפנוטיפ של RCDP. במטופלים מתונים יותר המייצגים רק 10% של מקרי RCDP, יש באריתרוציטים רק 30% מרמת הפלזמלוגן הנורמלית, או פי 10-40 מרמת פלזמלוגן ב-RCDP קלאסית (Itzkovitz וחב' ב-Hum Mut משנת 2011, ו-Braverman וחב' ב-Hum Mut משנת 2002). לבסוף, מטופלים עם פגמים ב-PEX7 ורמות פלזמלוגן קרובות לרמות הנורמליות באריתרוציטים, אינן דומים בכלל לאלה עם RCDP, ודומים יותר פנוטיפית למחלת Refsum במבוגרים, הנגרמת מהצטברות phytanic acid (van den Brink וחב' ב-Adv Exp Med Biol משנת 2003). מטופלים עם RCDP קלאסי לוקים בדיספלזיה שלדית, המאופיינת על ידי CDP (או chondrodysplasia punctata) על ידי rhizomelia, על ידי הסתיידות טרם-עת של הסחוס האפיפיזיאלי, פיגור בהסתיידות של החוליות, וכן אנומליות של המטפיזה. מינרליזציה של מבנים סחוסיים שאינם מתגרמים בדרך כלל כמו הגרון, צינור הנשימה והדיסקים הבין-חולייתיים, גם כן מזוהה. לפיכך, קיימים מרכיבים של מינרליזציה של הסחוס שהיא לא-תקינה, מופיעה טרם-עת או מפגרת בהופעתה.
הצטברות של אלכוהול שומני: Rizzo וחב' דיווחו ב-Biochem Med Metab Biol משנת 1993 על הצטברות של אלכוהול שומני בפיברובלסטים ובפלזמה של מאובחנים עם RCDP או עם ZSD, בגלל האינקורפורציה הלקויה שלו בשומנים אתריים. בפיברובלסטים, אלכוהולים שומניים מצטברים רק לאחר הוספה של חומצה פלמיטית (C16:0), שהגדילה את הפעילות של FAR, ללא הגברת החמצון של אלכוהול שומני.
מחלת מערכת הנשימה
מספר מחקרים דיווחו על קשר בין פלזמלוגנים מחוזרים לתרחיש של bronchopulmonary dysplasia (להלן BPD), גורם מוביל לתחלואה בפגים. רמות נמוכות של plasmalogen בשאיפה טרכיאלית בפגים, מגבירה בהם את הסיכון לפתח BPD (Rudiger וחב' ב-Crit Care Med משנת 2000). יילודים טרם-עת במטופלים עם סורפקטנטים עם תכולה גבוהה של plasmalogen נהנים משיפור נשימתי טוב יותר (Rudiger וחב' ב-Am J Physiol Lung Cell Mol Physiol משנת 2005). הוספה של כמויות קטנות (%2mol) של פלזמלוגנים לתערובת של סורפקטנט-פוספוליפידים מפחיתה את מתח הפנים הריאתי ואת הצמיגות, מה שמצביע על תפקיד מבני של פלזמלוגנים בסורפקטנט (Rudiger וחב' ב-Am J Physiol משנת 1998). שכיחות אסתמה כרוכה בחשיפה ל-ozone שהשפעותיו המזיקות קשורות כנראה לחמצון של ליפידים סורפקטנטיים (Wynalda ו-Murphy ב-Chem Res Toxicol משנת 2009). חשיפה של סורפקטנט של עכבר ל-ozone הפחיתה באופן בררני את רמת הפלזמלוגנים ב-53% בערך, בעוד שמינים של diacyl לא פחתו משמעותית. חסר plasmlogen נכרך גם עם COPD. במדגם גדול של מאובחנים עם COPD נמצא מתאם סטטיסטי משמעותי בין חסר plasmalogen לבין עישון, מה שאושר גם על ידי הפחתה של AGPS ברקת ריאה של מעשנים, מה שקשור לכאורה בירידה בסינתזה של plasmalogen (Wang-Sattler וחב' ב-PLos One משנת 2008). בדיקות הדמיה מצאו שהפלזמלוגנים מרוכזים בקצוות של דרכי האוויר הגדולים והקטנים, כנראה בממברנות של תאי אפיתל ריאתיים (Berry וחב' ב-J Lipid Res משנת 2011).
מספרי הפרוקסיזומים היו מוגברים בהרבה בתאי Clara ובתאים alveolar type 2 של תאי אפיתל ריאתיים, מה שמרמז לדרישה מוגברת של מטבוליזם פרוקסיזומלי שהיה מחייב סינתזה של plsmalogen (Kernati ב-Histochem Cell Biol משנת 2009). כיוון שהריאה היא יעד ישיר של ROS, פלזמלוגנים עשויים להגן מפני מחלה רספירטורית על ידי תפקידם נוגד החמצון. ידוע שיש העשרה מיוחדת של פלזמלוגנים ריאתיים בחומצה אראכידונית, שאף הוא רמז לתפקיד פלזמלוגנים בהגנה חיסונית. בנוסף לכך, שפלזמלוגנים תורמים באופן מבני לסורפקטנטים. אם מתייחסים לכל הנתונים הללו בנוסף למצוקה ריאתית גבוהה של מטופלים הלוקים ב-RCDP, יש בכל אלה להצביע על תפקידי מפתח של plasmalogen בפיזיולוגיה תקינה של הריאות.
נוירו-דגנרציה
כיוון שהמוח מכיל את הכמויות הגדולות ביותר של פלזמלוגנים רקמתיים, אין מפתיע הדבר שרמות מופחתות של פלזמלוגנים במוח מודגמות במפגעים נוירו-דגנרטיביים שונים. מפגעים אלה כוללים את מחלת אלצהיימר (Han וחב' ב-J Neurochem משנת 2001), מחלת פרקינסון (Fabelo וחב' ב-Mol Med משנת 2011), מחלת Nieman-Pick type C (Schedin וחב' ב-J Biol Chem משנת 1997), תסמונת Down (Murphy וחב' ב-Brain Res משנת 2000) ו-experimental autoimmune encephalomyelitis (Singh וחב' ב-Brain Res משנת 2004). עם זאת, נותר לקבוע האם החסר של plasmalogen הוא גורם התורם למהלך הפתולוגי של המפגעים האמורים. במודל של עכבר ל-X-linked adrenoleukodystrophy נמצא שחסר plasmalogen מגביר את הפגיעה המוחית (Brites וחב' ב-Brain משנת 2009). בנוסף, חסר של plasmenylethnolamine בחומר הלבן במוח של חולים עם adrenoleukodystrophy קשור לירידה ברמת תרכובות reactive oxidant species (או ROS) (על פי Khan וחב' ב-J Neurochem משנת 2008).
מחלת אלצהיימר
הפתו-פיזיולוגיה של מחלת אלצהיימר (להלן AD) כוללת הצטברות של סבכים (tangles) נוירו-פיברילריים המורכבים מגופי tau תוך-תאיים, מהצטברות של amyloid-β-peptide חוץ-תאי, מרבדים ואובדן סינפטי (Querfurth ו-LaFerla ב-N Eng J Med משנת 2010). בהמשך ניכרים נזקים דלקתיים וחמצוניים. למרות שהגורם המנבא היחיד ל-AD פרט לגיל מתקדם הוא הגנוטיפ ApoE4, מספר הולך וגדל של מחקרים מצביע על חסר plamalogen כמו גם על תפקוד לקוי ב-peroxisome. כיוון שלא נמצא מתאם בין חסר plsmalogen והגנוטיפ ApoE, נראה שחסר plasmalogen עשוי לשמש סמן בלתי-תלוי של AD (Han ב-Curr Alzheimer Res משנת 2005).
החוקרים מצאו ירידה דרמטית של עד %40mol בתכולת פלזמלוגן בחומר הלבן בשלבים מוקדמים של AD, ירידה של mol%10 בחומר האפור, וירידה של %mol30 בשיטיון חמור. נמצא שרמת פלזמלוגן באריתרוציטים הייתה במתאם עם חומרת המחלה, מה שמצביע על רמת פלזמלוגן מופחתת באטיולוגיה הסיסטמית של AD (Wood וחב' ב-J Psychiatry Neurosci משנת 2009). Kou וחב' דיווחו ב-Acta Neuropathol משנת 2011 על ירידה ב-VLCFA, וירידה בפלזמלוגנים המכילים חומצות שומן רב-בלתי-רוויות, לעומת עלייה בצפיפות של פרוקסיזומים בגופי תאי העצב, וירידה במספרי פרוקסיזומים ב-neurites. לפיכך, הפחתה בפלזמלוגנים יכולה להיות קשורה לסינתזה מופחתת שלהם, שהיא שניונית לאובדן הכללי של תפקודי פרוקסיזום במוח של AD. בהקשר זה נמצא שהעלייה ב-Aβ מפחית את רמות חלבון AGPS (Grimm וחב' ב-J Neurochem משנת 2011). גם הירידה ברמות docosahexanoic acid (או DHA) הנצפית במוחות AD, יכולה להיגרם מחסר בפלזמלוגנים (Astarita וחב' ב-PLos One משנת 2010). יתרה מכך, הסינתזה המופחתת של DHA שהודגמה בכבד של חולי AD, יכולה להעיד על סינתזה מופחתת של קודמנים (precursors) אלה בכבד של AD כמו במוח.
החסר של פלזמלוגנים במוח של חולי AD, יכול כמו כן להתרחש כתוצאה מנזק חמצוני על ידי ROS. בנוסף, קטבוליזם מוגבר של פלזמלוגנים הוצע על ידי הממצא על ידי רמה מוגברת של האנזים PLA2 הספציפי ל-plasmalogen באזורי ה-nucleus basalis וההיפוקמפוס של מוחות AD (Farooqui וחב' ב-Adv Exp Med Biol משנת 2003, ו-Ong וחב' ב-Curr Med Chem משנת 2010). נתון זה תואם את ההגברה הנצפית ב-remodeling של ליפידים, כמו גם ברמות מופחתות של DHA וחומצה אראכידונית, בפרקציות מוחיות של plasmalogen. רמה מופחתת של plasmalogen עלולה להגביר את הנזק החמצוני ב-AD. רמה מוגברת של כולסטרול חופשי מגבירה את ייצור Aβ מ-amyloid precursor protein (APP), ואילו cholesterol esters מעודדים את הפירוק של APP לא-עמילואידוגני (Hartmann וחב' ב-J Neurochem משנת 2007). חסר של plasmalogen המתבטא ברמה מוגברת של כולסטרול חופשי, יעודד יצירה של Aβ. יתרה מכך, האיגור (aggregation) של Aβ יכול להיות מאופנן על ידי פלזמלוגנים. לבסוף, איבוד של פלזמלוגנים בחומר האפור, צפוי להשפיע באופן שלילי על המבנה והתפקוד של הסינפסה, וכתוצאה מכך לפגיעה בנוירו-טרנסמיסיה האופיינית ל-AD.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 