הבדלים בין גרסאות בדף "פנטרקסין - Pentraxin - 3"
| (14 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 44: | שורה 44: | ||
==PTX3 ומחלות נירולוגיות== | ==PTX3 ומחלות נירולוגיות== | ||
| − | רמות גבוהות של PTX3 כמרכיב העיקרי של pentraxins כרוכות בתמותה מוגברת לאחר שבץ-מוחי איסכמי, אך מנגנון הקשר הזה אינו ברור. בהתבסס על המנגנון דרכו CRP פועל בהתפתחות של טרשת עורקים, PTX3 עשוי להיות קשור להתפתחות התהליך הטרשתי, שהרי 2 מולקולות אלו חברות במשפחת העל של pentraxins (על פי Norata וחב' ב-Trends Cardiovasc Med משנת 2010). הראו בעכברים שרמת PTX3 מוגברת לאחר שהושרה בהם שבץ מוחי (Rodriguez וחב' ב-J Neurosci משנת 2014). בנוסף, דווח על תפקיד של תווך שממלא PTX3 באנגיוגנזיס וב-neurogenesis לאחר תרחיש של אי-ספיקה מוחי. ל-PTX3 יש גם השפעה מועילה של התאוששות של תפקוד מוטורי לטרלי (Rodriquez-Grande וחב' ב-J Neuroinflamm משנת 2015). בשנת 2012 דווחו Ryu וחב' ב-Atheriosclerosis ש-PTX3 היה מנבא חזק ובלתי-תלוי שת תמותה לטווח ארוך לאחר אירוע של שבץ איסכמי. מחקר של Wang וחב' ב-Mult Scler משנת 2013, בחן את רמות PTX3 במטופלים עם MS ובמטופלים עם neuromyelitis optica (להלן NM). ממצאי המחקר הראו מתאם סטטיסטי משמעותי בין רמות PTX3 לבין ה-Extended Disability Status Scale בחולי MS ובחולי NM במהלך של משבר במחלה. ממצא | + | רמות גבוהות של PTX3 כמרכיב העיקרי של pentraxins כרוכות בתמותה מוגברת לאחר שבץ-מוחי איסכמי, אך מנגנון הקשר הזה אינו ברור. בהתבסס על המנגנון דרכו CRP פועל בהתפתחות של [[טרשת עורקים]], PTX3 עשוי להיות קשור להתפתחות התהליך הטרשתי, שהרי 2 מולקולות אלו חברות במשפחת העל של pentraxins (על פי Norata וחב' ב-Trends Cardiovasc Med משנת 2010). הראו בעכברים שרמת PTX3 מוגברת לאחר שהושרה בהם שבץ מוחי (Rodriguez וחב' ב-J Neurosci משנת 2014). בנוסף, דווח על תפקיד של תווך שממלא PTX3 באנגיוגנזיס וב-neurogenesis לאחר תרחיש של אי-ספיקה מוחי. ל-PTX3 יש גם השפעה מועילה של התאוששות של תפקוד מוטורי לטרלי (Rodriquez-Grande וחב' ב-J Neuroinflamm משנת 2015). בשנת 2012 דווחו Ryu וחב' ב-Atheriosclerosis ש-PTX3 היה מנבא חזק ובלתי-תלוי שת תמותה לטווח ארוך לאחר אירוע של שבץ איסכמי. מחקר של Wang וחב' ב-Mult Scler משנת 2013, בחן את רמות PTX3 במטופלים עם MS ובמטופלים עם neuromyelitis optica (להלן NM). ממצאי המחקר הראו מתאם סטטיסטי משמעותי בין רמות PTX3 לבין ה-Extended Disability Status Scale בחולי MS ובחולי NM במהלך של משבר במחלה. ממצא נוסף הוא של Ceylan וחב' ב-Cephalalgia משנת 2015, בו נמצא שבנבדקים הסובלים מ[[מיגרנה]], דווקא אלה בהם התקפי המיגרנה היו ממושכים יותר, רמות PTX3 היו נמוכות יותר, מה שמעיד על פי בעלי המחקר על שינויים בתהליכים דלקתיים במהלך המפגע הזה. |
| − | |||
| − | |||
| + | ==PTX3 ומחלות דלקתיות== | ||
ידוע שמחלות ראומטיות סיסטמיות כרוכות בתהליכים טרשתיים מואצים. דלקת כרונית גורמת להתפתחות רובד טרשתי לפגיעה בתפקוד האנדותל. PTX3 יכול לשמש כלי מועיל לזיהוי מחלה ראומטית סיסטמית במטופלים בסיכון גבוה למחלות קרדיו-וסקולריות (Atzeni וחב' ב-Auto-immune Rev משנת 2010, ו-Hollan וחב' ב-Arthritis Care Res משנת 2010). | ידוע שמחלות ראומטיות סיסטמיות כרוכות בתהליכים טרשתיים מואצים. דלקת כרונית גורמת להתפתחות רובד טרשתי לפגיעה בתפקוד האנדותל. PTX3 יכול לשמש כלי מועיל לזיהוי מחלה ראומטית סיסטמית במטופלים בסיכון גבוה למחלות קרדיו-וסקולריות (Atzeni וחב' ב-Auto-immune Rev משנת 2010, ו-Hollan וחב' ב-Arthritis Care Res משנת 2010). | ||
| שורה 56: | שורה 55: | ||
ממצאים אלה הביאו למחקר של רמות PTX3 כאינדיקטור פרוגנוסטי של המחלה. Matsui וחב' ב-Arteriosclerosis משנת 2010, דווחו שרמות PTX3 הגבוהות מ-3.1 ננוגרם/מיליליטר ב-204 מטופלים נבדקים עם תעוקת חזה בלתי-יציבה ו-non-ST elevation MI, מנבאות את ההתרחשות של אירוע לבבי במהלך 6 החודשים הבאים, כולל מוות לבבי, אשפוז מחודש בגין אירוע כלילי חריף, או החמרה באי-ספיקת הלב, ואילו Latini וחב' הראו ב-Circulation משנת 2004, שרמת PTX3 מעל 10.73 ננוגרם/מיליליטר, יכולה לנבא תמותה תוך 3 שנים, בין אלה עם התקף-לב. | ממצאים אלה הביאו למחקר של רמות PTX3 כאינדיקטור פרוגנוסטי של המחלה. Matsui וחב' ב-Arteriosclerosis משנת 2010, דווחו שרמות PTX3 הגבוהות מ-3.1 ננוגרם/מיליליטר ב-204 מטופלים נבדקים עם תעוקת חזה בלתי-יציבה ו-non-ST elevation MI, מנבאות את ההתרחשות של אירוע לבבי במהלך 6 החודשים הבאים, כולל מוות לבבי, אשפוז מחודש בגין אירוע כלילי חריף, או החמרה באי-ספיקת הלב, ואילו Latini וחב' הראו ב-Circulation משנת 2004, שרמת PTX3 מעל 10.73 ננוגרם/מיליליטר, יכולה לנבא תמותה תוך 3 שנים, בין אלה עם התקף-לב. | ||
| − | PTX3 ואי-ספיקת לב | + | ==PTX3 ואי-ספיקת לב== |
| − | |||
חלבון זה נכרך כמנבא של תוצאים שליליים ב-196 מטופלים עם אי-ספיקת לב ומקטע פליטה נמוך מ-50%, במחקר שנמשך בממוצע 655 יום (Suzuki וחב' ב-Am Heart J משנת 2008). במחקר נוסף שהתמקד באלה עם אי-ספיקת לב ומקטע פליטה נורמלי, רמות PTX3 בפלזמה נמצאו אף הן מוגברות (3.26 ננוגרם/מיליליטר בממוצע), למרות שרמת BNP בהם הייתה נורמלית (Matsubara וחב' ב-J Am Coll Carediol משנת 2011). | חלבון זה נכרך כמנבא של תוצאים שליליים ב-196 מטופלים עם אי-ספיקת לב ומקטע פליטה נמוך מ-50%, במחקר שנמשך בממוצע 655 יום (Suzuki וחב' ב-Am Heart J משנת 2008). במחקר נוסף שהתמקד באלה עם אי-ספיקת לב ומקטע פליטה נורמלי, רמות PTX3 בפלזמה נמצאו אף הן מוגברות (3.26 ננוגרם/מיליליטר בממוצע), למרות שרמת BNP בהם הייתה נורמלית (Matsubara וחב' ב-J Am Coll Carediol משנת 2011). | ||
| − | PTX3 ומחלת מסתמי לב | + | ==PTX3 ומחלת מסתמי לב== |
| − | |||
במחקר של Naito וחב' ב-Am Heart J משנת 2010, בו נחקר הביטוי של PTX3 בחולים עם הצרות של המסתם האורטלי, או עם רגורגיטציה כתוצאה מפגיעה במסתמים, נמצאה עליה משמעותית ברמת PTX3. יתרה מכך, PTX3 נמצא מבוטא בעיקר במקרופאגים שהתגודדו במסתמים האורטלים של חולים אלה. | במחקר של Naito וחב' ב-Am Heart J משנת 2010, בו נחקר הביטוי של PTX3 בחולים עם הצרות של המסתם האורטלי, או עם רגורגיטציה כתוצאה מפגיעה במסתמים, נמצאה עליה משמעותית ברמת PTX3. יתרה מכך, PTX3 נמצא מבוטא בעיקר במקרופאגים שהתגודדו במסתמים האורטלים של חולים אלה. | ||
| − | מעורבות של PTX3 במחלות קרדיו-וסקולריות | + | ==מעורבות של PTX3 במחלות קרדיו-וסקולריות== |
| − | |||
מספר מחקרים בחנו מדוע רמת PTX3 מוגברת בתחלואה קרדיו-וסקולרית, ואלה מתוכם שהתמקדו בגן PTX3 בעכברים, הציעו שביטוי של PTX3 מוגבר כדי להגן מפני נזק לרקמה הלבבית (Norata וחב' ב-Circulation משנת 2009). במודל עכברים בו הושרה אוטם שריר הלב על ידי ליגציה של עורק כלילי, עכברי knockout ללא PTX3 הראו החמרה של הנזק הלבבי עם שטח מוגדל של no reflow והגברת התגובה הדלקתית כולל הסננה מוגברת של ניטרופילים, הקטנת מספר הקפילרות, והגדלת המספר של קרדיו-מיוציטים אפופטוטיים. ממצאים אלה נורמלו על ידי החדרת PTX3 אקסוגני. אגב, התופעה של no reflow היא הכשל של דם לזלח מחדש אזור איסכמי לאחר שהחסימה הפיזית הוסרה או נעקפה. | מספר מחקרים בחנו מדוע רמת PTX3 מוגברת בתחלואה קרדיו-וסקולרית, ואלה מתוכם שהתמקדו בגן PTX3 בעכברים, הציעו שביטוי של PTX3 מוגבר כדי להגן מפני נזק לרקמה הלבבית (Norata וחב' ב-Circulation משנת 2009). במודל עכברים בו הושרה אוטם שריר הלב על ידי ליגציה של עורק כלילי, עכברי knockout ללא PTX3 הראו החמרה של הנזק הלבבי עם שטח מוגדל של no reflow והגברת התגובה הדלקתית כולל הסננה מוגברת של ניטרופילים, הקטנת מספר הקפילרות, והגדלת המספר של קרדיו-מיוציטים אפופטוטיים. ממצאים אלה נורמלו על ידי החדרת PTX3 אקסוגני. אגב, התופעה של no reflow היא הכשל של דם לזלח מחדש אזור איסכמי לאחר שהחסימה הפיזית הוסרה או נעקפה. | ||
| שורה 76: | שורה 72: | ||
המחקר של Magueri וחב' מצא שהרמות המרביות של PTX3 בפלזמה, הושגו 6 שעות מתחילת האוטם. מעניין שהרמות הנמוכות ביותר של PTX3 נמצאו בניטרופילים של מטופלים בשלב המוקדם של AMI, ואילו הרמות הגבוהות ביותר התגלו בשיטה מיקרוסקופית בניטרופילים בשלבי AMI מאוחרים. יתרה מכך, נמצא ש-PTX3 המופרש במטופלים בשלבים מוקדמים של AMI, עובר צימות עם טסיות המבטאות P selectin, בהשוואה לשלבים המאוחרים של AMI. מנתונים אלה משתמע ש-PTX3 פועל להגנה על הלב, על ידי קישורו לטסיות משופעלות בצירקולציה, והפחתת הסטאטוס הדלקתי במצע הקרדיו-וסקולרי. נמצא שרמת PTX3 בפלזמה עלתה באופן משמעותי בתרחיש של דלקת מפושטת, כגון ספסיס (Mauri וחב' ב-Crit Care Med משנת 2008). בתסריטים אלה, תאי אנדותל, תאים דנדריטים ו/או מקרופאגים משופעלים, יכולים להיות מקור עיקרי של PTX3, ולמרות שהודגם ש-PTX3 מעכב ספיחת תאים התלויה ב-P selectin, יש כנראה מנגנונים נוספים שעדיין לא זוהו, התורמים לתכונות האנטי-דלקתיות שלו in vivo. | המחקר של Magueri וחב' מצא שהרמות המרביות של PTX3 בפלזמה, הושגו 6 שעות מתחילת האוטם. מעניין שהרמות הנמוכות ביותר של PTX3 נמצאו בניטרופילים של מטופלים בשלב המוקדם של AMI, ואילו הרמות הגבוהות ביותר התגלו בשיטה מיקרוסקופית בניטרופילים בשלבי AMI מאוחרים. יתרה מכך, נמצא ש-PTX3 המופרש במטופלים בשלבים מוקדמים של AMI, עובר צימות עם טסיות המבטאות P selectin, בהשוואה לשלבים המאוחרים של AMI. מנתונים אלה משתמע ש-PTX3 פועל להגנה על הלב, על ידי קישורו לטסיות משופעלות בצירקולציה, והפחתת הסטאטוס הדלקתי במצע הקרדיו-וסקולרי. נמצא שרמת PTX3 בפלזמה עלתה באופן משמעותי בתרחיש של דלקת מפושטת, כגון ספסיס (Mauri וחב' ב-Crit Care Med משנת 2008). בתסריטים אלה, תאי אנדותל, תאים דנדריטים ו/או מקרופאגים משופעלים, יכולים להיות מקור עיקרי של PTX3, ולמרות שהודגם ש-PTX3 מעכב ספיחת תאים התלויה ב-P selectin, יש כנראה מנגנונים נוספים שעדיין לא זוהו, התורמים לתכונות האנטי-דלקתיות שלו in vivo. | ||
| − | אי התלות של PTX3 בגורמי סיכון מוכרים | + | ==אי התלות של PTX3 בגורמי סיכון מוכרים== |
| − | + | רמות PTX3 בפלזמה נמצאו בלתי תלויות בגורמי סיכון כליליים אחרים, כגון סך-כולסטרול, [[LDL-כולסטרול]], [[המוגלובין A1C]], סטאטוס העישון, מגדר, obesity ו-IMT או Intimal median thickness. למרות ש-Yamashina וחב' ב-Hypertension Res משנת 2002, דווחו על סף של 14.0m/s באשר לשפיעת הדם בווריד הברכיאלי (Brachial-ankle pulse wave velocity או PWV), בסריקה של נבדקים בסיכון לפתח מחלות קרדיו-וסקולריות באוכלוסייה הכללית, רמות PTX3 אינן שונות בין אלה עם ערכי PWV גבוהים או נמוכים מ-14.0m/s, או בין אלה עם עובי האינטימה בעורקים הקרוטידיים, שהיא גבוהה או נמוכה מ-1 מ"מ. | |
| − | רמות PTX3 בפלזמה נמצאו בלתי תלויות בגורמי סיכון כליליים אחרים, כגון סך-כולסטרול, LDL-כולסטרול, המוגלובין A1C, סטאטוס העישון, מגדר, obesity ו-IMT או Intimal median thickness. למרות ש-Yamashina וחב' ב-Hypertension Res משנת 2002, דווחו על סף של 14.0m/s באשר לשפיעת הדם בווריד הברכיאלי (Brachial-ankle pulse wave velocity או PWV), בסריקה של נבדקים בסיכון לפתח מחלות קרדיו-וסקולריות באוכלוסייה הכללית, רמות PTX3 אינן שונות בין אלה עם ערכי PWV גבוהים או נמוכים מ-14.0m/s, או בין אלה עם עובי האינטימה בעורקים הקרוטידיים, שהיא גבוהה או נמוכה מ-1 מ"מ. | ||
| − | |||
| − | |||
| − | הפרומוטרים הקריבנים (proximal) של PTX3 באדם, מכילים אתרי קישור של IL-6, NF, Sp-1 Ap-1 ו-NF-κB, על פי Breiario ב-J Biol Chem משנת 2002). כתוצאה מכך, PTX3 מבוטא בתגובה לאיתותים מקדמי דלקת של חיידקים, של IL-1 (אך לא של IL-6), וכן איתותים של TNF-α המיוצרים על ידי תאי אנדותל, ניטרופילים ומקרופאגים. כתוצאה מכך, מחלות דלקתיות, ובעיקר מפגעים של מערכת החיסון, כגון rheumatoid arthritis (על פי Luchetti וחב' ב-Clin Exp Immunol משנת 2000), טרשת סיסטמית מתקדמת או PSS על פי Iwata וחב' ב-J Rheumatol משנת 2009, תסמונת Chug Straus, גרנולומטוזיס ע"ש Wegener ו-polyangitis מיקרוסקופית (Fazzini וחב' ב-Arthritis Rheumatism משנת 2001, כמו גם SIRS או systemic inflammatory response syndrome על פי Mauri וחב' ב-Intensive Care Medicine משנת 2010. כל המחלות הללו גורמות לרמות PTX3 מוגברות בפלזמה (Yilmaz וחב' ב-Am Soc Nephrol משנת 2011, ו-Tong וחב' באותו כתב עת משנת 2007). | + | ==PTX3 במחלות אחרות== |
| + | הפרומוטרים הקריבנים (proximal) של PTX3 באדם, מכילים אתרי קישור של IL-6, NF, Sp-1 Ap-1 ו-NF-κB, (על פי Breiario ב-J Biol Chem משנת 2002). כתוצאה מכך, PTX3 מבוטא בתגובה לאיתותים מקדמי דלקת של חיידקים, של IL-1 (אך לא של IL-6), וכן איתותים של [[TNF-α]] המיוצרים על ידי תאי אנדותל, ניטרופילים ומקרופאגים. כתוצאה מכך, מחלות דלקתיות, ובעיקר מפגעים של מערכת החיסון, כגון [[rheumatoid arthritis]] (על פי Luchetti וחב' ב-Clin Exp Immunol משנת 2000), טרשת סיסטמית מתקדמת או PSS (על פי Iwata וחב' ב-J Rheumatol משנת 2009), תסמונת Chug Straus, גרנולומטוזיס ע"ש Wegener ו-polyangitis מיקרוסקופית (Fazzini וחב' ב-Arthritis Rheumatism משנת 2001), כמו גם SIRS או systemic inflammatory response syndrome (על פי Mauri וחב' ב-Intensive Care Medicine משנת 2010). כל המחלות הללו גורמות לרמות PTX3 מוגברות בפלזמה (Yilmaz וחב' ב-Am Soc Nephrol משנת 2011, ו-Tong וחב' באותו כתב עת משנת 2007). | ||
| − | לכן היה מעניין לקבוע את רמות PTX3 במחלות מעי דלקתיות (IBD) | + | לכן היה מעניין לקבוע את רמות PTX3 במחלות מעי דלקתיות (IBD) כ[[מחלת קרוהן]] ו[[קוליטיס כיבית]]. כיוון ש-IL-6 נמצא מוגבר במחלת קרוהן פעילה, אך לא בקוליטיס כיבית, אין הפתעה בממצא שרמות PTX3 נמצאו מוגברות רק בחולים עם קוליטיס כיבית, שכן IL-1 ולא IL-6, משרה ביטוי של PTX3. נראה ש-PTX3 יכול לשמש מדד אבחוני טוב להחמרת המצב של חולים עם IBD (על פי Kato וחב' ב-Digest Dis Sci משנת 2008, ו-Savchenko וחב' ב-Pathol Int משנת 2011). |
כיוון ש-PTX3 מגיב באופן בסיסי עם C1q שהוא המרכיב הראשון של ה-cascade הקלאסי של המשלים, והוא מסוגל להשרות דלקת חריפה או כרונית על ידי סוגי תאים הטרוגניים באיברים רבים, יש ל-PTX3 תפקודים ביולוגיים פלאומורפיים. PTX3 יכול להיכרך עם אי-תפקוד אנדותליאלי, עם מפגעים מטבוליים הגורמים ל-obesity, ריפוי פצעים, מחלות ראומטיות, ודיכוי מחלות סרטניות על ידי פעילותו האנטי-אנגיוגנית (Doni וחב' ב-Seminars in Immunol משנת 2016, Slusher וחב' ב-Mediators Inflamm משנת 2017 ו-Augusto וחב' ב-Int Rev Immunol משנת 2017). ל-PTX3 יש השפעות שונות על ידי עידוד או עיכוב סוגי סרטן שונים (Giacomini וחב' ב-Biochim Biophys Acta משנת 2018). | כיוון ש-PTX3 מגיב באופן בסיסי עם C1q שהוא המרכיב הראשון של ה-cascade הקלאסי של המשלים, והוא מסוגל להשרות דלקת חריפה או כרונית על ידי סוגי תאים הטרוגניים באיברים רבים, יש ל-PTX3 תפקודים ביולוגיים פלאומורפיים. PTX3 יכול להיכרך עם אי-תפקוד אנדותליאלי, עם מפגעים מטבוליים הגורמים ל-obesity, ריפוי פצעים, מחלות ראומטיות, ודיכוי מחלות סרטניות על ידי פעילותו האנטי-אנגיוגנית (Doni וחב' ב-Seminars in Immunol משנת 2016, Slusher וחב' ב-Mediators Inflamm משנת 2017 ו-Augusto וחב' ב-Int Rev Immunol משנת 2017). ל-PTX3 יש השפעות שונות על ידי עידוד או עיכוב סוגי סרטן שונים (Giacomini וחב' ב-Biochim Biophys Acta משנת 2018). | ||
| שורה 90: | שורה 84: | ||
מחקר של Sukiman וחב' ב-J Am Soc Nephrol משנת 2008, מצא שרמות PTX3 כרוכות באופן בלתי תלוי באי-תפקוד אנדותליאלי, באוכלוסיית חולים עם מחלת כליות סופנית (ESKD), והציעו לעשות שימוש ב-PTX3 כסמן לנזק וסקולרי היקפי. בדומה, מספר קבוצות שפכו אור על היחס בין PTX3 לבין מחלות רשתית כגון AMD, וחסימה וסקולרית של הרשתית (Min וחב' ב-Ocul Immunol Inflamm משנת 2014, Noma וחב' ב- JAMA Ophthalmol משנת 2013 ו-Park וחב' ב-Korean J Ophthalmol משנת 2014). | מחקר של Sukiman וחב' ב-J Am Soc Nephrol משנת 2008, מצא שרמות PTX3 כרוכות באופן בלתי תלוי באי-תפקוד אנדותליאלי, באוכלוסיית חולים עם מחלת כליות סופנית (ESKD), והציעו לעשות שימוש ב-PTX3 כסמן לנזק וסקולרי היקפי. בדומה, מספר קבוצות שפכו אור על היחס בין PTX3 לבין מחלות רשתית כגון AMD, וחסימה וסקולרית של הרשתית (Min וחב' ב-Ocul Immunol Inflamm משנת 2014, Noma וחב' ב- JAMA Ophthalmol משנת 2013 ו-Park וחב' ב-Korean J Ophthalmol משנת 2014). | ||
| − | רמות מוגברות של PTX3 בפלזמה קשורות להתפתחות ולהתקדמות של diabetic retinopathy בחולים קוריאנים עם סוכרת type 2: | + | ==רמות מוגברות של PTX3 בפלזמה קשורות להתפתחות ולהתקדמות של diabetic retinopathy בחולים קוריאנים עם סוכרת type 2== |
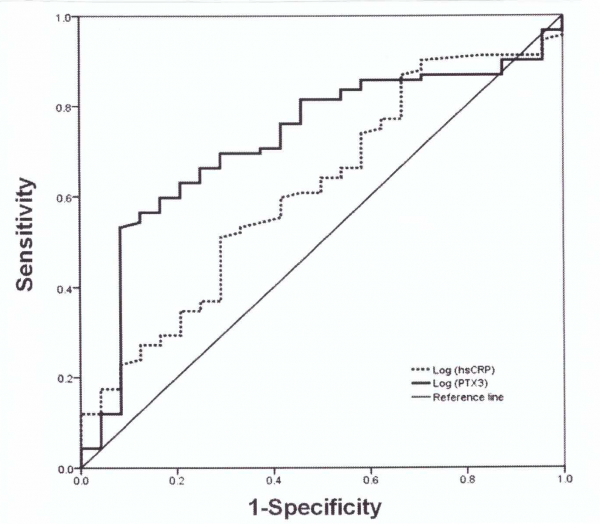
| + | מחקר של Yang וחב' ב-Sci Invest Ophthalmol Visual משנת 2014, בחן את הקשר בין רמות מוגברות של PTX3 בפלזמה לבין התפתחות או התקדמות של [[diabetic retinopathy]] (להלן DR). בקבוצה 1 השתתפו 92 חולי [[סוכרת]] עם DR, בקבוצה 2 נכללו 30 חולי סוכרת ללא DR, וקבוצה 3 כללה 41 נבדקים בריאים. תוצאות המחקר היו כדלקמן: רמת PTX3 הממוצעת בקבוצה 1 הייתה 1,817.9 פיקוגרם/מ"ל, בקבוצה 2 רמת PTX3 נקבעה כ-1,093 פיקוגרם/מ"ל ואילו בקבוצה 3 רמת חלבון זה נקבעה כ-916.1 פיקוגרם/מ"ל. באנליזה של תת-הקבוצות נמצא שערכי log PTX3 גדלו במתאם עם החומרה של DR (r=0.372, p<0.001). עקומות ROC של התפתחות DR סומנו תוך שינוי בערכי log PTX3 ו-log hsCRP, והשטח תחת העקומה (AUC) נמצא כ-0.721 (p=0.001), ו-0.614 (p=0.087), בהתאמה. מסקנות מחקר זה היו שרמת PTX3 בפלזמה תואמת באופן חיובי את התפתחות רטינופתיה סוכרתית, ויכולה לשמש מנבא מדויק יותר של התפתחות מפגע זה בהשוואה ל-hsCRP. | ||
| − | + | [[קובץ:PTX3-1.png|ממוזער|מרכז|600 פיקסלים|ערכי ROC עבור log PTX3 ו-log hsCRP לניבוי נוכחות של רטינופתיה סוכרתית בחולי סוכרת type 2]] | |
| − | + | ==רמות PTX3 בפלזמה ב-SLE== | |
| + | משפחת העל של pentraxins המתחלקת ל-PTX3 ארוכים וקצרים, יכולה להיות מושרית על ידי גירויים דלקתיים אחדים (Lech וחב' ב-PLos One משנת 2011). ה-PTXs הקלאסיים הקצרים הם CRP ו-serum amyloid protein או SAP, ואילו PTX3 וה-pentraxins הארוכים הם בעלי מבנה ציקלי (Deban וחב' ב-Cell Tissue Res משנת 2011). רמות מוגברות של PTX3 בצירקולציה נמצאו במספר מחלות אוטו-אימוניות כגון צליאק, vasculitis ואחרים. | ||
| − | + | למרות מספר מחקרים בנושא, יש נתונים סותרים באשר ל-PTX3 בחולי SLE, ומחקרם של Assandri וחב' נועד להבהיר קשר אפשרי זה. במחקר שותפו 64 חולי SLE ו-60 אנשים בריאים, תואמי-גיל ( ממוצע 46.8 שנה בחולי SLE ו-41.8 שנה בנבדקים הבריאים), וכן 87.5% נשים חולות SLE, לעומת 90% נשים בריאים. חולי SLE חולקו ל-3 קבוצות של SLEDAI (או SLE disease activity index) על פי דרגת פעילות המחלה (Gladman ו-Urowitz ב-Lupus משנת 1999). בין 64 חולי לופוס נכללו 18 בקטגוריה של מחלה לא-פעילה (SLEDAI<4), 32 חולים עם מחלה פעילה נכללו ב-SLEDAI<10, ועוד 14 חולי לופוס עם מחלה מאוד פעילה בקטגוריה של SLEDAI>10. | |
| − | + | תוצאות המחקר הן כדלקמן: מחקר זה הראה שרמות PTX3 בחולי SLE גבוהות משמעותית מרמות חלבון זה בנבדקים הבריאים והן אף שיקפו את פעילות המחלה. בקרב חולי SLE רמות PTX3 נעו בין 1,180 ל-95,100 פיקוגרם/מיליליטר, עם ערך ממוצע של 14,000 פיקוגרם/מיליליטר. בקבוצת הביקורת של הבריאים רמות PTX3 נעו בין 200 ל-4,800 פיקוגרם/מיליליטר, עם ערך ממוצע של 2,400 פיקוגרם/מיליליטר. נראה אם כן שרמות PTX3 בחולי SLE גבוהים משמעותית מאלה באנשים בריאים (p<0.001). ריכוז הסף (cutoff) של PTX3 בין חולי לופוס פעילים לבין נבדקים בריאים, נקבע כ-2,800 פיקוגרם/מיליליטר, ובערך סף זה רגישות השיטה היא 100% והספציפיות שלה היא 80%, עם ערך ניבוי שלילי (NPV) של 100%, וערך ניבוי חיובי (PPV) של 76%. דרגת הדיוק עם ערך סף זה היא של 88%. | |
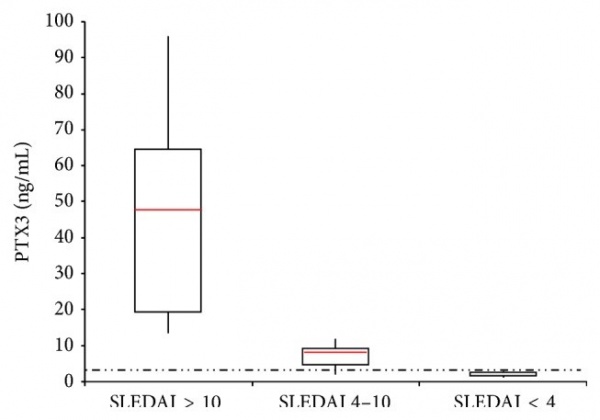
| − | + | [[קובץ:PTX3-2.jpg|ממוזער|מרכז|600 פיקסלים|תיאור גרפי של הממצאים של מחקר זה{{ש}}רמות PTX3 בפלזמה בשלוש הקטגוריות של SLEDAI . הקו המקוטע מייצג את ערך הסף של 2.8 ננוגרם/מיליליטר.]] | |
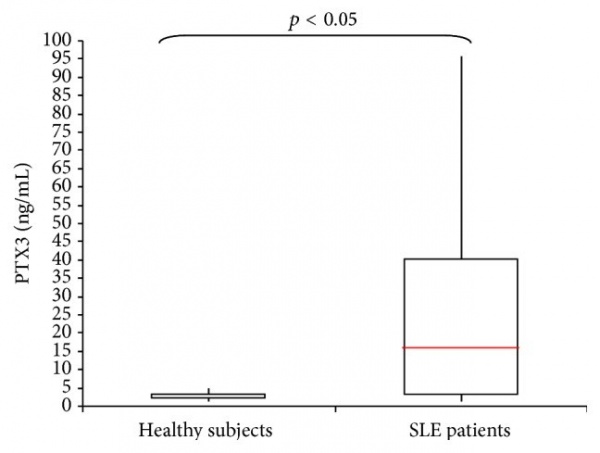
| − | + | [[קובץ:PTX3-3.jpg|ממוזער|מרכז|600 פיקסלים|רמות PTX3 בפלזמה של חולי לופוס לעומת אנשים בריאים.]] | |
| − | |||
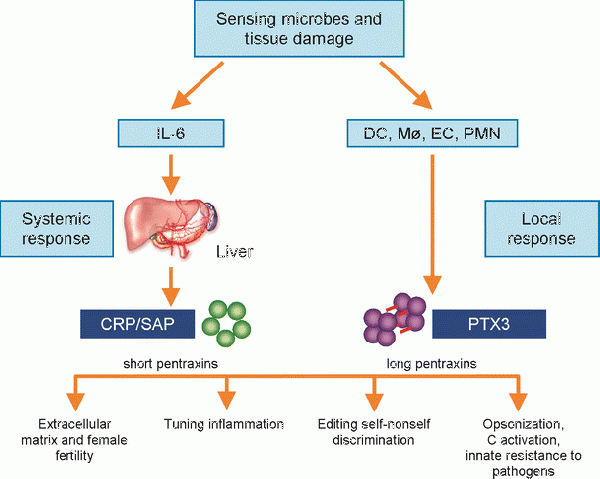
| − | + | [[קובץ:PTX3-4.gif|ממוזער|מרכז|600 פיקסלים|PTX3 והחסינות הטבעית (innate immunity)]] | |
| − | + | ==הוראות לביצוע הבדיקה== | |
| + | דימות הדם נאספו לאחר לפחות פרק זמן של 4 שעות של צום, למבחנה כימית (פקק אדום או צהוב). לאחר הסרכוז, הנסיוב נשמר בטמפרטורה של -75ºC. | ||
| − | + | ==ראו גם== | |
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[אבחון מחלות שונות|בדיקות מעבדה - אבחון מחלות שונות]] | ||
| + | * [[בדיקות ביוכימיות|בדיקות מעבדה - בדיקות ביוכימיות]] | ||
| − | |||
| − | + | {{ייחוס בן עמי}} | |
| − | + | [[קטגוריה:בדיקות מעבדה - אבחון מחלות שונות]] | |
| + | [[קטגוריה: בדיקות מעבדה - בדיקות ביוכימיות]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
גרסה אחרונה מ־06:24, 5 במאי 2019
| מדריך בדיקות מעבדה | |
| פנטרקסין 3 | |
|---|---|
| Pentraxin 3 | |
| שמות אחרים | PTX3, TNFAIP5, TSG-14 או TNF inducible gene 14 protein |
| מעבדה | כימיה בדם |
| תחום | סמן למגוון מצבים פתולוגיים. |
| טווח ערכים תקין | פחות מ-2 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
המבנה של PTX3
החלבון PTX3 המשועתק מכיל 381 חומצות אמינו, עם משקל מולקולרי מוערך של 40,165 דלטון, כאשר הקצה הקרבוקסי טרמינלי שלו מכיל 203 חומצות אמינו, והמקטע האמינו טרמינלי שלו מכיל 178 חומצות אמינו. חלבון זה משומר באופן בולט בין עכברים ובני-אדם, עם הומולוגיה של 82% של חומצות אמינו זהות, ו-92% של חומצות אמינו שמורות.
PTX3 מאופיין על ידי מבנה ציקלי מולטימרי (Mantovani וחב' ב-J Clin Immunol משנת 2008). חלבון זה מיוצר ברקמות היקפיות ומבטא פגיעה בתפקוד של האנדותל הווסקולרי. PTX3 מעכב אנגיוגנזיס, מעודד היצרות-מחדש (re-stenosis), ומגביר את היצירה של רבדים טרשתיים, על ידי עיכוב של פעולת fibroblast growth factor 2 (על פי Shindo וחב' ב-PLos One משנת 2014, Leali וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2012, ו-Leali וחב' ב-J Cell Mol Med משנת 2010). במנגנון זה, PTX3 מעכב את הקישור של FGF2 לקולטנים של תאי האנדותל, ונראה שעל ידי האינטראקציה של PTX3/FGF2 מושפע תהליך האנגיוגנזיס, במצבים פתו-פיזיולוגיים שונים, חיסון טבעי (innate immunity) ו/או התמרה סרטנית (Rusnati וחב' ב-Blood משנת 2004). כמו כן, נמצא ש-PTX3 הוא סמן רגיש לריאקציות מקומיות של דלקת, במחלות קרדיו-וסקולריות וכלייתיות (Hamad וחב' ב-Acta Obstet Gynecol Scand משנת 2012, Zhou וחב' ב-Vasc Med משנת 2013, Nakajima וחב' ב-Eur J Applied Physiol משנת 2010, Kocyigit וחב' ב-J Nephrol משנת 2014, ו-Hudzik וחב' J Interferon Cytokine Res משנת 2013).
הגן PTX3 מורכב מ-3 אקסונים, כאשר שניים מהם מקודדים ל-signal peptie ולמקטע ה-N טרמינלי (חומצות אמינו 18–179), בהתאמה. האקסון השלישי מקודד למקטע ה-C טרמינלי (חומצות אמינו 179–381) (על פי Bottazzi וחב' ב-J Biol Chem משנת 1997). ה-promoters של PTX3 מכילים אלמנטים מגבירי קישור, שמחזקים את הזיקה וההתקשרות של PTX3 למבני היעד שלו, כגון activator protein-1 או (AP-1), כמו גם nuclear factor-κB (או NF-κB), וכן selective promoter factor 1 (או SP1). בקצרה, AP-1 מעודד את הביטוי של PTX3, ואילו אתר הקישור של NF-κB פעיל בתגובה לציטוקינים הדלקתיים TNF-α ו-IL-1β. בתאי אנדותל, הביטוי של PTX3 מושרה על ידי TNF-α ו-IL-1β (על פי Kunes וחב' ב-Mediators Inflamm משנת 2012). ה-pentraxins יוצרים משפחת-על של חלבונים רב-תפקודיים, ששומרו פילוגנית מיצורים ארכנידים עד ליונקים.
משפחת העל של pentraxins יוצאת דופן על ידי הקצה ה-C טרמינלי שלה, המורכב ממקטע של בערך 200 חומצות אמינו, המכיל motif משומר ביותר עם רצף חומצות אמינו המכונה pentraxin signature שהרכבו HxCxS/TWxS עם שני שיירי ציסטאין בעמדות 210 ו-271. בעמדות המסומנות כ-x יכולים להופיע חומצות אמינו כלשהן. המקטע הקרבוקסי טרמינלי משותף ב-57% עם חומצות אמינו שמורות ו-17% של חומצות אמינו זהות לאלה שמוצאים ב-pentraxins קצרים. בהתבסס על ההרכב הראשוני של ה-promoter, ה-pentraxins יכולים להסתעף לשתי קבוצות: pentraxins קצרים או ארוכים (Bottazzi וחב' ב-Ann Rev Immunol משנת 2010). הראשון מבין ה-pentraxins הארוכים שזוהה היה PTX3 בו ה-module ה-C טרמינלי מחובר עם מקטע N-טרמינלי . PTX3 שונה מה-pentraxins הקלאסיים. השוני שלו מה-pentraxins הקצרים הוא במבנה ובמיקום של הגן המקודד, בזיהוי הליגנד, בסוג התאים המייצרים אותם, ובאיתותים שהם משגרים (Inoue וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2007). הנוכחות של שרשרת סוכרית הקשורה לחומצת האמינו Asp220 במקטע הקרבוקסי-טרמינלי של PTX3, היא הסיבה למשקל המולקולרי של 45,000 דלטון של PTX3, השונה מהמשקל המולקולרי של 40,000 דלטון על בסיס הרכב חומצות האמינו. בתנאים טבעיים, הפרוטומרים של PTX3 מתלכדים ליצירת מולטימרים. המבנה הגבישי של PTX3 עדיין לא נקבע אך ההנחה היא שכמעט כל הסגמנטים של ה-β-strands וה-α helical starands, שמורים (Introna וחב' ב-Blood משנת 1996).
ספציפיות הקישור לליגנדים
הכישורים הרב-תפקודיים של PTX3 יכולים להיות מוסברים בחלקם על ידי יכולת PTX3 להיקשר למספר ליגנדים שונים, תכונה הדומה לזו של petraxins קצרים דוגמת CRP ו-SAP. רשימה חלקית של ליגנדים אלה כוללת את מרכיבי המשלים C1q ו- factor H כמו גם L-ficolin, את חלבוני המשתית החוץ-תאיים (ECM) דוגמת TSG-6 ו-inter-α-trypsin inhibitor (או IalfaI), את פקטור הגדילה FGF2, את המרכיב הממברנלי הבקטריאלי KpOMPA, את התאים האפופטוטיים, וכן את הפתוגנים השונים כחיידקים, נגיפים, שמרים ופטריות (דוגמת A. fumigatus).
מרכיב המשלים C1q הוא הליגנד הראשון והמאופיין ביותר מבין הליגנדים הנקשרים על ידי PTX3 (על פי Bottazzi וחב' ב-J Biol Chem משנת 1997, ו-Nauta וחב' ב-Eur J Immunol משנת 2003). נמצא ש-PTX3 נקשר ל-C1q הצמוד למשטח פלסטי, בהיקשר ל"ראש" הגלובולרי של C1q הידוע כ-gC1q, ובמיוחד לשיירים הטעונים הממוקמים בשִׂיא המולקולה תוך מעורבות של כל שלוש השרשרות של C1q, דהיינו gC1qB, gC1qA ו-gC1qC (על פי Roumenina וחב' ב-Biochemistry משנת 2006). באותם תנאים ניסויים, PTX3 אינו מגיב עם מרכיבים אחרים של מערכת המשלים כגון C4, C3 ו-C4bP. בעוד ש-CRP ו-SAP מגיבים באופן אופטימלי עם C1q רק לאחר שלב של צילוב כימי (Hicks וחב' ב-J Immunol משנת 1992), ההתקשרות של PTX3 ל-C1q אינה תלויה בצימות מוקדם, כנראה כתוצאה מיציבות המבנה ה-multimeric. קישור PTX3 ל-C1q בפאזה נוזלית מעכב את שפעול המשלים על ידי חסימה של אתרי קישור רלוונטיים.
שיעור הגליקוזילציה של PTX3 משפיע על האינטראקציה בינו לבין C1q, ושפעול המשלים הנובע מכך, כפי שהודגם בכך שהסרת חומצה סיאלית שהיא סוכר הקצה של השרשרת הסוכרית, או הסרה של כל השרשרת הסוכרית של PTX3 מגבירים את יכולת הקישור של האחרון ל-C1q (על פי Infporzato וחב' ב-Biochemistry משנת 2006). בשנת 1999 הראו Jarva וחב' ב-J Immunol, ש-CRP יכול לגרום למודולציה של המסלול האלטרנטיבי של שפעול המשלים על ידי האינטראקציה עם פקטור H שהוא הווסת המסיס העיקרי של המסלול האלטרנטיבי. נתונים ראשוניים מראים שגם PTX3 יכול להיקשר לפקטור H, מה שמצביע על תפקיד כללי ומורכב יותר של PTX3 בפיקוח על תפקודי המשלים.
הכרת פתוגנים או תאים אפופטוטיים על ידי PTX3
בדומה ל-CRP ול-SAP, גם PTX3 נקשר לתאים אפופטוטיים, בשלבים הסופיים של אפופטוזיס, וכך הוא מעכב את הכרתם של תאים אלה על ידי תאים דנדריטים (Rovere וחב' ב-Blood משנת 2000). נמצא ש-PTX3 נקשר למקטע ייחודי בממברנת תאים אפופטוטיים, אם כי מקטע זה עדיין לא זוהה. PTX3 יכול להיקשר ל-histones, מה שמעלה אפשרות של התקשרות חלבון זה למרכיבים גרעיניים. ליגנדים נוספים אליהם יכול PTX3 להיקשר, כולל פקטורי גדילה, מרכיבים של ECM, מרכיבי ממברנה של חיידקים וכן פתוגנים שונים, אך הוא אינו נקשר לליגנדים קלאסיים של ה-pentraxins הקצרים CPP ו-SAP, כגון phosphocoline, phosphoethanolamine, וכן לציטוקינים וכימוקינים שונים (Rusnati וחב' ב-Blood משנת 2004). למרות ש-PTX3 נקשר ל-fibroblast growth factor 2, הוא אינו נקשר לחברים אחרים של משפחת FGF, כגון FGF1, ו-FGF4. אתר הקישור של FGF2 על פני PTX3, מוּפּה במקטע ה-N טרמינלי של PTX3, על ידי הדגמה בעזרת מקטעים N ו-C-טרמינליים רקומביננטיים של PTX3, שבוטאו ובודדו מתאי CHO (על פי Camozzi וחב' ב-J Biol Chem משנת 2006). שני הפפטידים הסינתטיים (82–110) PTX3 ו-(PTX3 (97-110, באזור ה-N-טרמינלי של PTX3, היו מסוגלים לעכב את קישור PTX3 ל-FGF2 שעבר אימוביליזציה, מה שמאשר שאתר הקישור ל-FGF2 ממוקם במקטע ה-N-טרמינלי של PTX3 בין חומצות אמינו 97–110. PTX3 אינו נקשר לקולאגן IV, לפיברונקטין, ל-laminin, ולחומצה היאלורונית (Salustri וחב' ב-Development משנת 2004).
כמו CRP ו-SAP, כן גם PTX3 יכול להגיב עם מספר פּתוגנים שונים: חיידקים, שמרים ונגיפים. קישור ספציפי זוהה לחיידקים גראם-חיוביים וגראם-שליליים, כולל Staph aureus, וכן ,Pseudomonas aeruginosa, Klebsiella pneumoniae, Streptococcus pneumoniae, Neisseria meningitis ו- Salmonella typhimurium (על פי Jeannin וחב' ב-Immunity משנת 2005, ו-Garlanda וחב' ב-Nature משנת 2002). בנוסף, PYTX3 יכול להיקשר ל-zymosan, ל-Paracoccidioides brasiliensis ול-conidia של Aspergillus fumigatus (על פי Diniz וחב' ב-J Leukoc Biol משנת 2004). כמו כן, PTX3 מזהה את הנגיף cytomegalo מאדם ומעכברים, כמו גם את הזן H3N2 של נגיף ה-influenza אך לא את הזן H1N1 (על פי Bozza וחב' ב-Blood משנת 2006). ה-pentraxins הם מולקולות דמויות לקטינים, והאינטראקציה בין CRP ו-SAP עם סוכרים מתועדת היטב. השאלה עלתה האם גם PTX3 מסוגל להיקשר לשיירים סוכריים. סקירה ראשונית של glycoarray העלתה אינטראקציה מתונה עם שייר LacNAc של גנגליוזידים, אך דרושים ניסויים נוספים לתאר טוב יותר את האינטראקציה של PTX3 עם glucans.
בניסיון לאפיין את המבנים המולקולריים ש-PTX3 מזהה על פני השטח של הפתוגנים השונים, נמצא ש-PTX3 אינו נקשר לליפופוליסכרידים (LPS), וכן אינו נקשר ל-lipotheicoic acid או LTA, ובנוסף אינו נקשר ל-enterotoxin A ול-enterotoxin B, ל-exotoxin A, או ל-N-acetylmuramyl-L-alanyl-D-isoglutamine או MDP, אך הוא נקשר ל-protein A שבממברנה החיצונית של Klebsiella pnemoniae (או KpOmpA) שהוא מרכיב עיקרי בממברנה החיצונית של חיידקים גראם-שליליים המשומרים באוד במשפחת ה-enterobacteriaceae.
בעוד שהאינטראקציה של ה-pentraxins הקצרים CRP ו-SAP עם הליגנדים שלהם תלויים בנוכחות סידן (Szalai וחב' ב-Clin Chem Lab Med משנת 1999), נמצא ש-PTX3 חסר אתר קואורדינציה עם סידן, ולכן יוני סידן אינם דרושים לאינטראקציה של PTX3 עם C1q. עם זאת, עם הגילוי של ליגנדים אחרים של PTX3, נראה שלא מדובר בנתון כללי הנוגע לקישורו של PTX3 לכלל הליגנדים. אכן, נוכחות סידן נדרשת בהתקשרות של PTX3 ל-FGF2, ל-KpOmpA, ל-factor H, ל-TSG-6 ול-IalfaI. לעומת זאת, סידן אינו דרוש לאינטראקציה של PTX3 עם תאים אפופטוטיים, או עם ה-Condia של Aspergillus ושל נגיף ה-influenza.
PTX3 בדם
PTX3 מגיב כחלבון acute phase שרמתו בדם אדם בתנאים נורמליים נמוכה מ-2 ננוגרם/מ"ל, עולה במהירות ובאופן דרמטי כ-6–8 שעות לאחר הגירוי הראשוני, לרמות של 200–800 ננוגרם/מ"ל, במהלך של הלם אנדוטוקסי, ספסיס ומצבים של דלקת או זיהום, כאשר רמת PTX3 נמצאת במתאם עם חומרת התרחיש. בתנאים אלה, PTX3 הוא סמן מהיר לשפעול ראשוני מקומי של חסינות טבעית (innate immunity) ודלקת (Muller וחב' ב-Crit Care Med משנת 2001, Fazzini וחב' ב-Arthritis Rheum משנת 2001, Latini וחב' ב-Circulation משנת 2004, Azzuri וחב' ב-Microbe Infection משנת 2005 ו-Mairuha וחב' ב- J Med Virol משנת 2005).
הרמות הפיזיולוגיות של PTX3
הריכוזים הפיזיולוגיים הנורמליים של PTX3 בפלזמה, נקבעו כ-2 ננוגרם/מיליליטר או למטה מכך במחקר שמדד רמות PTX3 בפלזמה של 1,749 נבדקים בריאים ביפן (818 גברים ו-931 נשים) ונערך על ידי Yamasaki וחב' ב-Cln Chem Lab Med משנת 2009). רמות PTX3 בגברים נמצאו נמוכות משמעותית בהשוואה לרמת מדד זה בנשים (1.87 לעומת 2.12 ננוגרם/מיליליטר, בהתאמה, (0.0001p<). רמת PTX3 נמצאה גם גבוהה יותר משמעותית בנשים וגברים בגיל המתקדם: בנשים, ברביעון הגיל העליון-2.14 ננוגרם/מיליליטר, לעומת 1.62 ננוגרם/מיליליטר בנשים ברביעון הגיל התחתון (p<0.001). בגברים ברביעון הגיל העליון-2.23 ננוגרם/מיליליטר, בהשוואה לרמה ממוצעת של PTX3 בגברים ברביעון הגיל התחתון-2.05 ננוגרם/מיליליטר (p<0.05). רמות PTX3 נמצאו גם במתאם הופכי עם רמות טריגליצרידים (r=0.19 בגברים, ו-r=0.18 בנשים, 0.00001>p). כן נמצא שרמות PTX3 הן בתאום הופכי עם מדד מסס הגוף (BMI), כאשר בגברים r=0.16, ובנשים r=0.24, עם משמעות של 0.00001p<).
PTX3 ומחלות נירולוגיות
רמות גבוהות של PTX3 כמרכיב העיקרי של pentraxins כרוכות בתמותה מוגברת לאחר שבץ-מוחי איסכמי, אך מנגנון הקשר הזה אינו ברור. בהתבסס על המנגנון דרכו CRP פועל בהתפתחות של טרשת עורקים, PTX3 עשוי להיות קשור להתפתחות התהליך הטרשתי, שהרי 2 מולקולות אלו חברות במשפחת העל של pentraxins (על פי Norata וחב' ב-Trends Cardiovasc Med משנת 2010). הראו בעכברים שרמת PTX3 מוגברת לאחר שהושרה בהם שבץ מוחי (Rodriguez וחב' ב-J Neurosci משנת 2014). בנוסף, דווח על תפקיד של תווך שממלא PTX3 באנגיוגנזיס וב-neurogenesis לאחר תרחיש של אי-ספיקה מוחי. ל-PTX3 יש גם השפעה מועילה של התאוששות של תפקוד מוטורי לטרלי (Rodriquez-Grande וחב' ב-J Neuroinflamm משנת 2015). בשנת 2012 דווחו Ryu וחב' ב-Atheriosclerosis ש-PTX3 היה מנבא חזק ובלתי-תלוי שת תמותה לטווח ארוך לאחר אירוע של שבץ איסכמי. מחקר של Wang וחב' ב-Mult Scler משנת 2013, בחן את רמות PTX3 במטופלים עם MS ובמטופלים עם neuromyelitis optica (להלן NM). ממצאי המחקר הראו מתאם סטטיסטי משמעותי בין רמות PTX3 לבין ה-Extended Disability Status Scale בחולי MS ובחולי NM במהלך של משבר במחלה. ממצא נוסף הוא של Ceylan וחב' ב-Cephalalgia משנת 2015, בו נמצא שבנבדקים הסובלים ממיגרנה, דווקא אלה בהם התקפי המיגרנה היו ממושכים יותר, רמות PTX3 היו נמוכות יותר, מה שמעיד על פי בעלי המחקר על שינויים בתהליכים דלקתיים במהלך המפגע הזה.
PTX3 ומחלות דלקתיות
ידוע שמחלות ראומטיות סיסטמיות כרוכות בתהליכים טרשתיים מואצים. דלקת כרונית גורמת להתפתחות רובד טרשתי לפגיעה בתפקוד האנדותל. PTX3 יכול לשמש כלי מועיל לזיהוי מחלה ראומטית סיסטמית במטופלים בסיכון גבוה למחלות קרדיו-וסקולריות (Atzeni וחב' ב-Auto-immune Rev משנת 2010, ו-Hollan וחב' ב-Arthritis Care Res משנת 2010).
הייתה השערה שתאים דנדריטים לא-בשלים מיאלואידים הם התאים השולטים בייצור PTX3. אך בהמשך נמצא שגם אוכלוסיות תאים אחרים מייצרים PTX3 כגון מונוציטים/מקרופאגים, תאי שריר חלק, תאי אפיתל כלייתיים, תאי סינוביום, כונדרוציטים, אדיפוציטים, תאי אפיתל אלבאולריים בריאות, תאי גליה, פיברובלסטים, ותאי אנדותל (Introna וחב' ב-Blood משנת 1996). בתאי אנדותל, הביטוי של PTX3 מושרה על ידי TNF-α ועל ידי IL-1β, לכן תאי האנדותל הופכים מתאים "רגועים" ונוגדי דלקת, לתאים תומכי קרישה ודלקת (Kunes וחב' ב-Mediators Inflamm משנת 2012).
בדומה, במודל של התקף-לב בעכברים, ה-mRNA של PTX3, בא לביטוי 4 שעות לאחר החסימה היזומה של העורק הכלילי, מגיע לשיאו כעבור 24 שעות, וחוזר לרמה הנורמלית כעבור 3 ימים (Salio וחב' ב-Circulation משנת 2008). כמו כן נמצא שרמות PTX3 בפלזמה היו מוגברות ב-16 מטופלים עם תעוקת חזה בלתי-יציבה, עם רמה ממוצעת של 6.2 ננוגרם/מיליליטר (Inoue וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2002).
ממצאים אלה הביאו למחקר של רמות PTX3 כאינדיקטור פרוגנוסטי של המחלה. Matsui וחב' ב-Arteriosclerosis משנת 2010, דווחו שרמות PTX3 הגבוהות מ-3.1 ננוגרם/מיליליטר ב-204 מטופלים נבדקים עם תעוקת חזה בלתי-יציבה ו-non-ST elevation MI, מנבאות את ההתרחשות של אירוע לבבי במהלך 6 החודשים הבאים, כולל מוות לבבי, אשפוז מחודש בגין אירוע כלילי חריף, או החמרה באי-ספיקת הלב, ואילו Latini וחב' הראו ב-Circulation משנת 2004, שרמת PTX3 מעל 10.73 ננוגרם/מיליליטר, יכולה לנבא תמותה תוך 3 שנים, בין אלה עם התקף-לב.
PTX3 ואי-ספיקת לב
חלבון זה נכרך כמנבא של תוצאים שליליים ב-196 מטופלים עם אי-ספיקת לב ומקטע פליטה נמוך מ-50%, במחקר שנמשך בממוצע 655 יום (Suzuki וחב' ב-Am Heart J משנת 2008). במחקר נוסף שהתמקד באלה עם אי-ספיקת לב ומקטע פליטה נורמלי, רמות PTX3 בפלזמה נמצאו אף הן מוגברות (3.26 ננוגרם/מיליליטר בממוצע), למרות שרמת BNP בהם הייתה נורמלית (Matsubara וחב' ב-J Am Coll Carediol משנת 2011).
PTX3 ומחלת מסתמי לב
במחקר של Naito וחב' ב-Am Heart J משנת 2010, בו נחקר הביטוי של PTX3 בחולים עם הצרות של המסתם האורטלי, או עם רגורגיטציה כתוצאה מפגיעה במסתמים, נמצאה עליה משמעותית ברמת PTX3. יתרה מכך, PTX3 נמצא מבוטא בעיקר במקרופאגים שהתגודדו במסתמים האורטלים של חולים אלה.
מעורבות של PTX3 במחלות קרדיו-וסקולריות
מספר מחקרים בחנו מדוע רמת PTX3 מוגברת בתחלואה קרדיו-וסקולרית, ואלה מתוכם שהתמקדו בגן PTX3 בעכברים, הציעו שביטוי של PTX3 מוגבר כדי להגן מפני נזק לרקמה הלבבית (Norata וחב' ב-Circulation משנת 2009). במודל עכברים בו הושרה אוטם שריר הלב על ידי ליגציה של עורק כלילי, עכברי knockout ללא PTX3 הראו החמרה של הנזק הלבבי עם שטח מוגדל של no reflow והגברת התגובה הדלקתית כולל הסננה מוגברת של ניטרופילים, הקטנת מספר הקפילרות, והגדלת המספר של קרדיו-מיוציטים אפופטוטיים. ממצאים אלה נורמלו על ידי החדרת PTX3 אקסוגני. אגב, התופעה של no reflow היא הכשל של דם לזלח מחדש אזור איסכמי לאחר שהחסימה הפיזית הוסרה או נעקפה.
הביטוי של PTX3 נבחן גם בעכברי knockout כפול, בהם יש חסר של PTX3 ושל apolipoprotein E. כאשר בוצעה אנליזה של ביטוי גני בקשתות האורטליות של עכברים אלה תוך שימוש בשבב גני, נמצא שהוגבר הביטוי של מספר גורמי שעתוק הכרוכים באיתות תוך-תאי מקדם דלקת, כגון NF-κB, והחלבונים הקשורים אליו כגון Fos, Jun ,Erg2 ,Erg3 ,Irak1 ,GATA3 ו-GATA4, לאחר שעכברים אלה הוזנו משך 16 שבועות במזון מקדם טרשת עורקים. הביטוי של mRNA של מולקולות הספיחה הווסקולרית החוץ-תאית endothelial leukocyte adhesion molecule-1 ו-vascular cell adhesion molecule 1, ומולקולת הספיחה של טסיות לאנדותל, נמצא אף הוא מוגבר בעכברי knockout כפולים אלה בהשוואה לעכברי Wild type. בנוסף, ביטוי היתר הטרנסגני של PTX3 נמצא מגביר את העמידות לנזק טוקסי הנגרם על ידי ליפופוליסכריד, זאת בנוסף לראיות ש-PTX3 יכול להביא למודולציה של נזק רקמתי הנגרם מדלקת (Dias וחב' ב-J Leukoc Biol משנת 2001).
PTX3 נמצא מגן מפני טרשת עורקים. דווח על קשר בין PTX3 לבין מולקולת הספיחה התאית P selectin בנגעים הטרשתיים (Deban וחב' ב-Nature Immunol משנת 2010). לדוגמה, ניטרופילים הנעים על פני P selectin בנימי דם באתרי דלקת או פציעה, מקבלים איתותים הגורמים להפרשה מגרנולות ספציפיות. PTX3 מופרש זה, נקשר באופן סלקטיבי ל-P selectin המבוטא באופן מקומי, אך אינו נקשר ל-E selectin או ל-L selectin, באופן פארקריני. ככל שיותר ניטרופילים נעים, הם מפרישים יותר PTX3 הנקשר ליותר מולקולות P selectin. מצב זה יוצר מערכת משוב שלילי מקומית המפחיתה את ריסון הניטרופילים, ומגבירה את כושר נדידתם. אכן, הביטוי של PTX3 נמצא מפחית את מספר הניטרופילים הנעים על פני P selectin בתנאי in vitro, כאשר הזרקה של PTX3 בתנאי in vivo, נמצאה מפחיתה את מספר הניטרופילים הנעים בנימים מזנטריים של עכברים.
המקור של PTX3 האנטי-דלקתי נבחן אף הוא על ידי השתלה של מח עצם מעכברי wild type או מעכברים חסרי PTX לתוך עכברי wild type מוקרנים או לתוך עכברים חסרי PTX3, הראו Deban וחב' ב-Nature Immunol משנת 2010, ש-PTX3 ממקור של תאים המטו-פויאטיים נדרש כדי לדכא גיוס של ניטרופילים לחלל הפלאורלי בשעתיים הראשונות אחרי האתגור על ידי כימוקינים. בחלון זמן קצר זה ניטרופילים היו מקור סביר של PTX3, בהיותם התאים ההמטו-פויאטיים היחידים המכילים PTX3 (על פי Maugeri וחב' ב-J Immunol משנת 2011). במחקר אחרון זה הודגם שהפרשה של PTX3 מתרחשת מניטרופילים משופעלים בתרחיש של תסמונת כלילית חריפה (ACS). הכמות הכללית של PTX3 בניטרופילים של מטופלים נמדדה על ידי FACS בשלבים מוקדמים של AMI (פחות מ-6 שעות מתחילת האירוע), בשלבים מאוחרים של AMI (כ-48 שעות מהאירוע), במחלת עורקים כליליים יציבה, ובמתנדבים בריאים.
המחקר של Magueri וחב' מצא שהרמות המרביות של PTX3 בפלזמה, הושגו 6 שעות מתחילת האוטם. מעניין שהרמות הנמוכות ביותר של PTX3 נמצאו בניטרופילים של מטופלים בשלב המוקדם של AMI, ואילו הרמות הגבוהות ביותר התגלו בשיטה מיקרוסקופית בניטרופילים בשלבי AMI מאוחרים. יתרה מכך, נמצא ש-PTX3 המופרש במטופלים בשלבים מוקדמים של AMI, עובר צימות עם טסיות המבטאות P selectin, בהשוואה לשלבים המאוחרים של AMI. מנתונים אלה משתמע ש-PTX3 פועל להגנה על הלב, על ידי קישורו לטסיות משופעלות בצירקולציה, והפחתת הסטאטוס הדלקתי במצע הקרדיו-וסקולרי. נמצא שרמת PTX3 בפלזמה עלתה באופן משמעותי בתרחיש של דלקת מפושטת, כגון ספסיס (Mauri וחב' ב-Crit Care Med משנת 2008). בתסריטים אלה, תאי אנדותל, תאים דנדריטים ו/או מקרופאגים משופעלים, יכולים להיות מקור עיקרי של PTX3, ולמרות שהודגם ש-PTX3 מעכב ספיחת תאים התלויה ב-P selectin, יש כנראה מנגנונים נוספים שעדיין לא זוהו, התורמים לתכונות האנטי-דלקתיות שלו in vivo.
אי התלות של PTX3 בגורמי סיכון מוכרים
רמות PTX3 בפלזמה נמצאו בלתי תלויות בגורמי סיכון כליליים אחרים, כגון סך-כולסטרול, LDL-כולסטרול, המוגלובין A1C, סטאטוס העישון, מגדר, obesity ו-IMT או Intimal median thickness. למרות ש-Yamashina וחב' ב-Hypertension Res משנת 2002, דווחו על סף של 14.0m/s באשר לשפיעת הדם בווריד הברכיאלי (Brachial-ankle pulse wave velocity או PWV), בסריקה של נבדקים בסיכון לפתח מחלות קרדיו-וסקולריות באוכלוסייה הכללית, רמות PTX3 אינן שונות בין אלה עם ערכי PWV גבוהים או נמוכים מ-14.0m/s, או בין אלה עם עובי האינטימה בעורקים הקרוטידיים, שהיא גבוהה או נמוכה מ-1 מ"מ.
PTX3 במחלות אחרות
הפרומוטרים הקריבנים (proximal) של PTX3 באדם, מכילים אתרי קישור של IL-6, NF, Sp-1 Ap-1 ו-NF-κB, (על פי Breiario ב-J Biol Chem משנת 2002). כתוצאה מכך, PTX3 מבוטא בתגובה לאיתותים מקדמי דלקת של חיידקים, של IL-1 (אך לא של IL-6), וכן איתותים של TNF-α המיוצרים על ידי תאי אנדותל, ניטרופילים ומקרופאגים. כתוצאה מכך, מחלות דלקתיות, ובעיקר מפגעים של מערכת החיסון, כגון rheumatoid arthritis (על פי Luchetti וחב' ב-Clin Exp Immunol משנת 2000), טרשת סיסטמית מתקדמת או PSS (על פי Iwata וחב' ב-J Rheumatol משנת 2009), תסמונת Chug Straus, גרנולומטוזיס ע"ש Wegener ו-polyangitis מיקרוסקופית (Fazzini וחב' ב-Arthritis Rheumatism משנת 2001), כמו גם SIRS או systemic inflammatory response syndrome (על פי Mauri וחב' ב-Intensive Care Medicine משנת 2010). כל המחלות הללו גורמות לרמות PTX3 מוגברות בפלזמה (Yilmaz וחב' ב-Am Soc Nephrol משנת 2011, ו-Tong וחב' באותו כתב עת משנת 2007).
לכן היה מעניין לקבוע את רמות PTX3 במחלות מעי דלקתיות (IBD) כמחלת קרוהן וקוליטיס כיבית. כיוון ש-IL-6 נמצא מוגבר במחלת קרוהן פעילה, אך לא בקוליטיס כיבית, אין הפתעה בממצא שרמות PTX3 נמצאו מוגברות רק בחולים עם קוליטיס כיבית, שכן IL-1 ולא IL-6, משרה ביטוי של PTX3. נראה ש-PTX3 יכול לשמש מדד אבחוני טוב להחמרת המצב של חולים עם IBD (על פי Kato וחב' ב-Digest Dis Sci משנת 2008, ו-Savchenko וחב' ב-Pathol Int משנת 2011).
כיוון ש-PTX3 מגיב באופן בסיסי עם C1q שהוא המרכיב הראשון של ה-cascade הקלאסי של המשלים, והוא מסוגל להשרות דלקת חריפה או כרונית על ידי סוגי תאים הטרוגניים באיברים רבים, יש ל-PTX3 תפקודים ביולוגיים פלאומורפיים. PTX3 יכול להיכרך עם אי-תפקוד אנדותליאלי, עם מפגעים מטבוליים הגורמים ל-obesity, ריפוי פצעים, מחלות ראומטיות, ודיכוי מחלות סרטניות על ידי פעילותו האנטי-אנגיוגנית (Doni וחב' ב-Seminars in Immunol משנת 2016, Slusher וחב' ב-Mediators Inflamm משנת 2017 ו-Augusto וחב' ב-Int Rev Immunol משנת 2017). ל-PTX3 יש השפעות שונות על ידי עידוד או עיכוב סוגי סרטן שונים (Giacomini וחב' ב-Biochim Biophys Acta משנת 2018).
מחקר של Sukiman וחב' ב-J Am Soc Nephrol משנת 2008, מצא שרמות PTX3 כרוכות באופן בלתי תלוי באי-תפקוד אנדותליאלי, באוכלוסיית חולים עם מחלת כליות סופנית (ESKD), והציעו לעשות שימוש ב-PTX3 כסמן לנזק וסקולרי היקפי. בדומה, מספר קבוצות שפכו אור על היחס בין PTX3 לבין מחלות רשתית כגון AMD, וחסימה וסקולרית של הרשתית (Min וחב' ב-Ocul Immunol Inflamm משנת 2014, Noma וחב' ב- JAMA Ophthalmol משנת 2013 ו-Park וחב' ב-Korean J Ophthalmol משנת 2014).
רמות מוגברות של PTX3 בפלזמה קשורות להתפתחות ולהתקדמות של diabetic retinopathy בחולים קוריאנים עם סוכרת type 2
מחקר של Yang וחב' ב-Sci Invest Ophthalmol Visual משנת 2014, בחן את הקשר בין רמות מוגברות של PTX3 בפלזמה לבין התפתחות או התקדמות של diabetic retinopathy (להלן DR). בקבוצה 1 השתתפו 92 חולי סוכרת עם DR, בקבוצה 2 נכללו 30 חולי סוכרת ללא DR, וקבוצה 3 כללה 41 נבדקים בריאים. תוצאות המחקר היו כדלקמן: רמת PTX3 הממוצעת בקבוצה 1 הייתה 1,817.9 פיקוגרם/מ"ל, בקבוצה 2 רמת PTX3 נקבעה כ-1,093 פיקוגרם/מ"ל ואילו בקבוצה 3 רמת חלבון זה נקבעה כ-916.1 פיקוגרם/מ"ל. באנליזה של תת-הקבוצות נמצא שערכי log PTX3 גדלו במתאם עם החומרה של DR (r=0.372, p<0.001). עקומות ROC של התפתחות DR סומנו תוך שינוי בערכי log PTX3 ו-log hsCRP, והשטח תחת העקומה (AUC) נמצא כ-0.721 (p=0.001), ו-0.614 (p=0.087), בהתאמה. מסקנות מחקר זה היו שרמת PTX3 בפלזמה תואמת באופן חיובי את התפתחות רטינופתיה סוכרתית, ויכולה לשמש מנבא מדויק יותר של התפתחות מפגע זה בהשוואה ל-hsCRP.
רמות PTX3 בפלזמה ב-SLE
משפחת העל של pentraxins המתחלקת ל-PTX3 ארוכים וקצרים, יכולה להיות מושרית על ידי גירויים דלקתיים אחדים (Lech וחב' ב-PLos One משנת 2011). ה-PTXs הקלאסיים הקצרים הם CRP ו-serum amyloid protein או SAP, ואילו PTX3 וה-pentraxins הארוכים הם בעלי מבנה ציקלי (Deban וחב' ב-Cell Tissue Res משנת 2011). רמות מוגברות של PTX3 בצירקולציה נמצאו במספר מחלות אוטו-אימוניות כגון צליאק, vasculitis ואחרים.
למרות מספר מחקרים בנושא, יש נתונים סותרים באשר ל-PTX3 בחולי SLE, ומחקרם של Assandri וחב' נועד להבהיר קשר אפשרי זה. במחקר שותפו 64 חולי SLE ו-60 אנשים בריאים, תואמי-גיל ( ממוצע 46.8 שנה בחולי SLE ו-41.8 שנה בנבדקים הבריאים), וכן 87.5% נשים חולות SLE, לעומת 90% נשים בריאים. חולי SLE חולקו ל-3 קבוצות של SLEDAI (או SLE disease activity index) על פי דרגת פעילות המחלה (Gladman ו-Urowitz ב-Lupus משנת 1999). בין 64 חולי לופוס נכללו 18 בקטגוריה של מחלה לא-פעילה (SLEDAI<4), 32 חולים עם מחלה פעילה נכללו ב-SLEDAI<10, ועוד 14 חולי לופוס עם מחלה מאוד פעילה בקטגוריה של SLEDAI>10.
תוצאות המחקר הן כדלקמן: מחקר זה הראה שרמות PTX3 בחולי SLE גבוהות משמעותית מרמות חלבון זה בנבדקים הבריאים והן אף שיקפו את פעילות המחלה. בקרב חולי SLE רמות PTX3 נעו בין 1,180 ל-95,100 פיקוגרם/מיליליטר, עם ערך ממוצע של 14,000 פיקוגרם/מיליליטר. בקבוצת הביקורת של הבריאים רמות PTX3 נעו בין 200 ל-4,800 פיקוגרם/מיליליטר, עם ערך ממוצע של 2,400 פיקוגרם/מיליליטר. נראה אם כן שרמות PTX3 בחולי SLE גבוהים משמעותית מאלה באנשים בריאים (p<0.001). ריכוז הסף (cutoff) של PTX3 בין חולי לופוס פעילים לבין נבדקים בריאים, נקבע כ-2,800 פיקוגרם/מיליליטר, ובערך סף זה רגישות השיטה היא 100% והספציפיות שלה היא 80%, עם ערך ניבוי שלילי (NPV) של 100%, וערך ניבוי חיובי (PPV) של 76%. דרגת הדיוק עם ערך סף זה היא של 88%.
הוראות לביצוע הבדיקה
דימות הדם נאספו לאחר לפחות פרק זמן של 4 שעות של צום, למבחנה כימית (פקק אדום או צהוב). לאחר הסרכוז, הנסיוב נשמר בטמפרטורה של -75ºC.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק