פרפור פרוזדורים - אטימת אוזנית העלייה השמאלית - Atrial fibrillation - left atrial appendage occlusion
| פרפור פרוזדורים - אטימת אוזנית העלייה השמאלית | ||
|---|---|---|
| Atrial fibrillation - left atrial appendage occlusion | ||
| ||
| יוצר הערך | ד"ר רפאל רוסו, ד"ר עידו י' בירתי, ד"ר אמיר הלקין
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פרפור פרוזדורים
פרפור פרוזדורים הוא הפרעת הקצב השכיחה ביותר, וההיארעות שלו עולה עם הגיל: כ-10% מהגברים ו-7% מהנשים שגילם מבוגר מ-80 שנה סובלים מהפרעת קצב זו[1].
קיום פרפור פרוזדורים מכפיל את שיעורי התמותה[2] ויוצר סיכון משמעותי לשבץ מוחי על רקע תסחיף פקיקי (Thromboembolism)[2-5].
טיפול נוגד קרישה ב-Coumadin (Warfarin) הוא הבסיס למניעת שבץ מוחי ואירועים קליניים אחרים מתסחיפים לבביים בחולים עם פרפור פרוזדורים[16-20 ,9 ,4]. למרות היעילות הגבוהה של Coumadin במניעת אירועים מוחיים, הטיפול בתכשיר זה עלול לגרום לאירועי דמם חמורים, העלולים לעתים גם להיות מסכני חיים - בעיקר דימומים תוך-גולגולתיים.
היווצרות קרישים לבביים בחולים עם פרפור פרוזדורים מסתמי ללא מחלת לב מבנית מתרחשת בעלייה השמאלית, וכ-90% מכלל קרישי הדם הללו נוצרים באוזנית העלייה השמאלית (Left atrial appendage)[31 ,30]. לפיכך, אטימת האוזנית או כריתתה עשויים למנוע את הצורך במתן - Coumadin בפרפור פרוזדורים.
התפתחות טכנולוגית מהירה חלה בתחום ביטול חלל אוזנית העלייה השמאלית בחולי פרפור פרוזדורים, אולם השיטה היחידה שנבדקה במחקר קליני אקראי היא סגירת האוזנית בצנתור.
הסיכון לשבץ מוחי
קיום פרפור פרוזדורים מכפיל את שיעורי התמותה ויוצר סיכון משמעותי לשבץ מוחי על רקע תסחיף פקיקי. כאחד משישה אירועי שבץ מוח מיוחסים לפרפור פרוזדורים[6], וחולים הסובלים מהפרעת קצב זו נמצאים בסיכון גבוה פי חמישה לשבץ מוחי בהשוואה לחולים ללא פרפור פרוזדורים[7-9 ,4].
הסיכון השנתי לשבץ מוחי מפרפור פרוזדורים גובר עם הגיל: מוערך ב-1.5% בגילאים 50-59, ומגיע עד כ-24% בגילאים 80-89[10]. אירועי שבץ מוחי הנגרמים על ידי תסחיף לבבי בפרפור פרוזדורים נוטים להיות נרחבים יותר מבחינת הפגיעה האנטומית, וגורמים בשכיחות גבוהה יותר לפגיעה תפקודית או לתמותה בהשוואה לאירועים המתרחשים בהיעדר פרפור פרוזדורים[13]. על פי אומדנים מסוימים, התמותה אחרי שבץ מוחי מפרפור פרוזדורים יכולה להגיע עד כ-80% במהלך חמש שנות מעקב[12 ,11].
כלים להערכת הסיכון
כלים או סרגלים קליניים לכימות הסיכון ללקות בשבץ מוחי בשל פרפור פרוזדורים דווחו בהרחבה בספרות הרפואית.
אחת משיטות אלה קרויה ה-CHADS 2 (CHADS2 Score), ונכללים בה חמישה גורמי סיכון:
- היסטוריה של אי ספיקת לב (Congestive heart failure)
- יתר לחץ דם (Hypertension)
- גיל מעל 75 שנים (Age)
- סוכרת (Diabetes mellitus)
- שבץ מוחי בעבר (S2 - Prior stroke - 2 points)
על פי שיטה זו, קיום כל אחד מגורמי הסיכון מכומת בנקודה אחת, למעט היסטוריית אירוע מוחי הזוכה לכימות של שתי נקודות.
הסיכון לשבץ מוחי מפרפור פרוזדורים עולה ביחס ישר למספר גורמי סיכון: ניקוד של 0 לפי ה- CHADS2 Score, מכתיב סיכון שנתי לשבץ מוחי בשיעור של 1.9% (1.2-3.0, רווח בר-סמך (CI - Confidence interval) 95%), בעוד ניקוד של 6 לפי סולם זה מכתיב סיכון שנתי לשבץ מוח בשיעור של 18.2% (95% CI ,10.5-27.4) [15 ,14 ,7].
פרפור פרוזדורים - טיפול נוגד קרישה
טיפול נוגד קרישה ב-Coumadin הוא הבסיס למניעת שבץ מוחי ואירועים קליניים אחרים מתסחיפים לבביים בחולים עם פרפור פרוזדורים[16-20 ,9 ,4]. בהשוואה לאינבו (Placebo), טיפול ב-Coumadin וחוסמים (אנטגוניסטים) אחרים של ויטמין K גורמים להפחתה של כ-60% בסיכון לאירוע מוחי תסחיפי מפרפור פרוזדורים.
טיפול ב-Acetylsalicylic acid, לעומת זאת, מפחית את הסיכון לאירוע מוחי מפרפור פרוזדורים רק ב-20% בהשוואה לאינבו[17 ,6]. למרות היעילות הגבוהה של Coumadin במניעת אירועים מוחיים, הטיפול בתכשיר זה עלול לגרום לאירועי דמם חמורים, העלולים לעתים גם להיות מסכני חיים - בעיקר דימומים תוך-גולגולתיים.
בטיחות הטיפול בנוגדי קרישה
בסקירת-על (Meta-analysis) שפורסמה בשנת 2007, נקשר טיפול ב-Coumadin בחולים הסובלים מפרפור פרוזדורים ל-11 מקרים של דמם קטלני, לעומת 6 בלבד בחולים שטופלו ב-Acetylsalicylic acid[17]. מלבד הסיכון לפתח דימום משמעותי, הטיפול ב-Coumadin כרוך במספר קשיים אחרים:
- החלון הטיפולי של התרופה צר מאוד, ועל כן במהלך טיפול ב-Coumadin יש צורך בבדיקות תכופות של תפקודי הקרישה והתאמת מינון התרופה לערך הקרישה המנורמל (INR - International normalized ratio).
- יש אינטראקציות משמעותיות בין Coumadin למזון ולתרופות שונות.
בשל קשיים אלו הראו מחקרים שונים באופן עקבי כי מספר החולים המטופלים ב-Coumadin נמוך ממספר החולים שיש להם התוויה לטיפול בתרופה זאת, בעיקר בקרב קשישים שבהם הסיכון ללקות באירוע מוחי בזמן פרפור פרוזדורים גבוה במיוחד[21].
במחקרים קליניים שבהם נבדקה בטיחות הטיפול ב-Coumadin, נמצא כי הטיפול נוגד הקרישה הגביר את הסיכון לדמם משמעותי מ-0.3-0.5% לשנה בחולים ללא Coumadin ל-1-1.4% לשנה בקרב המטופלים בתרופה, למרות ניטור הדוק של תפקודי הקרישה[23 ,22].
בקרב חולים בקהילה שאינם מטופלים במסגרת פרוטוקול מחקר קליני (כאשר ניטור תפקודי הקרישה אינו תכוף במיוחד) שיעור אירועי דמם משמעותיים הוא גבוה בהרבה, ומגיע לכדי 1-5% לשנה[24].
גורמי הסיכון החשובים לדמם בטיפול ב-Coumadin כוללים[26 ,25 ,18]:
- היסטוריית דמם בעבר
- חוסר איזון ערכי INR
- מחלה כלייתית או כבדית
- שימוש בו-זמנית ב-Acetylsalicylic acid או בתכשירים נוגדי דלקת שאינם סטרואידים (NSAIDs - Non-steroidal anti-inflammatory drug)
- יתר לחץ דם
- שתיית אלכוהול
- גיל מבוגר
גורמי סיכון נוספים לדמם תוך כדי טיפול ב-Coumadin בחולים מבוגרים כוללים נטייה לנפילות (המגבירה את הסיכון לדמם תוך-גולגולתי מ-1.1% ל-2.8% לשנה)[27], והפרעה קוגניטיבית[28].
שיטה קלינית לכימות הסיכון לדימום בטיפול ב-Coumadin קרויה HAS-BLED Score, וכוללת את גורמי הסיכון הבאים:
- יתר לחץ דם (Hypertension)
- הפרעה תפקודית כבדית וכלייתית (Abnormal renal\ liver function)
- סיפור קודם של אירוע מוחי (Stroke)
- סיפור קודם של דמם (Bleeding)
- חוסר איזון בערכי INR (Labile INRs)
- גיל מבוגר מ-65 (Elderly)
- נטילת תרופות כמו Acetylsalicylic acid או נוגדי דלקת שאינם סטרואידים
- שתיית אלכוהול (Drugs or alcohol)
על פי שיטה זו, קיום כל אחד מגורמי הסיכון מזוכה בנקודה אחת. הסיכון לדמם עולה ביחס ישר לפי מספר גורמי הסיכון, ותוצאה של 3 ומעלה מזהה חולים בסיכון גבוה לדימום[29].
חלק מגורמי הסיכון ב-HAS-BLED (גיל מבוגר מ-65, יתר לחץ דם וסיפור קודם של אירוע מוחי) מופיעים גם ב-CHADS2 Score.
הקושי הניכר בנטילת נוגדי קרישה לפרקי זמן ממושכים הוביל להתפתחות אפשרויות טיפוליות אחרות, חלקן תרופתיות וחלקן נסמכות על טיפולים התערבותיים.
אוזנית העלייה השמאלית (Left atrial appendage) כמטרה של טיפול מניעתי
היווצרות קרישים לבביים בחולים עם פרפור פרוזדורים מסתמי ללא מחלת לב מבנית מתרחשת בעלייה השמאלית, וכ-90% מכלל קרישי הדם הללו נוצרים באוזנית העלייה השמאלית. לפיכך, אטימת האוזנית או כריתתה עשויים למנוע את הצורך במתן Coumadin בפרפור פרוזדורים.
ב-15% מהחולים עם פרפור פרוזדורים לאחר אירוע מוחי ניתן לזהות באקוקרדיוגרם תוך-ושטי (TEE - Transesophageal echocardiogram) קרישי דם באוזנית העלייה השמאלית[31]. תיתכן הסברה כי בשאר המקרים שבהם לא זוהו קרישי הדם באוזנית נסחף התסחיף כולו במהלך האירוע המוחי.
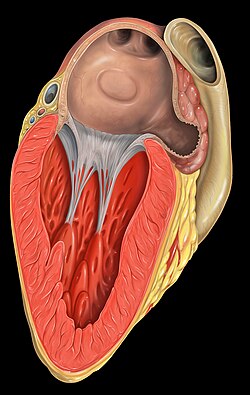
אוזנית העלייה השמאלית היא בעלת אנטומיה מורכבת, ועשויה לכלול מספר אונות שונות בממדיהן[32-37]. האוזנית מתפתחת בשבוע השלישי לחיים העובריים[38], וממוקמת בין וריד הריאה השמאלי העליון למסתם הדו-צניפי (Mitral valve)[38 ,36]. העורק הכלילי העוקף (Circumflex artery) עובר בסמוך לבסיס האוזנית[36]. הירידה במהירות זרימת הדם האיטית בתוך האוזנית והמבנה האנטומי המורכב שלה הם מצע להיווצרות קרישי הדם בתוכה (תמונה 1).
סגירת אוזנית העלייה השמאלית בגישה מלעורית (Percutaneous)
פותחו מספר שיטות לאטימת אוזנית עלייה שמאלית, אולם עד כה פורסם רק מחקר אקראי מבוקר יחיד שבו הושוותה יעילות אחת השיטות הללו לעומת Coumadin למניעת תסחיפים לבביים בפרפור פרוזדורים. המחקר, שנקרא PROTECT AF[39], פורסם בעיתון הבריטי Lancet בשנת 2009. במהלך המחקר נעשה שימוש בהתקן שנקרא Watchman (מיוצר על ידי Atritech Inc) (תמונה 2). מדובר בהתקן ייעודי שתוכנן למיקום במוצא אוזנית העלייה השמאלית לצורך אטימתה. ההתקן עשוי מסגסוגת מתכת הקרויה ניטינול (Nitinol).
קוטר ההתקן 21 עד 33 מ"מ, והוא ממוקם באוזנית העלייה השמאלית בעזרת מערכת הולכה מיוחדת המוחדרת לעלייה דרך המחיצה הבין-עלייתית. ההתקן מעוגן לדפנות האוזנית באמצעות קרסים זעירים, ובזכות נטייתה הטבעית של מתכת הניטינול הוא מתרחב ממצב מכווץ (בתוך מערכת ההולכה) לצורתו החופשית של ההתקן. לאחר הפעולה החולים מטופלים בדרך כלל ב-Coumadin וב-Acetylsalicylic acid במשך 45 יום. בסיום תקופה זו מתבצעת בדיקת אקו תוך-ושטי (תמונה 3).
באותם חולים בהם הודגמה אטימה מוצלחת של האוזנית, הטיפול ב-Coumadin מוחלף ב-Clopidogrel, ובתום 3 חודשים נוספים ניתן לטפל ב-Acetylsalicylic acid בלבד.
בחולים בהם לא הושגה אטימה טובה של האוזנית לפי בדיקת האקו ב-45 יום מהפעולה, הטיפול ב-Coumadin נמשך ומתבצעות בדיקות אקו חוזרות למעקב אחרי הזרימות לתוך האוזנית. כפי שהודגם במחקר ה-PROTECT AF, הפסקת Coumadin מושגת ביותר מ-90% מהמטופלים בתום שישה חודשי מעקב.
למחקר ה-PROTECT AF גויסו כ-900 חולים עם פרפור פרוזדורים ללא מחלת לב מסתמית, עם ניקוד 1 לפחות לפי סולם CHADS2, וללא התוויית נגד לנטילת Coumadin. המגויסים עברו חלוקה אקראית ביחס 2:1 ל-Coumadin או להתקן ה-Watchman. במעקב אחר החולים עד 3 שנים הודגם במחקר ה-PROTECT AF כי יעילות התקן ה-Watchman איננה נופלת מזו של Coumadin במניעת אירועים מוחים איסכמיים[39].
בקרב 463 חולים שעברו השתלת התקן Watchman שיעור אירועים מוחיים, תמותה ממחלות לב וכלי דם ותסחיפים היקפיים (פריפריים) לא היה שונה מזה שנצפה בקרב 244 חולים שנטלו Coumadin: 3 לעומת 4.9 מקרים ל-100 שנות חולה, סיכון יחסי 0.62 (95% CI ,0.355-1.25). הסיכון לדמם תוך-מוחי היה נמוך יותר בקבוצת ה-Watchman (סיכון יחסי 0.09-0-0.45). כ-85% מהחולים שטופלו בהתקן ה-Watchman נגמלו מהטיפול ב-Coumadin כעבור 45 יום מההשתלה, ו-93% עשו זאת כעבור 6 חודשים.
במהלך המחקר נרשם אחוז לא מבוטל של סיבוכים (כ-12%) במהלך השתלת ההתקן Watchman. רשימת הסיבוכים כללה אלח דם (ספסיס), תסחיף של ההתקן, טמפונדה (Tamponade) ותסחיפי אוויר.
ב-3.7% מהחולים נמצאו קרישי דם על משטח ההתקן, ובחולה אחד הדבר זוהה 6 ימים לאחר אירוע מוחי איסכמי. שיעור הסיבוכים, בעיקר הסיכון לתפליט בקרום הלב (Pericardial effusion), ירד בצורה משמעותית במהלך המחקר כחלק מהשפעת "עקומת לימוד" ושינויים בטכניקת ההשתלה[39].
נתונים שפורסמו לאחרונה על ידי Reddy וחב' ב-Circulation[40] מדגימים ירידה בולטת בהיארעות סיבוכים מהפעולה, מ-7.7% ב-PROTECT AF, לכ-3.7% ברשומות מחקר ה-CAP (Continued access protocol) (p=0.07). שיעור התפליטים בקרום הלב, שהיוו יותר מ-50% מכלל הסיבוכים ב-PROTECT AF, היה נמוך יותר ב-CAP (5% לעומת 2.2%, p=0.019). כמו כן, נצפתה ירידה בשיעור האירועים המוחים סביב הפעולה מ-0.9% ל-0% (p=0.039).
התקן נוסף לסגירת אוזנית הוא Amplatzer. ההתקן Amplatzer בנוי מניטינול, ומורכב משתי דסקיות עם קוטר שונה המחוברות בחלקן אמצעי. הדסקית הפנימית אוטמת את האוזנית בעומק של כ-10 מ"מ, והדסקית החיצונית מכסה את פתחה החיצונית של האוזנית. החיבור המרכזי גורם למתיחה עדינה של הדסקיות ומייצב את מיקומן באוזנית.
התקן Amplatzer נבדק במספר עבודות לא מבוקרות שהצביעו על כך שיעילותו במניעת אירועי תסחיפים לבביים איננה פחותה בהשוואה ל-Coumadin, עם פרופיל בטיחות טוב(42 ,41). מחקר אקראי ומבוקר המשווה טיפול באמצעות התקן Amplatzer ו-Coumadin באוכלוסיית חולים הקרובים בעלת מאפיינים דומים לאלו של חולי מחקר ה-PROTECT AF עומד להתחיל בעתיד הקרוב.
כריתת אוזנית העלייה השמאלית
כריתת אוזנית העלייה השמאלית מומלצת ברוב החולים המועמדים לניתוח לב מסתמי או ניתוח מעקפים כליליים (Coronary artery bypass surgery - CABG)[43]. בעבודה רטרוספקטיבית שסקרה 205 חולים שעברו כריתת אוזנית העלייה השמאלית במהלך ניתוח החלפת המסתם המיטרלי הראתה ירידה משמעותית בשיעור אירועי תסחיפים לבביים בהשוואה לחולים שלא עברו כריתת אוזנית (3% לעומת 17%)[44].
מצד שני, סקירה של כ-1,400 חולים שעברו כריתה שגרתית של אוזנית במהלך ניתוח לבבי לא הצביעה על יתרון בולט לשיטה זו במניעת תסחיפים ואירועים מוחיים[45]. נמצא כי ב-30% עד 55% מהחולים נעשתה רק כריתה חלקית של אוזנית העלייה השמאלית, וסביר להניח כי שרידי האוזנית הם מצע להתפתחות קרישי דם, ואף אירועי תסחיפים לבביים בכ-8% מהמקרים[46].
כמו כן, קיים ניסיון מסוים בטכניקות כירורגיות זעיר-פולשניות (Minimally invasive surgery) לכריתת אוזנית העלייה השמאלית באמצעות תורקוסקופיה (Thoracoscopy)[47], ולאחרונה התפרסם ניסיון של סגירה דרך עילית הלב (אפיקרדיאלית) של האוזנית בעזרת התקן LARIAT(מיוצר על ידי Sentre HEART Inc)[48].
הניסיון בישראל
אטימת אוזנית העלייה השמאלית באמצעות התקני Watchman ו-Amplatzer מתבצעת במספר מרכזים בארץ.
במרכז הרפואי תל אביב על שם סוראסקי טופלו עד כה 19 חולים עד כה בהשתלת התקן Watchman (טבלה 1).
ההשתלה הייתה מוצלחת ב-15 חולים. בשניים מארבעת החולים הנותרים לא נעשה ניסיון השתלה בשל הסיבות הבאות:
- עיוות מולד בוורידי האגן שמנע דיקור תוך-מחיצתי (טרנס-ספטלי) בטוח
- היווצרות קריש על פני מערכת ההולכה עוד לפני ניסיון ההשתלה, בחולה עם היסטוריה של תרומבוציטופניה מושרית-הפרין (Heparin-induced thrombocytopenia).
בשני החולים הנותרים, האנטומיה של האוזנית לא נחשבה מתאימה להשתלת ה-Watchman.
לא תועדו סיבוכים משמעותיים במהלך הפעולה ב-18 מקרים. במקרה יחיד נגרמה חבלה לקיבה ממתמר האקו, שהסתמנה בהקאה דמית אחרי מהלך מוצלח של השתלת ההתקן. סיבוך זה אומנם הצריך עירוי דם וטיפול באנדוסקופיה (Endoscopy), אולם נוהל שמרנית ולא נחשב כסיבוך ישיר של השתלת ההתקן. 17 מתוך 19 החולים הופנו לפעולה בשל התוויית נגד לטיפול ב-Coumadin בשל אירועי דמם חמורים בטיפול זה. שני החולים הנותרים הופנו לפעולה בשל סירובם ליטול Coumadin.
מטופלים בעלי התוויית נגד ל-Coumadin
פורסמו תוצאות מחקר של אטימת אוזנית העלייה השמאלית בחולי פרפור פרוזדורים עם התוויית נגד לטיפול נוגד קרישה, אבל ההתקן במחקר זה היה התקן הקרוי PLAATO (Percutaneous left atrial appendage transcatheter occlusion)[50 ,49], שפיתוחו הופסק. לפיכך, לא פורסם עדיין מחקר מבוקר שבחן אטימת אוזנית העלייה השמאלית באמצעות התקן מסחרי בקרב מטופלים עם התוויית נגד לטיפול ב-Coumadin, ויישום ממצאי ה-PROTECT AF בחולים הללו חייב להיחשב ניסיוני. כמו כן, לא ידוע היום מה יעילותם היחסית של ההתקנים לאטימת אוזנית העלייה השמאלית בהשוואה לתרופות נוגדות קרישה חדשות (דוגמת ה-Pradaxa (Dabigatran) ששיווקה החל לאחרונה).
מרבית החולים שעברו השתלה של ההתקן במרכז הרפואי תל אביב נזקקו לטיפול נוגד קרישה בשל ציון CHADS2 גבוה, אולם לא יכלו לקבל Coumadin בשל נטייה לדמם. מבחינה זו, חולים אלו אינם דומים לחולים שנכללו במחקר ה-PROTECT AF.
ביבליוגרפיה
- Speranza M, Corcos M, Godart N, et al. Current and lifetime prevalence of obsessive compulsive disorders in eating disorders. Encephale 2001;27(6):541-550
- Wolf PA, Kannel WB, McGee DL, et al. Duration of atrial fibrillation and imminence of stroke: the Framingham study. Stroke 1983;14(5):664-667
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham Study. Arch Intern Med 1987;147(9):1561-1564
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. Aug 1991;22(8):983-988.
- Brand FN, Abbott RD, Kannel WB, et al. Characteristics and prognosis of lone atrial fibrillation. 30-year follow-up in the Framingham Study. JAMA 1985;254(24):3449-3453
- Fuster V, Ryden LE, Asinger RW, et al. ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation: Executive Summary A Report ofthe American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences. Developed in Collaboration With the North American Society of Pacing and Electrophysiology. Circulation 2001;104(17):2118-2150
- Garcia DA, Hylek E. Reducing the risk for stroke in patients who have atrial fibrillation. Cardiol Clin 2008;26(2):267-275
- Sherman DG, Kim SG, Boop BS, et al. Occurrence and characteristics of stroke events in the Atrial Fibrillation Follow-up Investigation of Sinus Rhythm Management (AFFIRM) study. Arch Intern Med 23 2005;165(10):1185-1191
- Go AS, Hylek EM, Chang Y, et al. Anticoagulation therapy for stroke prevention in atrial fibrillation: how well do randomized trials translate into clinical practice? JAMA 2003;290(20):2685-2692
- Lin HJ, Wolf PA, Kelly-Hayes M, et al. Stroke severity in atrial fibrillation. The Framingham Study. Stroke 1996;27(10):1760-1764
- Fisher CM. Reducing risks of cerebral embolism. Geriatrics 1979;34(2):59-61, 65-56
- Petty GW, Brown RD, Whisnant JP, et al. Ischemic stroke subtypes: A population-based study of functional outcome, survival, and recurrence. Stroke 2000;31(5):1062-1068
- Marini C, De Santis F, Sacco S, et al. Contribution of atrial fibrillation to incidence and outcome of ischemic stroke: results from a population-based study. Stroke 2005;36(6):1115-1119
- Kim E, Xiong H, Striemer CC, et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. J Am Chem Soc 2 2008;130(13):4230-4231
- Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001;285(22):2864-2870
- Cooper NJ, Sutton AJ, Lu G, et al. Mixed comparison of stroke prevention treatments in individuals with nonrheumatic atrial fibrillation. Arch Intern Med 2006;166(12):1269-1275
- Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146(12):857-867
- Hylek EM, Singer DE. Risk factors for intracranial hemorrhage in outpatients taking warfarin. Ann Intern Med 1994;120(11):897-902
- Hylek EM, Skates SJ, Sheehan MA, et al. An analysis of the lowest effective intensity of prophylactic anticoagulation for patients with nonrheumatic atrial fibrillation. NEJM 1996;(8)35:3540-3546
- Optimal oral anticoagulant therapy in patients with nonrheumatic atrial fibrillation and recent cerebral ischemia. The European Atrial Fibrillation Trial Study Group. NEJM 1995;333(1):5-10
- Singer DE, Chang Y, Fang MC, et al. Should patient characteristics influence target anticoagulation intensity for stroke prevention in nonvalvular atrial fibrillation?: the ATRIA study. Circ Cardiovasc Qual Outcomes 2009;2(4):297-304
- Schulman S, Beyth RJ, Kearon C, et al. Hemorrhagic complications of anticoagulant and thrombolytic treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008;133(6 Suppl):257-298
- Reynolds MW, Fahrbach K, Hauch O, et al. Warfarin anticoagulation and outcomes in patients with atrial fibrillation: A systematic review and metaanalysis. Chest 2004;126(6):1938-1945
- Levine MN, Raskob G, Landefeld S, et al. Hemorrhagic complications of anticoagulant treatment. Chest 2001;119(1 Suppl):108-121
- Bleeding during antithrombotic therapy in patients with atrial fibrillation. The Stroke Prevention in Atrial Fibrillation Investigators. Arch Intern Med 1996;156(4):409-416
- Hylek EM, Evans-Molina C, Shea C, et al. Major hemorrhage and tolerability of warfarin in the first year of therapy among elderly patients with atrial fibrillation. Circulation 2007;115(21):2689-2696
- Gage BF, Birman-Deych E, Kerzner R, et al. Incidence of intracranial hemorrhage in patients with atrial fibrillation who are prone to fall. Am J Med 2005;118(6):612-617
- Gorter JW. Major bleeding during anticoagulation after cerebral ischemia: patterns and risk factors. Stroke Prevention In Reversible Ischemia Trial (SPIRIT). European Atrial Fibrillation Trial (EAFT) study groups. Neurology 1999;53(6):1319-1327
- Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010;31(19):2369-2429
- Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg 1996;61(2):755-759
- Harloff A, Handke M, Reinhard M, et al. Therapeutic strategies after examination by transesophageal echocardiography in 503 patients with ischemic stroke. Stroke 2006;37(3):859-864
- Fountain RB, Holmes DR, Chandrasekaran K, et al. The PROTECT AF (WATCHMAN Left Atrial Appendage System for Embolic PROTECTion in Patients with Atrial Fibrillation) trial. Am Heart J 2006;151(5):956-961
- Friedman PA, Asirvatham SJ, Dalegrave C, et al. Percutaneous epicardial left atrial appendage closure: preliminary results of an electrogram guided approach. J Cardiovasc Electrophysiol 2009;20(8):908-915
- Heist EK, Refaat M, Danik SB, et al. Analysis of the left atrial appendage by magnetic resonance angiography in patients with atrial fibrillation. Heart Rhythm 2006;3(11):1313-1318
- Su P, McCarthy KP, Ho SY. Occluding the left atrial appendage: anatomical considerations. Heart 2008;94(9):1166-1170
- Veinot JP, Harrity PJ, Gentile F, et al. Anatomy of the normal left atrial appendage: a quantitative study of age-related changes in 500 autopsy hearts: implications for echocardiographic examination. Circulation 1997;96(9):3112-3115
- Aberg H. Atrial fibrillation. I. A study of atrial thrombosis and systemic embolism in a necropsy material. Acta Med Scand 1969;185(5):373-379
- Ernst G, Stollberger C, Abzieher F, et al. Morphology of the left atrial appendage. Anat Rec 1995;242(4):553-561
- Holmes DR, Reddy VY, Turi ZG, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. Lancet 2009;374(9689):534-542
- Reddy VY, Holmes D, Doshi SK, et al. Safety of percutaneous left atrial appendage closure: results from the Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF (PROTECT AF) clinical trial and the ContinuedAccess Registry. Circulation 2011;123(4):417-424
- Meier B, Palacios I, Windecker S, et al. Transcatheter left atrial appendage occlusion with Amplatzer devices to obviate anticoagulation in patients with atrial fibrillation. Catheter CardiovascInterv 2003;60(3):417-422
- Park JW, Bethencourt A, Sievert H, et al. Left atrial appendage closure with amplatzer cardiac plug in atrial fibrillation: Initial european experience. Catheter Cardiovasc Interv 2010
- Bonow RO, Carabello BA, Chatterjee K, et al. 2008 Focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines: endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of ThoracicSurgeons. Circulation 2008;118(15):523-661
- Garcia-Fernandez MA, Perez-David E, Quiles J, et al. Role of left atrial appendage obliteration in stroke reduction in patients with mitral valve prosthesis: a transesophageal echocardiographic study. J Am Coll Cardiol 2003;42(7):1253-1258
- Dawson AG, Asopa S, Dunning J. Should patients undergoing cardiac surgery with atrial fibrillation have left atrial appendage exclusion? Interact Cardiovasc Thorac Surg 2010;10(2):306-311
- Katz ES, Tsiamtsiouris T, Applebaum RM, et al. Surgical left atrial appendage ligation is frequently incomplete: a transesophageal echocardiograhic study. J Am Coll Cardiol 2000;36(2):468-471
- Blackshear JL, Johnson WD, Odell JA, et al. Thoracoscopic extracardiac obliteration of the left atrial appendage for stroke risk reduction in atrial fibrillation. J Am Coll Cardiol 2003;42(7):1249-1252
- Bartus K, Bednarek J, Myc J, et al. Feasibility of closed-chest ligation of the left atrial appendage in humans. Heart Rhythm 2011;8(2):188-193
- Sievert H, Lesh MD, Trepels T, et al. Percutaneous left atrial appendage transcatheter occlusion to prevent stroke in high-risk patients with atrial fibrillation: early clinical experience. Circulation 2002;105(16):1887-1889
- Ostermayer SH, Reisman M, Kramer PH, et al. Percutaneous left atrial appendage transcatheter occlusion (PLAATO system) to prevent stroke in high-risk patients with non-rheumatic atrialfibrillation: results from the international multi-center feasibility trials. J Am Coll Cardiol 2005;46(1):9-14
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר רפאל רוסו, ד"ר עידו י' בירתי, ד"ר אמיר הלקין


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 


