ראאלין - Reelin
| מדריך בדיקות מעבדה | |
| ראאלין | |
|---|---|
| Reelin | |
| שמות אחרים | RELN, LIS2, PRO1598, RL |
| מעבדה | כימיה בדם וב-CSF |
| תחום | מפגעים מוחיים |
| טווח ערכים תקין | בנסיוב: רמת reelin ממוצעת בנסיוב במבוגרים 1.32 מיקרוגרם/מ"ל (טווח של 0.156-3.17 מיקרוגרם/מ"ל). |
| יוצר הערך | פרופ' בן-עמי סלע |
הפיזיולוגיה של reelin
Reelin הוא גליקופרוטאין משתית (extracellular matrix) גדול המופרש ומסייע לווסת תהליכים של נדידה נוירונלית ומיקום במוח המתפתח על ידי בקרה של אינטראקציות בין תאים. מלבד זאת, reelin ממשיך לפעול במח הבוגר (Bosch וחב' ב-Front Cell Neurosci משנת 2016). Reelin תורם למודולציה של synaptic plasticity על ידי הגברת האינדוקציה והתחזוק של הפוטנציאציה לטווח ארוך (Weeber וחב' ב-J Biol Chem משנת 2002, ו- D'Arcangelo ב- Neuron משנת 2005). Reelin גם מעודד התפתחות של דנדריטים (Liu וחב' ב-Neuron משנת 2004), ומווסת את הנדידה המתמשכת של נוירובלסטים הנוצרים באזורים של נוירוגנזה במוח הבוגר, כגון אזורי המוח התת-ונטריקולריים והתת-גרנולריים. Reelin נמצא לא רק במוח, אלא גם בכבד, בבלוטת התריס, באדרנל, בשדיים, בחצוצרות הרחם ובריכוזים נמוכים יותר במגוון של רקמות אנטומיות נוספות בגוף.
הביטוי reelin מקורו בהליכה מתנודדת של עכבר reeler, שנמצא חסר את חלבון זה במוח, והיה הומוזיגוטי למוטציה בגן RELN (Falconer ב-J Genet משנת 1951). הפנוטיפ העיקרי הכרוך באובדן של פעילות reelin הוא הכישלון של ההתמקמות הנוירונלית ב-CNS המתפתח בעובר. עכברים שהם הטרוזיגוטיים למוטציה בגן RELN, בהם פגמים נוירו-אנטומיים פחותים מבטאים מאפיינים הקשורים למפגעים פסיכוטיים (Tueting וחב' ב-Neurosci Behavior Rev משנת 2006). מוטציות ספונטניות שימושיות זוהו בתחילה בעיקר בתחום הפגיעה המוטורית תוך זיהוי עכברים פגועים שהתקשו בתנועה בכלוב בשגר של עכברים, ואופי הפגיעות המוטוריות הקנה לעכברים הפגועים כינויים כגון reeler ,weaver ,lurcher או staggerer. כאמור עכבר reeler תואר לראשונה בשנת 1951 באוניברסיטת אדינבורג. מחקרים היסטו-פתולוגיים בשנות ה-60 גילו שהמוחון של עכבר זה פחוּת באופן דרמטי בגודלו, וכן התגלה הרס למינרי באזורי מוח אחדים (Hamburgh ב-Develop Biol משנת 1963). בשנות ה-70 נעשתה התצפית של היפוך שכבה תאית ב-neocortex של עכבר זה (Caviness ב-J Compar Neurol משנת 1976).
מולקולות reelin נמצאו יוצרות קומפלקס חלבוני גדול, כאשר ההומודימר היוצר מולקולה זו קשור בקשרים די-סולפידיים תוך-מולקולריים (Utsumomiya-Tate וחב' ב-Proc Natl Acad Sci USA משנת 2000, ו-Kubo וחב' ב-Neurosci Res משנת 2002). אם נכשלת יצירת הדימר לא מתבצעת פוספורילציה יעילה של שיירי טירוזין ב-Dab1 במערכת in vitro. יתרה מכך, 2 הקולטנים העיקריים של reelin מסוגלים ליצור תלכידים (clusters), אך בעיקר משחקים תפקיד חשוב באיתותים הגורמים למתאם התוך-תאי Dab1 לעבור דימריזציה או אוליגומריזציה (Strasser וחב' ב-Mol Cell Biol משנת 2004). בנוסף, reelin כשלעצמו מסוגל לבקע קשרים פפטידיים המחברים חלבונים אחרים בהיותו serine protease, מה שיכול להשפיע על תהליכי ספיחה ונדידה תאית. איתות של reelin מוביל לפוספוריזציה של cofilin 1 שהוא חלבון המגיב עם actin, מה שעשוי לסייע לייצוב של אקטין בשלד התאי, ולמנוע שגשוג של נוירובלסטים בכך שהוא קושר ומעגן תהליכי נדידה של תאים אלה (Chai וחב' ב-J Neurosci משנת 2009, ו-Frotcher וחב' ב-J Neural Transmission משנת 2009).
קולטנים של reelin
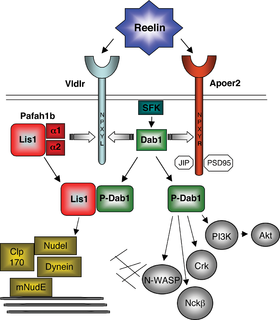
הבקרה של reelin על אינטראקציות בין-תאים מתבצעת על ידי קישורו לשני חברים של משפחת ה-LDL receptor gene, שהם VLDLR ו-ApoER2 (על פי D'Arcangelo וחב' ב-Neuron משנת 1999, Hiesberger וחב' באותו כתב עת מאותה שנה, ו-Benhayon וחב' ב-Mol Brain Res משנת 2003). שני הקולטנים העיקריים של reelin הם בעלי תפקידים שונים: VLDLR אחראי ל-stop signal, בעוד ש-ApoER2 חיוני לנדידה של נוירונים נאו-קורטיקליים (Hack וחב' ב-Development משנת 2007). הודגם גם שהאזור ה-N טרמינלי של reelin, אזור השונה מהמקטע ב-reelin המגיב עם VLDLR/ApoER2, נקשר לקולטן של α-3-β-1 integrin (על פי Schmid וחב' ב-Cerebral Cortex משנת 2005). לאחר קישורו לקולטניו, מוחדר reelin לתוך התא בתהליך אנדוציטוזה והמקטע ה-N טרמינלי שלו מופרש מחדש (Hibi ו-Hattori ב-FEBS lett משנת 2009). מקטע זה המופרש החוצה, עשוי לשרת לאחר הלידה למניעה של צמיחת-יתר של דנדריטים אפיקליים של נוירונים פירמידליים בשכבות II/III של קליפת המוח, תוך שהוא פועל במסלול בלתי-תלוי בקולטנים של reelin (על פי Chameau וחב' ב-Proc Natl Acad Sci USA משנת 2009).
קולטנים של reelin נמצאים כל פני נוירונים ותאי glia. יתרה מכך, תאי glia רדיאליים, מבטאים את אותה כמות של ApoER2, אך כמות הקולטן VLDLR על פניהם קטנה פי-10 (על פי Hartfuss וחב' ב-Development משנת 2003). חיזוק של השפעת reelin נגרם על ידי האינטראקציה של ApoER2 עם הקולטן NMDA. אינטראקציה זו מתרחשת כאשר ב-ApoER2 מכיל אזור המקודד על ידי exon 19. על פי מחקר אחד, ביטוי reelin בהיפוקמפוס גדל במהירות כאשר קיים צורך לאגור זיכרון, ואנזימים מסוג demethylase "פותחים" את הגן RELN (על פי Miller ו-Sweatt ב-Neuron משנת 2007).
פיזור רקמתי והפרשת reelin
מחקרים הראו ש-reelin נפקד מהבועיות הסינפטיות והוא מופרש במסלול של הפרשה קונסטיטוטיבית, כאשר הוא אגור בבועיות הפרשה ב-Golgi (Lacor וחב' ב-Proc Natl Acad Sci USA משנת 2000). בעת התפתחות המוח מופרש reelin בקליפת המוח ובהיפוקמפוס על ידי תאי Cajal-Retzius (Meyer וחב' ב-Cerebl Cortex משנת 1997). תאים המבטאים reelin במוח עובר או יילוד, מופיעים בעיקר באזור השולי (marginal zone או MZ) של קליפת המוח ובשכבה הגרנולרית הסובפיאלית (Subpial granular layer אוSGL) (Meyer ו-Goffinet ב-J Compar Neurol משנת 1998), וכן ב- stratum lacunosum-moleculare בהיפוקמפוס ובשכבה השולית העליונה של ה-dentate gyrus. במוחון המתפתח, reelin מתבטא לראשונה בשכבה הגרנולרית החיצונית, לפני נדידת התאים הגרנוליים לשכבה הפנימית של התאים הגרנולריים (Nielsen וחב' ב-E J Neurosci משנת 1997). הסינתזה של reelin דועכת במהירות לאחר שהגיעה לשיאה מיד לאחר הלידה, ואכן בחומר הלבן של המוח הבוגר, רק כמויות זעירות של reelin מתגלות על ידי צביעה ספציפית של חלבון זה בנוירונים האינטרסטיציאליים (Suárez-Solá וחב' ב-Front Neuroanatomy משנת 2009).
מחוץ למוח, ניתן למצוא reelin בדם, בכבד, ב-pars intermedia של ההיפופיזה, ובתאי chromaffin באדרנל (Smalheiser וחב' ב-Proc Natl Acad Sci USA משנת 2000), כאשר בכבד ממוקם reelin בתאי stellate (Samama ו-Boehm ב-Anatom Rec משנת 2005). הביטוי של reelin גדל כאשר הכבד ניזוק, וחוזר לערכיו הנורמליים כאשר הנזק מתוקן (Cobold וחב' ב-J Hepatol משנת 2002). בעיניים, מופרש reelin על ידי תאי גנגליון ברשתית, ונמצא כמו כן בשכבה האנדותליאלית של הקרנית (Pulido וחב' ב- Graefe's Arch Clin Exp Ophthalmol משנת 2007). כמו בכבד, הביטוי של reelin בעין גדל עם נזק לרקמה זו. Reelin מיוצר גם על ידי odontoblasts, שהם התאים בשולי מוך השן (dental pulp), הן במהלך תהליך האודוטוגנזה והן בשן הבשלה (Buchaille וחב' ב-Matrix Biol משנת 2000). יש הסבורים שאודונטובלסטים משמשים בתפקיד נוסף כתאים סנסוריים המסוגלים להעביר איתותי כאב לקצות עצבים, ועל פי השערה זו reelin משתתף בתהליך זה על ידי הגברת המגע בין אודונטובלסטים לקצות העצבים (Maurin וחב' ב-Matrix Biol משנת 2004).
המבנה של reelin
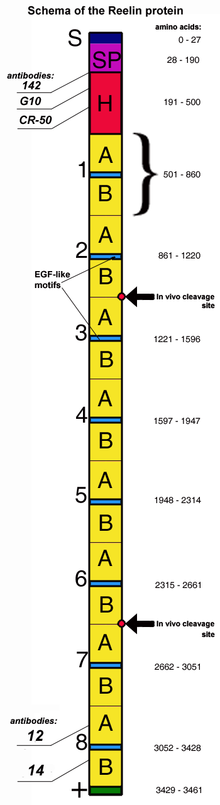
הגן RELN המקודד ל-reelin באדם ממוקם על הזרוע הארוכה של כרומוזום 7 באתר 7q22.1. הגן RELN מכיל 65 אקסונים שאורכם המצטבר kb450 (Royaux וחב' ב-Genomics משנת 1997). במבנה גן זה זוהו שני אתרים של העתק שעתוק, ושני אתרי polyadenylation. Reelin מורכב מ-3,461 חומצות אמינו ומשקלו המולקולרי 388 קילו-דלטון (Yasui וחב' ב-Proc Natl Acad Sci USA משנת 2007). ל-reelin יש גם פעילות של serine protease (Quattrocchi וחב' ב-J Biol Chem משנת 2002). חלבון ה-reelin מתחיל עם 27 חומצות אמינו המהוות signaling peptide, המלוות על ידי אזור הדומה ל- F-spondin (המכונה reeler domain) ומסומן כ-SP בתרשים למטה, ועל ידי אזור ייחודי ל-reelin, המסומן ב-H. לאחר מכן מופיעים שמונה repeats בגודל של 300–350 חומצות אמינו. Repeats אלה קרויים reelin repeats והם מכילים במרכזם motif של epidermal growth factor. המחלק כל repeat לשני subrepeats, האחד ידוע כ-BNR/Asp-box repeat, והשני ידוע כ-EGF-like domain (Nogi וחב' ב-EMBO J משנת 2006).
המקטע האחרון של reelin מכיל את הקצה ה-C טרמינלי הקצר והמאוד בסיסי של החלבון המסומן ב-"+", המכיל 32 חומצות אמינו. מקטע זה מאוד משומר והוא זהה ב-100% בין כל היונקים שנחקרו. הייתה השערה שמקטע C טרמינלי זה נחוץ להפרשת reelin, זאת כיוון שמוטציית Orleans reeler בה יש חסר מוחלט של מקטע זה, אינה מסוגלת להפריש reelin וגורמת להצטברותו בציטופלזמה. עם זאת, מחקרים אחרים לא מאששים את הקשר המידי בין המקטע ה-C טרמינלי והפרשת reelin (Nakano וחב' ב-J Biol Chem משנת 2007). Reelin עובר ביקוע in vivo בשני אתרים הממוקמים לאחר מקטעים 2 ו-6 בערך בין repeats2 ו-3 ובין repeats 6 ו-7 מה שגורם ליצירה של שלושה מקטעים (Lambert de Rouvroit וחב' ב-Exp Neurol משנת 1999). ביקועים אלה אינם מפחיתים את פעילות reelin שכן המקטעים 3–6 מסוגלים כשלעצמם להיקשר לקולטנים של ליפופרוטאין, לגרות את הפוספורילציה של Dab1 כמו גם לחקות את התפקודים של reelin במהלך התפתחות השכבתיות של קליפת המוח (Jossin וחב' ב-J Neurosci משנת 2004). יתרה מכך, העיבוד של reelin על ידי נוירונים אמבריונליים, עשוי להיות נחות עבור קורטיקו-גנזה תקינה (Jossin וחב' באותו כתב עת משנת 2007).
גורמים המשפיעים על ביטוי reelin
הביטוי של reelin מושפע על ידי מספר גורמים מלבד מספרם של תאי Cajal-Retzius. לדוגמה, גורם השעתוק TBR1 (או T-box, brain) החיוני בהתפתחות המוחית העוברית, ובהתמיינות והנדידה של נוירונים, הקשורים בוויסות התפתחות קליפת המוח, וקשור בהיעדרו לפיגור למידה ועיכוב יכולות דיבור כמו גם בתסמונת הרצף האוטיסטי, מווסת את פעילות RELN (על פי Wang וחב' ב-Neuron משנת 2004). ברמה הגבוהה יותר, טיפול אימהי מסור בחולדות בימי החיים הראשונים, נמצא כרוך בביטוי של reelin בעיקר בהיפוקמפוס (Weaver וחב' ב-Proc Natl Acad sci USA משנת 2006), ובקליפת המוח (Smit-Rigter וחב' ב-PLos One משנת 2009). מחקר אחד מצא שחשיפה ממושכת של מכרסמים ל-corticosterone, הפחיתה משמעותית נוכחות reelin בהיפוקמפוס, ממצא הקשור כנראה לתפקיד ההיפותטי של קורטיקו-סטרואידים בתהליכי דיכאון (Lussier וחב' ב-Neurosci Lett משנת 2009). מחקר פוסט-מורטם קטן, מצא מתילציה מוגברת של הגן RELN באנשים בוגרים, לעומת צעירים שנפטרו לפני הבשלות המינית (Lintas ו-Persico ב-NeuroReport משנת 2010).
פעילות reelin במערכת העצבים במבוגרים
במוח הבוגר reelin משחק תפקיד חיוני ב-2 אזורים הפעילים ביותר בנוירוגנזה, האזור התת-ונטריקולרי וה-dentate gyrus. במינים אחדים של בעלי חיים, נוירובלסטים מהאזור התת-ונטריקולרי נודדים במבנה שרשרתי במה שקרוי rostral migratory stream (להלן RMS) עד הגיעם ל-olfactory bulb, שם reelin מפרק את המבנה השרשרתי לתאים בודדים המסוגלים להמשיך לנדוד באופן עצמאי. נוירונים אלה משנים את צורת נדידתם מטנגנציאלית לרדיאלית, תוך שהם נעזרים בסיבי glia רדיאליים לכוון את מסלולם. יש מחקרים המראים שלאורך ה-RMS עצמו, שני הקולטנים VLDLR ו-ApoER2, והמרכיב התוך-תאי Dab1, מתפקדים באופן בלתי תלוי ב-reelin (על פי Andrade וחב' ב-Proc Natl Acad Sci USA משנת 2007), זאת בהשפעת ליגנד שהוצע, throbospondun-1 (על פי Blake וחב' ב-EMBO J משנת 2008). ב-dentate gyrus הבוגר, reelin מספק הדרכה לנוירונים המגיעים באופן קבוע לשכבת תאי ה-granule מהאזור התת-גרנולרי, ובכך שומרים על הקומפקטיות של שכבה זו (Frotcher וחב' ב-Cerebral cortex משנת 2003).
מחקר מראה שהביטוי של reelin עולה ככל שקליפת המוח נעשית מורכבת יותר, ומגיע לשיאו בתלות בתאי Cajal-Retzius באקסונים של תאי עצב (Molnar וחב' ב-Eur J Neurosci משנת 2006). נמצא ש-reelin מופיע ב-telencephalon של כל בעלי החוליות שנלמדו, אם כי בגרסאות מתווה שונות. לדוגמה, דגי Zebra חסרים תאי Cajal-Retzius, ובהם reelin מופרש על ידי נוירונים אחרים.(Perez-Garcia וחב' ב-J Chem Neuroanatom משנת 2001, ו-Costagli וחב' ב-J Comp Neurol משנת 2002).
אינטראקציה עם Cdk5
ווסת מרכזי בנדידה של נוירונים, הוא Cdk5 או cyclin-dependent kiase 5, מסוגל לזרחן את Dab1 (על פי Arnaud וחב' ב-Mol Cell Biol משנת 2003, ו-Ohshima וחב' ב-Brain Res משנת 2007), כמו גם יעדים ציטוזוליים נוספים של איתות reelin, כגון Tau (על פי Kobayashi וחב' ב-FEBS Lett משנת 1993), ו-Lis1 שהוא אחד מיעדי Dab1 (על פי Sasaki וחב' ב-Neuron משנת 2000). ההשריה של LTP על ידי reelin בפרוסות של ההיפוקמפוס, אינה מתבצעת בעכברי knockout ב-p35 (על פי Beffert וחב' ב-J Neurosci משנת 2004). מולקולת p35 היא משפעלת מרכזית של Cdk5, ועכברי knockout כפולים ב-p35/Dab1, ב-p35/RELN, ב-p35/ApoER2 וב-p35/VLDLR, מפגינים פגיעה בנדידה נוירונלית (Ohshima וחב' ב-Proc Natl Acad Sci USA משנת 2001), מה שמצביע במסלולים של קורטיקוגנזה נורמלית על פעולה סינרגיסטית של ApoER2/VLDLR→Dab1→ p35/39→Cdk5.
פתולוגיות הקשורות ל-reelin
Reelin הוצע כמולקולה הכרוכה בפתוגנזה של מספר מחלות מוחיות. הביטוי של חלבון זה נמצא נמוך באופן משמעותי בסכיזופרניה, ובתסמונת דו-קוטבית פסיכוטית (Fatemi וחב' ב- Mol Psychiatr משנת 2000), אך הסיבה לממצא זה אינה ברורה שהרי מחקרים מראים שתרופות פסיכוטרופיות כשלעצמן משפיעות על הביטוי של reelin. יתרה מכך, היפותזות אפּיגנטיות שנועדו להסביר את ההבדלים ברמות של ביטוי reelin (Grayson וחב' ב- Schizophrenia Research Forum משנת 2008) שנויות במחלוקת (Tochigi וחב' ב- Biol Psychiatr: משנת 2008, ו- Mill sadzadeh וחב' ב-Am J Hum Genet משנת 2008). חסר מוחלט של reelin גורם לסוג מסוים של ליסְאֶנצֶפַליָה שהיא תסמונת תורשתית המתארת תינוקות הנולדים עם מוח חלק, כלומר ללא הקיפולים והשקעים שמאפיינים מוח אנושי נורמלי. Reelin יכול גם למלא תפקיד במחלת אלצהיימר, באפילפסיה של האונה הרקתית ובאוטיזם.
בשנת 1994, הושג אלל חדש של ה-reeler בטכניקה של insertional mutagenesis (על פי Miao וחב' ב-Proc Natl Acad Sci USA משנת 1994). נתון זה סיפק את הסמן המולקולרי הראשון שאיפשר למקם את ה-locus המדויק של הגן המקודד ל-reelin שמופה לאתר 7q22.1, והגן אמנם שובט וזוהה (D'Arcangelo וחב' ב-Nature משנת 1995). קבוצת מחקר יפנית במרכז הרפואי ב-Kochi פיתחה נוגדנים כנגד תמציות מוח תקינות מהעכבר reeler, ונוגדנים אלה זכו לכינוי CR-50, שכן הם הגיבו עם נוירונים ע"ש Cajal-Retzius שלא היו ידועים עד אז (Ogawa וחב' ב-Neuron משנת 1995). הקולטנים של reelin, שהם apolipoprotein E receptor 2 (להלן ApoER2) ו-very-low-density lipoprotein receptor (להלן VLDLR), התגלו על ידי Herz ו- Trommsdorff וחב' שגילו בתחילה שהחלבון ה-adaptor הציטוזולי Dab1, מגיב עם המקטע הציטופלזמטי של חברים במשפחת הקולטן של LDL (על פי Trommsdorff וחב' ב-J Biol Chem משנת 1998). בהמשך הראו חוקרים אלה שעכברי knockout כפולים, דהיינו אלה החסרים ApoER2 וכן את VLDLR האמורים להגיב עם Dab1, לוקים בפגמים בשכבתיות של קליפת המוח בדומה לפגמים שמוצאים בעכבר reeler (על פי TRommsdorff וחב' ב-Cell משנת 1999).
מסלולי הפעילות של reelin הובהרו גם בעזרת עכברים מוטנטיים נוספים, כולל yotari ו-scrambler. עכברים מוטנטיים אלה הם בעלי פנוטיפים הדומים לעכברי reeler אך ללא מוטציות ב-reelin. הודגם שהגן ל-Dab1 אחראי לפנוטיפים של עכברים אלה, שכן החלבון Dab1 היה חסר לחלוטין בעכברי yotari או שהוא בקושי ניתן לזיהוי בעכברי scrambler (Sheldon וחב' ב-Nature משנת 1997). כאשר פוגעים ב-Dab1 מתקבל פנוטיפ הדומה ל-reeler. נראה אם כן ש-Dab1 הוא ווסת מרכזי ב-cascade של האיתותים של reelin.
Reelin וסכיזופרניה
הפחתה בביטוי של ה-mRNA של reelin ושל חלבון זה עצמו, במוחות של חולים סכיזופרניים, דווחה בשנת 1998 על ידי Impagnatiello וחב' ב-Proc Natl Acad Sci USA, וכן בשנת 2000 על ידי Guidotti וחב' ב-Arch Gen Psychiatry. ממצאים אלה אומתו באופן בלתי תלוי במדידות שבוצעו בהיפוקמפוס, במוחון (Fatemi וחב' ב-Schizophrenia Res משנת 2005), בגנגליה הבזאלית (Veldic וחב' באותו כתב-עת משנת 2007) וכן בקליפת המוח (Eastwood ו-Harrison ב-Mol Psychiatry משנת 2003, ו-Abdolmaleky וחב' ב-Am J Med Genet משנת 2005). הפחתה זו ברמת reelin יכולה להגיע עד 50% באזורי מוח שונים, והיא כרוכה בביטוי מופחת של האנזים GAD67 המקטלז הסבת חומצה גלוטמית ל-GABA. הרמות של reelin והאיזופורמים שלו, גם כן מופחתות בדמם של סכיזופרניים, כמו גם באלה עם מפגעים של מצבי-רוח (Fatemi וחב' ב-NeuroReport משנת 2001). הביטוי הקדם-פרונטלי המופחת של reelin mRNA בסכיזופרניה, נמצא כהפרעה המשמעותית ביותר מבחינה סטטיסטית במפגע זה, כפי שנמצא במחקר רב-מוסדי שהתבצע ב-14 מעבדות שונות כיוזמה של קונסורציום Stanley לנוירו-פתולוגיה וסוכם על ידי Knable וחב' ב-Brain Res Bull משנת 2001).
היפר-מתילציה אפיגנטית של DNA בסכיזופרניים, הוצעה כסיבה לירידה ברמת reelin (על פי Grayson וחב' ב-Proc Natl Acad Sci USA משנת 2005, ו-Dong וחב' באותו כתב-עת מאותה שנה). זאת בהסכמה עם תצפיות משנות ה-60 על כך שהזרקת מתיונין לחולים סכיזופרניים, מחמירה באופן חמור את תסמיניהם של 60-70% מתוכם (Pollin וחב' ב-Science משנת 1961, Brune וחב' ב-J Nervous Mental Dis משנת 1962, Park וחב' ב- Arch Gen Psychiatry משנת 1965, ו-Antun וחב' ב-J Psychaitr Res משנת 1971). המנגנון המוצע הוא חלק מההיפותזה האפי-גנטית של הפתו-פיזיולוגיה של סכיזופרניה שנוסחה 2008 על ידי Grayson וחב' ב-Epigenetics משנת 2009).
מחקר postmortem שהשווה את הביטוי של DNA methyltransferase (להלן DMNT1) ו-reelin mRNA בשכבות הקורטיקליות I ו-V של חולים סכיזופרניים ושל ביקורת בריאה, הדגים שבשכבה V, רמות DMNT1 ו-reelin היו נורמליות, ואלו בשכבה I רמת DMNT1 הייתה פי-3 גבוהה יותר, מה שגרם כנראה לירידה פי-2 ברמת reelin (על פי Ruzicka וחב' ב-Mol Psychiatry משנת 2007). ישנן ראיות ששינויים אחרונים אלה, הם בררניים, ו-DMNT1 מבוטא ביתר ב-GABAergic neurons המפרישים reelin, אך לא בשכניהם הגלוטמטרגיים ((Veldic וחב' ב-Proc Natl Acad Sci USA). האתר 7q22.1 בו ממוקם הגן RELN, כרוך עם סכיזופרניה (Wedenoja וחב' ב-Mol Psychaitr משנת 2008), והגן עצמו כרוך במחלה זו במחקר רחב-היקף, שמצא ש-פולימורפיזם rs7341475 מגביר את הסיכון למחלה בנשים אך לא בגברים. נשים עם single-nuclptide polymorphism הן בסיכון הגבוה ב-40% ללקות במחלה, (Shifman וחב' ב-PLos Genet משנת 2008). מחקר אחר מצא שסכיזופרנים הם בעלי רמות נמוכות יותר של VLDLR, אחד משני הקולטנים של reelin בלימפוציטים היקפיים (Suzuki וחב' ב-Schizophrenia Res משנת 2008), ולאחר 6 חודשים של טיפולים אנטי-פסיכוטיים, רמת VLDLR חזרה לנורמה.
Reelin ומחלת אלצהימר
קולטני reelin, ApoER2 ו-DLDLR, שייכים למשפחת הגן המקודד לקולטן של LDL, וכל חברי משפחה זו משמשים קולטנים ל-ApoE, לו יש באדם שלושה איזופורמים (E2, E3 ו-E4). האיזופורם ApoE4 הוא גורם סיכון גנטי מרכזי במחלת אלצהיימר של הגיל המבוגר. נתון זה הביא להשערה שהקולטנים של ApoE4 הם מרכיב חשוב בפתוגנזה של מחלה זו (Herz ו-Chen ב- Nature Rev Neuroscience משנת 2006, ו-Botella-Lopéz ב-Proc Natl Acad Sci USA משנת 2006). מחקר אחד קבע שהביטוי של reelin כמו גם מתווי גליקוזילציה עוברים שינוי במחלת אלצהיימר. בקליפת המוח של חולים אלה, רמות reelin היו גבוהות ב-40% השוואה לביקורת, אך היו נורמליות במוחון (Seripa וחב' ב-J Alzheimers' Dis משנת 2008).
ממצאים אלה הם בהסכמה עם מחקר קודם שהראה נוכחות של reelin הכרוך עם ה- amyloid plaques במודל של המחלה בעכברים טרנסגניים (Wirths וחב' ב-Neurosci Lett משנת 2001). מחקר גדול של Baloyannis וחב' משנת 2007 ב- Acta Oto-Laryngologica, הראה שינויים בגן RELN הכרוכים במחלת אלצהיימר בנשים. המספר של תאי Cajal-Retzius המייצרים reelin, נמצא נמוך משמעותית בשכבה הקליפתית הראשונה בחולי אלצהיימר (Hoe וחב' ב-J Neurosci משנת 2009, ו- Durakoglugil וחב' ב-Proc Natl Acad Sci USA משנת 2009). מחקר אחר הראה ש-reelin מגיב עם amyloid precursor protein (Chen וחב' באותו כתב עת משנת 2010). מחקר נוסף in vitro הראה ש-reelin מסוגל לבטל את השפעת השיכוך של פעילות הקולטן של NMDA, המושרית על ידי Aβ. תכונה זו של reelin מאופננת על ידי האיזופורמים של ApoE, המשנים באופן בררני את המחזור של הקולטנים ApoER2, AMPA ו-NMDA.
תפקיד פתולוגי אפשרי של reelin ב-lissencephaly
ליסְאֶנצֶפַליָה היא תסמונת תורשתית (הידועה גם כתסמונת Norman-Roberts), בה תינוקות נולדים עם מוח חלק, ללא הקיפולים והשקעים שמאפיינים את מוח אנושי נורמלי, ועם היפו-פלזיה של המוחון (Hong וחב' ב-Nature Genet משנת 2000, ו-Crino ב-Epilepsy Curr משנת 2001). פגם מוחי זה גורם לפיגור שכלי קשה ביותר. גופם של תינוקות אלה מתפתח בצורה רגילה, אך יכולתם השכלית מוגבלת ביותר, ללא אפשרות דיבור, תנועה מוגבלת כתוצאה מהיפוטוניה, ואי יכולת ליצור קשר עם הסובבים אותם. גם פרכוסים מאפיינים תסמונת זו. תוחלת חייהם של תינוקות אלה קצרה ביותר. פגיעה בגן RELN נחשבת כגורם למפגע זה. מוטציות פוגעות ב-splicing של עותקי RELN mRNA, מה שמביא ליצירת כמויות זעירות של reelin. בשנת 2007 תיארו Zaki וחב' ב-Am J Med Genet טרנסלוקציה כרומוזומלית חדשה, הגורמת כנראה לתסמונת.
תרופות פסיכו-טרופיות
כיוון שיש הכורכים את reelin במספר מפגעים מוחיים, וביטויו בדרך כלל נמדד לאחר המוות, קביעת ההשפעה האפשרית של תרופות בהחלט חשובה. בהתאם להשערה האפי-גנטית, תרופות המשפיעות על האיזון לטובת דה-מתילציה, הן בעלות פוטנציאל לשכך את ההשפעה המופחתת של RELN ושל GAD67 הנגרמת על ידי מתילציה. GAD67 (או האנזים glutamate decarboxylase המקטלז את דה-קרבוקסילציה הופך חומצה גלוטמית ל-GABA). במחקר אחד נמצא ש-clozapine ו-sulpiride, אך לא haloperdol או olanzapine, מגבירים את הדה-מתילציה של שני הגנים האמורים בעכברים שטופלו קודם לכן על ידי מתיונין (Dong וחב' ב-Proc Natl Acad Sci USA משנת 2008). חומצה ולפרואית, שהיא מעכב של histone deacetylase, כאשר היא נלקחת בשילוב עם תכשירים אנטי-פסיכוטיים, מומלצת כבעלת יתרונות אחדים. אך ישנם מספר מחקרים שאינם מאששים את התאוריה האפי-גנטית, ומחקר של Fatemi וחב' ב-Schizophrenia Res משנת 2009, לא מצא הגברה של ביטוי RELN על ידי חומצה ולפרואית. מחקר אחרון זה היה מפורט יותר מקודמיו, והוא בחן בחולדות את השפעת חומצה ולפרואית. מחקר זה מדד בקליפת המוח את הביטוי של משתתפים בשרשרת האיתותים של reelin, כגון Gsk3B, Dab1 ו-VLDLR בנוסף לביטוי של reelin עצמו, וכן את הביטוי של GAD65 ו-GAD67.
קולטנים של reelin
הבקרה של reelin על אינטראקציות בין-תאים מתבצעת על ידי קישורו לשני חברים של משפחת ה-LDL receptor gene, שהם VLDLR ו-ApoER2 (על פי D'Arcangelo וחב' ב-Neuron משנת 1999, Hiesberger וחב' באותו כתב עת מאותה שנה, ו-Benhayon וחב' ב-Mol Brain Res משנת 2003). שני הקולטנים העיקריים של reelin הם בעלי תפקידים שונים: VLDLR אחראי ל-stop signal, בעוד ש-ApoER2 חיוני לנדידה של נוירונים נאו-קורטיקליים (Hack וחב' ב-Development משנת 2007). הודגם גם שהאזור ה-N טרמינלי של reelin, אזור השונה מהמקטע ב-reelin המגיב עם VLDLR/ApoER2, נקשר לקולטן של α-3-β-1 integrin (על פי Schmid וחב' ב-Cerebral Cortex משנת 2005). לאחר קישורו לקולטניו, מוחדר reelin לתוך התא בתהליך אנדוציטוזה והמקטע ה-N טרמינלי שלו מופרש מחדש (Hibi ו-Hattori ב-FEBS lett משנת 2009). מקטע זה המופרש החוצה, עשוי לשרת לאחר הלידה למניעה של צמיחת-יתר של דנדריטים אפיקליים של נוירונים פירמידליים בשכבות II/III של קליפת המוח, תוך שהוא פועל במסלול בלתי-תלוי בקולטנים של reelin (על פי Chameau וחב' ב-Proc Natl Acad Sci USA משנת 2009).
קולטנים של reelin נמצאים כל פני נוירונים ותאי glia. יתרה מכך, תאי glia רדיאליים, מבטאים את אותה כמות של ApoER2, אך כמות הקולטן VLDLR על פניהם קטנה פי-10 (על פי Hartfuss וחב' ב-Development משנת 2003). חיזוק של השפעת reelin נגרם על ידי האינטראקציה של ApoER2 עם הקולטן NMDA. אינטראקציה זו מתרחשת כאשר ב-ApoER2 מכיל אזור המקודד על ידי exon 19. על פי מחקר אחד, ביטוי reelin בהיפוקמפוס גדל במהירות כאשר קיים צורך לאגור זיכרון, ואנזימים מסוג demethylase "פותחים" את הגן RELN (על פי Miller ו-Sweatt ב-Neuron משנת 2007).
התפקיד של reelin בלמידה וזיכרון
החלבון reelin משתתף בתהליך הזיכרון המרחבי כמו גם בזיכרון של פחד. בעכברים בוגרים wild-type, הזרקת reelin מגבירה לא רק את הפלסטיות של הסינפסה, אלא גם את הזיכרון המרחבי (Ishii ב-Front Cell Neurosci משנת 2016, ו-Lussier וחב' באותו כתב עת מאותה שנה). עכברים החסרים את ApoER2 או את VLDLR, הם בעלי יכולת מופחתת לרכוש זיכרון של אירוע מפחיד התלוי בהיפוקמפוס (Weber וחב' ב-J Biol Chem משנת 2002). עכברי knockout ב-VLDLR נמצאו בעלי חסר משמעותי בזיכרון-פחד בהשוואה לעכברי wild-type מאותו שגר, ואילו עכברי knockout ב-ApoER2 לא סבלו מחסר זה. תפקידו של reelin בזיכרון-פחד נתמך על ידי התצפיות שעכברי reeler הטרוזיגוטיים הם בעלי כושר מופחת של למידת פחד הֶקְשֵׁרִית (קוֹנְטֶקְסְטוּאָלִית) לטווח קצר (Qiu וחב' ב-Neurobiol Learn Mem משנת 2006, כמו גם חסר בשתי הצורות של זיכרון-פחד לטווח ארוך (Iafrati וחב' ב-Mol Psychiatr משנת 2014).
הוראות לביצוע הבדיקה
את הדם יש לדגום ללא כל הכנה מיוחדת כגון צום, למבחנה כימית (פקק אדום או צהוב). לאחר סרכוז של 15 דקות הצנטריפוגה מקוררת, יש להקפיא את הנוזל העליון. הדגימה יציבה למשל 3 חודשים בהקפאה, למשך 4 שבועות בקירור או למשך 48 שעות בטמפרטורת החדר. מדידת reelin מתבצעת בשיטת ELISA, או למטרה חצי כמותית בשיטת Western blot.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק