שלפוחית רגיזה - מנגנוני פעולה חדשים בטיפול - 2017 - Overactive bladder treatment - new mechanisms of action drugs
הופניתם מהדף שלפוחית רגיזה - מנגנוני פעולה חדשים בטיפול (2017) - Overactive bladder - new drugs mechanisms of action לדף הנוכחי.
| שלפוחית רגיזה - מנגנוני פעולה חדשים בטיפול (2017) | ||
|---|---|---|
| Overactive bladder - new drugs mechanisms of action | ||
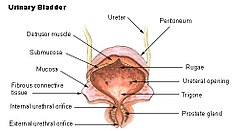
| ||
| שמות נוספים | מנגנוני פעולה חדשים בטיפול בשלפוחית רגיזה | |
| יוצר הערך | ד"ר שחר אהרוני | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – סל תרופות 2018, שלפוחית רגיזה
תלונות על מערכת השתן התחתונה - LUTS (Lower Urinary Tract Symptoms) מופיעות בנשים ובגברים בשכיחות דומה ועולה בהתאמה לגיל. תלונות אלו נחלקות לשלב האגירה (Storage), הריקון (Voiding) ותסמיני בתר השתנה (Post micturition phase). האבחנה המבדלת של תלונות אלו משתנה בהתאם לגיל, למגדר ולמחלות הרקע.
הפרעות בשלב האגירה של שלפוחית השתן יכולות לנבוע מפעילות יתר של שלפוחית השתן, אשר מכונה גם "שלפוחית רגיזה" או בלעז - OverActive Bladder) OAB).
תסמונת זו אופיינה על ידי ICS (International Continence Society) ב-2002 כמשלבת דחיפות במתן שתן עם או בהיעדר אי נקיטת שתן מדחיפות, אשר לרוב מלווה בעלייה בתכיפות הטלת השתן היומית והלילית, זאת לאחר שנשללה פתולוגיה אחרת של מערכת השתן. הדחיפות בהטלת השתן, תחושת דחף פתאומי אשר קשה מאוד לדחות אותו, היא התסמין העיקרי בבסיס התסמונת.
מספר עבודות אפידמיולוגיות (Epidemiological) בדקו את שכיחות התסמונת בעולם המערבי. מחקר ה-NOBELE (The National Overactive Bladder Evaluation) הראה שכיחות מגדרית דומה של 17 אחוזים מהאוכלוסייה הנדגמת. שכיחות התסמונת עולה עם הגיל, מעל גיל 75 יסבלו ממנה כ-31 אחוזים מהנשים ו-42 אחוזים מהגברים. בכל קבוצות הגיל בגברים, שכיחות פעילות יתר של השלפוחית ללא דליפת שתן (שלפוחית "רגיזה יבשה") הייתה גבוהה יותר משמעותית מתסמונת המשולבת עם דליפת שתן (שלפוחית "רגישה רטובה"). בנשים שכיחות התסמונת ה"רטובה" דומה לשכיחות התסמונת ה"יבשה".
מחקר EPIC הראה תוצאות דומות אך בנוסף תרם מידע נוסף הנוגע לפגיעה המתמשכת באיכות החיים, סיכון לתחלואה נלווית, עלויות כספיות, צורך בטיפול ואובדן ימי עבודה בקרב הסובלים מתסמונת פעילות היתר של שלפוחית השתן.
הטיפול ביתר פעילות של שלפוחית השתן מיועד בראש ובראשונה להיטיב את תלונות החולה, כלומר להפחית את תחושת הדחיפות, לרווח את תכיפות מתן השתן ולמנוע את אירועי דליפת השתן מדחיפות.
אנו עדים לשינוי בטיפול בתסמונת השלפוחית הרגיזה הנובע מהטמעה של מנגנוני פעולה הנושאים עימם פתרונות טיפוליים לחולים העמידים לטיפול המקובל. על אף שהאטיולוגיה (Etiology) בבסיס התסמונת ומנגנוני הטיפול עדיין אינם ברורים לחלוטין, ההתקדמות המחקרית מביאה אותנו לפתחו של עידן שבו נוכל לתת טיפול מותאם בצורה מיטבית יותר לתלונות החולה העומדות בבסיס התסמונת.
הטיפול בתסמונת
הערכת תוצאות הטיפול מבוססות על השינוי בתסמינים ובאיכות החיים. הטיפול בתסמונת זו, כפי שהוגדר על ידי איגודים מקצועיים שונים בעולם, כולל גישה מדורגת (Stepwise) תוך התאמת הטיפול למאפייני המטופל, מחלות הרקע והטיפול התרופתי שאותו הוא נוטל, בהתייחס לטיפולי העבר אותם קיבל, למידת יעילותם ולתופעות הלוואי של אותם טיפולים.
השלב הראשון מבוסס על טיפול התנהגותי הכולל שינוי אורחות חיים, סיגול אורח חיים המתאים לתסמונת, פיזיותרפיה (Physiotherapy) לחיזוק ואימון רצפת האגן והשלפוחית וכיוצא בזה. כישלון הטיפול השמרני יוביל לקו השני בטיפול - הטיפול התרופתי.
הגורם/גורמים ל-OAB עדיין אינו ידוע במלואו אך מחקרים מרמזים כי התסמינים נובעים ממקור תחושתי. גירוי אפרנטי (Afferent) מוגזם (מהשלפוחית למערכת העצבים המרכזית) או בעיבוד לקוי של הגירוי במערכת העצבים המרכזית. מאידך, נמצאו עדויות למעורבות מוטורי (Motor) - התכווצויות לא מבוקרות של שריר השלפוחית בזמן מילוי שלפוחית השתן - DO (Detrusor Overactivity) אשר באות לידי ביטוי קליני כתחושת דחיפות במתן שתן עד דליפת שתן מדחיפות.
השימוש ב-β3 Agonists
שריר השלפוחית, ה-Detrusor, נמצא תחת השפעה קבועה סימפתטית (Sympathetic) ופארא-סימפתטית (Parasympathetic) במשך כל שלבי המילוי והריקון של השלפוחית. בעוד שבגוף מוכרים כחמישה תת-קולטנים מוסקריניים (Muscarinic) (M5-M1), בשלפוחית נמצאים קולטנים מסוג M2 ו-M3. הפעלת הקולטנים מסוג M2 גורמת לכיווץ ה-Detrusor. הפעלת הקולטנים מסוג M3 (66 אחוזים מהקולטנים המוסקריניים בשלפוחית) כלל אינה גורמים לכיווץ ה-Detrusor תחת תנאים רגילים. הם משמשים לויסות הפעילות הסימפתטית. בניגוד לתאוריות עבר, הפעילות הכולינרגית (Cholinergic) אינה אופיינית רק לשלב הריקון אלא מתרחשת באופן רציף בתהליך מילוי השלפוחית ועיקרה איזון והיזון המערכת הסימפתטית.
למערכת הסימפתטית שני סוגי קולטנים בשלפוחית השתן. קולטני α הנמצאים בעיקר בצוואר כיס השתן ועיקר חשיבותם בתפקוד מוצא השלפוחית, וקולטני β3 אשר להם תפקיד בוויסות כיווץ ה-Detrusor.
שלב מילוי השלפוחית, האגירה, מאופיין ב-Detrusor רפוי המאפשר קיבולת מיטבית של כיס השתן. הרפיית השריר נובעת מפעולה משולבת של רצפטורי β3 אשר גורמים להרפיה פעילה של השריר ובנוסף לדיכוי הפעילות המוסקרינית על ידי עיכוב הקולטנים מסוג M3.
הטיפול הקלאסי ב-OAB מבוסס על תכשירים אנטימוסקרינים (Antimuscarinic). מחקרים קליניים הראו כי השפעת תרופות אלו מתבטאת בשיפור תלונות שלב האגירה של השלפוחית ללא השפעה משמעותית על שלב ריקון השלפוחית.
נכנס לשימוש התכשיר שהוא β3 Agonist, Mirabegron (Betmiga). התרופה אושרה לשימוש על ידי ה-FDA (Food and Drug Administration) עוד ב-2012 לטיפול בבוגרים עם תסמיני פעילות יתר של שלפוחית השתן.
מספר עבודות 3 Phase הדגימו יעילות מינונים שונים של התרופה[1],[2],[3], תוצאותיהם אינן שונות באופן מובהק מהחלופות האנטי מוסקריניות הקיימות היום[2],[4]. בנוסף, היעילות והבטיחות ארוכת הטווח של Mirabegron הוכחו בעבודות[5],[6]. לראיה, איגודים מקצועיים, הן בצפון אמריקה והן באירופה, הכלילו את התרופה הנזכרות למעלה בקווים המנחים לטיפול בשלפוחית רגיזה במקביל לטיפול המקובל. מספר עבודות נוספות[7],[8] הראו את יעילות התרופה כטיפול משולב עם אנטי-כולינרגים (Anticholinergic), לחולים עם תגובה לא מספקת לטיפול התרופתי. הטיפול המשולב לא גרם לעלייה בשכיחות תופעות הלוואי והראה יעילות מוכחת סטטיסטית.
היתרון היחסי של התרופה, בהשוואה לתרופות האנטי-כולינרגיות, כולל זמן התחלת פעולה מהיר יותר ופרופיל תופעות לוואי משופר. מספר עבודות הראו שיפור יחסי בהיענות חולים לטיפול ב-Mirabegron, בהשוואה לטיפול מקביל באנטי-כולינרגים, כאשר שיפור זה מיוחס לפרופיל תופעות הלוואי[9]. בנוסף, הטיפול המשולב הראה שיפור ביעילות הטיפול ללא החמרה בתופעות הלוואי בהשוואה לטיפול בכל תרופה כשלעצמה[7].
כאשר הטיפול הפרמקולוגי (Pharmacological) אינו מוביל לשיפור הרצוי בתלונות המטופל, או כאשר תופעות הלוואי הכרוכות בטיפול מונעות מהמטופל להמשיך לנטול אותן, עומדות בפני המטופל מספר אפשרויות להתקדם לטיפול התערבותי זעיר פולשני.
השימוש ברעלן הבוטולינום - Intra detrusor BoNTA injection
רעלן הבוטלינום BoNTA (Botulinum Toxin A) הוא Neurotoxin שמיוצר על ידי חיידק ה-Clostridium botulinum. ידועים כשבעה תת-סוגים של הרעלן, כאשר תת-הסוג (BoNTA) הוא בעל השימוש הקליני הנרחב ביותר. רוב העדויות הקיימות היום בספרות כוללות מידע בנוגע לרעלן ה-OnabotA (OnabotulinumtoxinA) (Botox) אשר בו נעשה השימוש הקליני הנרחב ביותר. הרעלן גורם לביקוע (Cleavage) של חלבונים המשמשים בתהליך האיחוי של השלפוחית לממברנה הציטופלזמטית (Cytoplasmic membrane). זהו קומפלקס (Complex) חלבוני הקרוי Snare proteins וכולל 3 חלבונים. ה-BoNTA גורם לנטרול הקומפלקס על ידי ביקוע ה-25-SNAP (SyNaptosomal-Associated Protein 25). בשלפוחית החלבון הנזכרות למעלה נמצא בקצות העצבים הסימפתטיים, הפארא-סימפתטיים והתחושתיים. עיכוב ההפרשה מהעצבים הפארא-סימפטתיים גורם לירידה בהפרשת Acetylcholine ובכך לדיכוי יכולת הכיווץ של ה-Detrusor. עיכוב ההפרשה מהעצבים התחושתיים מתבטא בירידה בהפרשת נוירופפטידים (Neuropeptides) בעמוד השדרה וב-Urothelium, המעורבים בהעברת האות (Signal) העולה מהשלפוחית למרכזי השליטה בתהליכי ההשתנה בגזע המוח וב-Cortex.
השימוש הראשוני בהזרקת הרעלן לדופן השלפוחית התבצעו בחולים נוירוגנים כדוגמת נפגעי עמוד שדרה וטרשת נפוצה עם עדות אורודינמית (Urodynamuc) להתכווצויות לא רצוניות של ה-Detrusor (DO). מאוחר יותר הוכחה ההשפעה גם בחולי OAB גם בהיעדר DO.
בשנת 2013 פרסם Nitti[10] את העבודה שהניחה את הבסיס לשימוש ב-BoNTA בחולים הסובלים מפעילות יתר של מערכת השתן. במחקר הוכח כי 100 יחידות Botox גורמות לשיפור הנע בין פי 2 ל-4 בהשוואה לאינבו במדדי תפקוד השלפוחית. אחוזי שיפור כאלה לא נצפו באף מחקר אשר העריך יעילות תרופות פומיות בתסמונת פעילות היתר של השלפוחית. תועד שיפור במספר אירועי דליפת השתן מדחיפות ליום (29.9 אחוזים יבשים לחלוטין בקבוצת הטיפול לעומת 6.5 אחוזים בקבוצת האינבו), שיפור במדדי איכות החיים, נפחי ההשתנה וירידה בתכיפות ההשתנה היומית.
המינון המקובל בטיפול ב-OAB הוא 100 יחידות Botox[11]. זוהי למעשה פשרה בין יעילות הטיפול לתופעות הלוואי. הטיפול מוגבל בזמן בשל יכולת הריפוי של האקסון המוטורי (Motor Exon). פרק הזמן שבו הטיפול אפקטיבי מוערך בכ-42 שבועות[12].
תופעת הלוואי המשמעותית בטיפול - איבוד יכולת ההשתנה הספונטנית - היא תלוית מינון, בהזרקת 200 יחידות כ-15–20 אחוזים מהחולים, ואילו ב-100 יחידות 6–8 אחוזים[13]. תופעה זו מוגבלת בזמן, בעוד ב-50 אחוזים מהחולים תהיה חזרה להשתנה ספונטנית בתוך כחודש מתהליך ההזרקה. שאר החולים יראו שיפור מתמשך, כאשר רוב מוחלט של החולים יחזור להשתנה ספונטנית בתוך 6 חודשים מההזרקה.
השימוש בקיצוב סקרלי - SNM (Sacral NeuroModulation)
השימוש בקוצב סקרלי מבוסס על עיקרון הנוירומודולציה (Neuromodulation). בעוד גירוי של עצב גורם להפעלתו/ שיתוקו ולתמונה קלינית מיידית, בנוירומודלוציה הגירוי החשמלי של העצב גורם לשינוי הוויסות העצבי. פעילות ה-Detrusor התקינה משקפת איזון סקרלי תחת שליטה וויסות על-סקרלי (Supra-sacral) של מערכת העצבים הסימפתטית והפארא-סימפתטית. מנגנון הפעולה המדויק אינו ברור לחלוטין. התאוריה המובילה גורסת כי הגירוי החשמלי מוביל לדיכוי/ מודלוציה של מידע אפרנטי מן השלפוחית דרך מסלולים עולים בחוט השדרה אל ה-Pontine micturition center ובכך מדכאים התכווצויות לא רצוניות של ה-Detrusor שמקורן בקשת החזר (Reflex) בחוט השדרה, תוך שימור יכולת ההשתנה הרצונית.
דיווחים ראשונים על שימוש ב-SNM הופיעו ב-1999[14]. מאז חלו שינויים גם בציוד וגם בטכניקה הניתוחית אשר שיפרו את מהימנות ושרידות השתל. הגירוי החשמלי מבוצע על ידי החדרה של אלקטרודה (תחת הרדמה, בחדר ניתוח) דרך התעלה הסקרלית של שורש S3.
עבודות שונות מראות אחוזי תגובה לטיפול ב-60–70 אחוזים מהחולים המראים שיפור העולה על 50 אחוזים בתלונות הדחיפות והתכיפות. אחוזים קטנים יותר (20-5 אחוזים) הראו היעלמות דליפת השתן מדחיפות[15].
עיקר הסיבוכים המתוארים כללו מיגרציה של האלקטרודה, כשלים טכניים וכאב. לאורך כשלוש שנות מעקב, כשליש מהמושתלים נזקקו לניתוח חוזר בשל בעיה בשתל.
ביבליוגרפיה
- ↑ Herschorn S, Barkin J, Castro-Diaz D, Frankel JM, Espuna-Pons M, Gousse AE, et al. A phase III, randomized, double-blind, parallel-group, placebo-controlled, multicentre study to assess the efficacy and safety of the p 3 adrenoceptor agonist, mirabegron, in patients with symptoms of overactive bladder. Urology. 2013;82(2):313-20.
- ↑ 2.0 2.1 Khullar V, Amarenco G, Angulo JC, Cambronero J, H0ye K, Milsom I, et al. Efficacy and tolerability of mirabegron, a p 3-adrenoceptor agonist, in patients with overactive bladder: results from a randomised European-Australian phase 3 trial. European urology. 2013;63(2):283-95.
- ↑ Nitti VW, Auerbach S, Martin N, Calhoun A, Lee M, Herschorn S. Results of a randomized phase III trial of mirabegron in patients with overactive bladder. The Journal of urology. 2013;189(4):1388-95.
- ↑ Batista JE, Kolbl H, Herschorn S, Rechberger T, Cambronero J, Halaska M, et al. The efficacy and safety of mirabegron compared with solifenacin in overactive bladder patients dissatisfied with previous antimuscarinic treatment due to lack of efficacy: results of a noninferiority, randomized, phase IIIb trial. Therapeutic advances in urology. 2015:1756287215589250.
- ↑ Chapple CR, Cardozo L, Nitti VW, Siddiqui E, Michel MC. Mirabegron in overactive bladder: a review of efficacy, safety, and tolerability. Neurourology and urodynamics. 2014;33(1):17-30.
- ↑ Chapple CR, Kaplan SA, Mitcheson D, Klecka J, Cummings J, Drogendijk T, et al. Randomized doubleblind, active-controlled phase 3 study to assess 12-month safety and efficacy of mirabegron, a p 3-adrenoceptor agonist, in overactive bladder. European urology. 2013;63(2):296-305.
- ↑ 7.0 7.1 Abrams P, Kelleher C, Staskin D, Rechberger T, Kay R, Martina R, et al. Combination treatment with mirabegron and solifenacin in patients with overactive bladder: efficacy and safety results from a randomised, double-blind, dose-ranging, phase 2 study (Symphony). European urology. 2015;67(3):577-88.
- ↑ Drake MJ, Chapple C, Esen AA, Athanasiou S, Cambronero J, Mitcheson D, et al. Efficacy and safety of mirabegron add-on therapy to solifenacin in incontinent overactive bladder patients with an inadequate response to initial 4-week solifenacin monotherapy: a randomised double-blind multicentre phase 3B study (BESIDE). European urology. 2016;70(1):136-45.
- ↑ Kim TH, Lee K-S. Persistence and compliance with medication management in the treatment of overactive bladder. Investigative and clinical urology. 2016;57(2):84-93.
- ↑ Nitti V, Dmochowski R, Herschorn S. EMBARK Study Group et al (2013) OnabotulinumtoxinA for the treatment of patients with overactive bladder and urinary incontinence: results of a phase 3, randomized, placebo controlled trial. J Urol.189(6):2186-93.
- ↑ Dmochowski R, Chapple C, Nitti VW, Chancellor M, Everaert K, Thompson C, et al. Efficacy and safety of onabotulinumtoxinA for idiopathic overactive bladder: a double-blind, placebo controlled, randomized, dose ranging trial. The Journal of urology. 2010;184(6):2416-22.
- ↑ Cruz F, Herschorn S, Aliotta P, Brin M, Thompson C, Lam W, et al. Efficacy and safety of onabotulinumtoxinA in patients with urinary incontinence due to neurogenic detrusor overactivity: a randomised, doubleblind, placebo-controlled trial. European urology. 2011;60(4):742-50.
- ↑ Cruz F, Nitti V. Clinical data in neurogenic detrusor overactivity (NDO) and overactive bladder (OAB). Neurourology and urodynamics. 2014;33(S3).
- ↑ Schmidt RA, Jonas U, Oleson KA, Janknegt RA, Hassouna MM, Siegel SW, et al. Sacral nerve stimulation for treatment of refractory urinary urge incontinence. The Journal of urology. 1999;162(2):352-7.
- ↑ van Kerrebroeck PE, van Voskuilen AC, Heesakkers JP, a Nijholt AAL, Siegel S, Jonas U, et al. Results of sacral neuromodulation therapy for urinary voiding dysfunction: outcomes of a prospective, worldwide clinical study. The Journal of urology. 2007;178(5):2029-34.
המידע שבדף זה נכתב על ידי ד"ר שחר אהרוני, היחידה לאורולוגיה תפקודית, המערך האורולוגי, בית החולים בילינסון, המרכז הרפואי רבין, פתח תקוה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק