תרומבומודולין - Thrombomodulin
| מדריך בדיקות מעבדה | |
| תרומבומודולין | |
|---|---|
| Thrombomodulin | |
| שמות אחרים | THBD, CD141, BDCA3, fetomodulin |

| |
| מעבדה | כימיה בדם |
| תחום | תפקודי קרישה |
| טווח ערכים תקין | תחת ל-10 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
האנטיגן שתואר כ-BDCA3 או כ-CD141, התגלה למעשה כזהה ל-TM 0 (על פי Dzionek וחב' ב-Human Immunol משנת 2002). כך התגלה שמולקולה זו מופיעה על פני תת-קבוצה נדירה ביותר (0.02%) של תאים דנדריטים באדם הקרויה MDC2 אם כי תפקידו של TM בתאים אלה אינו ידוע.
מוטציות ב-TM (Thrombomodulin) חשובות יותר במחלות עורקיות מאשר במחלות ורידיות (Fareed ו-Iqbal ב-Diagn Mol Pathol משנת 2017). פולימורפיזם של TM, של שחלוף נוקלאוטיד G על ידי A בעמדה 127 של הגן נחקר בהקשר של הרלוונטיות שלו במחלה עורקית. האלל 25Thr נמצא שכיח יותר בגברים עם אוטם שריר הלב, מאשר באוכלוסיית ביקורת. פולימורפיזם נדיר ב-promoter של הגן ל-TM הידוע כ-33G/A-, משפיע על רמות ה-TM המסיס בפלזמה ומגביר את הסיכון למחלת לב כלילית. נשאים של האלל 33A- נמצאו בעלי שכיחות מוגברת של תהליכי טרשת בעורקים התרדמניים (carotids) בנבדקים מעל גיל 60 שנה.
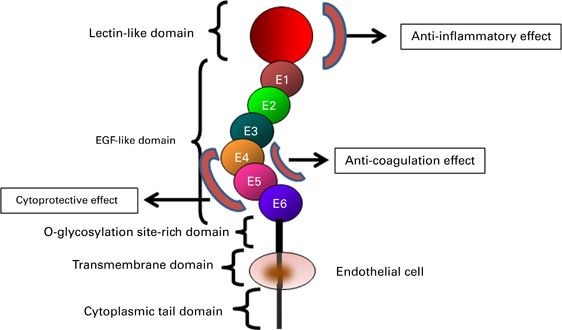
המבנה של TM
TM התגלה בשנת 1982 על ידי Esmon וחב' ב-J Biol Chem, ונמצא שבנוסף להיותו מצפה את שכבת האנדותל הווסקולרי, הוא מופיע באופן נרחב במספר רקמות נוספות, מה שמרמז למספר תפקידים נוספים לאלה המקובלים שלו, כאנטי-קואגולנט וכנוגד דלקת (Van de Wouwer ו-Conway ב-Crit Care Med משנת 2004). TM זוהה ברקמות רבייה באדם כגון בשלייה וב-myometrium (Uszyński וחב' ב-Adv Med Sci משנת 2006), באפיתל החניכיים (Matsuyama וחב' ב-J Periodontal Res משנת 2000), בקרטינוציטים (Senet וחב' ב-Arch Dermatol Res משת 1997), בניטרופילים רב-מורפו-נוקלאריים (Conway וחב' ב-Blood משנת 1992), במונוציטים (Tsai וחב' ב-Shock משנת 2010), בדנדריטים (Yerkovich וחב' ב-J Allergy Clin Immunol משנת 2001), באוסטאובלסטים (Maillard וחב' ב-Endocrinology משנת 1993) ואפילו בטסיות-דם (Suzuki וחב' ב-J Biochem משנת 1988). TM זוהה גם במגוון של תאים בתרבית, כולל תאי שריר חלק (Soff וחב' ב-Blood משנת 1991), בתאי A549 של SCLC (Fujiwara וחב' ב-Pathol Int משנת 2002), ותאי NIH 3T3 (Dittman וחב' ב-J Biol Chem משנת 1988), בעוד שווריאנטים מסיסים של TM התגלו בשתן (Nakano וחב' ב-Thromb Haemost משנת 1988) ובנסיוב (Zycinska וחב' ב- Eur J Med Res משנת 2009).
גליקו-חלבון טרנס ממברנלי זה מכיל מקטע N-טרמינלי דמוי לקטין C-type, C מקטעים דמויי EGF, מקטע עתיר serine/threonine עם נקודות קישור של שרשרות סוכריות בקשר O-גליקוזידי, מקטע טרנסממברנלי ומקטע ציטופלזמטי קצר. התרומבין נקשר למקטעים 5-6, כאשר המקטעים 4-6 נדרשים לשפעול של protein C, ואילו המקטעים 3-6 נדרשים לשפעול של TAFI או thrombin-activatable fibrinolysis inhibitor.
הגליקופרוטאין TM הוא פוליפפטיד מונומרי type 1 המכיל 557-9 חומצות אמינו ומכיל חמישה מקטעים חוץ-תאיים (Suzuki וחב' ב-EMBO J משנת 1987, ו-Sadler ב-Thromb Hemost משנת 1997). למרות שמקטע הקצה דמוי לקטין C אינו בעל פעילןת אנטי-קואגולנטית, הוא משחק תפקיד חשוב בתיווך הפעילויות נוגדות הדלקת של TM (על פי Conway וחב' ב-J Exp Med משנת 2002). המקטע הבא של TM מכיל 6 מקטעים דמויי-EGF החוזרים על עצמם. מקטע זה נמצא בעל פעילות מיטוגנית על פיברובלסטים בתרבית ועל תאי שריר-חלק בדופן כלי דם. פעילויות אלה תווכו על ידי שפעול האנזים protein kinase C ועל ידי protein kinase המשופעל על ידי מיטוגן (MAPK) על פי Tohda וחב' ב-Arteriosclr Thromb Vasc Biol משנת 1998. האינטראקציה של הקטעים EGF5-6 עם תרומבין מונעת את הקישור של תרומבין עם מצעים המשתתפים בתהליך הקרישה כמו פקטור V או פיברינוגן (Esmon וחב' ב-J Biol Chem משנת 1982, Hofsteenge וחב' ב-Biochem J 1986 משנת 1986 ו-Tsiang וחב' ב-J Biol Chem משנת 1992). הקטעים החוזרים על עצמם EGF4-6, דרושים לשפעול של protein C, ואילו הקטעים EGF3-6 נחוצים לשפעול של TAFI (על פי Wang וחב' ב-J Biol Chem משנת 2000, ו-Wu וחב' באותו כתב עת משנת 2009).
המקטע השלישי, זה העתיר ב-serine וב-threonine, נושא שיירי OH-, אליהם נקשרות שרשרות סוכרים בקשר O-glycosidic. מקטע זה מסייע לקישור של chondroitin sulfate (להלן CS). מחקרים הראו שכאשר CS נקשר ל-TM הוא מגביר את היכולת של TM לשפעל את protein C (על פי Koyama וחב' ב-Eur J Biochem משנת 1991, ו-Elisen וחב' ב-Blood משנת 1998). בנוסף, קישור CS ל-TM מזרז את הנטרול של תרומבין ומעודד את הקישור של platelet factor 4 (להלן PF4) ל-protein C (על פי Mosnier ב-J Biol Chem משנת 2011). השייר של CS עשוי לחזק את הקשר תרומבין-TM, על ידי התקשרותו עם החלק קושר האניונים של תרומבין, אותו חלק אליו נקשר הפארין. נמצא שהפארין מעכב את הקשר תרומבין-TM, כנראה על ידי תחרות עם הקומפלקס TM-CS על קישור עם תרומבין (De Cristfaro וחב' ב-Circulation משנת 1998).
המקטע המשומר היטב הטרנס-ממברנלי, מלווה על ידי מקטע זנב ציטופלמי קצר. שייר ציסטאין במקטע זנב זה, כנראה מתווך ב-multimerization של TM (על פי Conway וחב' ב-J Cell Physiol משנת 1994). בתאי אנדותל של וריד האדם בתרבית, קישור של תרומבין ל-TM השרה אירועי איתות שהובילו לשפעול של nitric oxide synthase-3 אנדותליאלי דרך מודולציה של הקולטן הקשור לחלבון G (על פי David-Dufilho וחב' ב-J Biol Chem משנת 2005). למרות שעכברי knockout החסרים לחלוטין TM מתים עוד ברחם בגלל פגם בהתפתחות השלייה (Healy וחב' ב-Proc Natl Acad Sci USA משנת 1995), עכברי knock-in המבטאים TM מוטנטי החסר את המקטע הציטופלזמי של TM, לא מראים כל אנומליה בהתפתחות העוברית, בהישרדותם וביכולת הקרישה שלהם (Isermann וחב' ב-Developement משנת 2001, ו-Conway וחב' ב-Blood משנת 1999).
תרומבומודולין (להלן TM) הוא גליקופרוטאין ממברנלי המבוטא על פני תאים אנדותליאליים (Lougheed וחב' ב-Protein Sci משנת 1995). גליקופרוטאין זה מבוטא בגוף ב-2 צורות: לצורה הראשונה משקל מולקולרי גבוה יותר (150,000 דלטון) והיא קשורה לממברנה הציטופלזמית של תאי האנדותל, בעוד שלצורה השנייה משקל מולקולרי נמוך יותר (69,000 דלטון) והיא מבטאת את הצורה המסיסה או הפלזמטית (Ohlin וחב' ב-Tromb Res משנת 1996, ו-Tomura וחב' ב-Clin Nephrol משנת 1994). המרכיב החלבוני של TM מכיל מספר מקטעים, שכל אחד מהם מכיל כ-40 חומצות אמינו, המשפיעים על המבנה השלישוני של TM, ואחראיים לספציפיות הפעולה שלו. רצפי חומצות אמינו אלו, יכולים לשמש כקו-פקטורים בשפעול של protein C, ויש להם פעילות נוגדת-קרישה על ידי התקשרות לתרומבין. TM עשוי לעודד שגשוג של תאי אנדותל כאשר תכונה זו של TM תלויה במבנה המקטע של המולקולה הידוע כמקטע דמוי-EGF.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק