Acid alpha-glucosidase
| מדריך בדיקות מעבדה | |
| Acid alpha-glucosidase | |
|---|---|
| שמות אחרים | Acid α-glucosidase, acid maltase, α-1,4-glucosidase, α-glucopyranosidase, .α-D-glucosidase ,glucopyranosidase ,α-glucoside hydrolase |
| מעבדה | כימיה בדם |
| תחום | אבחון מחלת Pompe |
| טווח ערכים תקין | פעילות אנזים מעל 0.5 ננומול'/מיליליטר/בשעה, או 5.5-25.0 ננומול'/.בשעה/מיליגרם חלבון. בלוקים במחלת Pompe פעילות האנזים נמוכה מ-0.5 ננומול'/למיליליטר/בשעה. בלוקים בצורת ה-late-onset של המחלה ייתכנו ערכי פעילות אנזים גבוהים יותר מ-0.5 ננומול'/מיליליטר/בשעה. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכה של נבדק בכל גיל עם תסמינים קליניים המרמזים על אפשרות של מחלת Pompe כגון היפוטוניה שרירית, חולשה או קרדיומיופתיה.
מחלת Pompe
ערך מורחב – מחלת פומפה - מחלת אגירת גליקוגן מסוג 2 - Pompe disease - glycogen storage disease type 2
מחלת Pompe הידועה גם כ- glycogen-storage disease type II (להלן GSD II), היא אחת מהמחלות המטבוליות הידועות כמחלות אגירה ליזוזומלית. GSD II היא מפגע אוטוזומלי-רצסיבי הנובע מחסר באנזים acid α-glucosidase (להלן AAG), שהוא אנזים הידרוליטי הפועל בליזוזום. התפקיד התאי של AAG הוא להתמיר גליקוגן ליחידות גלוקוזה בתוך הליזוזום. הפתולוג הדני Joannes Pompe תאר את המחלה לראשונה בשנת 1932, כאשר בחן תינוקת בת 7 חודשים שמתה לאחר שפיתחה hypertrophic cardiomyopathy אידיופתית. Pompe הבחין הצטברות לא-נורמלית של גליקוגן בכל הרקמות שנלקחו מתינוקת זו בניתוח שלאחר המוות, ואף תאר בפרוטרוט את המאפיינים הפתולוגיים הלבביים, של מחלת אגירה ליזוזומלית זו. ל-GSD II יש ספקטרום קליני רחב. שלוש צורות של המחלה מוכרות: המחלה הקלאסית של אבחון המחלה בילדים הגיל הרך; הווריאנט הלא-קלאסי של אבחון המחלה בגיל הרך, וצורת ה-late-onset הכוללת ילדים, צעירים בשנות העשרה, ואף הופעת התסמינים במבוגרים.
הצורה האינפנטילית הקלאסית של המחלה, יכולה כבר להופיע בעובר ברחם אמו, אך המפגע בדרך כלל מאופיין במהלך החודשיים שלאחר הלידה. בצורת מחלה זו יש מעורבות של הלב, השלד, ושרירי מערכת הנשימה, ותסמינים קליניים של הצורה האינפנטילית כוללים היפוטוניה, חולשת שרירים כללית, לב מוגדל, קשיים באכילה, FTT, עקה נשימתית, ואיבוד שמיעה. צורת מחלה זו מאופיינת על ידי התקדמות מהירה של החמרת התסמינים ומוות בגיל צעיר. ללא טיפול של החדרה חלופית של האנזים החסר, המוות מתרחש בשנת החיים הראשונה בגלל מחלה לבבית פרוגרסיבית של הפרעה בשפיעת הדם מהחדר השמאלי. צורת המחלה האינפנטילית הלא-קלאסית מופיעה במהלך שנת החיים הראשונה. תינוקות בגיל מעל 6 חודשים מאופיינים על ידי פיגור מוטורי, והתפתחות איטית של חולשת שרירים. מוות נגרם מאי-ספיקה נשימתית, אם כי בצורה זו מחלה לבבית אינה מהווה מרכיב מכריע בתחלואה, למרות שניתן למצוא לב מוגדל.
הצורה השלישית של late-onset של GSD-II מאופיינת על ידי חולשת שרירים פרוקסימליים ובעיות נשימה. מבוגרים עם צורת מחלה זו, באופן אופייני סובלים מחולשת שרירים פרוקסימליים בין העשור השני והשישי לחיים. מטופלים אחרונים אלה מתים בדיעבד מכשל נשימתי. מעורבות לבבית פחות משמעותית בין אלה עם צורת ה-late-onset של המחלה (Chien וחב' ב-Pediatr Neonatol משנת 2013, ו-van der Beek וחב' ב-Orphanet J Rare Diseases). חלק מהלוקים בצורת ה-late-onset של המחלה, נפטרים ממפרצת של העורק הבזילארי (Bulkley ו-Hutchins ב-Am Heart J משנת 1978), כאשר בכולם נמצאה אגירה לא נורמלית של גליקוגן בליזוזומים של סיבי שריר החלק בדופן העורק.
אפידמיולוגיה של המחלה
ההיארעות של מחלת Pompe לכל צורותיה תלויה באתניות, ובאזור הגיאוגרפי. בארה"ב שכיחות שלושת הצורות של המחלה, מוערכת ב-1 ל-40,000. השכיחות הגבוהה ביותר נמצאת במגזר האפרו-אמריקני בו שלושת צורות המחלה עלולות לפגוע ב-1 ל-14,000 איש. בפורטוגל שכיחות Pompe נמוכה במיוחד ומוערכת במקרה אחד ל-600,000 לידות חי (Pinto וחב' ב-Eur J Hum Genet משנת 2004). באוסטרליה שכיחות מחלה זו היא 1 ל-145,000 (Meikle וחב' ב-JAMA משנת 1999). השכיחות של Pompe ב-Taiwan ובדרום סין הוא 1 ל-50,000 (Lin וחב' ב- J Inherit Metab Disמשנת 1987). בהולנד, שכיחות הצורה האינפנטילית של המחלה היא 1 ל-138,000, ואילו שכיחות צורת ה-late-onset בהולנד היא 1 ל-57,000 (Ausems וחב' ב- Eur J Hum Genet משנת 1999). שמט של אקסון 18 היא המוטציה השכיחה המופיעה ב-34% מאלה עם מחלת Pompe בהולנד (Van der Kraan וחב' ב- Biochem Biophys Res Commun משנת 1994).ממוצע השכיחות הכלל-אירופית של מחלה זו, היא של 1 ל-100,000 של הצורה האינפנטילית, ו-1 ל-60,000 של צורת ה-late-onset (Martiniuk וחב' ב- Am J Med Genet משנת 1998, ו- Hirschhorn ו-Reuser ב- Metab Mol Bases of Inhered Disease משנת 2001).
מבחינת המוצא האתני: מוטציות משותפות בגן AAG הכרוכות עם הצורה האינפנטילית של פרוץ התסמינים נמצאו ב-Taiwan, הולנד, ואפרו-אמריקנים. מוטציה משותפת הכרוכה עם צורת ה-late-onset נמצאה בלבנים. אין עדיפות למחלת Pompe בין שני המגדרים.
פעילות האנזים acid α-glucosidase
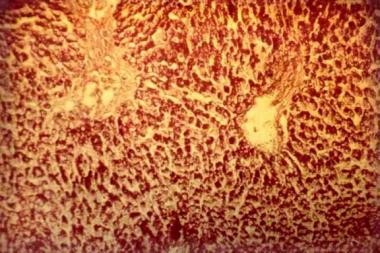
אנזים זה מפרק גליקוגן, עמילן ודי-סכרידים ליצירת גלוקוזה. בדרך כלל פעילות נמוכה של האנזים AAG מצביעה על הופעת תסמיני מחלת Pompe בגיל צעיר. חסר מוחלט של האנזים (פחות מ-1% מרמתו הנורמלית) כרוך בצורה האינפנטילית הקלאסית של המחלה; חסר חלקי של האנזים (2-10% מפעילותו הנורמלית) כרוך בצורה האינפנטילית הלא-קלאסית ובצורת ה-late onset של המחלה. על פי המלצת ה-Pompe Disease Diagnostic Working Group 2008, האישור של המחלה חייב להתבצע ב-2 מדידות פעילות אנזים נפרדות, או בטיפות דם מיובשות, בפיברובלסטים בתרבית או בביופסיה של רקמת שריר. באופן היסטורי, פיברובלסטים בתרבית שימשו לקביעת פעילות האנזים, אך זו הייתה שיטה איטית, שכן היה צורך בתקופה של 4-6 שבועות לקבל מספר ראוי של פיברובלסטים הגדלים בתרבית. ביופסיית שריר עשויה לסייע באבחון שכן מדובר במחלת אגירה ליזוזומלית. אגירת גליקוגן יכולה להיראות בליזוזומים של תאי שריר, כווקואולות הנצבעות באופן בולט בצביעת PAS (periodic acid-Schiff). אך מדובר בשיטה חודרנית, כאשר בצורת ה-late onset של המחלה עם פעילות אנזים חלקית, לא תמיד מתקבלת צביעת PAS חיובית ב-20-30% מהנבדקים (Engel וחב' ב-Neurology משנת 1973).
באופן תפקודי אנזים זה דומה ל-glycogen debranching enzyme, אך הגנים ל-2 אנזימים אלה נמצאים על כרומוזומים שונים. האנזים AAG מבצע הידרוליזה של שיירי α-גלוקוזה טרמינאליים הקשורים בקשר 1→4 לא-מחזר, לשחרור מולקולות α-גלוקוזה בודדות (Chiba ב-Biosci Biothechnol Biochem משנת 1997). שני מנגנוני פעולה של האנזים כוללים nucleophilic displacement ויצירת תוצר ביניים בצורת יון oxocarbenium.
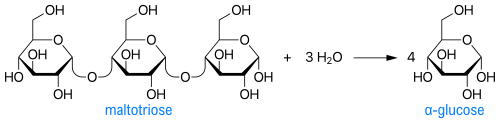
כדוגמה לריאקציה מקוטלזת על ידי האנזים α-glucosidase ניתן להביא את יצירת α-glucose מ-maltotriose:
פתו-פיזיולוגיה
למעשה, AAG הוא אנזים הידרוליטי ליזוזומלי הדרוש לבקע רק אחוז קטן (1-3%) מהגליקוגן התאי. המסלול העיקרי לפירוק של גליקוגן אינו נפגע ב-GSD II; לכן, יצירת אנרגיה אינה מושפעת, ולא מגיעים למצב של היפו-גליקמיה. יחד עם זאת, החסר בפעילות AAG מביא להצטברות של גליקוגן תקין מבחינה מורפולוגית, בליזוזומים ובציטופלזמה של הלוקים במחלה. אגירה מוגזמת של גליקוגן בתוך ליזוזומים פוגעת התפקוד הנורמלי של אברונים אחרים התא, ומובילה לפגיעה תאית. כך גם נגרמת הגדלה ותפקוד לקוי של הלב לדוגמה בהופעת קרדיו-מיופתיה. בצורה האינפנטילית הקלאסית של מחלת Pompe, נוצרת אגירה משמעותית של גליקוגן בשריר הלב, מה שגורם במשך הזמן לקרדיומגליה והתעבות הדופן של החדר השמאלי ולפגיעה בשפיעת דם החדר זה. הצטברות גליקוגן בשריר השלד, גורמת להיפוטוניה ולחולשה. שרירי מערכת הנשימה מושפעים אף הם, מה שמביא להיפו-ונטילציה ולנזק נשימתי מתקדם. המעורבות של מערכת העצבים המרכזית מוגבלת בעיקר לתאי הקרן הקדמית של עמוד השדרה, ולגרעיני גזע המוח. למרות המעורבות של ה-CNS הכושר האינטלקטואלי נותר נורמלי. בצורה האינפנטילית הלא-קלאסית של המחלה, שכיחה מעורבות של השרירים ושל מערכת הנשימה. לעומת זאת, בצורת מחלה זו המעורבות הלבבית היא בעלת מגוון רחב. בצורת ה-late-onset של המחלה אין מוצאים מעורבות לבבית משמעותית, והלוקים בה בדרך כלל נפטרים בעשור השני או השלישי לחייהם.
אנליזה מולקולרית של הגן AAG
הגן המקודד לאנזים AAG ממוקם על כרומוזום 17 בעמדה 17q25.3. למרות שאנליזה מולקולרית של הגן זמינה, היא עלולה להחמיץ את המוטציות בגן זה, לכן בחינת DNA אינה יכולה לשמש במקום מדידת פעילות האנזים לבסס את אבחון המחלה. אנליזה של DNA עשויה לסייע בזיהוי נשאים במשפחה עם חולה במחלת Pompe. אישור נוסף מתבצע כאשר מזוהים שני אללים של AAG הגורמים למחלה. המוצא האתני והפנוטיפ של החולה מסייעים יכולים לכוון את החוקרים לאיתור אחד משלושת הווריאנטים השכיחים של הגן הפגוע: p.Asp645Glu, p.Arg854Ter או-c.336-13T>G. אם לא מזהים אף לא אחד משלושת הווריאנטים הללו, ניתן לבצע ריצוף מלא של הגן (על פי Leslie ו-Tinkle ב-Gene Rev משנת 2016).
גישות נוספות לאבחון Pompe: שיטות הדמיה: רדיוגרפיה של החזה יכולה להראות הגדלה של הלב בילדים עם הצורה האינפנטילית של המחלה. שיטה זו יכולה גם לאפשר הערכה של מערכת הנשימה. אקורדיוגרפיה: אקו של הלב יכול לשמש להערכה של מעורבות לבבית במחלה, בעיקר באלה עם צורת המחלה האינפנטילית. ממצאי בדיקת אקו יכולים לסייע באבחנה בין הופעת המחלה בילדים לבין הופעתה בשנות הבחרות. בדיקת אקו משמשת לקביעה של הגדלת הלב (hypertrophic cardiomyopathy) ולאבחן עיבוי של החדר השמאלי, עיבוי דו-ונטריקולרי, והפרעה בשפיעת הדם מהחדר השמאלי. אלקטרוקרדיוגרפיה: ECG במחלת Pompe יכולה לסייע במקרים של הפרעות קצב. הממצא האופייני בבדיקה זו הוא קיצור של מקטע PR, ואפשרות של הגדלת הקומפלקס QRS. אלקטרומיוגרפיה: EMG מזהה את המפגע המיופתי בכל הלוקים במחלת Pompe. ברבים מהמאובחנים עם מחלת Pompe מוצאים הבזקים פסבדו-מיוטוניים (דהיינו הבזקים מיוטוניים ללא עדות למיוטוניה קלינית), וכן מוצאים ' fibrillation potentials וגלים חיוביים כתוצאה ממעורבות של תאי הקרן הקדמית. שיטות מיקרוסקופיות: מיקרוסקופ אור יכול לגלות וקואולות גדולות המכילות גליקוגן כמעט בכל סיבי השריר. וקואולות אלו יכולות להיות מאופיינות באופן היסטו-כימי כליזוזומים שניוניים. סיבי שרירtype I ו-type II מושפעים באופן זהה. גם מיקרוסקופ אלקטרוני נמצא בשימוש להגדרה של תת-סוגים של וקואולות בהן יש הצטברות של גליקוגן. אוליגוסכרידים בשתן: רמה מוגברת של glucose tetrasaccharide בשתן אופיינית למחלת Pompe, אך זה ממצא לא ספציפי שכן הוא נמצא גם במחלות אגירה נוספות של גליקוגן (Ausems וחב' ב-Neurology משנת 1999).
גילוי מקרי Pompe בסקר יילודים ב-Taiwan:
ב-Taiwan נסקרו 473,738 יילודים למחלת Pompe(Chien וחב' ב-Pediatrics משנת 2008) בשיטה הפלואורימטרית. הסקירה התבצעה בשתי שיטות: פעילות האנזים נמדדה ב-pH 3.8 בנוכחות acarbose ופעילות האנזים הנויטרלי AAG (להלן NAG) נמדדה כמו כן ב-pH 7.0 ללא acarbose. ערך cutoff ליחס של NAG/AAG שמעל 100 היה אינדיקטיבי לתוצאת חסר האנזים והובילו למבדקי המשך לאישור החשד. מבדק שלישי, בו סך פעילות AAG נמדדה ב-pH 3.8 ללא acarbose, התבצע כאשר תוצאות המבדק הראשון לא היו חותכות, דהיינו יחס NAG/AAG שבין 30 ל-100. סקר יילודים זה ב-Taiwan הביא לזיהוי של 9 מקרים של שתי הצורות האינפנטיליות של המחלה, ול-19 מקרים של צורת ה-late-onset. גילוי מקרי Pompe בסקר יילודים באוסטריה: באוסטריה עשו שימוש בשיטת electrospray ionization MS/MS בדגימות דם מיובש של 34,736 יילודים במחקר פיילוט. ערך ה-cutoff של פעילות האנזים נקבע כ-2.0 µmol/hr/L. בסריקת הקו הראשון זוהו 25 דגימות עם פעילות אנזים נמוכה, ודגימות אלו נמדדו מחדש כאשר 5 מתוכן אושרו כחולים ב-Pompe. אנליזה מולקולרית איששה 4 מקרים כחולים במחלה ואחד כ-.false-positive גילוי מקרי Pompe בסקר יילודים באיטליה: בבדיקת פיילוט לקביעת היעילות של סקר יילודים בקרב 3,403 יילודים באיטליה שימשה השיטה הפלואורימטרית, כאשר ערך ה-cutoff נקבע כ-25% ממוצע הפעילות הנורמלית של האנזים24.5 nmol/hr/mL) ). ב-12 דגימות נמצאו ערכי אנזים נמוכים, כאשר בדיקה שנייה של אותן 12 דגימות, קבעה שרק ב-3 דגימות נמצאו ערכי פעילות נמוכים. בדיקה מולקולרית לא אישרה אף מקרה חיובי של המחלה. גילוי מקרי Pompe בסקר יילודים בהונגריה: בהונגריה, MS/MS שימש לסריקה של 40,024 יילודים (Wittmann וחב' ב- JIMD Repמשנת 2012). ערך ה-cutoff של פעיות האנזים AAG היה 3.00 µmol/hr/L. ב-163 יילודים נמצא ערך פעילות נמוך של האנזים בבדיקה הראשונית, וכאשר חזרו על הבדיקה ביילודים אלה נמצא אנזים נמוך ב-64 דגימות. 64 דגימות אלו נשלחו לבדיקה גנטית מולקולרית ו-9 יילודים אכן אושרו בלוקים במחלת Pompe, 25 יילודים אובחנו כנשאים ושלושה מהיילודים נקבעו כמקרים "לא ודאיים", לעומת זאת 27 יילודים נקבעו כנורמליים.
גילוי מקרי Pompe בסקר יילודים ביפן:
ביפן, נקבעה רמת האנזים בטיפות דם מיובשות של 496 אנשים בריאים כביקורת, 29 מטופלים יפנים עם מחלה מאובחנת (שניים עם מחלה אינפנטילית קלאסית, 14 עם צורת המחלה האינפנטילית הלא-קלאסית, ו-13 מבוגרים עם המחלה), וכן ב-5 נשאים אובליגטוריים (Oda וחב' ב- Mol Genet Metabמשנת 2014). פעילות האנזים נמדדה בשיטה הפלואורימטרית. בערך cut-off של 8% מפעילות האנזים התקינה ((1.7 pmol/punch per hour הביא לזיהוי כל 29 הלוקים במחלה (100%), לזיהוי חמישה נבדקים בריאים הומוזיגוטיים עם pseudodeficiency alleles (33%), לזיהוי נשא אובליגטורי אחד (20%), והתוצאה התקבלה שלילית בכל הנבדקים הבריאים, כאשר שיעור ה-false-positives לא עלה על 0.3%.
הניסיון של בדיקות של מחלת Pompe במספר מדינות בארה"ב:
הוועדה המייעצת של משרד הבריאות האמריקני בתחום מפגעים תורשתיים ביילודים, הממליצה על סדרת מחלות הראויות להיכלל בפאנל של סקר היילודים, הוסיפה ב-2 במרס 2015 את מחלת Pompe ל-RUSP או Recommended Uniform Screening Panel.
בוושינגטון, נסקרו 111,544 טיפות דם יבשות בשיטת MS/MS. ה-cutoff של פעילות האנזים לאבחון מחלת Pompe נקבע כפחות מ-2.6 µmol/hr/L שהוא פחות מ-15% מממוצע הפעילות התקינה. בקו הסריקה הראשון, פעילות AAG של 17 דגימות הייתה נמוכה מערך ה-cutoff. אנליזה של הווריאנטים מצאה ש-4 דגימות התאימו למחלת Pompe, 4 דגימות נמצאו נשאים, 3 דגימות היו בעלי אלל ל-pseudodeficiency, ו-6 דגימות נקבעו כ-pseudodeficiencies. מסקנת סקר זה בוושינגטון למחלת Pompe העלתה שיעור תחלואה של 4.5 מקרים ל-100,000 יילודים (Marsden ו-Levy ב-Clin Chem משנת 2010).
במיזורי, הוכנסה לפאנל של סקר יילודים בדיקת מחלת Pompe כבדיקת שגרה. בדיקה בשיטת digital microfluidics החלה שם בינואר 2013 (Hopkins וחב' ב-J Pediatrics משנת 2015). תוצאות של 43,701 נסקרים ראשונים פורסמו לאחר שנה. סף ה-cutoff נקבע כ-.0 µmol/hr/L8, ונמצאו 18 יילודים עם ערכי פעילות נמוכים מסף זה. מבין 18 יילודים אלה, שלושה אושרו כלוקים בצורה האינפנטילית ( 2 מקרים קלאסיים ומקרה אחד לא קלאסי), שלושה נמצאו לוקים בצורת ה-late-onset, ועוד 2 מקרים עם משמעות לא ברורה. מידע נוסף מתכנית הסקר במיזורי, שכללה עוד כ-269,500 יילודים עד 15 ביוני 2016. נמצאו 137 מקרים חיוביים, מתוכם 24 אושרו כחולי Pompe (4 מקרים של הצורה האינפנטילית הקלאסית, ו-2 מקרים לא קלאסיים) ו-18 מקרי ,late-onset 8 מקרים עם משמעות לא ברורה, 23 מקרים עם pseudodeficiency, 29 נשאים, ו-42 עם רמות אנזים תקינות.
ב-Illinois, החלה סריקה למחלת Pompe בנובמבר 2014, בשיטת-Ultra-high pressure liquid chromatography– MS/MS. נסרקו 166,463 יילודים, עם ממצא של חולה אחד לכל 15,133. מתוך 110 יילודים שנזקקו לבירור נוסף, 65 נמצאו נורמליים, 12 נמצאו נשאים של המחלה, וב-12 נקבעה .pseudodeficiency
במדינת ניו-יורק סקר היילודים ל-Pompe בשיטת MS/MS כלל כ-390,000 דגימות, מתוכן 75 דגימות הופנו לבירור מאשר עם cutoff של פחות מ-15% מהרמה המוצעת. בין אלה 1 נקבע כצורת המחלה האינפנטילית-קלאסית, ועוד אחד כצורה הלא-קלאסית. עשרים ותשע דגימות זוהו כמקרים פוטנציאליים של צורת ה-late-onset עם פעילות אנזים של 5.6-14.3% מהנורמה, ב-14 יילודים נקבעה pseudodeficiency, עם פעילות אנזים של 9.4-14.7% מהנורמה. חמישה עשר יילודים עם ערכי אנזים נמוכים (11.5-15.0% מהנורמה) נמצאו כווריאנטים בעלי אללים נורמליים. בשנת 2006 הפך התכשיר α-alglucosidase לטיפול הראשון במחלת Pompe, שכן תכשיר זה הוא אנאלוג של α-glucosidase (Yoshimizu וחב' ב-Clin Chim Acta משנת 2008, Gungor וחב' ב- J Inher Metab Dis משנת 2015, ו-Katzin ו-Amato ב-J Clin Neuromuscul Dis משנת 2008). מחקרים נוספים עלalglucosidase α גילו ש-אימינו-סוכרים מעכבים את האנזים, וכן ש-) 1-deoxynojirimycinאו (DNJ נקשר לאנזים באופן החזק ביותר ומנטרל באופן מוחלט את פעילותו (Bischoff וחב' ב- Clin Invest Medמשנת 1995). הקשר של α-glucosidase לסוכרת: Acarbose, הוא מעכב של האנזים α-glucosidase באופן תחרותי והפיך במעיים. עיכוב זה מפחית את קצב הספיגה של גלוקוזה ומאריך את משך העיכול של פחמימות. לכן משמש acarbose למניעת התפתחות תסמיני סוכרת. גם luteolin נמצא מעכב חזק של פעילות האנזים α-glucosidase, והוא עשוי לעכב את פעילות האנזים ב-36% בריכוז של 0.5 מיליגרם/מ"ל. הוראות לביצוע הבדיקה:
צריך לשלוח למעבדה כ-3 מיליליטר של דם במבחנה כימית (פקק צהוב או אדום) שהיא המבחנה המועדפת, אם כי ניתן לקחת את הדם גם במבחנת סודיום או ליתיום הפארין (פקק ירוק), או במבחנת ספירת-דם (EDTA פקק סגלגל). הדגימות צריכות להישלח כדם מלא ללא סרכוז או הפרדת הנוזל מהתאים. ניתן גם לשלוח פלט של לויקוציטים. הדגימות האחרונות מתאימות לצורך בדיקה גנטית מולקולרית, לקביעת נשאוּת, pseudodeficiency, או סטאטוס המחלה.
לבדיקות סקר יילודים יש לשלוח 2 טיפות דם מיובשות על כרטיס נייר פילטר (# קטלוגי T493), אם כי מתקבלים גם כרטיסי Ahlstrom # קטלוגי 226, כרטיס Nunktell TFN, או כרטיס Whatman Saver 903 paper.
הוראות לאיסוף הדם: ליילודים רצוי להפיק דם מהעקב עם דוקרן, ולילדים בגיל 1-3 שנים על ידי דקירת האצבע והצמדת טיפת הדם לכרטיס הסופג. יש לייבש את הדם על ידי השארת הכרטיס במצב אופקי למשך 3 שעות בטמפרטורת החדר. אין לחשוף את הכרטיס לחום או לאור השמש. אין להערים מספר כרטיסים עם טיפות רטובות אחד על משנהו. יש לשמור את הכרטיסים בתנאי יובש ומוגנים מאור. סיבה לפסילת הבדיקה היא טיפת-דם שנראים בה מעגלים קונצנטריים המעידים על מספר שכבות בנטילה לא מיומנת. דם מלא רצוי להעביר למעבדה בקירור אך לא בהקפאה. לא תתקבלנה דגימות דם מאוד המוליטיות, דם אמור להישמר עד הגעתו למעבדה בטמפרטורת החדר או מקורר לא יאוחר מ-3 ימים מנטילתו. דגימות שהיו חשופות לטמפרטורה שמעל 25 מעלות למשך יותר מ-48 שעות, עלולות לתת תוצאות מוגברות-כזובות של פעילות האנזים, מה שעלול לגרום להחמצת האבחון של מחלת Pompe.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק