מחלת אנדרסון-פברי - Anderson-Fabry disease
הופניתם מהדף Anderson-fabry disease לדף הנוכחי.
| מחלת אנדרסון-פברי | ||
|---|---|---|
| Anderson-Fabry disease | ||
| 250px | ||
Alpha galactosidase - the protein that is deficient in Fabry disease
| ||
| שמות נוספים | Fabry disease ,Fabry’s disease ,Alpha-galactosidase A deficiency, Angiokeratoma corporis diffusum, Ceramide trihexosidosis, Ruiter-Pompen-Wyers syndrome, Sweeley-Klionsky disease | |
| ICD-10 | Chapter E 75.2 | |
| ICD-9 | 272.7 | |
| MeSH | D000795 | |
| יוצר הערך | פרופסור אניק רז-רוטשילד | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות אגירה#מחלות אגירה ליזוזומליות
מחלת אנדרסון-פברי (Anderson-Fabry) היא מחלת אגירה ליזוזומלית (Lysosomal storage disease) המורשת בתאחיזה לכרומוזום ה-X (Chromosome X- linked). תפוצתה באוכלוסיה היא פן- אתנית (Pan-ethnic) ושכיחותה אינה ברורה.
מחלת Fabry מאופיינת על ידי ירידה או חסר בפעילות של האנזים (Enzyme) הליזוזומלי Alpha-galactosidase-A המובילה לאגירה של סובסטרט (Substrate) ממשפחת ה-Glycosphingolipids ולפגיעה רב מערכית. מחלת Fabry היא חלק מקבוצת ה-Sphingolipidosis. הפגיעות העיקריות הן במערכת העצבים, במערכת הקרדיווסקולרית (Cardiovascular) ובכליות. הגברים הינם Hemizygotes ומפתחים מחלה רב מערכתית ואילו הנשים הן Heterozygotes אך על פי רוב תפתחנה גם הן תסמינים אשר עלולים להיות חמורים כמו בגברים.
זוהי מחלה פרוגרסיבית (Progressive) וסימניה הראשונים יכולים להופיע כבר בגיל הילדות. חומרת המחלה וצורת הופעתה מגוונות בין המשפחות השונות וגם בתוך כל משפחה.
משנות ה-90 של המאה הקודמת קיים טיפול באנזים חליפי ועל כן, אבחון מוקדם ומתן טיפול (בטרם נוצר נזק בלתי הפיך לרקמה ולאיברים) עשויים לשפר את איכות חיי החולים ואולי אף להאריכם [1].
פתופיזיולוגיה
נכון לשנת 2011, בעקבות חסר או ירידה בפעילות האנזים Alpha-galactosidase-A נמנע פירוק תקין של Glycosphingolipids ובעיקר Globotriaosylceramide (GL3 ,Gb3 ,Ceramide trihexoside) בתאים שונים ובמיוחד בולט הדבר בתאי האנדותל הווסקולרי (Vascular endothelium). הסובסטרט נאגר בליזוזומים וגורם לפגיעות משניות בתפקוד תאים כגון תאי עצב, תאי האפיתל הגלומרולרי (Glomerular epithelium) והטובולרי (Tubular epithelium) של הכליות, תאי מערכת ההולכה של קוצבי הלב והקרדיומיוציטים (Cardiomyocytes)[1]. הפגיעה התאית גוררת פגיעה ברקמה עם הופעה של איסכמיה (Ischemia) ופיברוזיס (Fibrosis). עד היום לא ברור מתי הנזק לתאים הוא בלתי הפיך ומתי הטיפול אינו יכול להביא לשיפור במצבם של החולים. האגירה מתחילה כבר בשלב העוברי [2] ומצטברות עדויות כי מתן טיפול מוקדם הוא יעיל [1], [3], [4].
תורשה ושכיחות
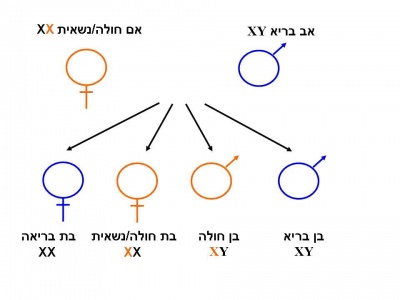
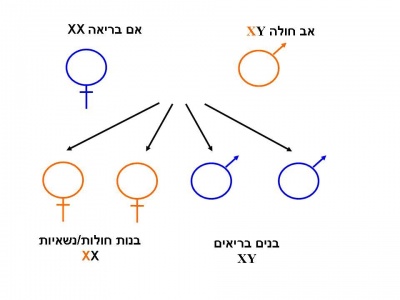
הגן המקודד לאנזים Alpha-galactosidase-A ממופה על גבי הזרוע הארוכה של כרומוזום X [Xq22] ומכיל 7 אקסונים (Exons)[3]. לכל משפחה מוטציה משלה (Private mutation). מחלת Fabry מורשת בתאחיזה לכרומוזום ה-X. בניגוד למחלות תורשתיות אחרות המועברות בתאחיזה לכרומוזום ה-X, שבהן הנשים הנשאיות בדרך כלל אינן סימפטומטיות, נשים הנושאות מוטציות בגן ל-Alpha galactosidase-A יהיו עם הזמן סימפטומטיות בדרגות חומרה שונות [1]. כמו כן, בשל דפוס ההורשה האחוז ל-X, תהיינה בנותיו של גבר חולה Fabry בהכרח נשאיות ואילו כל בניו יהיו בריאים. לגבי אישה נשאית, לכל בת יהיה סיכוי של 50 אחוזים להיות נשאית עם אפשרות לפתח את המחלה, כאשר לכל בן של אישה נשאית, הסיכוי לבן חולה עומד על 50 אחוזים.
מחלת Fabry אינה שכיחה יותר בעדות או בעמים מסוימים ופוגעת בכל האוכלוסיה בשכיחות דומה. בעבר תוארה המחלה כמחלה נדירה המופיעה בזכרים בשכיחות של מקרה אחד ל-60,000-40,000[1], אולם במחקרי סקר ילודים שנערכו במספר מדינות, נמצאה שכיחות גבוהה בהרבה; מקרה אחד ל-13,341-1237[5]. בישראל היו מאובחנים נכון לשנת 2011 כ-30-25 חולים (גברים, נשים וילדים).
סימני המחלה
רוב התסמינים שמהם סובלים חולי Fabry אינם ספציפיים למחלה ולכן אבחון חולה עם Fabry ואבחון חולים עם מחלות נדירות בכלל מהווים אתגר משמעותי.
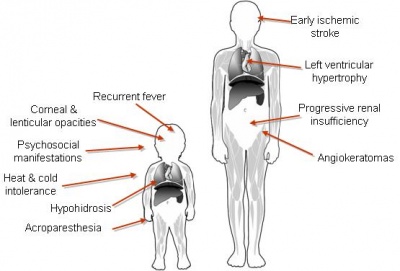
חולה Fabry יופיע במרפאה עם אחד או יותר מהממצאים הבאים (תמונה מספר 1): נוכחות נגעים עוריים מסוג Angiokeratoma, כאבים "שורפים" בגפיים (Acroparesthesia), כאבי בטן, שלשולים במיוחד אחרי אכילה, חוסר הזעה, עייפות, אי סבילות לחום, אי סבילות למאמץ וכן סיפור משפחתי של תסמינים כמו אי ספיקת כליות, שבץ מוחי (Stroke), או מחלה קרדיאלית (Cardiac)[1].
אחד הכלים היעילים ביותר לאבחון המחלה הוא בירור האם קיימים קרובי משפחה עם תסמינים אשר יכולים להיות קשורים למחלת Fabry. כלומר, בניית עץ משפחה המתאים לתורשה בתאחיזה ל-X שבו נמצא חולים עם התסמינים המוזכרים שהקשר ביניהם הוא הנשים במשפחה. לאחר אבחון של אדם במשפחה חדשה, יש צורך לבדוק את כל בני המשפחה המצויים בסיכון על בסיס נתוני המשפחה, תוך התייחסות לאופן ההורשה. לשם כך מומלץ להפנות את החולים גם לרופא גנטיקאי.
סימני המחלה מתחילים להופיע בגיל הילדות ומחמירים עם הזמן גם בגברים וגם בנשים [5]. סימנים ראשונים מופיעים בבנים כבר בגילאי 10-3 ובבנות בגילאי 19-13. האבחנה הסופית היא בממוצע גילאי 26 בגברים ו-32-30 בנשים [6]. בתקופה זו ולמעשה עוד בשלבים העובריים מצטבר GL3 ברקמות ונוצר נזק שעלול להיות בלתי הפיך בגיל מבוגר יותר. חולים עם פעילות אנזימתית ירודה או לא קיימת מציגים תמונה קלאסית של המחלה ואילו חולים עם פעילות אנזימתית שאריתית מציגים מחלה קלה יותר או Variant disease[7].
חולים עם הופעה קלאסית מציגים את הסימנים הבאים, המערבים מספר מערכות, ואילו חולים קלים יותר יציגו רק כמה מהסימנים:
ממצאים נוירולוגיים: כאבים כרוניים (Acroparesthesia) או התקפי כאבים ("משברי Fabry") במיוחד בזמן מאמץ, בזמן מחלת חום או במזג אוויר חם, שינויים בחומר הלבן של המוח, אשר ניתנים לאבחון רק ב-MRI (Magnetic Resonance Imaging). חולים יכולים להופיע עם תמונה קלינית של שבץ מוח או Transient Ischemic Attack) TIA) בגיל צעיר יחסית [8]. נמצא כי 5 אחוזים מהגברים הסובלים מ-Acute cryptogenic stroke הם חולי Fabry שלא אובחנו[9]
ממצאים כלייתיים: סימנים ראשונים הם Proteinuria ו-Isosthenuria. עם הזמן הפגיעה מתקדמת עם עלייה בקראטינין (Creatinine) וירידה בקצב הסינון הגלומרולרי (Glomerular Filtration Rate ,GFR). במחקרים אשר בהם נסרקו אוכלוסיות המטופלות בהמודיאליזה לנשאות מחלת Fabry, נמצא כי רבע אחוז עד אחוז מהגברים המטופלים בהמודיאליזה (Hemodialysis) חולים ב-Fabry [7]. לאחרונה פורסמו הנחיות מטעם ה- European renal best practice המנחות נפרולוגים (Nephrologists) לחשוד במחלת Fabry בקרב חולים עם מחלת כליה לא מוסברת [4]
ממצאים גסטרואיטסטינאלים: כאבים אחרי האוכל, שלשולים, תחושה של שובע מהיר
ממצאים עוריים: נגעים מסוג Angiokeratomas המופיעים במיוחד באזור החלציים ומתרבים עם הזמן, חוסר הזעה (Hypo-anhydrosis)[1]
ממצאים קרדיווסקולריים: הפגיעה הלבבית עלולה להתבטא בצורות רבות, ביניהן הפרעות קצב (קיצור PR ללא גל δ, QRS מאורך, AV block ועוד), כאשר 20-10 אחוזים מהחולים נזקקים להשתלת קוצב קבוע. פגיעה בכלי הדם הכליליים עלולה להוביל להופעה של Angina pectoris ולאוטם שריר הלב. חולים יכולים להופיע עם תמונה של אי ספיקת לב משנית כגורם הבירור, פגיעה במסתמים או קרדיומיופטיה (Cardiomyopathy). סימנים אלה יופיעו על פי רוב בגיל צעיר מן הממוצע באוכלוסיה. נמצא כי 4-3 אחוזים מהגברים הסובלים מקרדיומיופטיה הם חולי Fabry שלא אובחנו[9], [10]. מחלת הלב ב-Fabry מאופיינת ב-Hypertrophy של החדר השמאלי הדומה לזו המתקבלת בחולים עם Sarcomeric hypertrophy או לחץ דם גבוה [10]
ממצאים המופיעים בעיניים: ב-90-70 אחוזים מהחולים (ללא הבדל מין) מופיעה Cornea verticillata ב-Corneal epithelium. אבחון ממצא זה מצריך שימוש במנורת סדק. זהו אינו ממצא סימפטומטי אך נוכחותו פטוגנומית (Pathognomonic) למחלת Fabry
ממצאים נוספים: התקפי Vertigo, ירידה בשמיעה, מחלת ריאות רסטריקטיבית וחסימתית (Restrictive-obstructive pulmonary disease) [1]
ממצאים התנהגותיים/ פסיכיאטריים: דיכאון שכיח מאוד בחולי Fabry ומופיע בכ-46 אחוזים מהחולים. כמו כן נראה ירידה בתפקוד במשימות ניהוליות, ביכולת הקשב ובמהירות עיבוד המידע תוך שמירה על הזיכרון והאינטלקט, התפישה ויכולת השיום [11]
נשאיות יכולות להיות סימפטומטיות
תוחלת החיים של נשים נשאיות למחלת Fabry קצרה ב-15 שנים יחסית לממוצע באוכלוסיה ועל פי רוב הן מפתחות סימפטומים (Symptoms) של המחלה עם הזמן [1],[8]. הופעת הסימפטומים בנשים מופיעה בין 5 ל-10 שנים מאוחר יותר לעומת גברים והאבחנה מתאחרת בהתאם [8], [6]. נמצא כי ב-30-20 אחוזים מהנשים מופיעים סימפטומים קשים כגון: נוירופתיים (Neuropathy), מחלת כליות, אירועים מוחיים ומחלת לב[1]. חשוב, אם כן, לזכור כי יש לעקוב גם אחרי נשים אסימפטומטיות (Asymptomatic) שכן לא ניתן לחזות מתי יתפתחו הסימפטומים.
אישור האבחנה במעבדה ואבחון טרום לידתי
אישור האבחנה בגברים מבוסס על בדיקת פעילות האנזים alpha galactosidase בלויקוציטים (Leukocytes), בנסיוב או בפלזמה (Plasma) או בבדיקה בטיפת דם מלא, המבוצעת על גבי נייר Guthrie ומאומתת על ידי בדיקה גנטית או בדיקה בדם מלא [9]. בנשים רמת הפעילות האנזימתית יכולה להיות נמוכה או תקינה בהתאם לכמות הלויקוציטים שבהם חלה אינאקטיבציה (Inactivation) של כרומוזום ה-X הנושא את הגן התקין [1]. לפיכך, מבוצע אישור האבחנה הקלינית בנשים על ידי בדיקת רצף הגן המקודד ל-Alpha-galactosidase-A, כמובן בשילוב התסמינים הקליניים.
במידה שאין ידע מוקדם על המוטציה הקיימת במשפחה, מבוצע ריצוף של כל הגן ובדיקת MLPA (Multiplex Ligation-dependent Probe Amplification) או Polymerase Chain Reaction) Real Time PCR) לשלילת חסר בגן אשר לא ניתן לאיתור בריצוף בשיטת Sanger. כאשר קיים מצב של ספק לגבי האבחנה, מומלץ לבצע בדיקת אגירה של Lyso-GL-3 בדם החולה ו/או ברקמה הפגועה (ביופסית עור, כליה או רקמת הלב) [12].
במשפחות שבהן אובחן חולה, מומלץ ייעוץ גנטי כדי לאבחן את מי שנמצא בסיכון ולתת מידע לגבי תכנון ההריון. ניתן לבדוק את DeoxyriboNucleic Acid) DNA) העובר על ידי בדיקת סיסי השליה בשבוע ה-11 או בתאי מי שפיר בשבוע ה-17. אפשרות נוספת היא אבחון טרם השרשה (Preimplantation genetic (Diagnosis. סוגיות אלו דורשות, כאמור, ייעוץ גנטי.
הטיפול באנזים חליפי
בטרם פותח הטיפול באנזים חליפי - Enzyme replacement therapy, היה הטיפול בחולי Fabry טיפול תומך וסימפטומטי בלבד [1]. בשנת 2001 הושקו שני תכשירים שפותחו בשיטות של הנדסה גנטית: Replagal (Agalsidase alpha) המיוצר בתאים פיברובלסטים (Fibroblasts) ממקור אנושי ו-Fabrazyme (Agalsidase beta) המיוצר בתאי שחלה של אוגר סיני CHO cells (Chinese Hamster Ovary cells). כאמור, בשנת 2001 אושרו שני התכשירים לשיווק באירופה ואילו ב-2003 אישרה רשות המזון והתרופות האמריקאית (Food and Drug Administration ,FDA) את Fabrazyme בלבד. בישראל מאושרות שתי התרופות ושתיהן כלולות בסל הבריאות לטיפול בחולי Fabry. Replagal מאושר לשימוש במינון של 0.2 מיליגרם לקילוגרם ואילו Fabrazyme מאושר לשימוש במינון של 1 מיליגרם לקילוגרם. שניהם ניתנים בעירוי לווריד בתדירות של פעם בשבועיים [1].
בבדיקות ביוכימיות (Biochemical) שבוצעו נראה כי רצף חומצות האמינו (Amino acids) זהה בשני התכשירים וכך גם הפעילות האנזימתית. קיים דיון בספרות לגבי היתרונות של תרופה אחת על פני האחרת [13], [14], [15] אך עדויות מהשנים האחרונות מצביעות על יתרונותיו של המינון הגבוה [16], [17]. לדוגמה, Tøndel וחבריה הדגימו כי רק במינון גבוה של אנזים יש ניקוי מלא של תאי ה-Podocytes בכליה ושיפור משמעותי ביחס אלבומין (Albumin)/קראטינין [16]. במחקר של שלושה מרכזים בגרמניה נראה כי חולים שהיו מיוצבים על המינון הגבוה של: Every Other Week מיליגרם אחד לכל קילוגרם ועשו שינוי למינון נמוך יותר, חוו הידרדרות הן בתפקודי הכליה כפי שנמדדו על יד eGFR והן בהופעת כאבים נוירופתיים ואי נוחות אופיינית במערכת העיכול [17].
מאחר שמדובר בהזרקה של חלבון אשר בחולים מסוימים הוא זר לגוף, תיתכן יצירת נוגדנים כנגד האנזים המוזרק [18], [19], אולם, השפעתם על יעילות הטיפול עדיין אינה ברורה [13], [14]. בשלב ראשון יינתן הטיפול במסגרת בית חולים, למשל במסגרת טיפול יום, ואחר כך, במידה שהחולה יציב במהלך הטיפול, ניתן לעבור למסגרת של טיפולי בית. במידה שמופיעות תופעות לוואי לטיפול, יש להפסיק את מתן העירוי מיד ולהתייעץ ברופא המטפל. הטיפול מדווח כמשפר את איכות החיים ומייצב, משפר או מאט את התקדמות המחלה באופן התלוי בחומרת המצב שבו נמצא החולה ובגורמים נוספים אשר לא כולם ידועים לנו היום [1], [20].
במי לטפל ומתי להתחיל טיפול
ההמלצה לטיפול בזכרים היא להתחיל בטיפול מוקדם במחשבה כי טיפול מוקדם עשוי למנוע נזק בתאים וברקמות. מן הראיות שהצטברו עד כה נראה כי חשוב לעקוב אחרי התפתחות המחלה בנשים "נשאיות" ולשקול טיפול בשלבים מוקדמים יחסית עם הופעת הסימפטומים כדי למנוע נזק בלתי הפיך [1]. בילדים כמו בילדות נראה כי יש מקום להתחיל טיפול כאשר תסמיני המחלה מופיעים. יש הסבורים שמומלץ להתחיל טיפול גם כאשר אין תסמינים בבנים כדי למנוע נזק בלתי הפיך. בשלב הזה מדובר בוויכוח פתוח ואין הסכמה בנושא זה בין המדענים והרופאים. בדרך כלל החלטה טיפולית בילדים נדונה עם הורים ועל פי המלצת הרופא המטפל.
הטיפול חייב לכלול מעקב על ידי צוות רב תחומי הכולל: רופא המשפחה או רופא ילדים, נפרולוג, קרדיולוג, נוירולוג, מומחה לכאבים ומומחים נוספים בהתאם לצורך. יש לשים דגש מיוחד על מעקב התפקוד הכלייתי, התפקוד הלבבי ומערכת העצבים. מומלץ טיפול סימפטומטי תומך כמו טיפול במעכבי ACE (Angiotensin Converting Enzyme inhibitors) ובחוסמי הרצפטור לאנגיוטנסין (Angiotensin Receptor Blockers ,ARBs) בחולים עם Proteinuria, יתר לחץ דם ו–Dyslipidemia. ניתן לטפל ב-Aspirin למניעת קרישיות יתר.
בגלל אופייה הפרוגרסיבי של המחלה, המפתח לטיפול יעיל ולהטבת איכות חיי החולים נעוץ באבחון המוקדם של המחלה ובתחילת מתן האנזים החליפי בטרם נוצר נזק בלתי הפיך לרקמה.
ביבליוגרפיה
- Ortiz A, Oliveira JP, Wanner C, et al. Recommendations and guidelines for the diagnosis and treatment of Fabry nephropathy in adults. Nat Clin Pract Nephrol. 2008; 4(6):327-36.
- Desnick RJ. Enzyme replacement therapy for Fabry disease: lessons from two alpha-galactosidase-A orphan products and one FDA approval .Expert Opin Biol Ther. 2004; 4(7):1167-76.
- Hopkin RJ, Bissler J, Banikazemi M, et al. Characterization of Fabry Disease in 352 Pediatric Patients in the Fabry Registry. Pediatr Res. 2008.
- Gambarin FI, Disabella E, Narula J, et al. When should cardiologists suspect Anderson-Fabry disease?. Am J Cardiol. 2010 15;106(10):1492-9.
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 Germain DP. Fabry disease. Orphanet J Rare Dis. 2010 22;)5(:30
- ↑ Elleder M , Poupĕtová H, Kozich V. Fetal pathology in Fabry's disease and mucopolysaccharidosis type I. Cesk Patol. 1998 ;34(1):7-12
- ↑ 3.0 3.1 Stratta P, Quaglia M, Messina M, et al. The challenges of diagnosing Fabry disease. Am J Kidney Dis. 2008; 51(5):860-4.
- ↑ 4.0 4.1 Terryn W, Cochat P, Froissart R, et al. Fabry nephropathy: indications for screening and guidance for diagnosis and treatment by the European Renal Best Practice. Nephrol Dial Transplant. 2013 ; 28(3):505-17.
- ↑ 5.0 5.1 Kolodny E, Fellgiebel A, Hilz MJ, et al. Cerebrovascular involvement in Fabry disease: current status of knowledge Stroke.2015;46(1):302-13 A.
- ↑ 6.0 6.1 Wilcox WR, Oliveira JP, Hopkin RJ, et al. Females with Fabry disease frequently have major organ involvement: lessons from the Fabry Registry. Mol Genet Metab. 2008; 93 (2):112-28.
- ↑ 7.0 7.1 Nakao S, Kodama C, Takenaka T, et al. Fabry disease: detection of undiagnosed hemodialysis patients and identification of a "renal variant" phenotype. Kidney Int. 2003; 64:801–7.
- ↑ 8.0 8.1 8.2 Wang RY, Lelis A, Mirocha J, et al. Heterozygous Fabry women are not just carriers, but have a significant burden of disease and impaired quality of life. Genet Med. 2007; 9(1):34-45.
- ↑ 9.0 9.1 9.2 Matern D, Gavrilov D, Oglesbee D, et al. Newborn screening for lysosomal storage disorders. Semin Perinatol. 2015;39(3):206-16
- ↑ 10.0 10.1 Elliott P1, Baker R, Pasquale F et al. Prevalence of Anderson-Fabry disease in patients with hypertrophic cardiomyopathy: the European Anderson-Fabry Disease survey. Heart. 2011; 97(23):1957-60.
- ↑ Bolsover FE , Murphy E, Cipolotti L J et al. Cognitive dysfunction and depression in Fabry disease: a systematic review.Inherit Metab
- ↑ Smid BE , van der Tol L , Biegstraaten M , et al . Plasma globotriaosylsphingosine in relation to phenotypes of Fabry disease. J Med Genet. 2015; 52(4):262-8.
- ↑ 13.0 13.1 Vedder AC, Breunig F, Donker-Koopman WE, et al. Treatment of Fabry disease with different dosing regimens of agalsidase: effects on antibody formation and GL-3. Mol Genet Metab. 2008; 94(3):319-25.
- ↑ 14.0 14.1 Vedder AC, Linthorst GE, Houge G, et al. Treatment of Fabry disease: outcome of a comparative trial with agalsidase alfa or beta at a dose of 0.2 mg/kg. PLoS ONE. 2007; 2(7): 598.
- ↑ Mehta A, Beck M, Kampmann C, et al. Sunder-Plassmann G. Enzyme replacement therapy in Fabry disease: Comparison of agalsidase alfa and agalsidase beta. Mol Genet Metab. 2008…
- ↑ 16.0 16.1 Tøndel C, Bostad L, Larsen KK, et al. Agalsidase benefits renal histology in young patients with Fabry disease. J Am Soc Nephrol. 2013;24(1):137-48
- ↑ 17.0 17.1 Lenders M, Canaan-Kühl S, Krämer J, Duning T, et al. Patients with Fabry Disease after Enzyme Replacement Therapy Dose Reduction and Switch-2-Year Follow-Up. J Am Soc Nephrol. 2015
- ↑ Bodensteiner D, Scott CR, Sims KB, et al. Unsuccessful reinstitution of agalsidase beta therapy in Fabry disease patients with previous IgE-antibody or skin-test reactivity to the recombinant enzyme.Genet Med. 2008;10(5):353-8.
- ↑ Ohashi T, Iizuka S, Ida H, et al. Reduced alpha-Gal A enzyme activity in Fabry fibroblast cells and Fabry mice tissues induced by serum from antibody positive patients with Fabry disease. Mol Genet Metab. 2008; 94(3):313-8.
- ↑ Germain DP, Charrow J, Desnick RJ et al. Ten-year outcome of enzyme replacement therapy with agalsidase beta in patients with Fabry disease. J Med Genet. 2015;52(5):353-8
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' אניק רז-רוטשילד - מנהלת המכון למחלות נדירות, המחלקה לגנטיקה, המרכז הרפואי שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק