Calcitonin gene-related peptide
| מדריך בדיקות מעבדה | |
| Calcitonin gene-related peptide | |
|---|---|
| שמות אחרים | CGRP |
| מעבדה | כימיה בדם |
| תחום | מיגרנה ותחלואי-לב |
| טווח ערכים תקין | טווח ריכוזים תקין של CGRP בדם במבוגרים הוא 17.2±42.8 פיקוגרם/מ"ל על פי Parlapiano וחב' ב-Eur Rev Med Pharmacol Sci משנת 1999. בילדים רמת CGRP בדם 53±6 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
הביולוגיה של CGRP
Calcitonin gene-related peptide (להלן CGRP) הוא חבר במשפחת הפפטידים הקלציטונינים, המורכבת מ-calcitonin, amylin, adrenomedullin, intermedin, ו-calcitonin-receptor-stimulating peptide (Edvinsson ב-Headache משנת 2017). קלציטונין מיוצר בעיקר על ידי תאי C בתירואיד, ואילו CGRP נאגר ומופרש ממערכת העצבים (Jia וחב' ב-Exp Therap Med משנת 2019 ו-Tschopp וחב' ב-Proc Natl Acad Sci USA משנת 2003). פפטיד זה מופיע באדם בשתי צורות: α-CGRP או CGRP-I, ו-β-CGRP או CGRP-II שיש להן הומולוגיה של 94% עם שיירים שונים בעמדות 3, 22 ו- 25 (על פי Russell וחב' ב-Physiol Rev משנת 2014). נוירופפטיד α-CGRP מכיל 37 חומצות אמינו והוא נוצר על ידי splicing אלטרנטיבי של הגן CGRP/calcitonin הממוקם בכרומוזום 11 בעמדה 11p15.2 (Amara וחב' ב-Nature משנת 1982). לעומתו, β-CGRP נחקר פחות, והוא מקודד על ידי גן סמוך בעמדה 11p14.2-p12. (Rezaeian וחב' ב-Brain Develop משנת 2009). לשתי הצורות של CGRP יש תפקידים ביולוגיים דומים, אך כאמור צורת α היא הדומיננטית בין השתיים,
היסטוריה
CGRP זוהה לראשונה בשנת 1982 (Amara וחב' ב-Nature משנת 1982). מיד לאחר גילויו CGRP הוכר כנוירופפטיד מרחיב כלי-דם, וכטרנסמיטור במערכות העצבים המרכזית וההיקפית, ולובנה משמעותו בהעברת כאב וכן כרגולטור קרדיו-וסקולרי. עד מהרה התברר ש-CGRP מופרש מהעצבים הטריגמינלים ומשחק תפקיד במיגרנה (O'conor ו-van der kooy ב-J Neurosci משנת 1988, ו-Edvinsson וחב' ב-Pharmacol Ther משנת 2012). האנטגוניסט הראשון של CGRP, שסומן כ-BIBN 4096 BN, הפגין יעילות בחיות ובאדם (Doods וחב' ב-Br J Pharmacol משנת 2000). בנוסף למשמעותו במיגרנה, ישנן ראיות ש-CGRP הוא גם בעל יעילות הגנתית במחלות קרדיו-וסקולריות (Smillie וחב' ב-Hypertension משנת 2014, ו-Aubdool ב-Circulation משנת 2017). בשנת 2018, dapagliflozin הייתה התרופה שניצבה במקום ה-227 ברשימת התרופות הנרשמות ביותר בארצות הברית עם למעלה מ-2 מיליון מרשמים. נראה ש-dapagliflozin יותר תועלתית מאשר empagliflozin (על פי Zelniker וחב' ב-Lancet משנת 2019. באיחוד האירופי התכשיר מומלץ לטיפול במבוגרים עם סוכרת type 2, כעזר לדיאטה מתאימה ולפעילות גופנית, כטיפול יחידני כאשר הטיפול עם metformin לא מסתייע.
אגירה, הפרשה ומטבוליזם
אף על פי ש-CGRP כרוך בעיקר עם הסיבים Aδ ו-C של נוירונים תחושתיים (Gibbins וחב' ב-Neurosci Lett משנת 1985), צביעה אימוּנית מדגימה את הנוכחות של CGRP בשריר חלק בלב ובכלי הדם המזינים אותו (Csillik וחב' ב-J Histochem Cytochem משנת 1995). הסינתזה של CGRP מתרחשת ב-dorsal root ganglion (Deng ו-Li ב-Peptides משנת 2005), כאשר הקדם-פפטיד עובר ביקוע לצורה הפעילה המאוחסנת בשלפוחיות בקצות העצבים התחושתיים, ומשם היא מופרשת ביחד עם substance P (Gulbenkian וחב' ב-J Neurocytol משנת 1986, ו-Schlereth וחב' משנת 2016). תהליך האקסוציטוזה המביא להפרשת CGRP מתֻווך על ידי מסלולים התלויים בסידן לאחר דה-פולריזציה של העצב (Russell וחב' ב-Physiological Rev משנת 2014). לאחר שחרורו, יש ל-CGRP תקופת מחצית חיים קצרה, והוא מתפנה מהציקולציה בשני שלבים כאשר השלב הראשון נמשך 6.9 דקות, ואילו השלב השני נמשך 26.4 דקות (Kraenzlin וחב' ב-Regul Pept משנת 1985). ריכוזי CGRP בפלזמה במתנדבים בריאים נמוכים בסדרי גודל של עשרות פיקוגרמים/מ"ל, בעיקר בגלל הפינוי המטבולי המהיר שלו מהפלזמה. אך CRP מוגבר באופן טבעי בתקופת ההיריון בה הוא כנראה מווסת את שפיעת הדם בין השלייה והרחם ושינויים וסקולריים באם (Dong וחב' ב-Biol Reprod משנת 2002. רמת CGRP מוגברת במספר מצבים פתולוגיים, כגון ספסיס (Joyce וחב' ב-Surgery משנת 1990). במיגרנה, רמת CGRP גדלה משמעותית (Ashina וחב' ב-Pain משנת 2000, ו-Messlinger באותו כתב משנת 2018). אך גם תאים לא-נוירונליים נמצאו מסנתזים CGRP, כולל לימפוציטים ומונוציטים (Bracci-Laudiero וחב' ב-J Neuroimmunol משנת 2002, Wang וחב' באותו כתב-עת מאותה שנה, ו-Linscheid וחב' ב-Crit Care Med משנת 2004).
התפקיד של CGRP
פפטיד זה נוצר על ידי נוירונים מרכזיים והיקפיים (Rosefeld וחב' ב-Nature משנת 1983) והוא מופרש לצירקולציה מקצוות של עצבים סב-וסקולריים (Zaidi וחב' ב-Eur J Pharmacol משנת 1985). הוא מרפה כלי-דם (vasodilator) פוטנטי, ויכול לתפקד גם בהעברת תחושות כאב (Brain וחב' ב-Nature משנת 1985, ו-McCulloch וחב' ב-Proc Natl Acad Sci USA משנת 1986). בחוט השדרה הביטוי והתפקיד של CGRP יכול להיות שונה בתלות בנקודת הסינתזה שלו. CGRP נובע בעיקר מנוירונים מוטוריים כאשר הוא מסונתז בקרן הוונטרלית של חוט השדרה, ואז הוא יכול לתרום לרה-גנרציה של מערכת העצבים לאחר פציעה. היפוכו של דבר כאשר CGRP נובע מה-dorsal root ganglion, ואז הוא קשור להעברת תחושות כאב (Chen וחב' ב-J Clin Neurosci משנת 2010). במערכת הוסקולרית הטריגמינלית, גופי התאים בגנגליון הטריגמינלי הם המקור העיקרי של CGRP. סבורים של-CGRP יש תפקיד בהומאוסטאזיס הקרדיו-וסקולרי. בלב, CGRP פועל כ-chronotrope המגביר את קצב הלב (Norman וחב' ב-Hormones משנת 2014, Mulderry וחב' ב-Neuroscience משנת 1985, ו-Franco-Cereceda ו-Lundberg ב- Arch Pharmacol משנת 1985). פרט לתפקידים אלה, CGRP ידוע כגורם למודולציה של מערכת העצבים האוטונומית ומשחק תפקיד בבליעת מזון, ויש לו השפעה מתונה על ההומאוסטאזיס של סידן. CGRP מופיע בפלזמה של אנשים בריאים (Girgis וחב' ב-Lancet משנת 1985), אך ריכוזיו בפלזמה גבוהים במיוחד במטופלים עם קרצינומה מדולרית של התירואיד (Mason וחב' ב-Clin Endocrinol משנת 1986, Edbrook וחב' ב-EMBO J משנת 1986, ו-Kim וחב' ב-J Clin Chem Clin Biochem משנת 1989), בקרצינומה של הריאה (Schifter וחב' ב-Endocrinol משנת 1989), ובפאוכרומוציטומה (Mouri וחב' ב-Peptides משנת 1989, ו-Conlon וחב' באותו כתב עת מאותה שנה). תאי אנדותל נמצאו אף הם מסנתזים ואוגרים CGRP בגופיפי Weibel-Palade בהם יש תפקיד רגולטורי בהמו-דינמיקה (Ozaka וחב' ב-Anat Rec משנת 1997, ו-Doi וחב' ב-Histol Histopathol משנת 2001).
מספר מחקרים פרמקולוגיים תומכים בדעה ש-CGRP משחק תפקיד סיבתי במיגרנה. ראשית, עירוי תוך ורידי של פפטיד זה מייצר במתנדבים כאבי ראש דמויי-מיגרנה (Lassen וחב' ב-Cephalalgia משנת 2002). שנית, olcegepant, האנטגוניסט של הקולטן ל-CGRP, יעיל בטיפול בהתקפי מיגרנה חריפים (Olesen וחב' ב-N Eng J Med משנת 2004), ונוגדנים חד-שבטיים המכוונים כנגד CGRP עצמו או כנגד הקולטן שלו, אושרו לטיפול במניעת התקפים (Walter ו-Bigal ב-Curr Pain Headache Rep משנת 2015, ו-Edvinsson וחב' ב-Nature Rev Neurol משנת 2018). שלישית, טריפּטנים, הנחשבים לתכשירים אנטי-מיגרניים יעילים, יכולים להפחית את רמות CGRP בחתולים ובאדם (Goadsby ו-Edvinsson ב-Ann Neurol משנת 1993).
כנוירופפטיד, CGRP פועל כמדכא תיאבון ותורם להפרשת חומצת קיבה. הוא גם פעיל בהומאוסטאזיס של טמפרטורת הגוף, בקצב הלב, ובהפרשה של הורמונים מההיפופיזה באופן פרקריני. לפיכך נאמר ש-CGRP פועל יותר כנוירו-טרנסמיטור מאשר כהורמון. ל-CGRP תפקיד בגיוס תאי גזע, והזרקתו לגוף מעלה משמעותית את מספר תאי הגזע במח העצם האנושי בהשראת granulocyte colony stimulating factor (להלן C-CSF) במסלול של Ramp 1 (Gao וחב' ב-Nature משנת 2021). הפפטיד CGRP משיג את השפעותיו דרך קולטן הֶטרומרי המורכב מחלק הצמוד לחלבון-G והידוע כ- calcitonin receptor-like receptor (להלן CALCRL), ומ-receptor activity-modifying protein (להלן RAMP 1) (Poyner וחב' ב-Pharmacol Rev משנת 2002). הקולטנים של CGRP מצויים בכל הגוף, מה שמצביע על כך שפפטיד זה מאפנן מגוון של תפקודים פיזיולוגיים בכל המערכות העיקריות (נשימה, אנדורינית, גסטרואנטרלית, חיסונית וקרדיו-וסקולרית (Arulmani וחב' ב-Eur J Pharmacol משנת 2004). הרגולציה של הגן CGRP מבוקרת באופן חלקי על ידי הביטוי של מסלול האיתות mitogen-activated protein kinases (להלן (MAPK (Durham ו-Russo ב-J Neurosci משנת 2003), ועל ידי ציטוקינים כדוגמת TNFα (Schäfers וחב' באותו כתב עת מאותה שנה) ו-iNOS (Li וחב' ב-Brain Res משנת 2008). האגוניסט של הקולטן 5HT1, sumatriptan, מגביר את רמת הסידן התוך-תאי, מה שמפחית את פעילות הפרומוטר של CGRP.
הקולטן ל-CGRP מכיל 3 תת-יחידות:
- receptor activity-modifying protein 1 (להלן RAMP1)
- calcitonin-like receptor (להלן CLR)
- receptor component protein (להלן RCP) (Deen וחב' ב-J Headache Pain משנת 2017).
הקולטן המרכזי קשור לחלבוני G וידוע כ- CALCRL החיוני לפעילות של CGRP ושל adrenomedullin. הקולטן CALCRL-RAMP1 כולל גם שני חלבונים ציטופלזמטיים לצורך העברת האיתות בתא. CALCRL מכיל תת-יחידה Gα, המשפעלת את האנזים adenylyl cyclase ואת מסלולי האיתות התלויים ב-cAMP. בשרירים החלקים באזור הנוירו-וסקולרי, הגברת cAMP על ידי השפעול של CGRP, גורת להרחבת כלי-דם. חשיפה כרונית ל-CGRP גורמת להַפְחָתָה בכמות הליזוזומים (Edvinsson וחב' ב- Nature Rev Neurol משנת 2018).
רמות מוגברות של CGRP נמצאו במטופלים עם מיגרנה (Buzzi וחב' ב-Cephalalgia משנת 1995, Edvinsson ו-Goadsby באותו כתב עת משנת 1994, Ferrari ו-Saxena באותו כתב עת משנת 1993, ו-Tepper וחב' ב- American Migraine Foundation משנת 2019), ועם המפגע המוכר כ-temporomandibular joint disorder, כמו גם במטופלים עם מגוון של תחלואות נוספות כגון אי-ספיקת לב (Goto וחב' ב- Ann NY Acad Sci משנת 1992), יתר לחץ-דם ואלח-דם (Joyce וחב' ב-Surgery משנת 1990). מתרבות ההוכחות לכך ש-CGRP יכול להיות תועלתי במניעת התפתחות של יתר לחץ-דם ומפגעים קרדיו-וסקולריים הכרוכים ביתר לחץ-דם. עם זאת תרפיה פרופילקטית עם CGRPs עלולה להשפיע על פוריות האישה בגיל הצעיר. זהו נתון מדאיג, בפרט כאשר נשים חשופות באופן גנטי יותר למיגרנה (16.6%) בהשוואה לגברים (7.5%) (Pellesi וחב' ב- Clin Pharmacol Drug Develop משנת 2017). ראיות קדם-קליניות מרמזות שבמהלך התקפי מיגרנה, נוירונים תחושתיים משופעלים קולטי תחושות כאב בקרומי המוח ובגנגליון הטריגמינלי, מפרישים CGRP מקצות העצב הממוקמים בקרומים האמורים (meninges) (Durham ב-Headache משנת 2006). CGRP מופרש זה נקשר ומשפעל את קולטניו הממוקמים סביב כלי הדם בקרומי המוח, מרחיבים את כלי הדם האלה, גורמים לדה-גרנולציה של תאי פיטום ולדליפת דם מכלי הדם לרקמות המקיפות אותו (extravasation) (Goadsby וחב' ב- Ann Neurol משנת 1990, ו-Edvinsson ב-Headache משנת 2006). במהלך מספר התקפים של מיגרנה, רמות מוגברות של CGRP יכולות להימצא גם ברוק ובפלזמה הנשאבת מווריד הצוואר (Lassen וחב' ב-Cephalalgia משנת 2002).
המשמעות של CGRP במיגרנה פדיאטרית
ניסוי וסקירה עדכנית של Fan וחב' התפרסמו בשנת 2019 ב-Frontiers in Neurology, על התגובה התרפויטית הקשורה ל-CGRP בילדים. לניסוי גויסו 121 ילדים שלא טופלו קודם לכן בשום תכשירים למניעת מיגרנה, מתוכם 69 ילדים מאובחנים עם מיגרנה, 30 ילדים עם כאבי ראש לא-מיגרניים, וקבוצת ביקורת שכללה 22 ילדים תואמי-גיל ללא כאבי ראש. התגובה לטיפולים בוצעה אחת לשבועיים לאחר תחילתם. מגיבים לטיפולים הוגדרו כאלה עם ירידה של למעלה מ-50% בכאבי הראש. ריכוזי CGRP בפלזמה נמדדו בשיטת ELISA. תוצאות הניסוי היו כדלקמן: בקבוצת המיגרנה, הרמה הממוצעת של CGRP בעת התקף הייתה 60±291 פיקוגרם/מ"ל, ובין התקפים רמת CGRP נקבעה בממוצע כ-240±48 פיקוגרם/מ"ל, ורמות אלו היו גבוהות משמעותית בהשוואה למטופלים עם כאבי ראש לא-מיגרנריים בהם הרמה הממוצעת של CGRP נקבעה כ-51±5 פיקוגרם /מ"ל, עם משמעות של p=0.006 ו-p=0.018, בהתאמה. בילדים בקבוצת הביקורת רמת CGRP בפלזמה נקבעה בממוצע כ-53±6 פיקוגרם/מ"ל הנמוכה אף היא בהשוואה לרמות הפפטיד בילדים עם מיגרנה או באלה עם כאבי ראש שלא ממיגרנה. ארבעים ושבעה מהמטופלים בניסוי (69%) שהיו זקוקים לטיפול למניעת כאבים היו בעלי רמת CGRP ממוצעת בפלזמה של 364±62 פיקוגרם/מ"ל, בהשוואה לאלה שלא נזקקו לטיפול משכך כאבים עם רמת CGRP ממוצעת של 54±183 פיקוגרם/מ"ל (הבדל משמעותי p=0.031). המטופלים שהגיבו ל-topiramate היו בעלי רמות CGRP גבוהות יותר (437±131 פיקוגרם/מ"ל (בהשוואה לרמתו באלה שלא הגיבו לטיפול (67±19 פיקוגרם/מ"ל) (הבדל משמעותי p=0.021). תוצאות אלו משמעותיות קלינית, בעיקר כשמדובר בילדים קטנים שאינם מסוגלים לתאר את תסמיני כאבי הראש שלהם. תסמינים הקשורים למיגרנה כגון כאבי בטן, כאבי רגליים, או לעיתים motion sickness הכולל בחילה, הקאות, זיעה קרה, רדימות, פיהוקים תכופים, איבוד תיאבון וריור-יתר שכיחים יותר בילדים בתקפי מיגרנה מאשר במבוגרים (Tarantino וחב' ב- Am Acad Neurol משנת 2014). כמו כן תרופות היעילות במבוגרים אינן מיועדות לשימוש בשגרה בילדים).
הקולטן של CGRP
האופי המורכב של הקולטן ל-CGRP נובע מהיותו מורכב מ-calcitonin receptor-like receptor (להלן CLR), מקולטן class B הקשור לחלבון G (להלן GPCR), מקולטן RAMP1 שהוא חבר במשפחת שלושת קולטני RAMP הטרנס-ממברנליים, וכן מה-receptor component protein (להלן RCP) (על פי Melatchie וחב' ב-Nature משנת 1998, Evans וחב' ב-J Biol Chem משנת 2000, ו-Dickerson ב-Protein Pept Sci משנת 2013). RAMP1 חשוב בטרנספורט של CLR לממברנת התא, שם הם יוצרים את ההטרודימר לגיבוש קומפלקס הקולטן השלם המאפשר קישור של האגוניסט (Booe וחב' ב-Mol Pharmacol משנת 2018), בעוד ש-RCP חשוב בתהליך האיתות התוך-תאי של חלבון G. עם זאת, בגלל האופי המְעֻרְבָּב של RAMP, סבורים כעת ש-CGRP יכול לאותת דרך קולטנים שאינם הולמים את התנאים המקובלים כגון השילוב של CLR/RAMP3 שהוא הקולטן של adrenomedulin (על פי Qi וחב' ב-Peptides משנת 2011), עם כי בפוטנצית קישור נמוכה יותר. חלבוני RAMP מווסתים את הטרנספורט של CLR מהרטיקולום האנדופלזמטי לממברנת התא, והודגם שהזנבות הציטופלזמטיים של חלבוני RAMP קריטיים לתנועה הציטופלזמטית של CLR לממברנה. וכדי להוסיף למורכבות של הקולטנים, נמצא שהקשר בין הקולטן לקלציטונין (CTR) ו-RAMP1 יוצר גם הוא קולטן המגיב לקישור CGRP. אכן, הביטוי של CTR/RAMP1 הוא בכל חשיבות פוטנציאלית במערכת הטריגמינלית התחושתית, בה הוא יכול למלא תפקיד בכאב המיגרני כפי שנראה על פי בביטוי וההיסטולוגיה שלו בחולדה ובאדם (Hay וחב' ב-J Pharmacol משנת 2018). CTRs יכולים לסייע לטרנסלוקציה של RAMP אל ממברנת התא. בְּמוֹרַד המסלול של שפעול קומפלקס הקולטן של CGRP, נוצר קשר עם Gαs ו-Gαq באופן שהוא רלוונטי להשפעת קישור האגוניסט תוך שילוב שני חלבוני G אלה. שימוש בשורת התאים HEK293 הצביע על כך ש-CGRP מעדיף את מסלול Gαs ולכן מרחיב כלי-דם (Weston וחב' ב-J Biol Chem משנת 2016), על ידי הגברת היצירה של NO בתאי אנדותל, והרפיית השריר חלק בדופן כלי הדם.
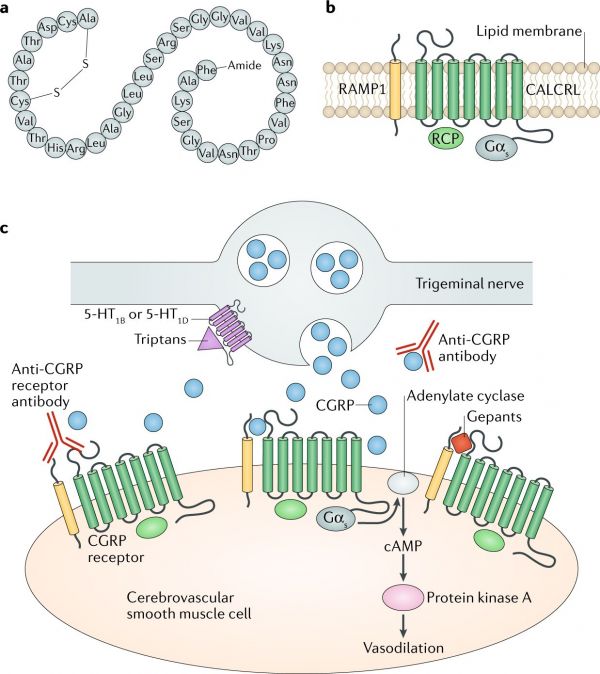
(b) קומפלקס הקולטן של CGRP המורכב משני חלבונים ממברנליים אינטגרלים (CALCRL ו-RAMP1), ומשני חלבונים ציטופלזמטיים (RCP ותת היחידה אלפא של חלבון Gs.
(c) היעדים לתרפיה של מיגרנה הקשורה ל-CGRP המצוינים בתוך עצב טריגמינלי המכיל CGRP ומעצבבים את השריר החלק הצרברו-וסקולרי.
5-HT- הקולטן ל 5-hydroxytryptamine.
השפעת CGRP בהרחבת כלי-דם
פיזיולוגית, עירוי תוך-ורידי של CGRP באדם, משרה ירידה בלחץ הדם כתוצאה מההשפעה הואזו-דילטורית כמו גם בגלל ההשפעה הכרונוטרופית החיובית (Struthers וחב' ב-Clin Sci משנת 1986), וכן כתוצאה מהשינוי בשפיעת הדם באדם (Jager וחב' ב-Eur J Clin Pharmacol משנת 1990). עירוי ורידי של CGRP מגביר גם את שפיעת הדם לעור (מה שבא לביטוי בסומק בפנים) וכן למוח שניתן למדידה על ידי הדמיית laser doppler. ל-CGRP יש גם השפעות על מערכות איברים, כגון הכליות, בכך שהוא משרה הרפיה והגברה ברמות cAMP מה מגביר שפיעת דם ועלייה בסינון הפקעתי (גלומרולרי) ומשפיע על ההמודינמיקה הכלייתית (Kurtz וחב' ב-Kidney Int משנת 1989, ו-Edwards ו-Trizna ב-Am J Physiol משנת 1990). כמו כן, משפיע CGRP על שפיעת הדם הכלילי מה שניתן לבחון על ידי אנגיוגרפיה (Ludman וחב' ב-Circulation משנת 1991). CGRP הוא בעל מגוון רחב של השפעות רגולטוריות שנלמדו בעיקר במכרסמים. נמצא שהפפטיד הזה משרה את השפעתו הואזו-דילטורית באופן בלתי-תלוי בתוצרים של cyclo-oxygenase כגון prostacyclin (על פי Brain וחב' ב-Nature משנת 1985). לשם השוואה, ל-CGRP יש מנגנון של ואזו-דילציה התלוי ב-NO במספר רקמות. קיימת גם אינטראקציה לפיה הקולטן ל-CGRP מפחית את ההשפעות של מכווץ כלי הדם אנדותלין תוך מעורבות של תת-היחידה betagama של חלבון G (על פי Meens וחב' ב-Br J Pharmacol משנת 2012). תופעות לוואי של התכשיר כוללות היפוגליקמיה, זיהומים של מערכת השתן, זיהומים של המבושים, והורדת נפח המים בגוף (Ptaszynska וחב' ב-Drug Safety משנת 2014). קטו-אצידוזיס סוכרתי היא תופעת לוואי שכיחה בחולים עם סוכרת type 1 (על פי Dandona וחב' ב-Diabetes Care משנת 2018, ותופעת לוואי חמורה אם כי נדירה היא Fournier gangrene (על פי Hu וחב' ב-Journal of Diabetes Research משנת 2020).
CGRP במחלה קרדיו-וסקולרית
יתר לחץ-דם: למרות השפעתו של CGRP כמולקולה ואזו-דילטורית, אין קונצנזוס בדבר הרמות של CGRP ביתר לחץ-דם. בבני-אדם עם יתר לחץ-דם, רמת CGRP בפלזמה נמצאה מוגברת (Masuda וחב' ב-J Hypertens משנת 1992, נורמלית (Schifter וחב' באותו כתב-עת משנת 1991, או אף מופחתת (Edvinsson וחב' ב-J Human Hypertens משנת 1989, ו-Portaluppi וחב' ב-J Hypertens משנת 1992). הוצע, שממצאים סותרים אלה מקורם בהבדלים בדגימת הדם, בשיטות ה-RIA ששימשו למדידה, וכן בגין הטרוגניות במדידת לחצי הדם, חומרת לחצים אלה והטיפולים התרופתיים להם היו חשופים הנבדקים (Bell ו-McDermott ב-Pharmacol Rev משנת 1996). עם זאת, במטופלים עם יתר לחץ-דם שניוני, רמות CGRP בפלזמה היו נמוכות לאחר הסרת האדרנל כחלק מהטיפול להפחתת לחץ הדם. נתונים אלה יכולים להעיד על ש-CGRP היא תגובה מפצה על לחץ הדם המוגבר, ותגובה זו יכולה להימנע או להיות מעוכבת עם ההתפתחות של התחלואה הנגרמת מלחץ דם מוגבר.
בעכברים טרנסגניים (knockout) ללא CGRP נמצא שלחץ הדם היה מוגבר משמעותית בחלק מהזנים אם כי לא בכולם (Kurihara וחב' ב-Hypertens Res משנת 2003, ו-Mai וחב' ב-J Am Soc Hypertens משנת 2014). התפקיד של CGRP נבחן במגוון של מודלים אחדים של יתר לחץ-דם במכרסמים. במחקר אחד בו הרמה הבסיסית של לחץ הדם לא הושפעה על ידי CGRP בעכברי knockout, הזרקת angiotensin במשך 28 יום, גרמה להגברת לחץ הדם, במקביל לירידת רמת האנזים NO synthase אנדותליאלי. במודל חולדות, יתר לחץ-דם המושרה על ידי angiotensin בהזרקה בעת ובעונה אחת של רמות מתונות של CGRP ושל אנגיוטנסין למשך 6 ימים הפחיתה משמעותית את לחץ הדם (Fujioka וחב' ב-J Hypertens משנת 1991). עם זאת, בניסוי של 10 ימים, אנגיוטנסין הגדיל את ביטוי הקולטן ל-CGRP, אך לא את הרמות האנדוגניות של CGRP (על פי Li ו-Wang ב-J Hypertens משנת 2005). בזן עכברים אחד של עכברי knockout משוללי CGRP, רמת renin בפלזמה הייתה גבוהה יותר (Li וחב' ב-J Hypertens משנת 2004). לכן נראה ש-CGRP מגן מפני לחץ-דם גבוה על ידי אינטראקציה עם renin angiotensin aldosterone system (להלן RAAS) לשמירה על רמת לחץ הדם (Kawasaki וחב' ב-Japan J Pharmacol משנת 1999). זה לכאורה לא מפתיע ש-CGRP באופן בלתי-ישיר עם מגוון של תווכים ואזו-אקטיביים. ראיות מוקדמות מה-mesentery (מִתְלֵה הַמְּעִי) בחולדות מראות ש-noradrenaline המופרש מנוירונים תחושתיים, יכול להשפיע על הפרשת CGRP וכן היפוכו של דבר, מה שמצביע על הפוטנציאל של CGRP להיות מעורב בוויסות התנגודת הווסקולרית (Kawasaki וחב' ב-J Pharmacol Exp Ther משנת 1998). צביעה אימונו-היסטוכימית גילתה ריכוזים גבוהים של סיבים חיוביים ל-CGRP בעורק המזנטרי בחולדה. נראה מכל המחקרים הללו שיש ל-CGRP היכולת לעכב פעילות עצבית סימפטתית.
איסכמיה
CGRP מופרש אנדוגנית בתגובה לאיסכמיה (Mishima וחב' ב-Am J Physiol heart Circ Physiol משנת 2011), והוא מוצע כממלא תפקיד בהגנה כנגד מפגיעה כתוצאה מזילוח מחדש (reperfusion). נמצא באדם שהביטוי של CGR בפלזמה, משודרג לאחר אוטם חריף של שריר הלב (Roudenok וחב' ב-Ann Anat משנת 2001). במודלים בחולדה הודגם ש-CGRP עשוי להפחית את הפגיעה מזילוח מחדש העלול להיגרם בלב, במוח, וברקמת הכבד (Song וחב' ב-Transplant Proc משנת 2009, ו-Liu וחב' ב-Regul Pept משנת 2011). השחרור של CGRP מ-TRPV1 גם כן נכרך במודל חולדות של איסכמיה/רה-פרפוזיה, וכאשר מוחדר ruthenium red שהוא אנגוניסט לא-סלקטיבי של TRP, ההשפעה המגינה של CGRP מתבטלת (Singh וחב' ב-Drugs Ther משנת 2012).
גישות תרפויטיות הכרוכות במסלולי CGRP
מספר כלים פרמקולוגיים המכוונים כנגד CGRP פותחו לטיפול במיגרנה. אנטגוניסטים של CGRP כגון Olcegepant הראו תוצאות טובות בטיפול במיגרנה, אך לא זכו לפיתוח נוסף (Yao וחב' ב-Neural Regen Res משנת 2013). ריאגנטים אלה נבחנו לבטיחותם לאחר קבלת מינון יחיד (Edvinsson ב-CNS Drug Rev משנת 2005) או לאחר מינון יומי מתמשך (Ho וחב' ב-Neurology משנת 2014), אך לא התגלו תופעות לוואי קרדיו-וסקולריות. עם זאת, ניסויים אלה היו קטנים יחסית בהיקפם וגם תקופת המעקב הייתה קצרה (לא מעל 12 שבועות). מחקרים ארוכים יותר עם נוגדנים חד-שבטיים גם כן לא הראו תופעות לוואי קרדיו-וסקולריות. במחקר אחד, שבחן במיוחד השפעות קרדיו-וסקולריות או המודינמיות של אנטגוניזם של CGRP באדם, לא מצאו שינויים משמעותיים בלחץ הדם, בקצב הלב, או ב-ECG לאחר טיפול שנמשך 24 שבועות (Bigal וחב' ב-Cephalalgia משנת 2014). ישנם ארבעה נוגדנים חד-שבטיים המכוונים כנגד CGRP או כנגד הקולטן שלו, שכבר עברו ניסויים קדם-קליניים ב-phase 2 או ב-phase 3, ובשלב זה לא נמצאו כל השפעות לוואי או שינויים משמעותיים במדידות קרדיו-וסקולריות כגון ECG שניתן היה ליחסן לנוגדנים אלה. רוב הניסויים בוצעו באנשים נורמליים-בריאים. ראיות חדשות שהופיעו לאחר בחינת ההשפעה של עירוי תוך ורידי של erenumab, במטופלים עם תעוקת חזה יציבה, לא הצביעו על הבדלים משמעותיים בתעוקת החזה או באיסכמיה שנגרמו לאחר פעילות גופנית מאומצת, מה שתאם את ההשפעה המינימלית של עיכוב CGRP בתרחישים חריפים (Depre וחב' ב-Headache משנת 2018). עם זאת, erenumab הוא הנוגדן היחיד שחוסם את הקולטן של CGRP, וזקוקים למחקרים נוספים כדי לברר האם הפחתה כרונית ברמת CGRP משפיעה באופן לא רצוי על מטופלים עם מחלות קרדיו-וסקולריות, מה גם שמיגרנה כרוכה בסיכון מוגבר של מחלה קרדיו-וסקולרית (Sacco ו-Kurth ב-Curr Cardiol Rep משנת 2014).
פרמקו-תרפיה של CGRP
טיפול עם אגוניסט של CGRP יפעל בהגברת האיתות של פפטיד זה, והוא עשוי לסייע בהגנה על הלב. לכן ניתן לשער שטיפול עם CGRP אקסוגני יכול לסייע במצבי יתר לחץ-דם, איסכמיה ואי ספיקת לב. עם זאת, אחד מהכשלים של CGRP הוא בכך שבהיותו פפטיד החשוף לביקוע פרוטאוליטי בקיבה ובמעי לא ניתן לתת אותו פומית. בנוסף, ל-CGRP יש תקופת מחצית-חיים קצרה והוא מתפנה במהירות מהדם. מתן אקסוגני של CGRP נלמד במטופלים עם אי-ספיקת לב גדושה (GHF), בהינתנו בעירוי מתמשך של 24 שעות, ונמצא תועלתי למשתנים ההמודינמיים (Gennari וחב' ב-Cardiovasc Res משנת 1990). אך יתרונות אלה התפוגגו תוך 30 דקות מהפסקת העירוי, שהרי תקופת מחצית חיי הפפטיד קצרה (Shekhar וחב' ב-Am J Cardiol משנת 1991). נגזרת של CGRP שעברה אצילציה (alfaCGRP), סונתזה ותקופת מחצית החיים שלה התארכה ל-10.2 שעות תוך בחינת נגזרת זו במודל של סוכרת (Nilsson וחב' ב-Eur J Pharmacol משנת 2010). אותו אנלוג של הפפטיד נבחן מאוחר יותר בעכברים במודלים של יתר לחץ-דם ושל אי-ספיקת לב, נמצא שהזרקת עכברים מדי יום במינון של 100 ננומול'/ק"ג, הגנה מפני יתר לחץ-דם על ידי החלשת ה-remodeling של הלב, הפחתת עקה חמצונית וכן הפחיתה את לחץ הדם במודל angiotensin II של יתר לחץ-דם. גם תפקוד כליות נשמר במקביל לשדרוג של RAMP1. במודל של כשל-לב מהיצרות של אבי העורקים הבטני, האנלוג האמור של CGRP הפחית את ההיפרטרופיה ואת תהליך אפופטוזיס בלב, מה שמדגים את ההשפעה התועלתית של טיפול עם CGRP למשך מספר שבועות במקרי כשל לב (Aubdool וחב' ב-Circulation משנת 2017). ברקמת אדם, האנלוג של CGRP, הדגים השפעות פרמקולוגיות דומות Sheykhzade וחב' ב-Eur J Pharmacol משנת 2018).
תרופות
תרופות חדשות נמצאות על המדפים, כוללות נוגדנים חד-שבטיים כנגד CGRP או כנגד הקולטן שלו (Pardridge ב-BioDrugs משנת 2017). התכשיר הראשון שאושר על ידי ה-FDA היה erenumab (שם מותג Aimovig), המיוצר על ידי Amgen ו-Novartis. נוגדן חד-שבטי זה מגיב עם הקולטן של CGRP, והוא ניתן אחת לחודש בהזרקה של 70 או 140 מיליגרם. תופעות הלוואי מעטות וקלות יחסית, בעוד שיש הפחתה משמעותית בעוצמת המיגרנות (Rosenberg ב- AJMC com משנת 2019, ו- Lattanzi וחב' ב-Drugs מאותה שנה). תכשיר נוסף שאושר על ידי ה-FDA הוא fremanezumab (שם מותג Ajovy) המיוצר על ידי Teva). תכשיר זה הניתן אחת לחודש או לשלושה חודשים מגיב עם CGRP עצמו. נמצא שתכשיר זה הפחית בלמעלה מ-50% בימי התקף המיגרנה באלה שהגיבו לו. תופעות הלוואי הצטמצמו למקום ההזרקה (Bigal וחב' ב-CNS Drugs משנת 2018). תכשיר שלישי שאושר על ידי ה-FDA הוא galcanezumab (שם מותג Emgality), מיוצר על ידי Eli Lilly ומגיב עם CGRP, הוא ניתן בהזרקה אחת לחודש, עם תופעות לוואי המוגבלות למקום ההזרקה (Lamb ב-Drugs משנת 2008). עוד תכשיר שזכה לאישור ה-FDA בפברואר 2020, הוא ubrogepant שהוא תכשיר פומי המיוצר על ידי Allergan. באותו תאריך אישר ה-FDA את השימוש ב-eptinezumab (שם מותג Vyepti) שהוא תכשיר פרופילקטי המיוצר על ידי Lundbeck והניתן בעירוי לווריד.
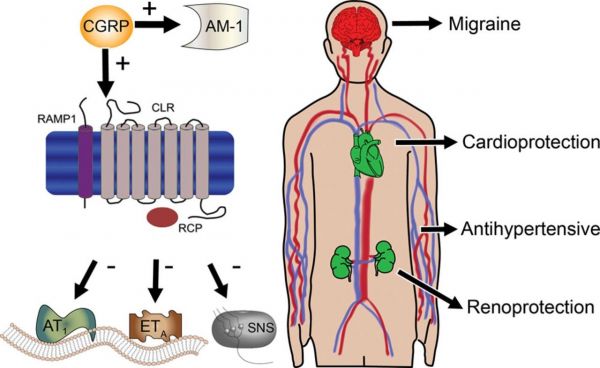
על ידי התקשרות לקולטן זה, αCGRP מדכא השפעות מזיקות המתווכות על ידי הקולטנים של angiotensin II type 1 (או AT1) ושל endothelin type A (או ETa), כמו גם מפחית את פעילות מערכת העצבים הסימפטתית (או SNS). כחלופה, αCGRP יכול לעודד את יצירת קולטנים ל-amylin-1 (או AM-1). αCGRP מפחית את יתר לחץ הדם, מפחית היפרטרפיה של הלב, ואף מגן על הכליות.
הוראות לביצוע הבדיקה
יש לדגום דם דרך מזרק מקורר, כאשר הדם מועבר למבחנת EDTA המכילה גם aprotinin (500KIU/ml). המבחנות מסורכזות למשך 15 דקות במהירות 5,000g, בצנטריפוגה מקוררת, והפלזמה נשמרת ב-מינוס 70º עד לבדיקה. ניתן לבצע את מדידת ריכוזי CGRP ב-radioimmunoassay בערכת בדיקה הכוללת נוגדנים מארנבת המגיבים בשיעור של 100% עם CGRP הומני. הבדיקה מתבצעת בעיקר בשיטת ELISA.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - מפגעי מערכת העצבים והמוח
- בדיקות מעבדה - תחלואת לב וכלי-דם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 