דסמין - Desmin
הופניתם מהדף Desmin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| דסמין | |
|---|---|
| Desmin | |
| |
| מעבדה | כימיה בדם ואונקולוגיה בדם |
| תחום | פילמנטים בתאי שריר |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
זיהוי של תאי שריר משורטט או חלק, וגידולים סרטניים הנובעים מסוגי תאים אלה.
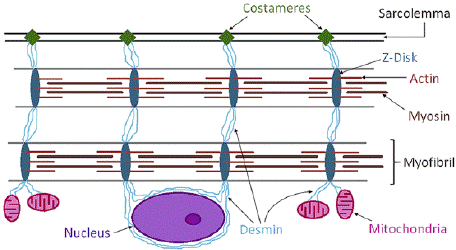
Desmin הוא חלבון המקודד באדם על ידי הגן DES (Muñoz-Mármol וחב' ב-Proc Natl Acad Sci USA משנת 1998, ו-Li וחב' ב-Gene משנת 1989). Desmin חלבון ספציפי לשריר, הוא intermediate filament type III הנמצא באינטרגרציה עם הסרקולמה, עם disk Z ועם ממברנת הגרעין בסרקומרים, ומווסת את המבנה של הסרקומר (Brodehl וחב' ב- Biophysical Reviews משנת 2018, ו-Sequeira וחב' ב-Biomembranes משנת 2014).
המבנה של desmin
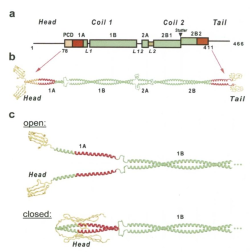
Desmin הוא חלבון במשקל מולקולרי של 53,500 דלטון, המכיל 470 חומצות אמינו (Zong וחב' ב-Circ Res משנת 2013). במולקולה של desmin ישנם שלושה מקטעים עיקריים: מוט (rod)α helix משומר (המורכב מ-4 קטעים סלילוניים 1A, ,2A ,1B 2B), "ראש" משתנה non α helix ו"זנב" קרבוקסי טרמינלי (Bär וחב' ב-J Struct Biol משנת 2004). Desmin בדומה לכל ה-intermediate filaments אינו מפגין קוטביות כאשר הוא עובר assembly. מקטעי הראש והזנב הם גלובולריים ואינם סלילוניים. מקטע המוט מורכב מ-308 חומצות אמינו עם מבנה של סליל דימרי לא מקביל עם שלושה קשרי ביניים. מקטע המוט קשור למקטע הראש המכיל 84 חומצות אמינו עם שיירים רבים של arginine, serine וחומצות אמינו ארומטיות, שחשיבותו בהתגודדות של הפילמנט ובאינטראקציות דימר-דימר. מקטע הזנב אחראי לאינטגרציה של הפילמנטים, ולאינטראקציה של desmin עם חלבונים ועם אברונים (organelles) תוך-תאיים. מוצאים desmin רק בבעלי חוליות, והוא מהווה תת-יחידה של intermediate filaments בשריר הלב, בשרירי שלד, וברקמת שריר חלק (Li וחב' ב-J Cell Biol משנת 1987). בשריר הלב, desmin מופיע ב-Z discs כמו גם בדיסקים משולבים. נמצא ש-desmin עובר אינטראקציה עם desmoplakin (Meng וחב' ב-J Biol Chem משנת 1997) וכן עם αB-crystallin (על פי Benarrdini וחב' ב-Circ Res משנת 1992). DES הגן המקודד ל-desmin ממוקם על כרומוזום 2 בעמדה 2q35, והוא בעל DNA גנומי בגודל של 8.4kb, ומכיל 9 אֶקסונים.
כמו IFs אחרים יש ל-desmin מחזוריות אקסיאלית אחת ל-20-22nm. Ip ו-Heuser הראו ש-desmin יוצר הטרו-פולימרים הנמצאים באגרגציה עם מבנים פיברילריים, טטרמריים מצולבים. וכך לדוגמה מקטע "ראש" desmin יכול לשהות צד בצד עם המקטע המרכזי של desmin סמוך (J Cell Biol משנת 1988). Desmin מופיע בתאי שריר משורטטים בשלבי ההתפתחות שלהם ב-myotube, בהם המיובלסטים מתאחים זה עם זה. Desmin מחליף כאן במידה רבה את vimentin, כיוון שהאחרון מהווה IF המבוטא בתחילה בכל התאים העובריים המזנכימליים. בשלב הראשון הפילמנטים של desmin מסודרים בצורה אורכית (longitudinal), אך לאחר שהשריר מתבגר, מתרכז desmin סביב ה-Z-discs. אנליזה של האימונו-ריאקטיביות של desmin בתאי שריר עובריים ובוגרים, תוך שימוש בנוגדנים חד שבטיים דוגמת D3 ו-D76, הראתה ש-D3 מזהה desmin תאי עוברי אך אינו מגיב עם תאים בוגרים; לעומת זאת, D76 מגיב רק עם desmin בוגר ולא עם עוברי. נתונים אלה מצביעים על כך ש-desmin כנראה עובר שינוי ביוכימי בעת התפתחות התא, או שאפיטופים שונים עוברים מיסוך בתאים עובריים ובוגרים (Fischman ו-Danto ב-Ann NY Acad Sci משנת 1985).
התפקוד של desmin
Desmin תואר לראשונה בשנת 1976 על ידי Lazarides וחב' ב-Proc Natl Acad Sci USA, ונוקה לראשונה בשנת 1977 על ידי Izant וחב' באותו כתב עת, כאשר הגן שובט בשנת 1989, ועכברי knockout הראשונים נוצרו בשנת 1996 ותוארו על ידי Costa וחב' ב-Brazil J Med Biol Res משנת 2004. התפקוד של desmin פוענח במחקרים עם עכברי knockout, ומסתבר שחלבון זה הוא אחד הסמנים החלבוניים המוקדמים ביותר של רקמת השריר בתהליך האמבריוגנזה שמגלים ב-somites שהם המסות של mesoderm המפוזרות בשני צדי הצינור העצבי בעוברים של בעלי חוליות. אף על פי ש-desmin מופיע מוקדם בהתפתחות תאי שריר, הוא מבוטא בריכוזים נמוכים, ההולכים וגדלים כאשר התא מתקרב לשלב הסופי של התמיינותו. עם זאת, עכברי knockout ל-desmin מתפתחים באופן נורמלי ורק בשלב מאוחר של חייהם מתגלים בהם פגמים.
בלבבות של עכברים בוגרים בגיל 10 שבועות נטולי-desmin, מוצאים שינויים דרסטיים במבנה השריר, כולל יִשּׁוּר פגום של מיופיברילות ומבנה לקוי תוך התנפחות של המיטוכונדריה, ממצאים שהיו חמורים יותר בשריר הלב מאשר בשרירי השלד. הרקמה הלבבית הפגינה גם נמק מתקדם והסתיידות של שריר הלב (Milner וחב' ב- J Cell Biol משנת 1996). מחקר נוסף ברקמת הלב מצא שעכברים עם לבבות נטולי-desmin, פיתחו קרדיומיופתיה היפרטרופית עם חדרי-לב מוגדלים ופגיעה בתפקוד הסיסטולי (Milner וחב' ב- J Mol Cell Cardiol משנת 1999). בשריר הבוגר, desmin יוצר שלד פיגומי (scaffold) סביב ה-Z disc של הסרקומר ומחבר את ה-Z disc לשלד התאי התת-סרקולמי (Paulin ו-Li ב-Exp Cell Res משנת 2004). על ידי חיבור של ה-Z discs, המיופיברילות נקשרות באופן לטרלי. על ידי התחברותו לסרקומר, desmin קושר את מַנְגָּנוֹן ההתכווצות של התא לגרעין התא ולמיטוכונדריה, וכך נשמרת השלמוּת המבנית והמכנית של התא במהלך ההתכווצות שלו (Shah וחב' ב- Biophys J משנת 2004). במצב של אי-ספיקת לב באדם, משתדרג הביטוי של desmin ומשערים שזהו מנגנון הגנה לשמור על סרקומר נורמלי במהלך פתוגנזה זו של הלב (Heling וחב' ב-Circ Res משנת 2000). יש גם ראייה מסוימת לכך ש-desmin גם מחבר את הסרקומר למשתית החוץ-תאית ((ECM על ידי דסמוזומים, ובכך מווסת תהליך התכווצות השריר ותנועתו. Desmin עשוי להיות משמעותי בתפקוד המיטוכונדריה שכן כאשר יש בעיה בתפקוד של desmin, יש פגיעה בפיזור התאי של המיטוכונדריה, במספר המיטוכונדריות בתא במורפולוגיה ובתפקוד שלהן (Milner וחב' ב-J Cell Biol משנת 2000, ו-Goldfarb וחב' ב-Brain משנת 2004).
המשמעות הקלינית של desmin
תרחיש דסמנופתיה של DRM (או desmin-related myofibrillar myopathy) היא תת-קבוצה של מחלות של מיופתיה מיופיברילרית הנובע ממוטציה בגן המקודד ל-desmin, המונעת מ-desmin ליצור פילמנטים חלבוניים, ובמקום זאת ליצור ברחבי התא אגרגציות של desmin עם חלבונים אחרים. מוטציות אלו בגן DES נכרכו עם קרדיומיופתיה מסוגים שונים: restrictive (Brodehl וחב' ב-Genes משנת 2019), dilated (Fischer וחב' ב- Int J Cardiol משנת 2020, ו-Brodehl וחב' ב- J Mol Cell Cardiol משנת 2016), אידיופתי (Li וחב' ב-Circulation משנת 1999, ו-Goldfarb וחב' ב-Nat Genet משנת 1998) ואריתמוגני (Protonotarios וחב' ב-Canad J Cardiol משנת 2020, Bermúdez-Jiménez וחב' ב-Circulation משנת 2018, Klauke וחב' ב- Hum Mol Genet משנת 2010, ו-Lorenzon חב' ב- Am J Cardiol משנת 2013). חלק ממוטציות אלו בגן DES גורמות לאגרגציה של desmin עם הציטופלזמה (Brodehl וחב' ב- J Biol Chem משנת 2012, ו-Brodehl וחב' ב- Genet Med משנת 2018). מוטציה p.A120D התגלתה במשפחה שמספר חברים בה מתו ממוות לבבי פתאומי (Brodehl וחב' ב- Circulation משנת 2013, ובנוסף, מוטציות ב-DES גורמות לעיתים קרובות לפגיעה בהוֹלָכָה החַשְׁמַלִית הלבבית (Schirmer וחב' ב- Mol Genet Genomic Med משנת 2018).
אף על פי ש-desmin מבוטא בעיקר בתאים מיוגניים, מחקרים in vitro מצביעים על נוכחותו גם בתאי עוּבּר תרנגולת ובפיברובלסטים של כליות אוגר, זאת בשל האופי המיו-פיברובלסטי של תאים אלה. עם זאת, לא כל תאי שריר מכילים desmin. לדוגמה, Schmid וחב' דווחו ב-Exp Cell Res משנת 1982 על שלושה סוגי תאים נפרדים: השריר החלק של אבי העורקים ביונקים, כאשר חלקם מבטאים רק vimentin, חלקם מבטאים ביחד vimentin ו-desmin וחלקם מבטאים רק desmin. שלושת הנוגדנים החד-שבטיים כנגד desmin הם DER-DER-11, D33 ו-DEB-5. בשיטה של Western blot, נמצא שנוגדנים אלה מזהים אפיטופים של desmin בין השיירים 324 ו-415, ויתרונם של נוגדנים אלה שהם אינם מגיבים עם IFPs אחרים. כללית, desmin כצפוי הוא סמן ספציפי של התמיינות מיוגנית בסרטנים של רקמות רכות. בתור שכזה, ניתן למצוא אותו ב-rhabdomyomas, ב-leiomyomas, ב-rhabdomyosarcomas וב-leiomyosarcomas (על פי Lehtonen וחב' ב-Acta Pathol Microbiol Scand משנת 1982). כיוון שמיופיברומטוזות הן באופן חלקי בעלות אופי מיוגני, ברור שגידולים דסמואידיים כמו גם מיופיברומות מכילים desmin. עם זאת, תאים מיו-אפיתליאליים חסרים desmin ולעומת זאת, desmin מופיע בגידולים דוגמת epitheliod sarcomas, ב-desmoplastic small round cell tumors, ב-MPNST או malignant peripheral nerve sheath tumor וכן ב-rhabdoid tumors (על פי Lae וחב' ב-Am J Surg Pathol משנת 2002).
Small ו-Sobieszek היו הראשונים שדווחו בשנת 1977 ב-Eur J Biochem על כך ש-desmin מהווה ישות ביוכימית ייחודית. הם מצאו ש-desmin מייצג חלבון פילמנטי שארי בתאי שריר שאינם מכילים actin ו-myosin בתנאי in vitro, וקבעו שהנקודה האיזו-אלקטרית שלו היא בערך 4.0, שהוא יציב בחום, ואינו מסיס בתמיסות עתירות מלח. אנליזה של חומצות אמינו הראתה ש-desmin עתיר בגלוטמאט ואספרטאט, ויש לו הומולוגיה לחלבונים פילמנטיים בתאי גליה. ממצא חשוב אחר הוא שתאי שריר נטולי desnin עדיין מסוגלים להתכווץ בתגובה ל-ATP ולסידן. מסקנת החוקרים הייתה ש-desmin אינו משחק תפקיד בכיווציות.
דסמינופתיות
התרחיש שאינו שכיח יחסית RCM או restrictive cardimyopathy, שייך לקבוצת המיופתיות הקשורות ל-desmin. חלק מאלה עם RCM סובלים גם ממיופתיה של השלד, מה שמעלה אפשרות שמוטציה בגן DES אחראית ל-RCM. הצטברות של desmin בשרירי הלב והשלד, נצפתה גם בחסר מוטציה בגן DES. מוטציות ב-DES יוחסו גם לתרחיש של DCM או dilated cardimyopathy. אנליזה של אולטרה-סטרוקטורה של שריר הלב במטופלים עם RCM מראה הצטברות של desmin בציטופלזמה, והרס של הארכיטקטורה של המיופיברילות בקרדיומיוציטים. בשריר השלד desmin מתגלה בשוליים של ה-Z-discs מתחת ל-sarcolemma, וכן בצמתים הנוירו-מוסקולריים. בשריר הלב, desmin שכיח בדיסקים המשולבים ובסיבי Purkinje. Desmin מבוטא בעיקר בתאי שריר השלד, הלב והשריר החלק. קוטרו 1010nm שהוא קוטר ממוצע בין הפילמנטים העבים (15nm), לבין הפילמנטים הדקים (5-6nm). חלבון זה משמש לשמירה על מבנה התא, ולצורך התנגדות לעקה מכנית חיצונית המופעלת על התאים (Fuchs ו-Weber ב-Annu Rev Biochem משנת 1994). Desmin ו-IFs נוספים יוצרים רשת הטרו-פולימרית המארגנת את המיופיברילות, וקושרת אותן לגרעין, למיטוכונדריה ול-sarcolemma (על פי Herrmann ו-Aebi ב-Cold Spring Harbour Perspect Biol משנת 2000, ו- Schroder וחב' ב-Lab Invest משנת 2000).
מאז התיאור הראשון של מוטציות ב-desmin, למעלה מ-40 מוטציות התגלו (Goldfarb וחב' ב-Nat Genet משנת 1998, ו-Munoz-Marmol וחב' ב-Proc Natl Acad Sci USA משנת 1998). התסמונת הסקפולופרונילית ע"ש Kaeser מיוחסת למוטציה אוטוזומלית-דומיננטית ב-desmin בקבוצה גדולה של בעלי קִרְבַת דָּם (Walter וחב' ב-Brain משנת 2007). הממצאים באנשים עם דסמינופתיה הם של חולשה, רמות CPK גבוהות בנסיוב, וממצאים ב-EMG. גיל הופעת התסמינים הוא 10–61 שנה, כאשר הפיזור של העייפות הוא הוא דיסטלי, או דיסטלי ופרוקסימלי.
מוטציה הטרוזיגוטית (A337P) זוהתה במשפחה עם הופעה מאוחרת של מיופתיה שלדית ומעורבות לבבית מתונה. שתי מוטציות אחרות, A360P ו-N393I התגלו במשפחה אחרת עם הופעה בגיל הילדות של מיופתיה שלדית ולבבית חמורה. בשלב זה לא ברור המנגנון לפיו מוטציות אחדות ב-DES גורמות ל-RCM, בעוד שמוטציות אחרות גורמות ל-DCM. מוטציה Glu401Asp ב-desmin, פוגעת ביצירת הפילמנטים, הורסת את שלמות ממברנת התא, ופוגעת בקצב הלבבי (Bermudez-Jimenez ב-Circulation משנת 2018). שלושה יפנים צעירים עם מוטציית Ile451Met במקטע הזנב של desmin, סבלו מפנוטיפ חמור יותר של lower left ventricular shortening והחלשת מקטע הפליטה.
בידוד של desmin
Hohenadl וחב' ב-Biophys J משנת 1999 למדו על המבנה הפולימרי של desmin בטכנולוגיה של quasi-elastic light scattering. החלבון desmin בודד מקֻרְקְבָן של תרנגולת, ופולימריזציה שלו הושרתה בתמיסות של 2mM MgCl2 או של 150mM NaCl. המסקנה הייתה שהאורך של הפילמנטים היה בין 0.1-1.0 מיקרון. בכל המקרים נמצא קוטר הידרודינמי של פילמנטים של desmin של 16–18 מיקרון. גם Ip וחב' ב-Anal Biochem משנת 1990, חקרו את נושא היציבות של IFs בגין אי המסיסות שלהם בתמיסות פיזיולוגיות, ומצאו תכונות דינמיות של IFs בדומה לאלו של אלמנטים ציטו-סקלטליים אחרים. במחקר המצוטט התבצעה מדידה פלואורסצנטית לצורך הכּימוּת של ה-assembly של IFs במערכת in vitro. תת-יחידות של desmun סומנו עם iodoacetamidofluorescein ביחס של mol/mol 0.4 על מנת לשמור את יכולת הפולימריזציה לפילמנטים, באופן שאינו ניתן להבדלה מה-IF הבלתי מסומן במיקרוסקופ אלקטרוני. בספקטרופוטומטריה לעומת זאת, עד 90% מהפלוארסצנציה ההתחלתית דועכת מתת היחידות של desmin.
הוראות לביצוע בדיקת immunostain של desmin
הבדיקה מתבצעת על ידי צביעה אימונו-היסטוכימית ברקמה. מועדפות 2 זכוכיות נושא טעונות חיובית (75X25X1מ"מ) לכל דגימה נבדקת, כאשר עובי חתך הרקמה הוא 4 מיקרון. מתקבל לבדיקה בלוק של רקמה שעבר קיבוע בפורמלין, ותהליך embedding בפרפין. מועדפת דגימה שתגיע למעבדה בטמפרטורת החדר או בקירור. לא תתקבלנה דגימות רקמה קפואות או רטובות, משטחים ציטולוגיים, רקמה שלא עברה קיבוע בפורמלין או embedding בפרפין. לא תתקבלנה דגימות על זכוכיות נושא לא טעונות, או ProbeOn. גיל הדגימות קריטי ועלול להשפיע על האימונו-ריאקטיביות. יש להעדיף שהחתכים שעברו embedding בפרפין יהיו בני פחות מ-6 שבועות.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק