אנקפלין - Enkephalin
הופניתם מהדף Enkephalin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| אנקפלין | |
|---|---|
| enkephalin | |
| מעבדה | כימיה בפלזמה וכימיה בנוזל השדרה. |
| תחום | אופיואידים ושיכוך כאבים |
| טווח ערכים תקין | טווח הריכוזים של met-enkephalin בפלזמה הוא 14–140 פיקוגרם/מ"ל, וב-CSF הוא 5–29 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
הביוכימיה של enkphalin
המושג אופיואיד מתייחס לקבוצת תרכובות כגון אלקלואידים, מורפין, קודאין ו-thebaine שמקורם בפרג אופיום. הם ידועים לפחות 1,000 שנים כמשככי כאבים וחומרי הרגעה. קבוצת חומרים אלה מכילה גם תרכובות-סמי-סינתטיות כגון הרואין, oxycodone, הידרוקודון והידרומורפון, שמקורם באותן מולקולות טבעיות או שמדובר בחומרים סינתטיים לחלוטין הכוללים fentanyl, מתאדון, petidine ,levorfanol ,tramadol ו-dextropropoxyphene. מורפין בודד לראשונה בשנת 1806, ושנים אחדות לאחר מכן בודד קודאין. בשנות ה-50 של המאה ה-19 החלו להשתמש במורפין בפרוצדורות כירורגיות, כמו גם לטיפול בכאב כרוני ובכאב בתר-ניתוחי (Brownstein ב-Proc Natl Acad Sci USA משנת 1993). עם הגילוי של אגוניסטים שונים של אופיואידים, אגוניסטים חלקיים כגון nalorphine ואנטגוניסטים, חוקרים אחדים שיערו ולאחר מכן הוכיחו שקיימים ב-CNS אזורי קישור סטראו-ספציפיים אחדים של אופיואידים, דרכם הם משרים את השפעתם הפיזיולוגית. חוקרים אלה אף הניחו שאתרי קישור אלה עשויים לשמש לאופיואידים אנדוגניים.
בשנת 1975, Hughes ו-Kosterlitz דיווחו על הראייה הראשונה לקיומם של אופיואידים אנדוגניים בתמציות מוח, שהיו מסוגלים לעכב את השחרור של אצטילכולין מעצבים המצויים ב-ileum של חזירי-ים. הם גם הראו שעיכוב זה נחסם על ידי טיפול עם האנטגוניסט של הקולטן של אופיואידים-naloxone. שני חוקרים אלה כינו את האופיואידים האנדוגניים שהם גילו בשם enkephalins. אנקפלין הוא פנטה-פפטיד המווסת העברת תחושות כאב בגוף. האנקפלינים הם ליגנדים אנדוגניים הנוצרים בגוף ונקשרים לקולטנים של אופיואידים. יש שלוש משפחות של פפטידים אופיואידים אלה: enkephalins, B-endorphin ו-dynorphins. הגן הבלעדי המקודד ל-met-enkephalin הוא הגן ל-enkepalin, בעוד ש-leu-enkephalin מקודד הן על ידי הגן ל-enkephalin וכן על ידי הגן המודד ל-dynorphin. הגן proopiomelanocortin (להלן POMC) מקודד גם כן לרצף של met-enkephalin, הנמצא בקצה ה-N טרמינלי של beta-endorphin, אך הפפטיד endorphin אינו מתפתח ליצירת enkephalin.
מבחינה מבנית, האנקפלינים הם פנטה-פפטידים הקיימים כשתי תת-קבוצות בהתאם לחומצת האמינו בקצה הקרבוקסי-טרמינלי שלהם, ויכולם להיות leucine-או methionine-enkephalins, ובהתאם, רצף חומצות האמינו שלהם הוא Tyr-Gly-Gly-Phe-Leu או Tyr-Gly-Gly-Phe-Met, ושניהם מקודדים על ידי הגן proenkephalin (על פי Noda וחב' ב-Nature משנת 1982).
האנקפלינים מהווים אחד משלוש מערכות פפטידיות הכוללות β-אנדורפינים ודינורפינים. במושגים מולקולריים, חומצות האמינו Tyr ו-Phe נקשרות לקולטן של אנקפלינים (Stein ב-Ann Rev Med משנת 2016), בעוד שהצמד Gly-Gly משמש כמְרווח (spacer). פפטידים אלה משמשים כנוירו-טרנסמיטורים בכל מערכת העצבים ובאיברי קצה (Holden וחב' ב-AACN Clin Issues משנת 2005). בנוסף, מחקר הראה ש-met-enkephalin הוא בעל תפקיד חיוני בשגשוג ובארגון של רקמות במהלך ההתפתחות, לכן ההתייחסות ל-met-enkephalin היא כאל פקטור גידול אופיואידי (Zagon וחב' ב-Brain Res Brain Res Rev משנת 2002).
אנקפלינים נוצרים על ידי ביקוע של pro-enkephalin שהיא מולקולת הקודמן (precursor). הגן pro-enkephalin מכיל שלושה exons המופרדים על ידי שני introns. בתהליך עיבוד של pro-enkephalin, נוצרים 6 עותקים של met-enkephalin ועותק אחד של leu-enkephalin באדם וביונקים נוספים. אנקפלינים מפוזרים באזורי מוח נרחבים, כמו גם בחוט השדרה, וכן ב-medulla של האדרנל. קיימת הנחה שאנקפלינים המופיעים בפלזמה מקורם בעיקר מהאדרנל (Pittius וחב' ב-EMBO J משנת 1985). אנקפלינים נהרסים על ידי הידרוליזה המבקעת את הפנטה-פפטיד בקשר Tyr-Gly. אנזימים מסוג enkephalinase ו-aminopeptidase ממשיכים את תהליך ההידרוליזה לקבלת פפטידים קצרים יותר המכילים 2–4 חומצות אמינו (Duque-Diaz וחב' ב-Vitam Horm משנת 2019). בשנות ה-80 של המאה ה-20 התגלה שמערכת האופיואידים האנדוגניים, ובעיקר met-enkephalin, הם בעלי תפקיד ברגולציה של שגשוג תאים נורמליים וסרטניים. לפיכך, met-enkephalin קרוי גם OGF או opioid growth factor ואילו הקולטן שלו מכונה OGFR. OGFR שונה משמעותית במבנה שלו בהשוואה לקולטנים הקלאסיים μ, δ ו-κ של האופיואיד. המנגנון העיקרי של פעולת האנקפלין מתבצע על ידי שדרוג של הקינאזות p16 ו-p21 התלויות ב-cyclin, הפועלות להפסקת ההתקדמות של מחזור הרפליקציה התאי מפאזת G0/G1 לפאזת S. מערכת זו פעילה באופן טונטי (tonically) והחלבון OGFR נמצא ברוב שורות התאים המתרבים (McLaughlin ו-Zagon ב-Biochem Pharmacol משנת 2012).
מערכות האיברים בהן משפיע אנקפלין
- מערכת העצבים: אנקפלינים ידועים כבעלי פיזור נרחב במערכות העצבים המרכזי, ההיקפית והאוטונומית של יונקים. שני סוגי האנקפלין, met-enkephalin ו-leu-enkephalin התגלו ב-82% ממסלולי גזע המוח של קוף הסנאי. בשיטות immunoassay זוהה met-enkephalin ב-CNS באזורים כגון ה-globus pallidus, בהיפותלמוס, באזור האפור הפרי-אקוודוקטלי (PAG), בעמיגדלה ובחוט השדרה. בנוסף, הביטוי של הגן PENK נמצא בחלק האחורי של ההיפופיזה וכן בחוט השדרה (Duque-Diaz וחב' ב-Anat Sci Int משנת 2017)
- מערכת הלב: במטופלים עם אי-ספיקת לב מוצאים רמות מוגברות של pro-enkephalin הנמצאות במתאם חיובי עם חומרת תפקוד הלב. הן לחץ הדם והגירוי ה-β-אדרנרגי, מגבירים את הביטוי של אנקפלין במודלים ניסויים. ההשפעות של אופיואידים על מערכת הלב, הם מולטי-פקטוריאליים ונראה שיש להם משך השפעה קצר יותר להפחתת קצב הלב ולחץ הדם, ומשך השפעה ארוך יותר על הגברת התכווצות הלב (Bozkurt וחב' ב-Circ Heart Fail משנת 2019)
- מערכת הנשימה: דיכוי הנשימה היא תופעה ידועה ומסוכנת ובעלת פוטנציאל קטלני במתן אקסוגני של אופיואידים ונראה שהקולטן מיו הממוקם בהיפותלמוס מתווך בתופעות לוואי אלה. אף-על-פי-כן, החשש מפני מצוקה נשימתית, אינו מצדיק את הגבלת השימוש באופיואידים. לדוגמה, בהקשר של ההתנהלות בכאבים של חולי סרטן, הניסיון מראה שאופיואידים יכולים להינתן בבטחה, עם חשש מופחת לדיכוי נשימתי (Portenoy ו-Ahmed ב-Hematol Oncol Clin North Am משנת 2018)
- מערכת העיכול: הקולטנים האופיואידיים העיקריים במערכת העיכול הם μ ו-δ, הממוקמים בשכבות התת-ריריות וב-myenteric plexus. השפעול של קולטני μ מעכב את התנועתיות במעי הגס, ומגביר את ספיגת הנוזלים, מה שעלול לגרום לעצירוּת (Camilleri וחב' ב-Clin Gastroenterol Hepatol משנת 2017)
- המערכת האנדוקרינית: גלוקו-קורטיקואידים נמצאו מגבירים באופן ישיר את השעתוק של ה- pro-enkephalin mRNA (להלן PENK), על ידי קישור לרצף DNA המוגדר כ-glucocorticoid response element (על פי Weisinger ב-Biochem J משנת 1995). היו ששיערו שאנקפלינים משחקים תפקיד במודולציה של העוצמתיות והמשך של תגובת העקה. תוך שימוש במודל knockout של עכברים, נמצא שעכברים החסרים את הגן PENK היו בעלי עקה הורמונלית מוגברת פי-2 בתגובה לעקה מושרית בהשוואה לעכברי wild type (על פי Bilkei-Gorzo וחב' ב-Psychoneuroendocrinology משנת 2008)
- מערכת החיסון: נמצא של-met-enkephalin יש השפעות אימונו-מודולטוריות במספר סוגי תאים. השפעות אלו כוללות את שדרוג הפעילות של תאי T מסוג +CD8, עידוד של פגוציטוזיס על יד מקרופאגים, הגברת השגשוג של תאי +CD4 T-helper 1, וסטימולציה של תגובת תאי natural killer (על פי Zhao וחב' ב-Int Immunopharmacol משנת 2016)
תפקודי אנקפלינים
הביטוי של אנקפלינים וקולטני האופיואיד שלהם הוא בעל פיזור נרחב במערכות העצבים המרכזית, ההיקפית והאוטונומית, וכן במגוון של איברים כמו גם ברקמות אנדוקריניות ובאיברי המטרה שלהן. ההשפעות השונות של אנקפלינים משתרעות בתחומי שיכוך כאבים, אנגיוגניות, ויסות לחץ הדם, התפתחות אמבריונלית, הזנה, היפוקסיה, מודולציה של המערכת הלימבית (מצבים רגשיים), תהליך הזיכרון, הגנה על המערכת העצבית, השפעה על תנועת המעיים (peristalsis), הפרשת הלבלב, ריפוי פציעות, בקרה על מערכת הנשימה, ומנגנוני הגנה על הכבד ל-leu-enkephalin יש מעורבות בבקרה על תפקוד בלוטות המין (גונדות). יש ראיות לכך שאנקפלינים מעודדים הפרשת חומצה ומעכבים אנזימים פנקראטיים והפרשת ביקרבונאט מהפנקריאס. ישנן גם ראיות לכך שפפטידים אופיאטים יכולים לדכא את השחרור של סומטוסטטין ולהגביר הפרשת אינסולין וגלוקגון מהפנקריאס (Konturek ב-Gastroenterology משנת 1980).
שיכוך כאבים (analgesia): ריכוזים גדולים של קולטנים לאופיואידים נמצאים ב- gray periaqueductal, ב-locus coeruleus, ב-rostral central medulla (שהוא הגרעין הוונטרו-מדיאלי של חוט השדרה ובו קבוצת נוירונים הממוקמים ליד רצפת המוח המאורך), וכן ב-substantia gelatinosa של הקרן הדורזלית. שפעול של קולטני μ במוח האמצעי גורם לעיכוב פוחת של PAG ושל ה-nucleus reticular paragigantocellularis. איתות מעכב זה מתפשט לנוירונים המכילים סרוטונין או אנקפלין, המתקשרים לקרן הדורזלית ועשוים למנוע או להפחית את העברת תחושות הכאב ל-CNS (על פי Toubia ו-Khalife ב-Clin Obstet Gynecol משנת 2019).
ויסות התגובה לעקה: בתגובה לעקה, הגוף משחרר corticotropin releasing factor (להלן CRF), אשר מעודד יצירת קטכולאמינים, ובאופן סימולטני מביא לשחרור אופיואידים אנדוגניים כולל אנקפלינים ו-endorphins. מערכת האופיואידים האנדוגניים משמשת לוויסות העוצמה ומשך תגובת העקה על ידי מגוון מנגנונים. אנקפלין, לדוגמה, נמצא פועל כמודולטור של הפרשת CRF מהגרעין הפארא-ונטריקולרי של ההיפותלמוס (Henry וחב' ב-Neural Plast משנת 2018).
פריסטלטיקה: אנקפלינים גורמים להאטה של תנועת המעיים על ידי שינוי של גירוי נוירונלי. ההשפעה העיקרית מתרחשת על ידי עיכוב של תעלות +K ו-+Ca2, הגורמות להיפר-פולריזציה של התא ובדיעבד מונעות את ההוֹלָכָה של פוטנציאל הפעולה (action potential) ואת שחרור הנוירו-טרנסמיטור הנדרש לגרום לתנועתיות המעי (Sternini וחב' ב-Neurogastroenterol Motil משנת 2004).
מנגנון הפעולה של אנקפלינים וקולטניהם
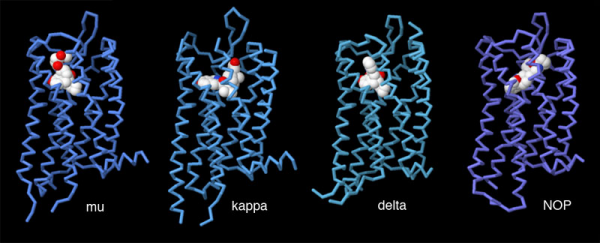
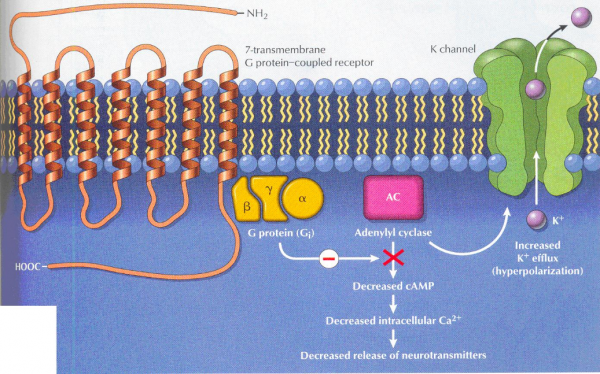
אנקפלינים מפעילים את השפעתם הפיזיולוגית דרך קולטנים אופיואידים ספציפיים הנפוצים ברחבי הגוף. שלושת סוגי קולטנים אלה הם מיו (המבוטא בעיקר ב-CNS), קולטן דלטא המבוטא באופן שווה ב-CNS ובחוט השדרה, וקולטן kappa המבוטא בעיקר בחוט השדרה. קבוצה רביעית של קולטני אופיואידים ידועה כ-nociceptin התגלתה בשנת 1994, אך אינה נחשבת כחלק נוסף של שלושת הקולטנים שצוינו, ואשר ההתייחסות אליהם היא כאל הקולטנים הקלאסיים של אופיואידים. לאנקפלינים יש את הזיקה הגבוהה ביותר לקולטן δ, זיקה פחותה יותר לקולטן μ, והזיקה החלשה ביותר שלהם היא לקולטן κ. קולטני האופיואידים שייכים למשפחת הקולטנים המצומדים לחלבוני G, וקולטנים אלה מזוהים על ידי המבנה של 7 לולאות החוצות ממברנת התא שיש להן הומולוגיה של 60% בערך. ההשפעה המעכבת העיקרית של אנקפלינים מתקבלת על ידי הפחת חדירת +K ו-+Ca2 לתא. שיגור האיתות של אנקפלינים מתחיל עם התקשרותם לקולטן, מה שגורם לדיסוציאציה של תת-היחידות Gα ו-Gβγ של חלבוני G. תת-היחידה Gα, מגיבה ישירות עם תעלות אשלגן שתוקנו מחדש, מה שגורם להיפרפולריזציה תאית. תת-היחידה Gα גם מעכבת את פעילות האנזים adenylyl cyclase, מה שמפחית יצירת cAMP, ובכך מפחית את הכניסה לתוך התא של +Ca2 התלויה ב-cAMP. תת-היחידה Gβγ אף היא מפחיתה את חדירת סידן לתא, על ידי התקשרותה לתעלות שונות של +Ca2 (על פי Al-Hasani ו-Bruchas ב-Anesthesiology משנת 2011).
השפעות אנקפלין על עקה
אנקפלין נחשב כנוירופפטיד, שפעילותו המאותת במוח אדם חשובה ביותר. כתגובה לכאב, נוראפינפרין משתחרר ביחד עם אנדורפינים (Pasternak ב-AccessScience משנת 2020). הודגם שאנקפלין כרוך עם פעילות מוחית במהלך תגובה לעקה בעיקר באזורי ההיפוקמפוס והקורטקס הקדם-פרונטלי. במהלך תגובה לעקה מספר אנלוגים של met-enkephalin הגבירו את הפעילות את הפעילות בהיפוקמפוס, ואילו אנלוגים של leu-enkephalin כדוגמת סומטוסטטינים היו קשורים לפעילות מופחתת. נתונים אלה הובילו למסקנה שגורמי עקה משפיעים על נוירופפטידים, ושפעולתם מוגבלת לאזורי מוח ספציפיים (Henry וחב' ב-Neural plasticity משנת 2017).
פעילות אנקפלין ברקמות היקפיות
אנקפלינים מבוטאים באופן ניכר במעי, כאשר רמותיהם הגבוהות ביותר הן בתריסריון וב-ileum, והם נמצאים ברמות נמוכות יותר בקיבה, ב-cecum, ובמעי הגס (Hughes וחב' ב-Br J Pharmacol משנת 1977). ב-ileum של חזירי ים רמות אנקפלין נמצאו ב-myenteric plexus זהות לרמתו במוח האמצעי (Smith וחב' ב-J Autonomic Nevous Syst משנת 1988). צביעה אימונו-פתולוגית הראתה רשת בולטת של סיבי אנקפלין בדופן המעי, בעיקר ב-myenteric plexus (על פי Elde וחב' ב-Neuroscience משנת 1976, ו-Polak וחב' ב-Lancet משנת 1977). על ידי צביעה אימונולוגית נמצא במעי ריכוז ניכר של met-enkephalin בצפיפות גבוהה ברירית האנטרל-פילורית ובתאי G בתריסריון, ובריכוזים נמוכים יותר במעי הדק הדיסטלי, במעי הגס, בצינור כיס המרה (cystic duct), בכיס המרה, בלבלב ובוושט (Uddman וחב' ב-Gastroentrology משנת 1980, ו-Larsson ב-J Histochem Cytochem משנת 1979). רוב הנוכחות של האנקפלינים במעי הדק הופיעה בנוירונים, בעוד שבמערת שוער הקיבה (antrum) האנקפלינים נמצאים הן בנוירונים כמו גם בתאים האנדוקריניים. כיוון שה-myenteric plexus עשיר הן באנקפלינים וכן בקולטנים של אופיאטים, פעילות אנקפלינים באזור זה משתמעת (Pert ו-Snyder ב-Science משנת 1973).
כאמור, האנקפלינים מפוזרים באופן נרחב במערכת העצבים ההיקפית, וכן במערכת העיכול (DiGiulio וחב' ב-Neuropharmacology משנת 1978). במקביל. דווח ש-leu-enkephalin מצוי בשפע בחוט השדרה, ובחומר האפור בעיקר בלמינות IV, II, I ו-VII. חומר בעל פעילות אנקפלינית אותר ב-vagus, בשרשרת הסימפתטית של אזור המותניים, וב-coeliac ganglia של חולדה. ה-coeliac ganglia הן שתי מסות בעלות צורה לא-רגולרית של רקמת עצבים בחלק הבטן העליונה. בהיותן מהוות חלק מהמערכת הסימפתטית של מערכת העצבים האוטונומית (ANS), שתי ה-coeliac ganglia הן הגנגליונים הגדולים ביותר ב-ANS, והן מעצבבות את רוב צינור העיכול. אנקפלינים מוקמו בתאים המכילים קטכולאמין של הגנגליונים הסימפתטיים (schultzberg וחב' ב-Neuroscience משנת 1979). חומר דמוי אנקפלין זוהה ביחד עם noradrenaline בבועיות של עצב הטחול של בקר (Wilson וחב' ב-Neurosci Lett משנת 1980). פיזור נרחב זה של אנקפלין בעצבים היקפיים ובגנגליונים סימפתטיים מרמזים לפעילות אוטונומית של אנקפלינים.
גם המדולה של האדרנל מהווה מקור עשיר של אנקפלינים באופן שאפשר ניקוי ובידוד של קודמנים של אנקפלין. האנקפלין במדולה של האדרנל ממוקם בתאי כרומפין המכילים קטכולאמין (Schultzberg וחב' ב-Neuroscience משנת 1978, ו-Lundberg וחב' ב- משנת 1979 ב-Proc natl acad sci USA משנת 1979). גוף הקרוטיד הוא איבר קשור למערכות כרומפין אחרות, אנקפלין מוקם בתאי Type 1 glomius של גוף הקרוטיד, בהם ממוקמים גם קטכולאמינים, דופמין ונוראדרנלין (Lundberg וחב' ב-Acta Physiol Scand משנת 1979). לפיכך, אנקפלין מופיע ביחד עם קטכולאמינים במדולה של האדרנל, בגוף הקרוטיד ובגנגליונים הסימפתטיים. אתרים היקפיים נוספים המכילים חומר אימונו-ריאקטיבי דמוי אנקפלין הם הכליות, הכבד, פרוזדורי הלב, העור, ורשתית העין (Brecha וחב' ב-Proc Natl Acad Sci USA משנת 1979, ו-Weber וחב' ב-Neurosci Lett משנת 1980). תפקידו הפיזיולוגי של אנקפלין ברקמות היקפיות אלו אינו ברור.
פתופיזיולוגיה
דיס-רגולציה של כאב: מחקרים מראים שהזמינות של הקולטן ל-μ opioid פוחתת במטופלים עם fibromyalgia, כאשר רמות של אופיואידים אנדוגניים ב-CSF גדלות. יתרה מכך, כאב המתגבר על ידי פעילות מוחית כפי שניתן למדוד על ידי fMRI, נמצא פרופורציוני לפוטנציאל הקישור לקולטן μ האופיואידי (Schrepf וחב' ב-Pain משנת 2016).
מפגעים הנובעים משימוש בחומרים אסורים: לאנקפלינים יש משמעות בריגוש לקוקאין, בהיותם מבוטאים באופן נמרץ באזור המזו-קורטיקו-לימבי במוח (Mongi-Bragato וחב' ב-Addict Biol משנת 2016). באלכוהוליסטים מוצאים ירידה בריכוזי pro-enkephalin ו-pro-dynorphin (על פי Sarkysian וחב' ב-Front Cell Neurosci משנת 2015).
התנהגות תזונתית: בעכברי knockout עם פגיעה בגן PENK נמצא משקל גוף נמוך משמעותית מאשר עכברי wild type באותם תנאי הזנה (Mendez וחב' ב-Neuropsychopharmacology משנת 2015).
שיכוך כאבים: התפקיד של אנקפלינים בשיכוך כאבים החל במודלים של חולדה (Belluzzi וחב' ב-Nature משנת 1976), אלא שהניסיונות לעשות בנתון זה שימוש נתקלו במכשול עקב היות אנקפלינים בלתי יציבים in vivo מפעולת אנדו-פפטידזות. ננקטו שתי גישות לנסות ולהתגבר על מכשול זה: בגישה הראשונה נעשה שינוי במבנה האנקפלין באופן שהופך אותו לעמיד יותר להידרוליזה ללא שינוי במסוגלות שלו להיקשר לקולטני האופיואידים מיו ודלתא, ועל ידי כך שמירה על הפוטנציאל משכך הכאבים שלו. הניסיונות ליישום גישה זו החלו בשנת 1976 במחקר של Pert וחב' שהופיע ב-Science, בו הם הזריקו לחדרי המוח של חולדות את הנגזרת D-Ala-met-enkephalin, נוסתה גישה חדשה, ביצירת אנקפלינים שעברו שינוי בהכנסת קשרים פפטידיים הבנוים על β-אלנין, העמידים לפעולה ההידרוליטית של carboxypeptidase או של aminopeptidase (על פי Kropotova וחב' ב-Bioorg Med Chem משנת 2020). גישה חלופית הדגימה שעל ידי חסימה יחידנית של enkephalinase או של aminopeptidase לא הושג שיכוך כאבים באדם או בחיות. לעומת זאת, חסימה סימולטנית של שתי הפפטידאזות הפיקה שיכוך כאבים יעיל. מספר מחקרים אמנם מכוונים לייצר מעכבים של שתי הפפטידאזות (dual enkephalinase inhibitors להלן DENKIs) (על פי Roques וחב' ב-Nat Rev Drug Discov משנת 2012).
אימונורגולציה ותרפיה של מחלות סרטניות
זמן קצר לאחר גילוי אנקפלין, החלו להתפרסם הראיות לקיומם של קולטנים של אופיואידים על פני תאי חיסון כגון תאי T ומקרופאגים (Wybran וחב' ב-J Immunol משנת 1979, ו-Foris וחב' ב-Mol Immunol משנת 1984). בסוף שנות ה-80 החלו להתפרסם ראיות ניסויות ישירות לפעילות אנטי-סרטנית של met-enkephalin (על פי Srisuchart וחב' ב-Int J Immunopharmacol משנת 1989). יש שפע ראיות ממחקרים in vivo ו-in vitro המדגימים את היכולת של אנקפלינים להאט גידולים סרטניים במגוון סוגי סרטן. מנגנון השפעה זו מסתייע בשדרוג של הקינאזות p16 ו-21 התלויות ב-cyclin, החוסמות את מחזור השגשוג התאי מפאזת G0/G1 לפאזת S.
שיטות למדידת met-enkephalin בפלזמה וב-CSF באדם
שיטה רגישה של radioimmunoassay למדידת met-enkephalin פותחה על ידי Clement-Jones וחב' ב-J Endocrinol משנת 1980. הראייה הראשונה לנוכחות met-enkephalin בצירקולציה באדם תוארה כמו גם נוכחותו ב-CSF. נוצלה הרגישות של שייר המתיונין ב-met-enkephalin לעבור חמצון ולהפוך לאנלוג ה-methionine-sulfoxide. לאחר מיצוי הדגימות מהפלזמה או מה-CSF, הן חומצנו על ידי מי חמצן, מה שאפשר מדידת סך ה-met-enkephalin. לשיטה זו יש ספציפיות במובן שהיא אינה מגיבה עם leu-enkephalin, עם beta-endorphine או עם beta-lipotrophin באדם. פותחה שיטת ניקוי של אנקפלין מסומן ביוד רדיו-אקטיבי, עם octadecasilyl-silica (להלן ODS-Silica, בקוטר 10 מיקרון) שהניבה סמן חד-יודי בעל זיקה גבוהה ויציבות למשך 3 חודשים בקירור. פותחה שיטה למיצוי met-enkephalin מפלזמה או CSF מוחמצות, עם חלקיקי ODS-silica גדולים (בקוטר 35–70 מיקרון). Met-enkephalin אימונו-ריאקטיבי נמדד בפלזמה בתחום ריכוזים של 14–140 פיקוגרם/מ"ל, וב-CSF הוא נמדד בתחום ריכוזים של 5–29 פיקוגרם/מ"ל. בשני נבדקים עם חסר פעילות של ההיפופיזה, ובנבדק אחד עם שעבר דיכוי עם dexamethasone, בהם ריכוזי ACTH ו-β-lipoptrophin בלתי ניתנים לגילוי, נמצאו רמות משמעותיות של met-enkephalin בפלזמה מה שמראה שהאחרון אינו ממקור של ההיפופיזה ואף לא תוצר הידרוליזה של β-lipotrophin או של β-endorphin.
בעוד שדיס-רגולציה של אנקפלינים היא בעלת משמעות בפתו-פיזיולוגיה של מחלות שונות, לא קיים עדיין מבדק מעבדתי הקשור לאנקפלינים לאבחון או לקביעת הפרוגנוזה של תחלואות שנלמדו בבעלי חיים או באדם. באופן היסטורי רמות אנקפלין נמדדו על ידי immunoassay ברקמות או בנוזלי גוף. שיטות מס-ספקטרוגרפיות פותחו בהמשך בהצלחה ושולבו יחד עם אלקטרופורזה קפילרית או עם כרומטוגרפיה נוזלית למדידת met-enkephalin ו-leu-enkephalin בפלזמה (Ozlap וחב' ב-Anal Biochem משנת 2018).
מדידה של met-enkephalin במוח חולדה על ידי radioimmunoassay ספציפי המכוון ל- met-sulphoxide enkephalin
שיטה זו דווחה על ידי Boarder וחב' ב- J Neurochem משנת 1982. שיטה זו מאפשרת מדידה של met-enkephalin באזורי מוח שונים. אנטי-סרום שהוכן כנגד נגזרת met-sulphoxide של הפפטיד, כאשר כל הדגימות והבקרים חומצנו על ידי H2O2 טרם השימוש בהם במבדק עם Met(O)-enkephalin מסומן ב 125 I על ידי chloramine T . נרשמה cross reactivity של 30% עם ההפטה-פפטיד [Arg6,Phe7] המחוזר. בשיטה זו נרשמה פחות מ-0.15% של cross reactivity עם פרגמנטים של ה- heptapeptide או עם פפטידים המכילים leu-enkephalin. מיצוי בתערובת חומצה-אצטון של ה-striatum של חולדה, מלווה על ידי כרומטוגרפיה על עמודת Sephadex G-50 ו-reversed phase-HPLC, הראו שלמעשה כל ה-immunoreactivity נדדה בכרומטוגרפיה עם .Met-enkephalin[Arg6,Phe7] נתון זה אישר את הספציפיות של השיטה, והראה שה-striatum אינו מכיל ריכוז גבוה של צורות עם משקלים מולקולריים גבוהים יותר עם heptapeptide בקצה ה-C טרמינלי. הפיזור של ה-heptapeptide הצביע על כך שהריכוזים הגבוהים ביותר של met-enkephalin נמצאים ב-globus pallidus, רמות ביניים שלו נמצאים ב- caudate-putamen ובהיפותלמוס, ואלו רמותיו הנמוכות ביותר נמצאים בקליפת המוח ובמוחון.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק