גלקטין - 3 - Galectin
הופניתם מהדף Galectin 3 לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| גלקטין-3 | |
|---|---|
| 3-Galectin | |
| שמות אחרים | MAC-2 antigen, CBP-35, mL-34, L- 29, hL-31, epsilon BP, IgE-binding protein, galactose-specific soluble lectin 3. |
| מעבדה | כימיה בדם |
| תחום | הערכה, התנהלות וטיפול באי-ספיקת לב |
| טווח ערכים תקין | במבוגרים מעל גיל 18 שנה-פחות מ-22.1 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
קביעת רמת galectin-3 מסייעת בהערכה פרוגנוסטית של לוקים באי-ספיקת לב. מדד זה מתגלה כעזר בהערכת סיכונים (risk-stratification) במטופלים עם אי-ספיקה. רמת מדד זה עשויה לתת אינדיקציה מוקדמת של כישלון טיפולי.
בסיס פיזיולוגי
Galectins הם משפחת חלבונים המוגדרים על ידי ספציפיות הקישור שלהם לסוכרים מסוג β galactoside כמו N-acetyllactosamine. כל הגלקטינים הם בעלי מקטע-מזהה-סוכרים (CRD או carbohydrate recognition domain) מאוד משומר מבחינה אבולוציונית. ה-CRD הוא מקטע β-sheet הבנוי מ-135 חומצות אמינו, עם גומחה בתוכה נוצר הקשר עם המבנה הסוכרי, והיא גדולה דייה כדי להכיל טטרה-סכריד ליניארי.
גלקטינים קרויים גם S-type lectins בגלל תלותם בקשרים דיסולפידים לייצוב הקשר שלהם עם סוכרים. עד כה התגלו ביונקים 15 חלבוני galectin, אם כי רק גלקטינים שמספריהם 1, 2, 3, 4, 7, 8, 9, 10, 12 ו-13 התגלו באדם. גלקטינים שמספריהם 5 ו-6 נמצאים במכרסמים, ואילוגלקטינים שמספריהם 11, 14 ו-15 נמצאים בכבשים ובעזים. חברי משפחת חלבונים זו התגלו גם בעופות, בדו-חיים, בדגים, בנמטודות, ובמספר פטריות. בניגוד לרוב הלקטינים, גלקטינים אינם קשורים לממברנת התאים, אלא חלבונים מסיסים עם תפקידים תוך-תאים וחוץ-תאיים. גלקטינים מוצאים בעיקר בציטוזול תאים, בגרעין, במשתית החוץ-תאית (ECM) ובצירקולציה.
רקע היסטורי
כבר בשנות ה-50 וה-60 של המאה הקודמת התבצעו מחקרים רבים תוך שימוש בלקטינים שבודדו מצמחים, שהיו בעלי ספציפיות התקשרות לסוכרים שונים, ובעלי יכולת לצמת תאים. בשנות ה-70 החלו לתור אחר לקטינים שמקורם ברקמות של בעלי חיים, והלקטין הראשון שזוהה בתאים אנימליים על ידי Gilbert Ashwell ב-NIH, היה הקולטן על פני תאי כבד ל-asialo glycoprotin. הלקטין האנימלי הבא המוכר כיום כ-galectin המקורי, תואר ב-1975במאמר ב-Proc Natl Acad Sci על ידי Teichberg ו-Silman ב"גופי החשמל" של הצלופח, וכונה בשעתו electrolectin, ויכולתו לצמת תאים עוכבה על ידי β-glycosides, והוא אף נוקה על עמודת-זיקה אליה קשור β-גליקוזיד. מדובר בפפטיד מונומרי במשקל מולקולארי של 15,000 דלטון בניגוד לרוב ה-galectins, האלקטרולקטין אינו מכיל שיירי ציסטאין, ודווקא שייר טריפטופן המהווה מרכיב ב-CRD, קריטי להתקשרות לגלקטוזיד. בשנת 1982 בודד גלקטין-3 לראשונה ממברנות של מקרופאגים של עכברים על ידי Ho ו-Springer ותואר במאמרם ב-J Immunol תחת הכינוי Mac-2 כחלבון במשקל מולקולארי של 32,000 דלטון.
כיוון שיכולת לקטינים אנימליים אלה לצמת תאים הייתה מותנית בהוספה של β-mercaptoethanol לבופר הריאקציה כדי למנוע חמצון ויצירת קשרים די-סולפידיים במולקולת הלקטין, התייחסו לחלבונים אלה כאל S-type lectins, להדגיש את תלותם בשיירי SH- חופשיים. היו גם שהתייחסו אליהם כאל C-type lectins, להדגיש את תלותם ביוני סידן (++Ca). לגלקטינים יש מגוון רחב של תפקודים, כולל הקשר לויטאליוּת של תאים וכושר הספיחה ההדדי ביניהם, סיוע לאינטראקציות בין תאים, שגשוג כלי-דם, וויסות תגובה חיסונית ותהליכי דלקת.
15 הגלקטינים המזוהים עד כה, מחולקים ל-3 תת-קבוצות, בתלות בהבדלים המבניים ביניהם וכן על פי מספר מקטעי CRD שכל אחד מהם מכיל. הגלקטינים הפרוטו-טיפיים שמספריהם 1, 2 ,5, 7, 10, 11, 13, 14, 15, מכילים domain יחיד של CRD, כאשר הגלקטינים עם מבנה כפול (tandem repeat) שמספריהם 4, 6, 8, 9, 12, הם בעלי שני מקטעים של CRD המופרדים על ידי שרשרת פפטידית בודדת (linker).
הגלקטין הראשון בבעלי חוליות בודד בשנת 1976 מרקמת שריר של תרנגולת, וכן מתמצית של לב וריאות בקר תוך שימוש בעמודת-זיקה המכילה asialofetuin, וכינויו galectin-1. בתחילת שנות ה-80, זוהה בפיברובלסטים של עכבר חלבון קושר קרבוהידראטים (CBP) במשקל מולקולארי של 35 אלף דלטון, שזכה לכינוי CBP35, שהיה אף הוא בעל זיקה ל-beta-galactosides, וכיום הוא מוכר כ-galectin-3, (אך היה ידוע גם בשמות L-29, L-31 ו-epsilon BP, בשל יכולתו לקשור IgE). בשנת 1994 החלה שיטת הנומנקלטורה הנהוגה היום של galectins על פי הסדר הכרונולוגי של גילויָם, כדלקמן:
- galectin-1, מופרש על ידי תאי חיסון (כמו T helper) בתימוס או על ידי תאי סטרומה המקיפים תאי B. נמצא גם בשפע בתאי שריר, בנוירונים ובכליות. מווסת באופן שלילי את השפעול של קולטני תאי B, משפעל אפופטוזיס בתאי T, מדכא את התגובות החיסוניות של תאי Th1 ו-Th17. עלול להחיש הדבקה ב-HIV, ונמצא up-regulated בתאים סרטנים.
- galectin-2, הנמצא בצינור העיכול, ותורם ל- splicing של קדם-mRNA בגרעין. נקשר סלקטיבית ל-β-galactosides של תאי T וגורם בהם לאפופטוזיס.
- galactin-3, בעל פיזור רחב בגוף. אחראי לוויסות של מספר גנים (כולל JNK1). יכול לסייע או למנוע אפופטוזיס (בתלות בסוג התא). משודרג במספר סוגי סרטן (שד) ועלול להגביר פוטנציאל גרורתי שלהם. תורם ל- splicing של קדם-mRNA בגרעין.
- galectin-4, נמצא במעיים ובקיבה. מסייע בהעברת חלבונים לתאים, בעל תכונות של crosslinking וספיחה. מסייע להתמיינות (differentiation) של קרטינוציטים. קשור למחלה דלקתית של המעי (IBD).
- galactin-7, נמצא באפיתליום הקשקשי (squamous), ייתכן שיש לו תפקיד באפופטוזיס, ובתהליכי תיקון מושרים על ידי p53. נחשב לבעל משמעות בתהליך הסרטני.
- galecin-8, בעל פיזור רחב בגוף, אך נמצא באופן בולט בכליות. בעל יכולת קישור ל-integrins ב-ECM, ופועל כטרנספורטר של חומצת שתן בכליה. עובר down-regulation במספר סוגי סרטן.
- galectin-9, נמצא בתימוס ובנוזל הסינוביאלי. משרה אפופטוזיס בתימוציטים ובתאי Th1, ומעודד בשלות של תאים דנדריטים להפריש ציטוקינים דלקתיים. משמעותי בתהליך של rheumatoid arthritis.
- galectin-10, בא לביטוי באאוזינופילים. בעל חשיבות משמעותית במערכת החיסון על ידי דיכוי של שגשוג תאי T.
- galectin-12, נמצא ברקמת שומן. מעודד אפופטוזיס באדיפוציטים, אך מעורב גם בתהליך ההתמיינות של אדיפוציטים.
- galectin-13, נמצא בשליה. בעל פעילות של lysophospholipase.
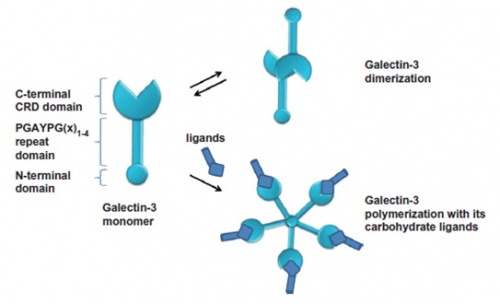
3 צורות קונפיגורציה של גלקטינים
הצורה המונומרית, הדימרית (או צורת ה-tandem) והצורה המולטימרית. בתמיסה, מופיע גלקטין-3 בעיקר בצורת המונומר שלו, כפי שמצאו Morris וחב' בשנת 2004 ב-Glycobiology, אך הוא יכול יצור הומו-דימרים על ידי התקשרות של 2 מקטעי CRD, כאשר הוא אינו קשור לליגנד שלו (Yang וחב' ב-Biochemistry משנת 1998). לעומת זאת, בנוכחות הליגנד הקרבוהידראטי שלו, גלקטין-3 יכול לעבור פולימריזציה ליצירת פנטמר כימֶרי דרך המקטע ה-N טרמינאלי שלו כמו שהראו Ahmad וחב' בשנת 2004 ב-J Biol Chem.
גלקטין-3
החלבון galectin-3 הוא חבר במשפחת הלקטינים, בה זוהו כבר ביונקים 14 galectins. משקלו המולקולארי הוא כ-30,000 דלטון, ובדומה לכל הגלקטינים הוא מכיל מקטע מזהה-קושר סוכרים (CRD) באורך של 130 חומצות אמינו בקצה ה-C טרמינאלי, המזהה ספציפית β-galactosides, וכן הוא מכיל חלק מתגמש בן 110-130 חומצות אמינו (עתיר בפרולין) בקצהו ה-N טרמינאלי (ידוע כ-ND או N-terminal domain). המקטע CRD של גלקטין-3 יוצר מבנה גלובולארי המורכב עם 5 ו-6 גדילי β-sheet, מסודרים כ-β-sandwich, וכמו כן מקטע CRD מכיל מבנה (motif) של 4 חומצות אמינו (Asp-Trp-Gly-Arg) החיוני להתקשרות ל-β-galactosides. ה-ND של גלקטין-3 מורכב מ-7 עד 14 רצפים חוזרים (repeats) שכל אחד מהם מכיל 9 חומצות אמינו ברצף הבא: Pro-Gly-Ala-Tyr-Pro-Gly-X-X-X, והוא הומולוגי לשרשרת α1 II של קולאגן. החלבון גלקטין-3 מקודד על ידי הגן LGALS3, הממוקם על כרומוזום 14 בעמדה q21-q22.
המולטימריזציה היא תכונה שכיחה של גלקטין-3 חוץ-תאי, מקום בו חלבון זה מגשר בין הליגנדים שלו נושאי הסוכר על פני שטח הפנים של תאים, ליצירת מבנים דמויי-סבכה (lattice), מה שמסייע לאתחל את תהליך מעבר האיתותים התאיים כמו שסיכמו Liu ו-Rabinovich בשנת 2005 ב-Nat Rev Cancer.
גלקטין-3 השתמר היטב באבולוציה, כאשר נוגדן חד-שבטי כנגד גלקטין-3 ממקור עכבר, מכיר ומגיב עם גלקטין-3 הומני (Cherayil וחב', 1990). גלקטין-3 הוא בעל CRD בודד, והוא מכיל בנוסף מקטע N-טרמינאלי לא-לקטיני ארוך, עתיר בפרולין, גליצין וטירוזין, התורמים ליכולת שלו לעבור self-aggregation. גלקטין-3 יכול להימצא בצורה מונומרית או שהוא יכול לעבור לצורת chimera דרך המקטע הלא-לקטיני, ובכך הוא הגלקטין היחיד המסוגל לכך בבעלי החוליות.
הקצה ה-N-טרמינאלי של גלקטין-3 חיוני לפולימריזציה של חלבון זה, והוא רגיש לביקוע פרוטאוליטי על ידי אנזימי MMP-2 ו-MMP-9. כפי שדיווחו Mennon ו-Hughes בשנת 1999 ב-Eur J Biochem, 12 חומצות האמינו הראשונות בקצה ה-N טרמינאלי של גלקטין-3 חיוניות להפרשת חלבון זה כמו גם לטרנסלוקציה שלו מהציטופלזמה לגרעין התא. כמו כן דיווח Hughes וחב' על כך ששייר טירוזין בעמדה 102 של הקצה ה-N טרמינאלי משתתף כנראה בקישור של גלקטין-3 לקרבוהידראטים.
גלקטין-3 מופיע במגוון גדול של רקמות אדם, כולל תאי חיסון, תאי אפיתל, ונוירונים כפי שסיכמו Domic וחב' בשנת 2006 ב-Biochim Biophys Acta. בשלבים עוּבּריים מוקדמים באדם מתבטא גלקטין-3 בעיקר באפיתל, בכליה, בכבד ובתאים כונדרוציטים של הסחוס. עכברי Knock-out בהם לא מיוצר גלקטין-3 נותרים בחיים ללא ממצאים חריגים באופן יוצא דופן (Colnot וחב' ב-Dev Dyn משנת 1998) מה שמרמז על כך שגלקטינים אחרים תופסים את מקומו מבחינה תפקודית). Sano וחב' פרסמו בשנת 2003 על עכברי Knock-out נטולי-גלקטין-3, בהם לפגוציטים ולתאי Kupfer הייתה יכולית מוגבלת של פגוציטוזה. גלקטינים אחדים מאבדים את פעילותם תוך 24 שעות אם הם אינם נשמרים בבופרים המכילים חומרים מחזרים, כתוצאה מחמצון הקשרים הדי-סולפידים בין 2 המונומרים. ייתכן גם שאי-יציבות זו נובעת מחמצון שייר הטריפטופאן ב-CRD. יחד עם זאת, גלקטין-3 דווקא שומר על יציבותו בתנאים בלתי מחזרים.
גלקטין-3 מבוטא בגרעין התא, בציטופלזמה, במיטוכונדריון, בפאגוזומים ובאקסוזומים, בשטח פני התא, ובמתחם החוץ-תאי. חלבון זה נמצא מעורב במגוון של תהליכים ביולוגיים כספיחה לתאים, שפעול תאים ושגשוגם, התמיינות תאים, ואפופטוזיס. גלקטין-3 כרוך בתהליכים סרטניים, דלקת ופיברוזיס, אי-ספיקת לב כתוצאה מעידוד של שגשוג של miofibroblasts, פיברוגנזה, דלקת ו-remodeling של חדרי הלב.
קישור גלקטין-3 לליגנדים שלו
גלקטין-3 נקשר חזק יותר גליקנים המכילים גלקטוזה כסוכר קצה מאשר למולקולת גלקטוזה חופשית. לדוגמה, לקטוזה ו-N-acetyllacosamine הם ליגנדים חזקים יותר של גלקטין-3 מאשר גלקטוזה. כמו כן, N-אצטיל-לקטוזאמין הוא בעל אפיניות גדולה פי-5 לגלקטין-3 מאשר מולקולת לקטוזה. כלומר, ככל שהשייר הסוכרי גדול יותר האינטראקציה של גלקטין-3 חזקה יותר, זאת כיוון שיותר קשרי Van der Waals יכולים להיווצר בין המבנה הסוכרי והגומחה באתר קושר הסוכרים של החלבון. הקישור לסוכרי תלוי בנוכחות סידן. לגלקטינים שונים יש ספציפיות קישור שונה לאוליגוסכרידים, ויש משמעות לרקמה בה נמצא הגלקטין.
למרות שגלקטין-3 נקשר חלש יחסית ליחידות בודדות של N-acetyllactosamine, זיקת הקישור שלו לאותן יחידות מתחזקת אם שיירי גלקטוזה הפנאוליטמטים (אלה הקשורים לחומצה סיאלית טרמינאלית), משוחלפים על ידי יחידות Galβ1-3, GalNAcα1-3, או על ידי שיירי fucoseα1-2. גלקטין-3 נקשר בזיקה גבוהה במיוחד לגליקנים עם רצפים חוזרים של [Galβ1-4GlcNAcβ1-3] או רצפים המכילים 3 או 4 יחידות של poly-N-acetyllactosamine. ניסויים על ידי יצירת גבישים של גלקטינים בקומפלקס עם N-acetyllactosamine, הראו שהקישור נעזר בקשרי מימן של שיירי הידרוקסיל על פחמנים 4 ו-6 של הגלקטוזה ועל פחמן 3 של N-acetylglucosamine לבין השרשרות הצדדיות של חומצות האמינו בגלקטין-3. קשרי מימן כאלה לא יכולים להיווצר עם סוכר דוגמת mannose.
גלקטין-3 הוא חלבון הנקשר ל-β-גלקטוזיד, ובתכונותיו הוא זהה ל-Mac-2 או macrophage galactose-specific lectin-2, לקטין הקושר גלקטוזה ו-IgE, המופרש על ידי מקרופאגים במצבי דלקת, אך מבוטא גם כאנטיגן על פני תאים. גלקטין-3 זהה גם ל-L-29, לקטין מסיס הנקשר ללקטוזה, המתבטא באופן בולט ואף עובר זרחון בתאים הנמצאים בתרבית בצפיפות רבה (confluent). גלקטין-3 זהה כמו כן עם CBP-35 או carbohydrate binding protein-35, שההתבטאות שלו בגרעין התא פוחתת לדוגמה עם התקדמות של התהליך הסרטני בקרצינומה של המעי הגס (עפ"י Lotz וחב', 1993). גלקטין-3 זהה גם עם ε BP או Human IgE binding factor ε שהוא בעל תכונות קישור ללקטוזה.
גלקטין-3 המסונתז בציטופלזמת התא נודד בין הציטופלזמה לגרעין התא. חלבון זה יכול להיות מופרש אל שטח הפנים של התא, או לנוזלי הגוף, במנגנון לא-קלאסי של אקסוציטוזה כפי שהראה Hughes ב-1999 ב-Biochim Biophys Acta, תוך שהוא עוקף את המסלול של Golgi complex ושל הרטיקולום האנדופלזמי. המעבר של גלקטין-3 לשטח פני התא מיוחס למקטע ה-N טרמינאלי של החלבון, אם כי יש גם ראיות לכך שמעבר זה נעזר במקטע ה-CRD של גלקטין-3, כפי שמציעים Gaudin וחב' בשנת 2000 ב-Biol Chem. לעומת זאת, המעבר של גלקטין-3 מהגרעין לציטופלזמה, כרוך ברצף של חומצות אמינו הממוקמות במקטע ה-CRD של החלבון (Tsay וחב' משנת 1999 ב-Exp Cell Res).
גלקטין-3 ותהליך ההיצמדות (adhesion) של תאים
גלקטינים יכולים הן לעודד אך גם לעכב היצמדות של תאים במנגנון המתווך על ידי integrin. בתהליך עידוד ההיצמדות, גלקטינים קושרים בהצלבה בין שני גליקנים שנמצאים על פני 2 תאים סמוכים. תהליך זה מקרב את התאים ומאפשר תהליך התקשרות עם integrin . אך גלקטינים יכולים גם למנוע היצמדות תאים, כאשר הם נקשרים ל-2 גליקנים על פני אותו תא, מה שחוסם את אתר הקישור של integrin. גלקטין-3 נקשר לקולטנים כמו α7β1 integrin וכן ל-α1β1 integrin, כמו גם ל-CD7 ל-CD43 ול-CD45, וכן לחלבונים ממברנאליים הקשורים לליזוזום הידועים כ-LAMP-1 ו-LAMP-2.
היכולת של תאים סרטניים ממקור אפיתליאלי להיצמד למשתית החוץ-תאית (ECM או extracellular matrix) באזור הגידול הראשוני, היא צעד חיוני התהליך הגרורתי של תאים אלה. ביטוי-יתר של גלקטין-3 כרוך ביכולת תאים סרטניים להתפשט לאזורי גוף מרוחקים, נתון נכון לגבי סוגי סרטן רבים דוגמת הגידול הנוירואנדוקריני pheochromocytoma, סרטן השחלה, המעי הגס, סרטן התירואיד ומלנומה, כפי שהראו Barrow וחב' בשנת 2011 ב-Int J Cancer. השפעה זו של גלקטין-3 מיוחסת חלקית לאינטראקציה שלו עם מגוון גליקופרוטאינים ב-ECM, כגון fibronectin ו-vitronectin, קולאגן type IV, אלסטין ו-laminin.
האינטראקציה של גלקטין-3 עם גליקנים הממוקמים על פני שטח הפנים של תאים סרטניים, עם חלבונים של ממברנת הבסיס, וכן עם Mgat5-modified N glycans וגם עם גליקופרוטאינים הקשורים לליזוזום, חיונית אף היא בתרומה של גלקטין-3 להיצמדות בינתאית. האינטראקציה של גלקטין-3 עם הקולטן ל-EGF וכן עם הקולטן ל-TGFβ על פני תאים, תורמת אף היא לכושר הגרורתי של תאים סרטניים. במקרים האחרונים, גלקטין-3 מצלב את הקולטנים הללו על פני התא, ובכך מונע את האנדוציטוזה שלהם אל תוך התא.
תפקיד ל-galectins בחסינות הטבעית (innate immunity)
ההשתתפות של galectin-3 ב-innate immunity נרמזת בעצם העובדה שהוא מבוטא על ידי מגוון של תאי חיסון כולל תאים דנדריטים, מקרופאגים, ותאי NK, כמו גם בתאי T ו-B משופעלים. Galectin-3 כמו גם אחרים, יכול להיקשר ישירות לגליקנים של פתוגנים שונים (חיידקים, טפילים), ובכך יכול לשמש לעידוד מקרופאגים לתקוף פתוגנים אלה, או לקלוט חומר אנטיגני של פתוגנים אלה לצורך הצגתו לתאי מערכת החיסון.
ממצאים מבודדים במערכות שונות רמזו לתפקיד אפשרי של galectins בחסינות הטבעית של הגוף. לדוגמה, galectin-1 ו-galectin-3 עוברים up-regulation בתאי אפיתל בקיבה המודבקים על ידי הליקובקטר פילורי, ואילו galectin-9 מושרה בתאי ליגמנט בחניכיים הנחשפים לליפופוליסכריד של החיידק Porphylomonas gingivalis. סדרת מאמרים של Gupta ב-1997, וכן Van den Berg מ-2004 כמו גם John ב-2002, הדגימו את היכולת של galectin-3 לקשור LPS של Pseudomonas aeruginosa, או LPS של Klebsiella pneuumoniae ואת זה של Neisseria gonorrhoeae. כן נמצא על ידי Barboni וחב' ש-galectin-3 יכול להיקשר ל-mycolic acid שהוא מרכיב מרכזי במעטפת של Mycobacterium tuberculosis, ואילו Pelletier ו-Sato הראו ב-2002 ש-galectin-3 נקשר ל-lipophosphoglycan של הטפיל Leishmania major.
בשנת 2000 הדגים Fradin ש-galectin-3 נקשר ל-oligomannosides, ובשנת 2006 Kohatsu וחב' הראו שחלבון זה נקשר רק לזנים של Candida albicans המכילים oligomannans על פני תאי הטפיל, המכילים קשרי β-1,2, אך אינו נקשר ל-Saccharomyces cerevisiae שאינו מכיל אוליגומנוזידים נטולי קשרי β-1,2. בשנת 2008 פרסם Li ש-galectin-3 הוא מווסת "טבעי" של תפקוד LPS, המגן על הפונדקאי מפני הלם העלול להיגרם על ידי אנדוטוקסין. התפקיד של גלקטינים בהגנה הטבעית כנגד מיקרואורגניזמים, התגלה גם בניסויים גנטיים בהם יצרו עכברים פגומים ביצירת גלקטינים שונים. לדוגמה, עכברים נטולי galectin-3 היו בעלי יכולת מוגבלת לסייע בהפסקת הדבקה עם חיידק השחפת בהשוואה לעכברי בר (wild-type), מה שמרמז למעורבות של חלבון זה בהגנה הטבעית מפני הדבקה מיקובקטריאלית.
גלקטין-3 והרגולציה של מערכת החיסון
גלקטין-3 חוץ-תאי יכול להיקשר לגליקאנים על פני שטח התא, ולהשרות אפופטוזיס בתאי T ובמונוציטים בשלב ההתחמקות של תאי הסרטן מההשגחה החיסונית. גלקטין-3 מדכא את יצירת IL-5 וכן הוא מעכב התמיינות של תאי B. יש גם ראיות לכך שגלקטין-3 יכול להגביר את השפעול של נויטרופילים (Fernandez וחב' משנת 2005 ב-Glycobiology), וכן יכול להגביר את התגובה החמצונית לנויטרופילים באדם תוך שיתוף האנטיגנים CD66a ו-CD66b כפי שהראו Karlsson חב' ב-1999 ב-J Immunol.
במונוציטים באדם, גלקטין-3 הוא כֶמוֹטקטי ומגביר את כניסת סידן לתאים אלה כאשר החלבון האמור נמצא בריכוז גבוה של 1 מיקרומולר אך בהיותו בריכוז נמוך של 10-100 ננומולר, הוא מעודד כמוקינזה (Sano וחב' משנת 2000 ב-J Immunol).כלומר, גלקטין-3 מווסת את התגובות החיסוניות של התאים ותורם לדיכוי מערכת החיסון ולהגברת התהליך הסרטני והגרורתי. גם מקרופאגים של אדם בתרבית תאים מגיבים לגלקטין-3.
גלקטין-3 והדיכוי של השפעול של הקולטן של תאי T
לגלקטין-3 יש תפקיד חיוני בוויסות שלילי של קולטן תאי T. על ידי פעולת הגישור (cross-linking) של קולטני תאי T עם גליקופרוטאינים אחרים על פני תאי T המתבצעת על ידי גלקטין-3, נמנע תהליך יצירת הצברים (clusters) של קולטני תאי T, ומדוכא השפעול של תאים אלה. ניסויים עם עכברים טרנסגניים עם חסר האנזים N-acetylglucosamine transferase V הם בעלי רגישות מוגברת למחלות אוטואימוניות. אנזים זה נחוץ לסינתזה של שרשרות polylactosamine, אשר משמשות ליגנדים לקישור גלקטין-3 על קולטני תאי T. כלומר, בעכברי knock-out אלה, גלקטין-3 אינו יכול למנוע שפעול עצמי של קולטני תאי T, ולכן תאי T אלה רגישים-ביתר. בנוסף, בתוך מערכת החיסון, הוכח שגלקטין-3 פועל כ-chemoattractant לתאי חיסון וכמשפעל של הפרשת ציטוקינים מעודדי דלקת.
לגלקטין-3 יש פעילות כמעורר דלקת (proinflammatory). גלקטין-3 כרוך בשפעול של תאי T כנראה על ידי אינטראקציה עם N-גליקנים המכילים poly-N-acetyllactosamine על גבי הקולטן של תאי T. הביטוי של תרכובות N-גליקניות אלו מבוקר בחלקו על ידי ההסתעפויות (branching) שלהן בעזרת האנזים β1-N-acetylglucosaminyltransferase V. עכברים טרנסגניים נטולי אנזים זה, מראים יצירה מוגברת של צברים (clusters) של T-cell receptor, מה שמצביע על כך שתרכובות ה-N-גליקנים המסועפות המגיבות עם גלקטין-3, יכולות להגביל יצירת צברים אלה, ולהפריע על ידי כך להתפתחות התקינה של התגובה של תאי-T.
גלקטין-3 יכול גם לעכב יצירת IL-5 במספר תאי חיסון, כולל אאוזינופילים באדם. לעומת זאת, גלקטין-3 יכול לשפעל תאי פיטום. נויטרופילים, ומונוציטים בעיקר בשחרור ציטוקינים וליצירת מולקולות עתירות חמצן העלולות להגיב עם רמות שונות. בעכברי knock-out עם חסר גלקטין-3 כרוך בהפחתת פעילות של תאי-פיטום, הפחתת ההצטברות של לויקוציטים בדרכי האוויר הדלקתיים של חולי אסתמה, והפחתת התגובות הדלקתיות בפריטונאום. כל העובדות הללו, מצביעות על תפקידים מורכבים של גלקטין-3 כתווך דלקתי, בוויסות היבטים רבים של תגובות דלקתיות.
בשנת 2012 פרסמו Mobergslien ו-Sioud שגלקטין-3 היא מולקולה רגולטורית, המעכבת שפעול של תאי T. על ידי ביטול ההתבטאות של גלקטין-3 בתאים דנדריטים בשיטות של מניפולציה גנטית, מעודדים תגובות אלוגנאיות של תאי T. אחוז תאי T העוברים תהליך של אפופטוזיס קטן באופן משמעותי בתרבית של תאים דנדריטים בהם גלקטין-3 עבר תהליך של knock-down.
גלקטין-3 והוויסות של תהליך האפופטוזיס
גלקטין-3 ציטופלזמטי הוא מעכב ידוע של תהליך האפופטוזיס. בשעת גירוי לאפוטוזיס מגיב גלקטין-3 ציטופלזמטי עם החלבון synexin שהוא חלבון תלוי סידן בפעילותו, וגם בעל תכונות קישור לפוספוליפידים. אינטראקציה זו בין גלקטין-3 ל-synexin, מסייעת להחדרת גלקטין-3 אל תוך המיטוכונדריה של התא, שם הוא מגיב וגורם ל-down regulation של החלבון Bcl-2, חוסם את השינוי בפוטנציאל של ממברנת המיטוכונדריה ומונע את השחרור של ציטוכרום C. כידוע, ציטוכרום C (משרשרת מעבר האלקטרונים) המשתחרר מהמיטוכונדריה נקשר לחלבון בשם Apaf-1. מספר עותקים של Apaf-1 יוצרים מבנה ביחד עם ציטוכרום C ועם האנזים caspase 9. מבנה זה נקרא אפופטוזום (apoptosome), והוא משפעל עותקים רבים של האנזים caspase 3 שממשיך לפרק חלבונים בתא ובהם את חלבוני שלד התא. התא הולך ומאבד את צורתו, מתכווץ, ומת. אם כן גלקטין-3 ציטופלזמי בריכוז גבוה יפעל למניעת אפופטוזיס, על ידי נטרול פעילות ציטוכרום C.
לעומת זאת, גלקטין-3 שבתוך גרעין התא, הוא בעל פעילות המעודדת אפופטוזיס לדוגמה בתאי סרטן הערמונית באדם, כמו שהראו Califice וחב' בשנת 2004 ב-Oncogene. המנגנון של הפעילות המעודדת באפופטוזיס זו של גלקטין-3 תוך-גרעיני, אינו ברור לחלוטין, אך הוצע על ידי Liu וחב' ב-2004ב-Biocheb J, שגלקטין-3 מגיב בתוך גרעין התא עם החלבון Nucling, שהוא חלבון הנקשר לחלבון Apaf-1, שהוא חלבון פרו-אפופטוטי. פעילותו המעודדת-אפופטוזיס של גלקטין-3 הודגמה בתאי T ובנויטרופילים והביאה למותם. אפופטוזיס של תאי T המושרה על ידי גלקטין-3, כורך את האנטיגנים CD7 ו-CD45.
בשנת 2012 הראו Caberoy וחב' שגלקטין-3 הוא ליגנד של האונקוגן mer הידוע כ-MERTK tyrosine kinase, ושהוא מייצר על ידי השפעול והזרחון העצמי של MERKT, איתות הידוע כ-eat me signal, המעודד את הפגוציטוזה של תאים אפופטוטיים על ידי מקרופאגים. לעומת זאת, Segusa וחב' הראו ב-2008 שגלקטין-3 מגן על תאי עור קרטינוציטים מפני אפופוטוזיס המושרית על ידי חשיפה לקרינת UVB. ניתן לסכם שמספר מרכיבים תוך-תאיים אליהם נקשר גלקטין-3 כגון Bcl-2, כמו גם הקולטן של Fas או CD95, וכן החלבון synexin הקושר סידן ופוספוליפידים , ידועים כמולקולות המפקחות על תהליך אפופטוזיס.
בציטופלזמה יכול Galectin-3 להיקשר עם Bcl-2 ולעכב תהליכי אפופטוזה בתא כפי שהראו Yang וחב' בתאי T במחקר משנת 1996 ב-Proc Natl Acad Sci. בציטופלזמה עשוי גלקטין-3 להגיב עם K-Ras משופעל, ולהשפיע על איתות של Akt הנעשה בתיווך של Ras, כמו שהדגימו Raz ו-Kloog בתאי קרצינומה של שד באדם, במחקר משנת 2005 ב-Cancer Res.
גלקטינים ותחלואה
כיוון שגלקטינים הם מולקולות הנמצאות ברקמות באזורי גוף נרחבים, הם נכרכים עם מגוון רחב של מחלות סרטניות, עם HIV, עם מחלות אוטו-אימוניות, עם מצבי דלקת כרוניים, עם תגובות אלרגיות, ועם מחלת השתל נגד המאחסן (GVHD). אך המנגנונים הנחקרים ביותר בהם מעורבים גלקטינים קשורים למחלת הסרטן ו-HIV.
גלקטין-3 וההתמרה הסרטנית
יש ראיות רבות המצביעות על כך שביטוי-יתר של גלקטין-3 מעודד התמרה סרטנית. מחקרים במעבדתו של Raz בדטרויט הראו ש-down-regulation של גלקטין-3 מדכא טומורוגניות של תאי קרצינומה של השד באדם (Clin Cancer Res משנת 2001), וכן על כך שגלקטין-3 מסייע להתפתחות תאי קרצינומה פפילאריים בבלוטת התריס (Int J Oncol, משנת 2001). בהתאם, עיכוב הביטוי של גלקטין-3 על ידי השריית antisense cDNA שלו בתאי קרצינומה פפילאריים בבלוטת התריס באדם, הביאו לדיכוי התפתחות השאת. יתרה מכך, Takenaka וחב' הצליחו על ידי טרנספקציה של cDNA של גלקטין-3 לתוך תאים פוליקולארים נורמלים בבלוטת התריס הביאה לשינוי בביטוי הגני ולהפיכתם לתאים סרטניים (Cancer Lett, 2003).
המנגנון המולקולארי דרכו מסייע גלקטין-3 להתמרה הסרטנית מיוחס באופן חלקי לאינטראקציה של חלבון זה עם האונקוגן K-Ras כפי שהראו Kloog וחב' ב-J Biol Chem בשנת 2004. אינטראקציה זו מעודדת את הקישור של K-Ras לממברנת התא, מה שמביא לשפעול של האנזים phosphatidylinositol 3-kinase או PI3-k, התלוי בפעילותו ב-K-Ras, וכן לשפעול של Raf-1. הפוטנציאל הסרטני של גלקטין-3 כרוך כפי הנראה גם באינטראקציה שלו עם β-catenin, או עם גורמי שעתוק שונים המעודדים את ביטויו של cyclin-D ושל c-MYC, ומסייע בכך להתקדמות מחזור חיי התא הסרטני (Shimura וחב' ב-Cancer Res, משנת 2004).
ריכוזי galectin-3 בנסיוב של חולי סרטן
במחקר משנת 2000 של Iurisci וחב' שהתפרסם ב-Clin Cancer Res, נמדדו ריכוזי galectin-3 בנסיוב של חולי סרטן מסוגים שונים, והושוו לריכוזי גלקטין זה בנסיוב של אנשים בריאים. באופן כללי נמצאה רמה מוגברת באופן משמעותי (p=0.014) של גלקטין-3 ברוב סוגי הסרטן שנבחנו: בשעה שהרמה הממוצעת של חלבון זה בדמם של נבדקים בריאים נקבעה כ-62 ננוגרם/מ"ל, הרי שרמתו הממוצעת במצבי סרטן שד ממוקם ולא מפושט נקבעה כ-40 ננוגרם/מ"ל, בעוד שבנשים עם סרטן שד גרורתי הייתה הרמה הממוצעת 100 ננוגרם/מ"ל. בסרטן המעי הגס נמצאה רמת גלקטין-3 ממוצעת של 75 ננוגרם/מ"ל במחלה לא-גרורתית, לעומת 329 ננוגרם/מ"ל במחלה גרורתית. במחלה גרורתית של NSCLC רמת החלבון הממוצעת נמצאה כ-171.5 ננוגרם/מ"ל, ובקרצינומה מפושטת של השחלות נמדדה רמה ממוצעת של 94.5 ננוגרם/מ"ל. בשני סוגי סרטן, מלנומה ו-non-Hodgkin lymphoma, לא הייתה רמת גלקטין-3 מוגברת בהשוואה לאנשים בריאים, 48.5 ו-50 ננוגרם/מ"ל, בהתאמה.
גלקטין-3 ויכולת ההתפשטות של תאי סרטן
יכולת ההישרדות של תאי סרטן החודרים לצירקולציה של הדם או של המערכת הלימפטית, והיכולת שלהם להיצמד לאנדותל הווסקולארי, הם שלבים קריטיים בתהליך הגרורתי. Yu הראה ב-2010 ב-World J Gastrointest Oncol שגלקטין-3 חיוני בתהליכים אלה. בהשוואה לאנשים בריאים, רמת גלקטין-3 בדמם של חולי סרטן, לא כל שכן חולים במחלה גרורתית, גבוהה משמעותית. אכן, Iurisci וחב' מדדו רמות גלקטין-3 בנסיוב של חולי סרטן בהשוואה לביקורת של אנשים בריאים, וממצאיהם פורסמו בשנת 2000 ב-Clin Cancer Res. נמצא שבעוד ממוצע רמת גלקטין-3 בדמם של אנשים בריאים נקבע כ-62 ננוגרם/מ"ל, רמות גבוהות משמעותית נמצאו בדם של מאובחנים עם סרטן שד, מעי גס, ריאות, שחלות, מלנומה ו-non-Hodgkin lymphoma. אך הממצא המשמעותי ביותר היה שרמות גלקטין-3 בחולי סרטן גרורתי היו גבוהות משמעותית מאלה בחולים במחלת סרטן מקומית. רמות גלקטין-3 הגבוהות ביותר במחקר זה נרשמו במאובחנים עם סרטן גרורתי של מערכת העיכול עם תוצאה ממוצעת של 320 ננוגרם/מ"ל.
דיווחים אחדים הראו שככל שרמות גלקטין-3 היו גבוהות יותר במקרים של סרטן המעי הגס, התירואיד והשחלות, המחלה הסרטנית הייתה מפושטת יותר והפרוגנוזה גרועה יותר. Yu וחב' הראו במחקרם משנת 2007 ב-J Biol Chem, שגלקטין-3 נקשר למבנה האונקו-עוברי הידוע כ-Thomasen-Friedenreich antigen שמבנה האפיטופ הסוכרי שלו galactoseβ1,3 N-acetylgalacyosamine α, ממוקם על ה-mucin הטרנס-ממברנאלי MUC1 המתבטא בתאים סרטניים. קישור אחרון זה של גלקטין-3 ל-TF/MUC1 משרה פיזור מחודש של MUC1 על שטח פני התאים, מה שמאפשר חשיפה של מולקולות היצמדות קטנות יותר, שהיו בדרך כלל "מוסתרות" על ידי אנטיגן MUC1 הגדול והעשיר בסוכרים. שינויים ממברנאליים אלה, מגבירים את יכולת ההיצמדות של תאים סרטנים לאנדותל הווסקולארי (Zhao וחב', ב-Cancer Res משנת 2009), אך גם מגבירים על פי אותם חוקרים את יכולת הצימות (aggregation) של תאים אלה ויכולתם ליצור מיקרו-תסחיפים, במאמר משנת 2010 ב-Mol Cancer.
רמות גבוהות של MUC-1 כרוכות בפרוגנוזה גרועה ובפוטנציאל מוגבר של גרורתיות. MUC-1 הוא ליגנד טבעי של גלקטין-3. בתאים נורמאלים MUC-1 משמש בתור מעטה הגנתי סביב תאים ומחליש את האינטראקציה הבינתאית. בתאי סרטן השד, יש לגלקטין-3 זיקה גבוהה ל-MUC-1, מה שגורם לדה-פולריזציה, ולשבירת המעטה של MUC-1 המגן על התאים. בכך נחשפות על פני התאים הסרטניים מולקולות ספיחה קטנות, המגיבות עם חלבוני ספיחה על תאי האנדותל של דופן כלי דם, כגון E-selectin, מה שמאפשר חדירת תאי סרטן אלה לזרם הדם. ניסויים הראו שביטוי-יתר של MUC-1 כשלעצמו אינו מספיק להגביר את הפוטנציאל הגרורתי של של התהליך הסרטני, ולמעשה אף מעכב את חדירת תאי הסרטן לזרם הדם. נדרשת גם הנוכחות של גלקטין-3 הנקשר ל-MUC-1, ומגביר את יכולת החדירה והגרורתיות של תאי הסרטן. ניסויים in vitro הראו שעיכוב פעילות גלקטין-3 בתרבית תאים של סרטן השד באדם, מביאה לאיבוד הממאירות של תאים אלה.
מעורבות גלקטין-3 בתהליך הסרטני
יש עדויות לכך שגלקטין-3 משחק תפקיד משמעותי בתהליכים סרטניים, כולל ההתמרה למצבים ממאירים, והגברת הפוטנציאל הממאיר של תאי סרטן. אחת הראיות למעורבות של גלקטין-3 בסרטן, היא האינטראקציה שלו עם אונקוגנים דוגמת Ras, ופעילות גלקטין-3 בשפעול מנגנוני איתות תוך-תאיים המעודדים חלוקתם. גלקטין-3 יכול גם לווסת מספר חלבונים הקשורים למחזור חיי התא, כמו c-myc ו-cyclin E, שמשתתפים בתהליך הסרטני. הריכוז של מוגבר בדמם של אנשים עם סוגי סרטן מסוימים כגון סרטן השד. גלקטין-3 זוהה קשור לגליקנים על פני תאי סרטן שד, ובדמם של אנשים המאובחנים עם גרורות סרטניות, רמת גלקטין-3 גבוהה במיוחד.
ממצאים אחרים מעידים על כך שחסר גלקטין-3 בעכברי Knock-out כרוך במספר שינויים פנוטיפיים כגון מחלת כבד שומני, הפחתה בתפקוד של תאי-פיטום (mast cells), הפחתה בתהליכי לייפת (פיברוזיס) בכבד, ונגעים גלומרולאריים התלויים בגיל. כמו כן בעכברים נטולי גלקטין-3 אלה, התגובות הדלקתיות מופחתות, ויש דעיכה בהסננה של נויטרופילים.
בתאי סרטן רבים, ביטוי-יתר של גלקטין-3 היא אחת התכונות הדומיננטיות. כמו כן, בשלב המעבר של תאי אדנומה לתאי קרצינומה יש מגמה של שינוי מיקומו של גלקטין-3 מהגרעין של תאים לציטופלזמה שלהם, כפי שהראו Andre וחב' בשנת 1999 ב-J Cancer Res Clin Oncol. יש ראיות חזקות למעורבות של גלקטין-3 בוויסות של "התנהלות סרטנית", כגון קצב התרבות התאים הסרטניים, דרגת ההתמיינות שלהם, תהליך האפופטוזיס, הדיכוי החיסוני של תאי סרטן, אנגיוגניות, יכולת הספיחה של תאי סרטן למשתית החוץ-תאית, יכולת החדירה של תאים אלה לרקמות המקיפות אותם, וכושרם בגרורתי, כל אלה בתלות בריכוז של חלבון זה ובמיקום התאי שלו.
ההשפעות המגוונות של גלקטין-3 על תאי סרטן, נובעות מהמבנה הייחודי של חלבון זה, והאינטראקציות השונות שלו עם תאים בתהליך הסרטני. ביטוי-יתר של גלקטין-3 ושינויים במיקומו התוך-תאי כמו גם בסמיכות לתא הסרטני, משפיעים על הפרוגנוזה של החולה. ביטוי של גלקטין-3 בדרגות פעילות שונות, עשויים להשפיע על שגשוג תאי הסרטן, על דרגת התמיינותם (differentiation), על תהליכי chemoattraction של כימיקאלים שונים אל התאים, על אנגיוגניות, אפופטוזיס, על הדיכוי שלהם על ידי מערכת החיסון, יכולת הספיחה של תאי הסרטן למשתית סביבם, יכולת חדירתם לרקמות שכנות ולבסוף על הכושר הגרורתי שלהם.
סוגי סרטן אחדים, כולל מלנומה, אסטרוציטומה, ושאתות של שלפוחית השתן והשחלה, מבטאים בעודף מספר גלקטינים, וביטוי יתר זה נכרך בהתנהגות אגרסיבית יותר ובמעבר של תאי הסרטן לפאזה גרורתית. שלושה גלקטינים במיוחד, נמצאו משמעותיים בהתקדמות התהליך הסרטני והגרורתי, ומדובר בגלקטין-1, גלקטין-3 וגלקטין-9. מספר מחקרים מציעים שחסימת פעילות גלקטין-3 עשויה להגביל את שליחת הגרורות.
גלקטין-3 מופיע בסוגי תאים רבים כתאי אפיתל, פיברובלסטים, תאים דנדריטים, ותאי דלקת. גלקטין-3 מופרש על ידי סוגי תאים רבים, כולל מונוציטים, מקרופאגים, ותאי אפיתל. ראוי לציין שגלקטין-3 אינו מופיע בהפטוציטים בכבד, אך מופיע בתאי הפאטו-קרצינומה. בשנת 1994 דיווחו Reichert וחב' על כך שגלקטין-3 מתבטא בתאי Schwann בתגוב לפגיעה במערכת העצבים ההיקפית.
גלקטין-3 ואנגיוגניות
יצירה של כלי-דם חדשים בתהליך הנצה מכלי-דם קיימים, הוא כידוע שלב קריטי בפלישה של תאים סרטניים לרקמה סמוכה ולתהליך הגרורתי על פי העקרונות שהציב יהודה פולקמן כבר לפני שלושה עשורים. תהליך האנגיוגניות מתדלק גידולים סרטניים בחמצן ובחמרי מזון חיוניים לצמיחתם האינטנסיבית. הוספה אקסוגנית של גלקטין-3 נמצאה מחישה תנועתם של תאי אנדותל בתרבית תאים, ומסייעת ליצירת קפילארות דם חדשות בניסויים בעכברים של Avraham Raz וקבוצתו בדטרויט בשנת 2000 ב-Am J Pathol.
תהליך אנגיוגני זה המושרה על ידי גלקטין-3, כרוך באינטראקציה בין חלבון זה לבין תת היחידה α3β1 של integrins, או עם פרוטאוגליקאנים מסוג NG2 הבאים לביטוי על פני מולקולות על שטח פני התאים כפי שהראו Fukushi וחב' ב-Mol Biol Cell בשנת 2004. אינטראקציה זו המביאה ליצירת צברים (clusters) של גלקטין-3 עם הליגנדים שלו על פני התאים, גורמת לשפעול של אנזימי קינאזה, הגורמים למודולציה של גורמי הגדילה VGEF או vascular endothelial growth factorr וכן bFGF או basic fibroblast growth factor, המסייעים לאנגיוגניות על פי Markowska וחב' ב-J Exp Med משנת 2010. כמו כן הראו דיווחו Yang וחב' ב-2007 ב-Biochem Biophys Res Commun, שאינטראקציה של גלקטין-3 עם האנזים aminopeptidase N/CD13 הממוקם על שטח פני האנדותל, מביאה לוויסות הנצת כלי הדם החדשים מהאנדותל בשלבים המוקדמים של אנגיוגניות.
גלקטין-3 ומחלה קרדיו-וסקולארית
רמות מוגברות של גלקטין-3 נמצאו כרוכות משמעותית עם סיכון מודבר למוות הן מאי-ספיקת לב חריפה, כמו גם מאי-ספיקת לב כרונית. באנשים בריאים, כמו גם בעכברים וחולדות, רמות גלקטין-3 נמוכות, וככל שמחלת הלב מתקדמת מתרחשת בשריר הלב עלייה ברמת חלבון זה. יש אם כן המציעים להשתמש בגלקטין-3 כסמן לזיהוי מטופלים בסיכון מוגבר, ומחקר של Sharma וחב' שהתפרסם ב-Circulation ב-2004, טוען שרמות גלקטין-3 יכולות לשמש כבר בשלבים מוקדמים של זיהוי מחלת לב, כדי לסייע בהערכת הטיפול האופטימאלי, תוך שימוש לדוגמה בתכשירים נוגדי-דלקת. גלקטין-3 נכרך גם כגורם משמעותי בתהליך ה-remodeling ופיברוזיס של חדרי הלב באי ספיקה (de Boer וחב' ב-Curr Heart Fail Rep משנת 2010 , ואותם מחברים ב-Ann Med משנת 2011).
הקשר הנסיבתי לפחות של רמה גבוהה של גלקטין-3 עם תהליכי remodeling לבביים, רלוונטי ביותר שהרי תהליך ה-remodeling הוא גורם חשוב בתוצאים (outcome) הקליניים של אי-ספיקת לב, תוך שהוא קשור להתקדמות המחלה ולפרוגנוזה גרועה כפי שסיכמו Ueland וחב' בשנת 2011 ב-Int J Cardiol. יש ראיות לכך שתהליך ה-remodeling מתחיל לעתים קרובות עם נזק לבבי הנגרם לדוגמה ממחלת לב כלילית (כולל אוטם שריר הלב), או נזק הנגרם מיתר לחץ-דם (חלק ממסקנות ניסוי PROVE IT-TIMI 22 של Grandin וחב' ב-Clin Chem משנת 2012). בחולים אלה, נזק לרקמת הלב מגרה תהליך דלקת ותגובה לתיקון הנזק, שהוא תהליך מועיל בדרך כלל. יחד עם זאת, בחלק מהחולים, תהליך הפיברוזיס הופך להיות דיפוזי ובעל אופי מתקדם, המסתיים בשינויים בצורה ובמימדים של הלב. תהליך זה ידוע כ-adverse remodeling ויש הכורכים אותו עם רמות מוגברות של גלקטין-3.
גלקטין-3 מסייע לאי-ספיקת לב
תהליך זה שכיח יחסית ומייצג כ-30% מכלל המקרים של אי-ספיקת לב קלה עד מתונה. בניגוד לצורות אחרות של HF, אי-ספיקת לב בתיווך גלקטין-3 היא מתקדמת, תוך שהיא גורמת לחולים לאבד מהר יותר את תפקוד הלב, ומגדילה את הסיכון לאשפוז ולמוות. לכן מדידה שגרתית של רמת גלקטין-3 בחולים עם HF, עשויה לאפשר לרופא לזהות מטופלים עם תהליך פיברוטי או תהליך של adverse remodeling הנגרמים מגלקטין-3 מוגבר. הזמינות של מבדק לקביעת רמת גלקטין-3 עשוי לסייע בבחירה אופטימאלית של חלופות טיפוליות בחולים עם HF.
בשנת 2011 התפרסמה סקירתם של McCullough וחב' ב-Rev Cardiovasc Med, בה הם מייחדים מקום לבדיקת הדם החדשה למדידת גלקטין-3, תוך שהם מתייחסים להתנהלות עם חולים עם באי-ספיקת לב. כאשר מיוציטים המתפקדים באופן תקין ברקמת הלב, באים במגע עם רקמת קולאגן מצולב כתוצאה מתהליכי פיברוזיס בשריר הלב, זו אבן-דרך בתהליך המתקדם לאי-ספיקת לב (HF), ללא כל קשר לאטיולוגיה הגורמת למצב זה. בתגובה למגוון של גירויים מכאניים ונוירו-הורמונאליים, מקרופאגים מפרישים גלקטין-3 הפועל כגורם אנדוקריני ופראקריני לעודד מקרופאגים נוספים, פריציטים, מיו-פיברובלסטים ופיברובלסטים, להגיב לאיתות זה בשגשוג מואץ, והפרשת procollagen I. חלבון אחרון זה, עובר קשרי צילוב (cross-links) באופן בלתי הפיך, ליצירה של קולאגן ולגרום לפיברוזיס לבבי. הפיכת הערכה למדידת רמת גלקטין-3 בדם לערכה זמינה במעבדה הקלינית, תסייע בהערכה פרוגנוסטית של HF סיסטולי ולא-סיסטולי.
מדידת רמת גלקטין-3 לפני שחרור החולה מאשפוז, או בהערכה של מטופלים אמבולטוריים, כאשר מומלץ לבצע בדיקה זו פעמיים בשנה לאלה עם אי-ספיקת לב יציבה. נתונים אלה נסמכים על ידי הראיות בנקודת זמן זו. רמות גלקטין-3 בדם שמעל ל-25.9 ננוגרם/מ"ל, ללא כל קשר לתסמינים, ממצאים קליניים או תוצאות מעבדה של מדדים אחרים, יש בה כדי לנבא שהנבדק עומד בפני התקדמות מוחשת של אי ספיקת הלב, והוא צפוי להתאשפז ואף נמצא בסכנה מוחשית למות. יתרה מכך, על פי בעלי הסקירה, הכפלה ברמת גלקטין-3 תוך פרק זמן של 6 חודשים, ללא כל קשר לרמת הבסיס של מדד זה, מזהה נבדק בדרגת סיכון גבוהה.
גלקטין-3 ומחלות אוטואימוניות
עכברי knock-out עם גנוטיפ של -/-gal3 נבחנו במערכת של EAE או experimental autoimmune encephalopathy, המשמשת מודל לטרשת נפוצה (MS) באדם, מסתמן תפקיד חשוב לגלקטין-3 בתרומה להחמרה במהלך המחלה. Jiang וחב' דיווחו ב-2009 ב-J Immunol, שהמחלה בעכברי -/-gal3, הייתה משמעותית פחות חמורה מאשר בעכברי +/+gal, ועכברי -/-gal ראו פעילות מופחתת של הסננת מקרופאגים ודנדריטים לרקמה העצבית.
בנוסף, מצאו Jiang וחב' בעכברי -/-gal שתאי T בקשרי הלימפה, יצרו פחות ציטוקינים מעודדי-דלקת כגון IL-17, אינטרפרון-γ ו-IL-6 בתגובה לגירוי אנטיגני, בהשוואה לעכברי +/+gal, וכן התברר שברקמה עצבית של עכברי -/-gal לא ניתן היה לגלות TNF-α, אינטרפרון-γ, IL-17 כמו גם את האנזים nitric oxide synthase, כל אלה בהשוואה לעכברי +/+gal. ממצא משמעותי נוסף היה שבטחול ובמערכת העצבים המרכזית של עכברי -/-gal, נמצאו בתדירות גבוהה יותר תאי +Foxp3 שהם תת-קבוצה של Tregs או T regulatory cells, שכונו בעבר suppressor T cells, שחשיבותם מרכזית במודולציה של מערכת החיסון. מסקנת Jiang וחב' שהתגובה המדכאת של ציטוקינים המופרשים מתאי Th2 ותאי Treg היא שאחראית למחלה המתונה יותר בעכברי -/-gal.
התוצאות של מודל EAE בניסוי המכונן של Jiang וחב', תואמות את התפקיד המוכר של גלקטין-3 כמולקולה שהיא proinflammatory, במודלים של מחלות שונות. Zuberi וחב' הראו במאמרם משנת 2004 ב-Am J Pathol, את תפקידו הקריטי של גלקטין-3 ביצירת דלקת דרכי האוויר ובתגובת-יתר ברונכיאלית במודל של אסתמה בעכברים. באותו כתב עת דיווחו בשנת 2000 Hsu וחב' שפגיעה ממוקדת בגן של גלקטין-3 מביאה לתגובות דלקתיות מופחתות בפריטונאום. ועוד באותו כתב עת מחקרם של Saegusa וחב' משנת 2009 על כך שגלקטין-3 קריטי להתפתחות תגובה דלקתית אלרגית במודל ל-atopic dermatitis בעכברים, ומחקרם של Bernardes וחב' משנת 2006, הראה שגלקטין-3 הוא בעל תפקיד רגולטורי בהדבקה עם Toxoplasma gondii.
גלקטין-3 ופיברוזיס
קיים קשר מובהק בין רמות גלקטין-3 וסוגים שונים של לייפת (fibrosis). גלקטין-3 עובר up-regulation במצבי לייפת הכבד, לייפת הכליות ולייפת אידיופאטית של מערכת הנשימה (IPF). מספר ניסוים עם עכברים עם חסר של גלקטין-3, הראו שבאותם תנאים בהם עכברים רגילים מפתחים IPF, או לייפת כליות או כבד, אותם עכברים עם חסר גלקטין-3 לא פיתחו לייפת, או שפיתחו לייפת מצומצמת. נראה אם כן שחלבון זה קשור למנגנון התפתחות לייפת, ולכן יש ניסיון של חברות פרמצבטיות דוגמת Galecto Biothec לפתח תכשירים החוסמים את התקשרות גלקטין למבנים קרבוהידראטים, כאשר אחד מתכשירים אלה המעכבים פעילות גלקטין-3 הוא TD139 נבחן לפוטנציאל שלו במניעת לייפת.
תכשירים לנטרול גלקטין-3
חברת Galectin Therapeutics בארה"ב מצאו שעיכוב פעילות חלבון זה, מפחיתה בעכברים יתר לחץ-דם פורטאלי כמו גם פיברוזיס. חברות אחרות פועלות ליצירת תכשירים בעלי פוטנציאל אנטגוניסטי לגלקטין-3, כגון נגזרות פקטין מפרי הדר. תכשיר זה הידוע כ-Modified Citrus Pectin, הוא כרגע המוצר הטבעי היחיד בעל פעילות מעכבת את פעילות של גלקטין-3. מכון מחק ב-La Jolla מתמקד במודולציה של גלקטין-3 בתהליך הסרטני, תוך שימוש ב-GSC-100, שהוא פוליסכריד הנקשר וחוסם את פעילות גלקטין-3.
מדידת רמות galectin-3
בשנת 2013 נכלל לראשונה מדד רמת galectin-3 על ידי ACCF וכן על ידי AHA בהוראות של שני איגודים אלה להתנהלות עם אי-ספיקת לב. גם ה-FDA נתן אישורו למדידת galectin-3 כעזר בהערכת הפרוגנוזה של מטופלים עם אי-ספיקת לב כרונית. מחקרים עדכניים אחדים מאששים המלצה זו, וביניהם נזכיר אחדים: מחקר AF-ACTION של Felker וחב' שהתפרסם ב-2012 ב-Circulation; מחקר DEAL-HF של Lok וחב' משנת 2010 שהתפרסם ב-Clin Res Cadiol; מחקרם של de Boer וחב' משנת 2011 ב-Ann Med.
ב-10 באפריל 2013 הודיעה חברת Abbott על שיתוף פעולה עם חברת BG Medicine בשיווק ערכת המבדק ARCHITECT Galectin-3, לסיוע בהערכה פרוגנוסטית של מטופלים עם אי-ספיקת לב כרונית. ערכה זו מבוססת על טכנולוגיית CMIA או chemiluminescent microparticle immunoassay למדידה כמותית של רמת galectin-3 בנסיוב או בפלזמה (EDTA) במערכת ARCHITECT. הגישה למדידת חלבון זה התבססה רבות על מחקרים רב-מוסדיים בהולנד בראשות de Boer וחב' שסוכמו ב-2009 ב-Eur J Heart Failure. יש להדגיש יחד עם זאת, שרמת galectin-3 אינה שימושית לאבחון אי-ספיקת לב חריפה, כאשר מדדים כמו BNP או NT-proBNP, צריכים לשמש לאבחון זה.
יש מספר מגבלות במדידת galectin-3, כמו לדוגמה דגימה המוליטית שעלולה לתת תוצאה חיובית-כזובה בשל דליפת חלבון זה ממקור תוך-תאי. יש לפסול דגימות המוליטיות לצורך בדיקה זו. בנבדקים עם רמות גבוהות של RF או rheumatoid factor, או באלה עם מפגעים אוטואימוניים אחרים עלולות להתקבל תוצאות מוגברות כזובות של galectin-3, כמו גם במקרים של אנשים עם רמה גבוהה של נוגדנים הטרופיליים לאחר חשיפה ממושכת לבעלי חיים או לתוצרים טיפוליים שמקורם בנסיוב של בעלי חיים.
פירוש של התוצאות
קלינית, ריכוזי galectin-3 יכולים להתחלק ל-3 קבוצות, כפי שהדבר מתבסס על תוצאות מחקרים אחדים בתחום אי-ספיקת לב כרונית: מתחת ל-17.8 ננוגרם/מ"ל-סיכון נמוך; 17.9-25.9 ננוגרם/מ"ל-סיכון ממוצע; מעל 25.9 ננוגרם/מ"ל-סיכון מוגבר. רמות מוגברות של galectin-3 מצביעות על סיכון מוגבר לתוצאים (outcomes) לא רצויים, ומרמזים לאפשרות של פיברוזיס מושרית על ידי galectin-3 או לשינויי מבנה וצורה לא רצויים (remodeling) של שריר הלב. תוצאות מוגברות של galectin-3 נותרות מוגברות באופן יציב לאורך זמן ללא טיפול.
ניסוי קליני פרוספקטיבי-תצפיתי רב-מוסדי בקנדה, מנוהל על ידי Christenson וחב', שהתפרסם ב-2010 ב-Clin Bichem, ניסה להעריך את הקשר בין רמות galectin-3 ב-1,092 נבדקים (גיל 55-80 שנה, 520 גברים, 572 נשים ללא מחלת לב ידועה) לתחלואה עתידית. נבדקים עם רמות galectin-3 מעל 22.1 ננוגרם/מ"ל, היו משמעותית מדורגים גבוה יותר במדרג NYHA, ובסיכון מוגבר לתמותה מאי-ספיקת לב.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק