הפסידין - Hepcidin
הופניתם מהדף Hepcidin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| הפסידין | |
|---|---|
| Hepcidin | |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | מערכת מפגעים במשק הברזל ואנמיה |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
משק הברזל בגוף
ברזל הוא יסוד חיוני ביותר בגוף החי. הוא מהווה מרכיב מפתח בתהליך העברת החמצן, ומהווה חלק מחלבוני אגירה כגון המוגלובין ומיוגלובין. כן הוא מהווה מרכיב מבני בחלבונים חיוניים כציטוכרומים המשתתפים בתהליכי חמצון-חיזור ליצירת אנרגיה. בנוסף, ברזל מהווה חלק ממכלול של NADPH oxidase, האחראי ליצירת פראוקסידים רעילים במקרופאגים, כאשר תאים אלה משמידים מיקרואורגניזמים. ביונקים, מאזן הברזל בגוף מווסת בעיקר על ידי ספיגת ברזל מהמזון בתריסריון, כאשר ברזל מתחמצן ברירית המעי מערכיות של Fe+2 (או ferrous) לערכיות של Fe+3 (או ferric), ובצורתו האחרונה נקשר בדם לחלבון הנשא טרנספרין, וכך הוא מועבר לרקמות המטרה שלו, ובעיקר למח העצם ולתאים קודמנים בתהליך בּשלוּת האריתרוציטים.
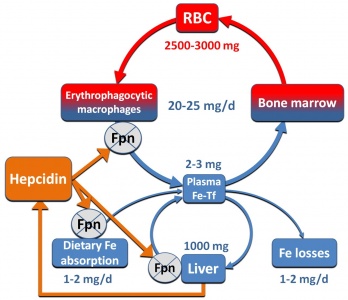
טרנספרין ומטען הברזל שלו נקשרים לקולטנים ייחודיים, ומוחדר יחד עם קולטניו אל תוך הציטופלזמה של התאים בתהליך אנדוציטוזה, שם הוא משחרר את הברזל. סך כמות הברזל בגוף אדם במשקל 70 ק"ג היא כ-3.500 עד 4,000 מיליגרם, כאשר כשני-שליש מכמות זו היא חלק מההמוגלובין בכדוריות הדם האדומות. הדרישה של ברזל לצורך תהליך האריתרופויאזה היא של כ-20 מיליגרם ליום. בני אדם ובעלי חוליות אחרים משמרים את הברזל בגוף באופן מוקפד, כאשר מדי יום ממוחזרת כמות של כ-20 מיליגרם ברזל במבוגר, שמקורה בהמוגלובין המשתחרר מתאי דם אדומים שהגיעו אל סוף דרכם.
תפקיד נכבד במִחזוּר ברזל הוא זה של מקרופאגים במערכת הרטיקולו-אנדותליאלית (RES), כאשר הפטוציטים בככד אוגרים את רוב הברזל קשור לפריטין, ותאי Kupffer נייחים מכילים ברזל הקשור להֶמוסידֶרין. כמות הברזל האובדת מדי יום בהפרשות הגוף אינה עולה על 1-2 מיליגרם, כאשר כמות הברזל היומית המומלצת בדיאטה מערבית אופיינית היא כ-12-10 מיליגרם. בבני-אדם, כמו גם ביונקים אחרים, העדר מנגנוני הפרשה פיזיולוגיים של ברזל, מחייבים ששמירת המאזן ההומאוסטתי של ברזל תתקיים דווקא על ידי וויסות ספיגתו במעי. אמנם מנגנון הוויסות של ספיגת ברזל על ידי תאים אנטרוציטים בחלק העליון של התריסריון היה בלתי מפוענח עד לאחרונה, עד אשר בא גילוי hepcidin ושפך אור בסוגיה זו.
חסר ברזל מהווה מפגע רפואי משמעותי הפוגע בלמעלה מ-1.5 מיליארד בני-אדם בעולם. השיטות המקובלות להערכת הסטאטוס של ברזל, כוללות מדידת רמת פריטין, רמת sTfR או הקולטן המסיס של טרנספרין, וכן רמת טרנספרין, ורמת הריוויון של טרנספרין (TIBC). לכל אחת מהשיטות הללו יש מגבלות: לדוגמה, פריטין הוא סמן של מאגרי ברזל, אך הוא עלול להיות מוגבר בנבדקים עם מצבי דלקת בשעת הבדיקה, אילו sTfR המשקף חסר רקמתי של ברזל מושפע על ידי פעילות אריתרופויאטית.
הסינתזה ותכונות החלבון hepcidin
Hepcidin הוא חלבון פפטידי המורכב מ-25 חומצות אמיניות המיוצר בכבד, שהתגלה בשנת 2001 דווקא בשל סגולותיו כחלק מההגנה הטבעית של הגוף בפעילותו האנטי-מיקרוביאלית. עד מהרה התבררו סגולותיו של hepcidin כמרכיב מרכזי בוויסות מאזן הברזל בגוף, וממילא נקשר hepcidin למנגנון הפתולוגי במחלות אגירת-יתר של ברזל, או של חסר ביסוד חיוני זה. Hepcidin פועל על ידי התקשרות לחלבון הטרנס-ממברנאלי ferroportin, שתפקידו להפריש ברזל הקשור במאגרי פריטין, אל מחוץ לתאים כגון הפאטוציטים בכבד, אנטרוציטים בתריסריון ומקרופאגים. קישור hepcidin ל-ferroportin גורם לאחרון להיות מופנם אל תוך ליוזומים בציטופלזמה שם הוא עובר פירוק. פעילות זו של hepcidin גורמת לאגירת-יתר של ברזל בתאים, ולרמה נמוכה יותר של ברזל בדם.
הגן באדם ל-hepcidin הידוע כ-HAMP, מכיל שלושה אֶקסונים והוא מקודד בכבד לסינתזה של החלבון בצורת הקודמן שלו-preprohepcidin, המורכב מ-84חומצות אמינו, שעובר ביקוע ב-2 שלבים דרך שלב ביניים של prohepcidin המכיל 60 חמצות אמינו, בסמוך לקצה ה-N טרמינאלי שלו. ביקוע זה מתבצע על ידי אנזים convertase ששמו furin, המבקע ליד רצף של 2 חומצות אמינו בסיסיות כגון Lys-Arg או Arg-Arg, כפי שהראו Papanikolau וחב' ב-Blood בשנת 2005. פרוטאוליזה זו מביאה ליצירת פפטיד פעיל ביולוגית המורכב מ-25 חומצות אמינו, כאשר בשתן מופיעות גם גרסאות קצרות יותר של hepcidin באורך של 22 ו-20 חומצות אמינו בעלות פעילות מופחתת, שהן כנראה תוצרי פירוק פרוטאוליטי של hepcidin-25 הפעיל. רצף של 25 חומצות האמינו ב-hepcidin הוא כדלקמן:
המשקל המולקולארי של הפסידין הוא 2,810 דלטון.
באופן יוצא דופן, למרות היותה פפטיד קצר, מולקולת hepcidin מכילה 8 שיירי ציסטאין, ויש בה 4 קשרים דיסולפידיים (-S-S-), שאחד מהם אף מקשר 2 שיירי ציסטאין סמוכים, במבנה קומפקטי דמוי-סולם המקנה לו יציבות יחסית בתמיסות פיזיולוגיות, והוא גם אופייני לפפטידים אחרים בעלי פעילות אנטי-מיקרוביאלית. בשל גודלו הקטן של hepcidin, מבנהו המאוד מכונס, ובעיקר בגלל היות חלבון זה בעל הרכב מאוד משוּמר (conserved) מבחינה אבולוציונית בין בעלי חיים שונים, מדגים ועד אדם, קשה להפיק נוגדנים כנגדו. למעשה רק בשנת 2003 דיווחה מעבדתו של Ganzב-Blood על שיטה מעבדתית לקביעת רמת hepcidin בשתן תוך שימוש בנוגדנים לפפטיד זה. בשל משקלו המולקולארי הקטן, וממדי הפפטיד הקטנים, מופרשת המולקולה בחופשיות בשתן, בהתחמקה מפילות פרוטאוליטית בפקעיות הכליה, וכן בהיותה ממוחזרת מעט על ידי ספיגה באבוביות הכליה. זו כנראה הסיבה לרמות נמוכות ביותר של hepcidin בדם, שהן לעתים מתחת לסף הגילוי, לעומת רמות של עד 10 מיקרוגרם/גר' קראטינין שניתן למצוא בשתן תקין.
- חלבוני טרנספורט דו-כיווניים להחדרת ברזל לתאי אגירה ולהוצאתו מתאים אלה
חדירת ברזל לגוף ולתאים השונים נעשית בעזרת מערכות טרנספורט אחדות, כאשר הברזל מגיע מהמזון ב-2 צורות: או במבנה תלת-ערכי, או כחלק ממכלול של heme. הברזל התלת-ערכי יכול להיספג במעי הדק רק לאחר חיזורו לברזל דו-ערכי על ידי אנזימים כגון מערכת ציטוכרום B בתריסריון. אז נכנס לפעולה החלבון DMT1 או divalent metal transporter 1, המחדיר את הברזל דרך ממברנת תאי רירית המעי. לעומת זאת, ברזל כחלק מ-heme נספג בעזרת החלבון HCP1 או heme carrier protein 1, שהתגלה בתאי האנטרוציט בתריסריון על ידי Shayghi וחב' התפרסם ב-Cell בשנת 2005.
בתוך הגוף מוצא הברזל דרכו אל תאי היעד שלו כאשר הוא נישא על פני החלבון טרנספרין הנקשר אל קולטנים ספציפיים, עובר אנדוציטוזיס אל תוך הציטופלזמה בתוך בועיות (vacuoles), וכאשר ה-pH בבועיות נעשה חומצי, משתחרר הברזל לציטופלזמה ונאגר בהיקשרו לפריטין. מקרופאגים ממחזרים ברזל הקשור ל-heme בהמוגלובין המשתחרר מתאי דם אדומים מזדקנים, לאחר שנבלעו והומסו בתוך מקרופאגים. מיצוי הברזל מתוך ה-heme, מסתייע באנזים heme oxygenase. תאים שונים כגון הפטוציטים, מקרופאגים במערכת ה-RES ואנטרוציטים בתריסריון מסוגלים לשחרר ברזל לפלזמה בדרך היחידה הידועה עד כה, והיא על ידי החלבון הטרנס-ממברנאלי ferroportin. נמצא ש-hepcidin גם מעכב טרנספורט של ברזל אל מחוץ למקרופאגים, כך שבמצבים של רמות גבוהות של hepcidin (כולל מצבי דלקת) רמת הברזל בנסיוב נופלת כיוון שהברזל נותר כלוא בתוך מקרופאגים. מחקרים של Knuston וחב' שהתפרסמו ב-2005 ב-Proc Natl Acad Sci, בעכברי knock-out מסוג fpn-Null/Null), בהם פגום הגן SLC40A1 המקודד ל-ferroportin, באופן שהחלבון האחרון חסר לחלוטין, הוכיחו את חיוניותו של חלבון זה בהוצאת ברזל מתוך מקרופאגים, בהוצאת ברזל מתאים אנטרוציטים במעי ומהפטוציטים בכבד, ובהעברת ברזל מהאם לעובר דרך תאי השליה, כאשר בכל אלה יש למעשה שחרור ברזל לפלזמה.
מעניין שהגלגול הסופי של ferroportin כחלבון ממברנאלי שתפקידו מרכזי בהוצאת ברזל אל מחוץ לתאים האוגרים אותו, עבר גלגולים רבים. בזמנו הוא זוהה בתאי אנטרוציט במעי כ-MTP1 או metal transporter protein-1, ומאוחר יותר התברר שחלבון זה מתבטא גם בתאים של המערכת הרטיקולו-אנדותליאלית, בטחול, בכבד ובמח העצם. התברר על ידי Yang וחב' במאמרם משנת 2002 ב-J Biol Chem, שניתן היה בתאים בתרבית שטופלו על ידי transfection, לבטא ביֶתֶר את החלבון MTP1, ולהראות שתאים אלה מפרישים באופן מוגבר ברזל תוך-תאי, כאשר רמת הפריטין קושר הברזל בציטופלזמה של תאים אלה התדלדלה, וממילא גם רמת הברזל התוך-תאי עצמו. בשנת 2000 זוהה בתאי התריסריון על ידי McKie וחב' חלבון שכונה על ידם IREG-1 או iron regulated transporter-1, שייחסו להתבטאות המוגברת שלו במנגנון הספיגה המרובה של ברזל בהמוכרומטוזיס. בהמשך התברר ש-MTP-1 ו-IREG-1 הם למעשה החלבון המוכר כיום כ-hepcidin.
הוצאת ברזל מתוך האנטרוציטים אל מחזור הדם תלויה לא רק ב-ferroportin, אלא אף בחמצון הברזל לצורה התלת-ערכית שלו, על ידי אנזים בעל פעילות של ferroxidase דוגמת החלבון נשא הנחושת-צרולופלזמין. יש להניח שיותר מאנזים אחד קשור לחמצון האמור של ברזל בתאי המעי, ודוגמה לאנזים כזה היא hephaesin, שהוא חלבון טרנס-ממברנאלי שהגלה על ידי Petrak וחב' בשנת 2005 במאמרם ב-Int J Biochem Cell Biol, בעקבות מחקרם על אנמיה בעכברים הידועה כ-SLA או Sex linked anemia, הנגרמת ממוטציה ב-hephaesin. בעכברים אלה עם חסר ברזל ואנמיה מיקרוציטית היפוכרומית, ספיגת הברזל מהמזון במעי תקינה, אך יציאת הברזל מהאנטרוציטים פגומה מחוסר יכולת לחמצן את הברזל התוך-תאי, על מנת שיוכל להיקשר בצורתו התלת-ערכית לטרנספרין בדם.
מנגנון הפעולה של hepcidin
למעשה רק משנת 2004 החל מתברר על ידי Nemeth וחב' במאמר ב-Science, מנגנון הפעולה של hepcidin. חלבון פפטידי זה נקשר ישירות ל-ferroportin הטרנס-ממברנאלי וגורם לאחרון להיות מופנם אל תוך הציטופלזמה, שם הוא נקלט אל תוך בועיות הליזוזום ומתפרק שם. בניסוי קלאסי בודדו חוקרים אלה שורת תאים יציבה (HEK293-Ffn) בה ניתן היה להשרות יצירה של חלבון כלאיים, Ffn-GFP, שהוא למעשה ferroportin אליו קשרו חלבון פלואורסצנטי (green fluorescent protein), מה שמאפשר מעקב מיקרוסקופי על מיקומו הממברנאלי של ferroportin. הוספת hepcidin בריכוז של 0.1 מיקרומולר לתאים אלה, הביאה לשינוי דרמטי במיקומו של ferroportin, באופן שהצביעה הפלואורסצנטית נעלמה מקרומי התאים והתרכזה בבועיות הציטופלזמטיות. סימון של hepcidin בעזרת יוד רדיואקטיבי (I-125) והדגרתו עם התאים היוצרים ferroportin המצומד ל-GFP שלאחריו מוצו חלבוני תאים אלה והופרדו באלקטרופורזה, הביא להדגמה ישירה של הזיקה, והקשר בין hepcidin ו-ferroportin. ראוי לציין שהרחקת hepcidinמהתאים, לא הביאה לנדידה של ferroportin בחזרה מהציטופלזה אל ממברנת התאים, מה שמדגיש את ה"חד כיווניות" של הרחקת חלבון זה בהשפעת hepcidin ממברנת התארים אל הלילזוזום בו הוא למעשה נהרס. חשוב גם להדגיש שהשפעה זו בשיבוש פעולת ferroportin הושגה עם hepcidin טבעי שהופק משתן, ובאותה מידת יעילות גם עם פפטיד זה שסונתז במעבדה, עובדה בעלת חשיבות בכל שיקול עתידי של שימוש ב-hepcidin סינטתי.
ממצא מעניין נוסף המרמז על השפעת hepcidin על יכולת האגירה של ברזל בציטופלזמת התא באופן שעשוי לעכב הפרשתו לדם, נובע מניסויים בתרבית תאים. כאשר מטפלים בתאי HEK293-Ffn אך גם בשורת תאים של מקרופאגים מסוג J774 בחומר ferric ammonium citrate, מושרית בהם התמעטות של החלבון הציטופלזמי קושר הברזל פריטין. לעומת זאת, הוספה של hepcidin לתאים המטופלים האחרונים, משרה בהם הגברה מחודשת של רמת פריטין, באופן שמגדיל כמובן את יכולת הקישור והאחסון של ברזל בתאים אלה. כאשר מביאים בחשבון את נפיצותו של החלבון "המייצא" ברזל מהתאים-ferroportin, בתאים אנטרוציטים בתריסריון, במקרופאגים ובהפטוציטים בכבד, ניתן לייחס להשפעת hepcidin על ferroportin משקל מכריע בהומאוסטאזיס של ברזל. כאשר מאגרי הברזל תקינים או מוגברים, הכבד מייצר יותר hepcidin הנע בדם אל המעי הדק, ונקשר אל ה-ferroportin הממוקם בממברנה הבאזו-לטראלית של האנטרוציטים, ובכך חוסם מעבר ברזל מתאים אלה לטרנספרין בפלזמה. תוך יום או יומיים, נושרים האנטרוציטים שטווח חייהם קצר אל תוך המעי, ומופרשים אל מחוץ לגוף על תכולת הברזל שבתוכם. לעומת זאת, כאשר מאגרי הברזל נמוכים, מדוכא ייצור hepcidin בכבד, מולקולות ה-ferroporin מתפקדות במלואן בממברנת האנטרוציטים ומשחררות את תכולת הברזל הנספג במעי אל הטרנספרין שבזרם הדם.
תפקידו המרכזי של hepcidin במשק הברזל בגוף:
משמעות קלינית של פעולת hepcidin
מידע מעניין קושר באופן מנגנוני את hepcidin לפחות לשני מצבים קליניים מנוגדים, בהם חל שיבוש במאזן הברזל בגוף: מצבי עודף ברזל כגון הֶמוֹכרומטוזיס תורשתית לצורותיה, בה יש ספיגה מופרזת של ברזל במעי, ריווי החלבון הנשא טרנספרין, והופעת משקעי ברזל רעילים בכבד, במפרקים וברקמות חיוניות אחרות, מוטציות בגן חיוני כגון HFE, ובחלבונים TfR2 ו-HJV, גורמות דווקא לדיכוי ביצירת hepcidin. בצורה נוספת של המוכרומטוזיס הידועה כמחלת ferroportin, למרות שיצירת hepcidin בכבד במחלה זו אינה מדוכאת, הוא אינו מבטא פעילותו, שכן מפגע זה נגרם כתוצאה ממוטציות בחלבון ferroportin, המונעות התקשרות hepcidin לחלבון היעד שלו בממברנות התאים, וכך לא ניתן להוציא ברזל מתאים אלה.
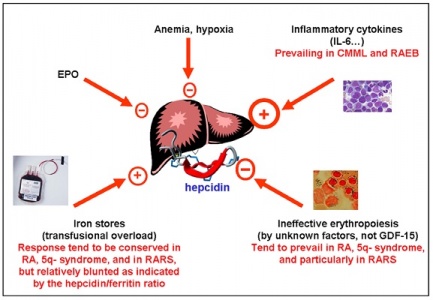
Hepcidin נכרך גם עם מכלול מצבים הידועים כ"אנמיה בעקבות דלקת", בה נגרמת hypoferremia משמעותית לאחר מצבי אלח-דם, או אף מצבי דלקת כרונית, מחלות ראומטיות, ואף בממאירויות אחדות. חוסר ברזל זה מביא ליצירת אנמיה מתמשכת שאינה מגיבה לעתים תכופות לטיפול באריתרופויאטין. במצבים אלה נמצא שיש דווקא השריית סינתזה מוגברת של hepcidin בכבד, לעתים אף עד פי-100 ומעלה מהמקובל, מה שעלול לגרום לירידה משמעותית ברמת הברזל בגוף. תיתכן בעתיד גישה טיפולית בהחדרת hepcidin סינתטי לגוף, כדי לעודד הגברת רמות ברזל במקרי חסר, או לחילופין טיפול באנטגוניסטים של hepcidin לדיכוי פעילות מוגברת שלו.
הגילוי המאוחר יחסית של hepcidin על ידי Ganz, הבהיר בדיעבד עד כמה פעולתו חיונית לסוגיות מרכזיות במאזן הברזל בגוף. אולי זה אף לא מפתיע שכאשר פורסם לראשונה על בידוד החלבון hepcidin בשנת 2000 ב-FEBS lett משתן של בני אדם, ההתייחסות אליו הייתה כאל חלבון הנוצר בכבד שהוא בעל תכונות אנטי-בקטריאליות וכן שהוא פועל נגד שמרים, ומכאן אף נגזר שמו המקורי LEAP-1 או liver-expressed antimicrobial peptide, אשר הוסב שנה לאחר מכן ל-HepCidin (או משמיד חיידקים שמקורו הפאטי).
כבר ב-2001 התפרסם מחקרם של Nicolas וחב' ב-Proc natl Acad Sci, שקשרו לראשונה את hepcidin עם וויסות ספיגת ברזל מהמעי ואגירתו במקרופאגים. ממצא אחרון זה התגלה באקראי במהלך מחקר בזן עכברים טרנסגניים, -/-Usf2, בהם מתרחשת מוטציה בגן המקודד לגורם השעתוק USF2, הקשור לוויסות גנים בכבד, שתלוי בגלוקוזה. במהלך מחקר זה התברר שעכברים מוטנטיים אלה אוגרים כמויות גדולות של ברזל ויסצראלי, שרמת הברזל בדמם עולה על הקיבול של החלבון קושר הברזל-טרנספרין, וכך ברזל חופשי מסתנן מהדם לרקמות שונות, ומצטבר בעיקר בככד, בבלוטת הלבלב, ואף בלב.
בהשוואה לעכברי wild type, דווקא בטחול של עכברי -/-Usf2, נמדדה כמות זעומה של ברזל. ממצא בלתי צפוי של שיבושים במאזן הברזל, הביא לניסיון לזהות את הגנים שגרמו לפגיעה כה משמעותית בהומאוסטאזיס של ברזל בעכבר האמור, תוך השוואה של המטען הגנטי בתאי כבד בעכבר הפגום לעומת עכברים תקינים.
כך בודדו Nicolas וחב' עותק של cDNA, המקודד אמנם לפפטיד hepcidin שבודד מן השתן של בני-אדם, ואשר רצף חומצות האמינו שלו פוענח באותה עת. נמצא כמו-כן שרמת mRNA של hepcidin והסינתזה של חלבון זה בכבד, עולות משמעותית בעכברים בהם נוצר באופן ספונטאני מצב של רמת-יתר של ברזל, או שמצב זה הושרה בהם על ידי Pigeon וחב' במחקרם שהתפרסם בשנת 2001 ב-J Biol Chem. ראייה ישירה יותר למשמעות הקריטית של hepcidin בהומאוסטאזיס של ברזל בגוף, ניתנה על ידי Nicolas וחב' בשנת 2002, על ידי יצירת עכבר טרנסגני המייצר בכבד hepcidin בעודף: הסתבר שעכברים אלה נולדו חיוורים ביותר כתוצאה מאנמיה חריפה על רקע של חסר ניכר של ברזל, ומתו סמוך ללידתם, ממצא שהתפרסם ב-Proc Natl Acad Sci.
מאמר נוסף של Rivera וחב' שהופיע ב-Blood ב-2005, על הקשר בין hepcidin לרמת ברזל בגוף במחקר המצוטט, היה שעכברים עם שאת סרטנית של תאים יוצרי hepcidin כגון אדנומה של הכבד, סבלו מרמת חסר של ברזל, ופיתחו אנמיה למרות שהוזנו בדיאטה עתירה בברזל. ממצאים אלה חיזקו את ההערכה שיותר מאשר hepcidin פעיל כחלבון הגנתי להשמדת חיידקים, יצירתו בכבד מתגברת בעיקר במצבי חסר ברזל, ומכאן החל מתברר הקשר של חלבון זה למאזן וחילוף החומרים של ברזל בגוף.
על מעורבות hepcidin במפגעי מאזן הברזל
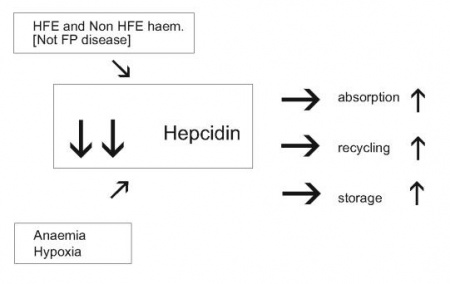
מחלת עומס ברזל (המוכרומטוזיס תורשתית) מתבטאת בספיגה מופרזת של ברזל במעי, ריווי אתרי הקישור לברזל בטרנספרין, ומשקעי ברזל חופשו ורעלני באיברים חיוניים, הגורמים לצמקת הכבד, נזק למפרקים, הרס בלוטות אנדוקריניות ונזק לשריר הלב. ארבע צורות של המחלה ידועות: Type I, השכיחה ביותר באוכלוסיה הלבנה ממוצא אירופאי, נגרמת ממוטציות בגן HFE ומשפיעה בעיקר על אנשים בגיל מתקדם. המוכרומטוזיס Type II, המופיעה בגיל הנעורים, היא צורת מחלת אגירת הברזל החמורה ביותר עם מוטציות בחלבון HJV או hemojuvelin, שהוא ווסת של יצירת hepcidin. סוג שלישי נדיר יחסית של המוכרומטוזיס, Type III, נובע ממוטציות בקולטן מסוג 2 של טרנספרין, TfR2, נחשב חמור יותר והוא מתבטא באגירה מרובה של ברזל בכבד. המוכרומטוזיס Type IV, הידועה גם כמחלת ה-ferroportin, בה המוטציות התגלו בחלבון זה, והיא מתאפיינת באגירת ברזל בעיקר במקרופאגים, בניגוד לצורות המוכרומטוזיס האחרות בהן הברזל נאגר בעיקר בהפטוציטים ותאי פרנכימה אחרים בכבד.
מעניין שבשלושת הסוגים הראשונים של המוכרומטוזיס רמת hepcidin נמוכה בצורה משמעותית, כאשר במחלת הנעורים Type II מדוכא ייצור hepcidin באופן מוחלט, וזאת למרות שהיה צפוי לכאורה שבמצבי אגירת-יתר של ברזל, תהיה רמת ברזל מוגברת בתגובה, על מנת להביא לתיקון והפחתה של עודף הברזל. לעומתם, במחלת ferroportin, דווקא נמדדה עליה צפויה ברמת hepcidin, אלא שפעילותו הביולוגית של האחרון לא באה לביטוי בשל המוטציות בחלבון ferroportin, שחוסמות את יכולת הקישור בין השניים כפי שמדגים Schimanski ב-Blood ב-2005.
אכן, ההטרוגניות של מוטציות בגן SLC40A1 המקודד ל-ferroportin, יכולה להתבטא בהגברת היכולת של חלבון ממברנאלי זה "לייצא" ברזל מהתאים, אך גם באיבוד יכולת זו. במוטציה כגון 162delVal, בה נשמטת חומצת האמינו valine מעמדה 162 של רצף החלבון ferroportin, נותר חלבון פגום זה בציטוזול של התאים בלי שהוא מצליח להגיע לממברנה החיצונית שלהם, ובכך בא לביטוי איבוד פעילותו. מוטציות מסוג אחר דווקא הופכות את ה-ferroportin הטבוע בממברנה לעמיד בפני פעולתו של hepcidin, ולפיכך פעולתו בהגברת ייצוא ברזל מהתאים גוברת באופן מוגזם, כפי שהדגים Camaschella ב-Blood ב-2005.
מחקרים של Nemeth ו-Ganz שסוכמו ב-2006 ב-Ann Rev Nutr, הראו שבני אדם עם המוכרומטוזיס משלושת הטיפוסים I, II ו-III, ובעכברים טרנסגניים עם תסמונות אגירת ברזל בהם הושרו מוטציות בגנים HFE, HJV ו-TfR2, בהתאמה, מוטציות אלה הביאו להפחתה משמעותי בסינתזת hepcidin. בייחוד בולטת עובדה זו עם הגן HJV המווסת ישירות את ביטוי hepcidin, ומונע הפחתת רמת הברזל המופרש מתאי אגירה שלו, כפי שדיווח Roetto ב-2003 ב-Nat Genet.
עניין רב מגלים החוקרים בפרק הזמן הקצר שחלף מאז גילוי hepcidin, שמביא לשפע תיאוריות על מנגנון פעולתו. כך למשל הוצע שדרך אחת לוויסות פעולת hepcidin, היא על ידי אחדים מהחלבונים המהווים את משפחת חלבוני העצם המוֹרפו-גנטיים, ה-BMPs. עשרים חלבוני BMP הם למעשה ציטוקינים השייכים למשפחת העל של TGF-β, והם פועלים על ידי התקשרות ל-2 סוגי קולטנים של האנזים (serine/threonine kinase (I & II, ובכך משרים את הזרחון של חלבוני Smad, המשרים את יצירתם של הֶטֶרוֹ-דימרים הנודדים לגרעין התא, ומשפעלים את השעתוק של חלבונים שונים. מסתבר שבעכברים, חלבוני BMP שמספריהם 2, 4 ו-9 המשרים את הביטוי של hepcidin באופן יעיל, והם אף בעלי פוטנציאל שפעול של סינתזת hepcidin שהוא בלתי תלוי בגנים HFE ו-TfR2, אשר מוטציות בהם גורמים כאמור לשתיים מהצורות העיקריות של המוכרומטוזיס כפי שפרסם Truska ב-2006 ב-Proc Natl Acad Sci. כמו כן הודגם ב-2006 על ידי Babitt ב-Nat Genet, שבמחלת המוכרומטוזיס של גיל הנעורים (Type II), בה יש מוטציה בגן HFE2 המקודד ל-hemojuvelin, נמצא שחלבון אחרון זה הוא חבר במשפחה המורחבת של קולטנים לחלבוני BMP. מוטציה ב-hemojuvelin פוגעת בכושר האיתות (signaling) של חלבוני BMP ובכך מופחת ייצורו של hepcidin בתאי הכבד.
טבלה של הפסידין ומפגעי ברזל Disorder Genes mutated Hepcidin Hereditary hemochromatosis (hepcidin deficiency) HFE, TfR2, HJV, hepcidin Low or inappropriately normal, despite iron load Hereditary hemochromatosis (hepcidin resistance) Ferroportin High, reflects iron load, rare Ferroportin disease Ferroportin Insufficiently studied Iron-refractory iron deficiency anemia TMPRSS6 High or inappropriately high normal, despite iron deficiency Hypotransferrinemia Transferrin Low unless transfused with plasma β-Thalassemia intermedia β-Globin Low unless transfused Chronic hepatitis C, alcoholic liver disease Decreased Anemia of inflammation High or inappropriately normal, despite anemia and hypoferremia Anemia of chronic kidney diseases High or inappropriately normal, despite anemia and hypoferremia
β-תלסמיה ו-hepcidin
β-תלסמיה היא אחת האנמיות המולדות השכיחות ביותר, הנובעת מחסר חלקי בסינתזה של β-גלובין. ספיגה מרובה של ברזל היא אחד המאפיינים של β-תלסמיה, מה שעלול לגרום לתחלואה תמותה. אנליזה מחזורית של עכברים עם β-תלסמיה, מצביעה על כך שרמות המוגלובין קטנות לאורך זמן, ובמקביל רמות ברזל בכבד, בטחול ובכליות, גדלות באופן בולט. הגברה זו ברמת הברזל כרוכה עם רמות hepcidin נמוכות, ואכן נמצא שרמות hepcidin נמוכות בבני-אדם עם β-תלסמיה. ממצאים אלה הביאו להשערה שבמחלה זו יותר מדי ברזל נספג בגוף, ממה שנדרש לאריתרופויזה, ולאפשרות שהגברת רמת hepcidin בחולים אלה עשויה להיות בעלת השפעה ריפויית, בהקטינה את ההצטברות העודפת של ברזל. השערה זו מהווה תמריץ ליצירה של תכשירים אגוניסטים של hepcidin.
התבטאות hepcidin במצבי אנמיה כתוצאה מדלקת
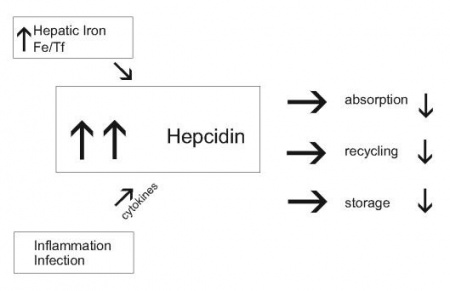
ישות קלינית שכיחה אחרת היא אנמיה המתפתחת כתוצאה ממצבי דלקת כרונית כמו במחלות ראומטיות, דלקות מעיים, מיאלומה נפוצה, וממאירויות אחרות, אך גם לאחר ימים אחדים של אלח-דם, ומתאפיינת על ידי רמה נמוכה של ברזל בדם, ירידה ברמת ברזל הקשור לטרנספרין, הגברה ברמת פריטין ואגירת ברזל במקרופאגים במח העצם. ההוכחה הראשונה שהתרחיש הידוע כ-anemia of inflammation, הגיעה ממעבדתה של Nancy Andrews בבוסטון, שבחנה שני מטופלים עם גידולים בכבד ואנמיה מיקרוציטית חמורה שלא הגיבו לתוספי ברזל. נמצא שהגידול בכבד ייצר hepcidin בעודף רב, והסרת הגידול במטופלים אלה הביאה לריפוי האנמיה.
מחקרים של Andrews משנת 2004 ב-J Clin Invest, מצביעים על כך שציטוקינים הנוצרים במצבי דלקת, ובעיקר IL-6, משרים בכבד יצירה מוגברת של mRNA של hepcidin, וממילא הגברה ניכרת ביצירת hepcidin הבאה לביטוי בהפרשה ניכרת של פפטיד זה בשתן. לאחרונה הודגם שפעולת IL-6 המשרה יצירת hepcidin בתגובה לתהליך דלקתי, מתרחשת לאחר התקשרות ציטוקין זה לצבר של קולטן α שלו וכן ל-gp130. התקשרות זו מחישה את הזרחון של משפחת חלבוני STAT או signal transducers and activators of transcription, ובעיקר את הזרחון של STAT3.
הזרחון של שייר טירוזין 705 ב-STAT3, מחיש את חדירתו של האחרון אל גרעין התאים, שם הוא מווסת את השעתוק של גנים רבים, ובתוכם הגן של hepcidin. ראוי לציין ש-Rivera וחב' מדדו בשתן של מטופלים עם אלח-דם חריף בהם התפתחה אנמיה, ומצאו בו רמות hepcidin שהיו גבוהות פי-980 מערכי הבסיס שלו בשתן. Beutler וחב' הדגימו בהפטוציטים של עכברים שגם ציטוקינים כמו IL-1α ו-IL-1β מעודדים באופן פעיל סינתזה של hepcidin, כאשר IL-10 הוא בעל השפעה זניחה, ואילו אינטרפרון-β אף מעכב יעיל של סינתזת hepcidin. עכברים המוזרקים עם האנטיגן הבקטריאלי LPS, ואף דגים הסובלים מהדבקה מסיבית בחיידקים, מגיבים ביצירה מוגברת של hepcidin בכבד.
באנשים עם אנמיה בעקבות דלקת, מוצאים רמות hepcidin גבוהות במיוחד, וכך נגרם להם חסר של ברזל שכן עודף hepcidin מעכב שחרור ברזל מהמקרופאגים הממחזרים אותו, מהפטוציטים בכבד האוגרים אותו, וכן נמנעת ספיגת ברזל מהמזון על ידי האנטרוציטים במעי. כיוון שרוב הברזל בפלזמה מיועד למח העצם, מצב של hypoferremia מקטין את כמות הברזל הזמין לסינתזה של המוגלובין ולהבשלת כדוריות דם אדומות. ידוע אגב, שעודף IL-6 כרוך בדרך כלל במצבי אנמיה כמו באנשים המטופלים באופן ניסויי ב-IL-6, או עכברים טרנסגניים המבטאים IL-6 בעודף. העובדה שיצירת hepcidin בכבד מושרית יותר על ידי IL-6 ולא על ידי TNF-α, מביאה להגדרתו של hepcidin כ-acute phase protein type II, בתגובה למצב של הדבקה חריפה או אף בדלקת כרונית.
נראה אם כן שהגברת יצירת hepcidin במצבי דלקת, והיכולת של hepcidin שיצירתו מוגברת בעכברים טרנסגניים, או כתוצאה מהתרחשות סרטנית, לדכא יצירת כדוריות דם אדומות כתוצאה ממחסור בברזל, מצביעים על פפטיד זה כגורם מרכזי בתרחיש של אנמיה כתוצאה מדלקת. מוקדם עדיין לנבא האם טיפול עתידי על ידי תכשירים המנטרלים או מעכבים את פעילות hepcidin, עשוי למנוע את תופעות חסר הברזל במצבי דלקת או החולים אונקולוגיים.
השריית ייצור-יתר של hepcidin בכבד במצבי דלקת המשפיעה בכיוון של הופעת אנמיה, אינה עומדת בסתירה לדיכוי יצירתו של hepcidin במצבי אנמיה ממושכת, או כתוצאה ממצבי חסר חמצן (hypoxia) ברקמות. אנמיה המושרית בעכברים על ידי דימום ממושך, או על ידי תמס-דם כתוצאה מטיפול עם פנילהידראזין (PHZ), גרמה לירידה משמעותית ברמות mRNA של hepcidin. בדומה, בעכברים ששהו שעות אחדות בתאים היפובאריים בדרגת חמצן נמוכה של 2%, או בחולדות שנחשפו משך 30 יום לרמת חמצן מופחת של 10%, נמצא דיכוי של יצירת hepcidin, מה שמאפשר ספיגה מוגברת של ברזל מהמזון, שחרור מואץ של ברזל ממקרופאגים ומהפטוציטים, מה שמסייע לתהליך המתבקש של אריתרפויאזה. פעילות hepcidin אחראית באופן חלקי לחסר ברזל בדם שמוצאים ב-IBD, בכשל כרוני של הלב, בקרצינומות, בדלקת שגרונתית של המפרקים, ובכשל של הכליות.
Hepcidin, שרמתו מופחתת במצבי חסר ברזל, ולכן מדידת רמתו בדם או בשתן, עשויה לאפשר הערכת הדרישה לברזל, ולספק מדד יעיל של חסר פיזיולוגי של ברזל, כפי ששיערו Kemna וחב' בשנת 2008 ב-Hematologica. מצבים קליניים אחדים מחייבים מדידת רמת hepcidin, כולל אבחון של אנמיה של מחלות כרוניות. אנמיה הקשורה למחלת כליות כרונית ודיאליזה, לתרחיש של המוכרומטוזיס, ולחסר ברזל אידיופאטי. יחד עם זאת, ההתלבטויות לגבי שיטה מדידה זמינה ומדוייקת למדידה שגרתית של hepcidin בעשייה הקלינית, הביאו לעיכוב בקביעת תחומי נורמה, ולא נקבעו עד לאחרונה דרגות הרגישות והספציפיות של ערכי-סף שונים של hepcidin בנסיוב, לאבחון חסר ברזל.
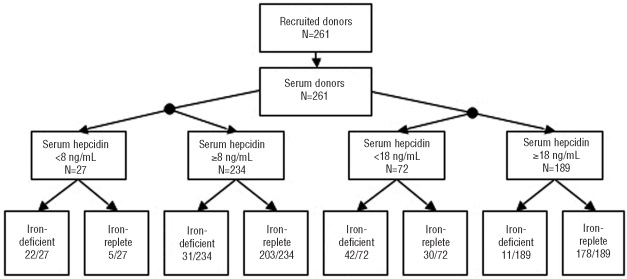
אחת האוכלוסיות המועדות לחסר ברזל, היא זו של נשים בגיל הפוריות, מה שהביא את Ganz ו-Nemeth לסקור נשים צעירות יחסית, לא-אנמיות ובמצב בריאותי תקין, לנסות ולאתר חסר ברזל בגישה של מדידת hepcidin. במחקרם שפורסם בשנת 2011 ב-Hematologica, נמדדו רמות hepcidin בשיטת ELISA, במקביל לרמת פריטין, רמת sTfR ורמת CRP כמדד לדלקת. חסר ברזל הוגדר כרמת פריטין הנמוכה מ-15 ננוגרם/מ"ל, ויחס (sTfR/log(ferritin גדול מ-3.2 אם רמת CRP נמוכה מ-10 מיליגרם/ליטר, או יחס גדול מ-2.2 אם רמת CRP הייתה גבוהה מ-10 מיליגרם/ד"ל.
במחקר נבדקו 261 דגימות דם, בהם נמצא חוסר ברזל המוגדר על ידי רמת פריטין ב-59 מתוך 261 הדגימות, וחוסר ברזל המוגדר על ידי היחס sTfR/log(ferritin) נמצא ב-53 מתוך 261 הדגימות. רמת פריטין בנבדקים עם רמת עודף של ברזל נקבעה בתחום הריכוזים הרחב שבין 8.2-199.7 נוגרם/מ"ל. לאבחון חסר ברזל המוגדר על ידי היחס (sTfR/log(ferritin, רמת hepcidin שמתחת ל-8 ננוגרם/מ"ל, הייתה בעלת רגישות של 41.5% וספציפיות של 97.6%, ואילו לרמת hepcidin שמתחת ל-18 ננוגרם/מ"ל, הייתה בעלת רגישות של 79.2% וספציפיות של 85.6%. סיכום של מחקר זה ניתן בתרשים:
רמת hepcidin בנסיוב במצבים של מפגעי ברזל
בהתאמה עם מדידות קודמות של רמות hepcidin בשתן שבוצעו על ידי Piperno וחב' והתפרסמו ב-Blood ב-2007, רמת hepcidin בנסיוב הייתה נורמאלית באופן בלתי צפוי במצבים של עודף ברזל, ונמצאה נמוכה כצפוי במטופלים עם מצבים של רמת ברזל נמוכה (אלה עם הצורה הבוגרת של המוכרומטוזיס תורשתית כתוצאה ממוטציות בגן HFE). רמת hepcidin בנסיוב נמצאה נמוכה במטופלים עםjuvenile hemochromatosis כתוצאה ממוטציות בגן של hemojuvelin. כצפוי, רמות hepcidin היו נמוכות באופן שאינו ניתן לגילוי ב-18 מתוך 19 מטופלים עם חסר ברזל (פריטין נמוך מ-10 ננוגרם/מ"ל). רמות hepcidin היו מוגברות באופן משמעותי במטופלים עם מצבי דלקת (CRP גדול מ-10 מיליגרם/ד"ל). במטופלים עם multiple myeloma המתאפיינת על ידי ייצור מוגבר של IL-6, ציטוקין המשרה הגברה ביצירת hepcidin, וגם במטופלים עם מחלת כליה כרונית נמצאו כצפוי רמות hepcidin מוגברות בנסיוב.
מחקר בהיקף גדול למדידת רמות hepcidin בנסיוב בשיטת ELISA התבצעה ב-Nijmegen, הולנד, בקרב 2,998 תושבי העיר, בריאים וחולים, כאשר בכל נבדק התבצעו גם מדידות של פרמטרים הקשורים לברזל, תפקודי כבד, קראטינין ו-CRP. תוצאות מחקר זה שהתפרסמו בשנת 2011 ב-Blood על ידי Galesloot וחב', הביאו למספר מסקנות מעניינות: רמות hepcidin בנסיוב היו נמוכות יותר בממוצע בנשים בגיל הפוריות (7.4 ננוגרם/מ"ל) בהשוואה לנשים בגיל המעבר (15.4 ננוגרם/מ"ל). רמות hepcidin בגברים היו לעומת זאת יציבות עם עליית הגיל, עם רמה ממוצעת של 14.1 ננוגרם/מ"ל. רמות hepcidin נמצאו במתאם חזק עם רמות פריטין בגברים (r=0.78) ובנשים (r=0.83). לגבי פרמטרים אחרים כמו CRP, רמת TIBC, רמת ALT, ו-GFR, נמצא מתאם פחות חזק עם רמת hepcidin.
שיטות מעבדה לכימות רמת hepcidin בנוזלי גוף
כימות hepcidin נתקל מאז גילוי המולקולה בשנת 2000 בקשיים: למולקולה יש נטייה לעבור צימות עם מולקולות hepcidin אחרות, וכן להיספח למשטחי פלסטיק במעבדה. כמו כן התעוררו קשיים להכין בארנבות או בעכברים נוגדנים כנגד hepcidin, זאת כיוון שהמולקולה קטנה וקומפקטית במיוחד. בנוסף, hepcidin הוא חלבון שעבר שימור אבולוציוני מרשים וההומולוגיה ברצף חומצות האמינו גבוהה ביותר בין המינים השונים. לפיכך, המולקולה אינה אימונוגנית במיוחד, וקשה לקבל כנגדה נוגדנים. בנוסף, 2 נגזרי hepcidin, הלא הם Hep20 ו-Hep22 המופיעים בשתן, אמנם אינם בעלי תפקיד במטבוליזם של ברזל, אך הם עלולים להפריע במדידות של Hep25 כיוון שהנוגדנים ל-Hep25 נקשרים גם ל-2 הנגזרים הקטנים יותר.
כבר בשנת 2000 בודדו Krause וחב' Hep25 מדגימות דם של בני-אדם, בשיטת mass spectrometry. שנה לאחר מכן Park ו- Ganz בודדו משתן Hep25 ו-Hep20 תוך שימוש בהפרדה על עמודה של מחליף קטיונים, ו-reverese-phase HPLC. ב-2004 פרסמו Ganz ו-Nemeth ב-Science שעדיף לכמת hepcidin בשתן, כיוון שריכוזי חלבון זה בדם נמוכים מסף הרגישות של רוב השיטות, זאת כיוון ש-hepcidin מתפנה בקלות לשתן, כאשר בדם הוא נקשר בקלות ל-ferroportin ונקלט לתוך תאים. ההתפנות של hepcidin בשתן היא או כיוון שאינו עובר באופן פיזיולוגי ספיגה מחדש באבוביות הכליה (overflow), או כתוצאה מספיגה מחדש פחות יעילה במצבי דלקת כרונית. Kemna וחב' פרסמו ב-Blood ב-2005 על שיטת laser desorption/ionization mass spectrometry לכימות hepcidin בשתן, אך שיטה זו אינה יעילה באלה עם anuria, או באלה העוברים דיאליזה.
שיטה אחרת לכימות hepcidin בנסיוב, פורסמה על ידי Murphi ב-Blood ב-2007, שזו שיטת LC-MS/MS או liquid chromatography tandem MS spectrometry, ואילו Kobold וחב' פרסמו ב-2008 ב-Clin Chem שיטת isotope dilution micro HPLC-tandem MS, אלא שהמכשור והמיומנות הרבה הנדרשת לביצוע שיטות מדידה אלה מונעים את שימושן במעבדות קליניות שגרתיות. בשנת 2009 פרסמו Li וחב' ב-J Pharmacol Toxicol Methods שיטת LC-MS/MS משופרת שעברה validation על ידי ה-FDA. בשלב זה פרסמו Ganz וחב' ב-Blood ב-2008, וכן Ashby וחב' ב-2009 ב-Kidney Int, וגם Zaritsky וחב' ב-2009 ב-Clin J Am Soc Nephrol שיפורים לשיטת ELISA לכימות hepcidin בנסיוב.
שיטת ELISA הביאה לקביעת תחום ערכים של hepcidin של 2-55 ננוגרם/מ"ל בנסיוב של מתנדבים בריאים, לעומת תחום ערכים של 29-254 ננוגרם/מ"ל בגברים מטופלים (ערך ממוצע 112 ננוגרם/מ"ל), ו-17-286 ננוגרם/מ"ל במטופלות (ערך ממוצע 65 ננוגרם/מ"ל). בשיטת Ganz במטופלים עם CKD, רמות hepcidin נעו בין 3.1-153.0 ננוגרם/מ"ל עם ממוצע של 26.5 ננוגרם/מ"ל, במטופלים בדיאליזה רמות הפסידין נעו בין 27.6-158.0 ננוגרם /מ"ל עם ערך ממוצע של 58.5 ננוגרם/מ"ל. כמו כן נמצא בשיטת Ganz שרמת hepcidin בנסיוב הייתה במתאם עם רמות פריטין בנסיוב (r=0.63), מה שמשקף את העובדה ש-2 חלבונים אלה אמנם נקבעים על פי רמת ברזל או מאגריו. רמת hepcidin בנסיוב נמצאה ב-24 מתנדבים בריאים במתאם עם רמתו בשתן (r=0.82).
נמצא שהיציבות של אחסון דגימות הנסיוב בהקפאה בטמפרטורה של מינוס 80 מעלות הייתה מרשימה באופן שרמת hepcidin כתום 6 חודשי הקפאה הייתה נמוכה אך ב-5% לעומת רמת החלבון שנמדד בזמן אמת. רמות hepcidin שנמדדו בנסיוב הראו שינויים יומיים, באופן שרמת החלבון הייתה גבוהה בשעת הצהריים או ב-2000 ונמוכה יותר בשעה 0600-0800. מתן טיפול בתוסף ברזל, הביא לתגובה בעלייה מיידית ברמת hepcidin.
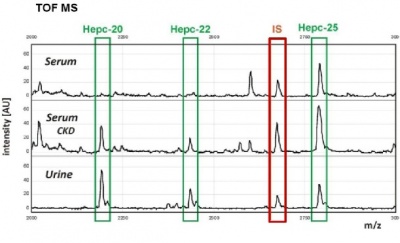
החברה ההולנדית Hepcidinanalysis.com, פיתחה שיטת מדידת hepcidin שהיא שילוב של exchange chromatography עם קטיון חלש ו-time-of-flight mass spectrometry, כאשר אנלוג של hepcidin משמש כ-internal standard לצורך כימות. בשיטה זו נמצאה בשתן של גברים רמת hepcidin ממוצעת בדגימות בוקר של 1.81 ננומול'/מילימול' קראטינין, ובנשים נמצאה רמה ממוצעת של 17.2 ננומול'/מילימול' קראטינין. לעומת זאת, מוצאת חברה זו בנסיוב במדגם של 1,066 גברים בתחום הגילים של 18-85 שנה רמת hepcidin ממוצעת של 8.14 ננוגרם/מ"ל, במדגם של 424 נשים בגיל הפוריות בטווח גילים של 18-54 שנה נמצאה רמת hepcidin ממוצעת של 3.62 ננוגרם/מ"ל, ואילו במדגם של 458 נשים בגיל המעבר בטווח גילים של 55-85 שנה נמצאה רמת hepcidin ממוצעת של 8.87 ננוגרם/מ"ל. להלן תרשימי ההפרדה של Hep-25 בנסיוב, ו-Hep-25, כמו גם Hep-22 ו-Hep-20 בשתן.
הוראות לביצוע הבדיקה
יש להיות בצום של 8-10 שעות לפני נטילת הדם. הדם צריך להילקח במבחנות כימיה עשויות מ-polypropylene (עם פקק אדום או צהוב) או במבחנות פוליפרופילן מכילות הפארין (פקק ירוק). יש להקפיד ליטול דם בכל נבדק בשעות מוגדרות במשך היום, שכן ישנם שינויים ברמת הפסידין (רמת שפל בשעת בוקר מוקדמת ורמת שיא בשעה הצהרים או בערב), ואם יש בדיקות הפסידין מחזוריות בנבדק מסוים יש להקפיד על היצמדות לשעה ספציפית של נטילת הדם בסדרת בדיקות זו. אם הבדיקה אינה מתבצעת בזמן אמת יש להקפיא את הנסיוב/פלזמה בטמפרטורה של מינוס 80 מעלות ולהימנע מהפשרה והקפאה נוספת.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק