הירודין - Hirudin
הופניתם מהדף Hirudin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| הירודין | |
|---|---|
| Hirudin | |
| מעבדה | כימיה בדם |
| תחום | מניעת קרישת דם. |
| יוצר הערך | פרופ' בן-עמי סלע |
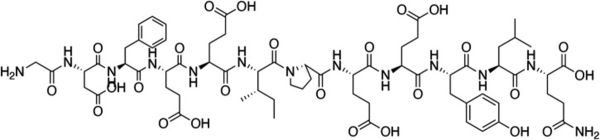
המבנה של הירודין
הירודין הוא פפטיד הנמצא בבלוטת הרוק של העלוקה מוצצת הדם כגון Hirudo medicinalis שיש לו תכונות נוגדות קרישה. זוהי תכונה משמעותית של העלוקות הניזונות מדם, כיוון שהיא מאפשרת לדמו של הפונדקאי לזרום לאחר המגע הראשוני של העלוקה עם העור. הירודין שייך למשפחת העל של מעכבי הקרישה הכוללת גם את hemadin ואת anti-statin.
במהלך שנותיו בבירמינגהם ובאדינבורג, היה John Haycraft עסוק במחקר על קרישת הדם, ובשנת 1884 גילה את העלוקה המפרישה אנטי-קואגולנט שהוא נתן לו את שמו, הירודין, אף על פי שזה לא התגלה עד שנות 1950, ומבנהו התגלה רק בשנת 1976. הירודין באורך מלא מורכב מ-65 חומצות אמינו, המאורגנות כמקטע N-טרמינלי קומפקטי המכיל שלושה קשרים די-סולפידיים, ומקטע C-טרמינלי חסר סדר כאשר הירודין נמצא בתמיסה כפפטיד חופשי (Fenton וחב' ב-Thromb Hemosts משנת 1998, ו-Folkers וחב' ב-Biochemistry משנת 1989). חומצות אמינו 1-3 יוצרות β-גְּדִיל (strand) מקביל עם שיירים 214–217 של תרומבין, ואטום החנקן של שייר #1 יוצר קשר חנקן עם serine-195 באתר הקטליטי של תרומבין. המקטע ה-C טרמינלי יוצר מספר אינטראקציות אלקטרוסטטיות עם אתרים קושרי אניונים של תרומבין, כאשר חמשת השיירים הנמצאים כלולאה הליקלית, יוצרות קשרים הידרופוביים רבים (Haruyama וחב' באותו כתב עת מאותה שנה). הירודין טבעי מכיל תערובת של מספר איזופורמים של חלבון.
שלושה זוגות של קשרים די-סולפידיים בקצה ה-N-טרמינלי של הירודין (Cys16-Cys28 ,Cys6-Cys14 ו-Cys32-Cys39), שיוצרים מבנה קומפקטי שיכול להיקשר לאתר הפעיל של תרומבין. מלבד זאת, הקצה ה-C טרמינלי של הירודין עשיר בחומצות אמינו חומציות, המסוגלות להיקשר לאתר הקישור לפיברינוגן של תרומבין, ובכך לעכב את הפעילות האנטי-תרומבוטית של האחרון (Nowak ב-Pathophysiol Haemost Thromb משנת 2003). בנוסף, רצף ספציפי המורכב מ-Pro-Lys-Pro תואר במרכז השרשרת הפפטידית המסוגל לא רק לסייע ליציבות של הירודין, אלא גם לסייע בקישור המדויק של הירודין לתרומבין (Markwardt וחב' ב-Thromb Haemost משנת 1984). לתרומבין יש תפקיד משמעותי במערכת הקרישה, בהמרת פיברינוגן לפיברין, בייצוב של פיברין, ובהגדלת יצירת פיברין על ידי פקטור XIII המשפעל, וכן פקטור V. בנוסף, הירודין הוא משפעל של טסיות התורמות לתרומבוזיס הנתמך על ידי טסיות ופיברין. עם זאת, הירודין נמצא מכיל פעילות מעכבת של תהליכים אלה (Markwardt ב-Thromb Haemost משנת 1991, ו-Monreal וחב' ב-Drugs Ageing משנת 1996). בשונה מאנטי-קואגולנטים אחרים כגון הפארין וסודיום-ציטראט, הירודין מעכב את פעילות תרומבין ללא סיוע של הקו-פקטור antithrombin III (Dodt וחב' ב-FEBS Lett משנת 1984), ונקשר לתרומבין ביחס של 1:1. בנוסף, הירודין שולל את האפשרות של תרומבין לבקע את פיברינוגן, ובכך נמנעת יצירת פיברין ואת הפילמור של מונומרים של פיברין במסלול יצירת הקריש. בשל היכולת האנטי-תרומבוטית של הירודין, נעשה בו שימוש לטיפול במקרים של CAD חריף, של DVT ושל מחלות תרומבוטיות אחרות (Zoldhelyi וחב' ב-Circulation משנת 1993, Levin ו-Bergqvist ב-Phamcoeconomics משנת 2001)). אך בגלל עלותו הגבוהה, תקופת מחצית החיים הקצרה שלו והסכנה בגרימת דימומים קיימת מגבלה בשימוש של הירודין למטרות קליניות.
הנגזרות של הירודין
לאחר עשרות שנים של פיתוחים, מספר נגזרות נוצלו ומשמשים באופן מוצלח בטיפול במחלות תרומבוטיות, נגזרות דוגמת desirudin, lepirudin ו-bivalirudin. Lepirudin הוא פפטיד בעל 65 חומצות אמינו ומשקל מולקולרי של 6,979 דלטון המסוגל לעכב ישירות את הקישור של תרומבין לאזור הפעיל של פיברינוגן (Greinacher ו-Lubenow ב-Circulation משנת 2001). ההרכב של lepurudin הוא desulfato-hirudin Leu1-Thr2, והפעילות האנטיתרומבינית של lepirudin היא של 18,000ATU/mg. Desirudin הוא גם מעכב ישיר של תרומבין, ויש לו רצף חומצות אמינו דומה לזה של lepirudin, כאשר ההבדל היחיד מופיע בחומצת אמינו ראשונה או שנייה בקצה הN--טרמינלי (Lee ו-Ansell ב-Br J Clin Pharmacol משנת 2011), דהיינו Leu1-Thr2 במקום Val1-Val2 של desirudin. הקישור של desirudin לתרומבין הוא בלתי-הפיך, והפעילות האנטי-תרומבוטית שלו היא 16,000 ATU/mg. נגזרת נוספת של הירודין, bivalirudin, היא פוליפפטיד סינתטי עם משקל מולקולרי של 2,180 דלטון, שיכולה לעכב את הצימות של טסיות. באופן דרמטי, הקישור בין bivalirudin לבין תרומבין הוא הפיך, בעיקר כיוון שהפפטיד אליו נקשרת נגזרת זו, Arg3-Pro4, יכול להישבר בקלות על ידי תרומבין (Scatena ב-Expert Opin Invest Drugs משנת 2000). נגזרת נוספת של הירודין היא hirugen שהוא פפטיד C-טרמינלי של הירודין.
נוצרו מספר נגזרות חדשות של הירודין, בגלל הדרישה הרבה להירודין במחקרים קליניים. כך נוצרו הריקומביננט-RGD של הירודין שהוא פי 2–3 יותר יעיל מהירודין במניעת פקקת וביכולת למנוע צימות טסיות (Mo וחב' ב-J Thromb Thrombolysis משנת 2009), מודיפיקציה של boronphenylalanine של הירודין, neorudin (בעל יכולת אנטי-תרומבינית דומה לזו של הירודין עם סיכון פחות של דימומים (Dong וחב' ב-J Chromatog משנת 2917), annexin V-hirudin-3-ABD המקצר את זמן הדימומים ומאריך את משך השהייה בדם (Han וחב' ב-Int J Pharmaceut משנת 2020), LGPR-hirudin בעל תקופת מחצית חיים ארוכה יותר מזו של הירודין (Zhang וחב' ב-Yao Xsu Ksu Bao משנת 2007), ו-DTIP עם סיכון מופחת של דימומים והשפעה אנטי-תרומבוטית בהזרקה תת-עורית (Zhao וחב' ב-Thromb Haemost משנת 2017, ו-Li וחב' ב-Acta Pharmacol Sin משנת 2020).
במצבים של תסמונת כלילית חריפה, נמצא שהירודין היה יעיל בהפחתת מקרי MI בהשוואה להפארין, אם כי יתרון זה עומעם על ידי הסיכון המוגבר לדימומים בהשוואה לזה המתקבל בטיפול עם הפארין (1.7% לעומת 1.3%). באשר למניעת re-stenosis לאחר תהליך אנגיופלסטי, במחקר שהתבצע בקרב מטופלים עם תעוקת חזה בלתי יציבה, נמצא שהירודין עשוי אמנם להפחית אירועים לבביים בטווח הזמן הקצר, אך אינו יעיל בטווח של 7 חודשים ניסוי GUSTO-IIb או Global Use of Strategies to Open Occluded Coronary Arteris, גייס מטופלים עם תסמונת כלילית חריפה עם או בלי עלייה במקטע ST, שטופלו עם הירודין טבעי או ריקומביננטי. התוצא הראשוני של מוות או של אוטם חוזר לא-קטלני נמצא ב-6.8% מקבוצת הירודין, ו-9.6% בקבוצת ה-unfractionated heparind כעבור 30 יום מתחילת הטיפול, ו-9.5% לעומת 12.3% בקבוצת המטופלים בהירודין לעומת אלה שטופלו עם הפארין, וכן נמצאה הפחתה של 2.2% בתמותה בקרב מאושפזים בין שתי קבוצות הטיפול. כאשר הירודין ניתן כשלעצמו הוא עלול ליצור רגישות-יתר, ובחלק מנגזרותיו נעשה ניסיון למנוע מצב זה. על ידי ביצוע priming של הנבדק עם הירודין במינון של 33 מיקרוגרם/גרם, והזרקת הירודין במינון של 0.08-0.15 מיליגרם/קילוגרם משקל גוף, נמנעה תופעת רגישות היתר. החיסרון העיקרי של הירודין, שהוא נזקק באופן מוחלט לתפקוד הכליות לצורך פינויו מהגוף.
פרמקו-קינטיה של הירודין
מחקרים פרמקוקינטיים של הירודין התבצעו במינים רבים, כולל חולדות ארנבות, כלבים ואדם: בגלל המבנה הפוליפפטידי של הירודין, קשה לקבוע את הריכוז האפקטיבי שלו במתן פומי. לפיכך, הירודין ניתן בדרך כלל בעירוי ורידי, על מנת להשיג זמינות ביולוגית גבוהה. הפרמקוקינטיקה של הירודין בחיות שונות נוטה להיות זהה. לאחר עירוי תוך-ורידי, תקופת מחצית החיים של הירודין נראית כאילו שהירודין מתפזר במהירות מאתר העירוי לאתרים היקפיים (markwardt וחב' ב-Thromb Res משנת 1988, Richter וחב' ב-Int Mag Klin Morphol Blutforsch משנת 1988, ו-Kaiser וחב' ב-Thromb Haemost משנת 1990). בנוסף, פרק הזמן של האלימינציה היה בערך 1 שעה, מה שמצביע על כך שהירודין יכול להיות מופרש במהירות תוך תהליך של מטבוליזם. זאת ועוד, הזמינות הביולוגית של הירודין הייתה כמעט 100% לאחר הזרקה תת-עורית (Nowak וחב' ב-Int Mag Klin Morphol Blutfpotsch משנת 1988). בהשוואה עם העירוי התוך-ורידי זמן מחצית החיים של האלימינציה היה מוארך בחולדות (2.1 שעות) ובכלבים (3.03 שעות). נמצא כמו כן שתקופת מחצית החיים של האלימינציה הייתה ארוכה יותר לאחר מתן הירודין בעירוי תוך-ורידי. כן נקבע במתנדבים בריאים, שהפינוי דרך העליות היווה כ-90% מהפינוי הסיסטמי.
השיבוט של cDNA של הירודין וניקוי של כמויות גדולות של הירודין רקומביננטי אפשרו את הלימוד של אנטי-קואגולנט זה לפרטיו. הירודין מכיל כאמור 65 חומצות אמינו והטירוזין בעמדה 63 עבר סולפציה, אם כי הירודין רקומביננטי אינו מכיל סולפציה זו, מה שגורם לירידה של פי-2 בפוטנציאל שלו, ללא כל ירידה בספציפיות העיכוב של תרומבין. לימוד המבנה של הקומפלקס הירודין-תרומבין על ידי קריסטלוגרפיה עם קרני X, מצביע על כך שהמקטע ה N-טרמינלי של הירודין מגיב עם האתר הפעיל של תרומבין בעמדה serine-195, ואילו המקטע ה-C טרמינלי נקשר ל-exosite 1 הטעון חיובית הקושר אניונים של תרומבין. בעירוי תוך-ורידי של של הירודין, תקופת מחצית החיים שלו היא בערך 40 דקות, והיא מוגברת ל-150–240 דקות בהזרקה תת-עורית. הירודין מתפנה מהגוף בעיקר על ידי הכליות. הירודין מאריך את ה-aPTT בתלות במינון שלו. הזרקה תת-עורית בודדת של הירודין במינון של 0.1 מיליגרם/ק"ג משקל גוף, מאריכה את ה-aPTT פי-2, והוא אינו מאריך את זמן הדימום כאשר הוא מוזרק לאנשים בריאים. בניסויים אקראיים באנשים עם מחלת עורקים כלילית, הירודין מראה ירידה קלה בסיבוכים הכרוכים בתהליך האנגיופלסטי, ללא הגברת הסיכון של דימום (Glusa ב-Kidney Int Suppl משנת 1998, ו-Bates ב- Semin Thromb Hemost משנת 1997). הירודין נמצא מעט טוב יותר מאשר הפארין במניעה של VTE במטופלים העוברים ניתוח להחלפת ראש הירך (Angelli ו-Sonaglia ב-Semin Thromb Hemost משנת 1997). למרות תוצאות מעודדות אלו, מתן הירודין במינונים גבוהים יותר כאשר הם ניתנים בשילוב עם תכשירים אנטי-תרומבוליטיים עלול לגרום לסיבוכי דימום תוך-מוחי מה שאילץ הפסקה מוקדמת של ניסויים אלו עם TIMI9A ו-HIT-III (Antman ב-Circulationn משנת 1994.
פעילות ביולוגית של הירודין
התרחשות מרכזית בשלבים הסופיים של קרישת הדם היא ההמרה של פיבריניגן לפיברין על ידי תרומבין שהוא serine protease. תרומבין מיוצר מפרותרומבין על ידי פעולת האנזים prothrombinase שהוא פקטור Xa עם הקו-פקטור Va. פיברין עובר אז cross linking עם פקטור XIII שהוא פקטור המייצב פיברין ליצירת קריש הדם. המעכב העיקרי של תרומבין בתהליך יצירת פקקת נורמלי הוא אנטי-תרומבין, שבדומה לו הפעילות האנטי-קואגולנטית של הירודין מבוססת על יכולתו לעכב את הפעילות הפרוקואגולנטית של תרומבין. הירודין הוא המעכב הטבעי הפוטנטי ביותר של תרומבין. בניגוד לאנטי-תרומבין, הירודין נקשר ומעכב רק את התרומבין המשופעל, עם פעילות ספציפית של פיברינוגן. לפיכך, הירודין מונע או מפרק את היצירה של פקקות, בהיותו בעל פעילות תרומבוליטית, ויש לו ערך טיפולי במפגעים של קרישת דם, הטיפול בהמטומות בעור, וביצירה של ורידים וריקוזיים שטחיים, אם בהזרקתו או על ידי משחה. בהיבטים מסוימים, להירודין יש יתרונות על אנטי-קואגולנטים הנמצאים בשימוש רווח יותר, כגון הפארין, כיוון שהוא אינו מפריע לפעילות הביולוגית של חלבוני נסיוב אחרים, ומסוגל לפעול גם על תרומבין קומפלקסי.
במצבים של תסמונת כלילית חריפה, נמצא שהירודין היה יעיל בהפחתת מקרי MI בהשוואה להפארין, אם כי יתרון זה עומעם על ידי הסיכון המוגבר לדימומים בהשוואה לזה המתקבל בטיפול עם הפארין (1.7% לעומת 1.3%). באשר למניעת re-stenosis לאחר תהליך אנגיופלסטי, במחקר שהתבצע בקרב מטופלים עם תעוקת חזה בלתי יציבה, נמצא שהירודין עשוי אמנם להפחית אירועים לבביים בטווח הזמן הקצר, אך אינו יעיל בטווח של 7 חודשים. ניסוי GUSTO-IIb או Global Use of Strategies to Open Occluded Coronary Arteris), גייס מטופלים עם תסמונת כלילית חריפה עם או בלי עלייה במקטע ST, שטופלו עם הירודין טבעי או ריקומביננטי. התוצא הראשוני של מוות או של אוטם חוזר לא-קטלני נמצא ב-6.8% מקבוצת הירודין, ו-9.6% בקבוצת ה-unfractionated heparind כעבור 30 יום מתחילת הטיפול, ו-9.5% לעומת 12.3% בקבוצת המטופלים בהירודין לעומת אלה שטופלו עם הפארין, וכן נמצאה הפחתה של 2.2% בתמותה בקרב מאושפזים בין שתי קבוצות הטיפול. כאשר הירודין ניתן כשלעצמו הוא עלול ליצור רגישות-יתר, ובחלק מנגזרותיו נעשה ניסיון למנוע מצב זה. על ידי ביצוע priming של הנבדק עם הירודין במינון של 33 מיקרוגרם/גרם, והזרקת הירודין במינון של 0.08-0.15 מיליגרם/ק"ג משקל גוף, נמנעה תופעת רגישות היתר. החיסרון העיקרי של הירודין, שהוא נזקק באופן מוחלט לתפקוד הכליות לצורך פינויו מהגוף.
השפעה אנטי-סרטנית של הירודין
מספר מחקרים אישרו את הפעילות האנטי-סרטנית של הירודין וגילו באופן חלקי את המנגנון של פעילות זו. הירודין יכול לפעול כנגד גליומה, קרצינומה הפטוצלולרית, hemangioma, ללnasopharyngeal carcinoma ( Liu וחב' ב-J Guangxi Med משנת 2016, ו-Tao וחב' ב-Shandong Med J משנת 2018). הירודין פועל נגד תאי הסרטן על ידי עיכוב השגשוג, הנדידה, והחודרנות של תאי הסרטן, סיוע לאפופטוזיס ואפנון (מודולציה) של מעגל חיי התא. מנגנון הפעולה של הירודין כולל שנמוך של מסלולי האיתותים ERK/MAPK ,VEGF/VEGF-R ו-HGF/C-met, ובכך הפחתה של ביטוי האנגיוגנזיס בהפחתת ה-adhesion kinase (FAK) ואחרים. גליומה היא אחת מסוגי סרטן המוח השכיחים ביותר המהווה 81% מסוגי סרטן מוחי ממאירים (Ostrom וחב' ב-Neurol Oncol משנת 2014). הפרוגנוזה של גליומה גרועה, מחקרים מוקדמים הוכיחו שהשדרוג של מסלול ERK/MAPK יכול להגדיל את הגירוי המיטוגני ולהגביר את השגשוג של תאי גליומה ממאירה (Han וחב' ב-Cell Death Dis משנת 2016). לפיכך, חסימת מסלול זה עשויה להיות דרך מבטיחה לטיפול בגליומות. Li וחב' דיווחו שהירודין הדגים השפעה אנטי-סרטנית על שורות תאי LN229 ו-U251 in vitro והוא דיכא משמעותית את גידולם של שני סוגי תאי סרטן אלה בהזרקה תוך-מוחית של הירודין במינונים של 15–50 מילימולר. בנוסף, הירודין גם הגביר את תהליך האפופטוזיס של תאי גליומה אלה, על ידי שנמוך הביטוי של Bcl-2 ועצירת מעגל החלוקה של תאים אלה ב-G1 phase. יצוין שכמות ה-pERK1/2 פחתה לאחר החדרת הירודין, כמו גם זו של החלבון ,cyclin D1 מה שמציע שהשנמוך של מסלול האיתות ERK/MAPK עשוי להיות קריטי בטיפול גלימה על ידי הירודין (Zhao ב-Int J Clin Exp Med משנת 2015).
האנגיוגניות הבלתי נורמלית כרוכה במספר מחלות כגון דלקת, rheumatoid arthritis, וסרטן (Kiselyov וחב' ב-Drugs משנת 2007). ההתמקדות באנגיוגניות היא אחת האסטרטגיות המבטיחות ביותר בפיתוח תכשירים אנטי-סרטניים. VEGF והקולטנים שלו, הם חלבוני מפתח באפנון של אנגיוגניות, והעיכוב של VEGF/VEGF-R נמצא יעיל בטיפול בסרטן (Sitohy וחב' ב-Cancer Res משנת 2012). הירודין נמצא מכיל תכונות מעכבות על קרצינומה הפטו-תאית, כנראה על ידי דיכוי אנגיוגניות. Li וחב' דיווחו שהירודין היה מסוגל לעכב שגשוג, אפופטוזיס, נדידה וחודרנות של תאי HepG2, באופן התלוי במינון. בנוסף, הביטוי של VEGF mRNA והחלבון, שונמכו משמעותית לאחר טיפול עם הירודין (Li וחב' ב-Chin J משנת 2016, ו-Morese וחב' ב-Clin Cancer Res משנת 2019). מחקר של Yang וחב' ב-Chin J Gerontol משנת 2015, הראה שהירודין במינון של 14U/ml היה מסוגל לעכב משמעותית את השגשוג ולעודד אפופטוזיס של תאי המנגיומה מסוג EOMA בעכברים in vitro.
השפעת הירודין על סיבוכי סוכרת
סוכרת נחשבת כמחלה מטבולית ודלקתית, הכרוכה במגוון של סיבוכים מיקרו-ומאקרו-וסקולריים, שאמורים לפגוע בערך ב-693 מיליוני אנשים בעולם בשנת 2045 (Ahlqvist וחב' ב-Nat Rev Nephrol משנת 2015, ו-Cole ו-Lopez באותו כתב עת משנת 2020). התמותה מסוכרת בעולם נמצאת בקו-עליה בגלל סיבוכים מיקרו, ומאקרו-וסקולריים כגון מחלת כליות וסקולרית כגון נוירופתיה סוכרתית. בשלבים מוקדמים של סוכרת היפר-גליקמיה תוך תאית גורמת להגברה של חדירות וסקולרית, לפעילות מוגברת של מכווצי כלי-דם, ולאפנון של גורמי חדירות כגון VEGF. בהתאם, בגלל מות תאים מתוכנת וחסימה של קפילרות המושרית על ידי יצירה מוגברת של משתית חוץ-תאית (ECM), בנוסף לשקיעה של חלבונים חיוביים לצביעת Schiff, מתרחש אובדן של תאים מיקרו-וסקולריים הגורם בדיעבד לסיבוכי סוכרת (Brownlee ב-Nature משנת 2001). הירודין נמצא יעיל במניעת diabetic nephropathy, כמו גם במניעת נפרופתיה היקפית, כנראה על ידי עיכוב של מסלולי VGEF, HIF-1α ו-p38 MAPK/NF-κB או על ידי שפעול של מסלול HIF1alfa/VEGF.
ההשפעה האנטי-תרומבוטית של הירודין
הירודין טבעי, כפפטיד אנטי-תרומבוטי פוטנטי, הפך למעכב הספציפי ביותר של תרומבין מאז שנות ה-50 המאוחרות (Mathesson ו-Goa ב-Drugs משנת 2000). ההשפעה המעכבת החזקה של הירודין על תרומבין קשורה למבנהו הכימי.
הוראות לביצוע הבדיקה
הדגימה חייבת להילקח לפני תרפיה אנטי קואגולנטית עם תכשירים דוגמת קומאדין, הפארין, מעכבים ישירים של תרומבין כדוגמת argatroban או dabigatran, או או מעכבי פקטור Xa כגון apixaban, rivaroxaban אוedoxaban. את הדם יש לדגום למבחנת ספירת-דם (EDTA) פקק בצבע סגלגל, או במבחנת סודיום ציטראט (פקק בצבע תכלת), ולהעביר את הפלזמה המתקבלת לאחר הסרכוז הראשון למבחנת פלסטיק ולבצע סרכוז נוסף (כדי להימנע מזיהום עם שארית טסיות העלולה לתת תוצאות שגויות). יש לחלק את הפלזמה למספר מחנות פלסטיק (0.25 מ"ל לכל מבחנה) ולהקפיא מיד (לא יאוחר מ-4 שעות לאחר נטילת הדם) בטפרטורה של 20- מעלות C (עדיף להקפיא בטמפרטורה של 40-מעלות C). יש לפסול דגימות המוליטות, ליפמיות או איקטריות.
מידע על יציבות הדגימות: דגימה קפואה יציבה למשך 14 יום, דם מלא בטמפרטורת החדר או דם שנשמר בקירור יציב גם כן למשך 14 יום.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק