LEUCINE-RICH ALPHA-2-GLYCOPROTEIN 1
| מדריך בדיקות מעבדה | |
| LEUCINE-RICH ALPHA-2-GLYCOPROTEIN 1 | |
|---|---|
| שמות אחרים | LRG-1 |
| מעבדה | כימיה בדם ובשתן |
| תחום | הערכת מצבי דלקת, וסקולאריזציה |
| טווח ערכים תקין | בפלזמה: 21-50 מיקרוגרם /מ"ל; בשתן: פחות מ-42 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
LRG-1 שייך למשפחת חלבוני ה-LRR או leucine-rich repeat, שנמצאה מעורבת באינטראקציות של חלבונים, בהעברת איתותים בין-תאיים, בספיחת תאים ובהתפתחותם (על פי Buchanan ו-Gay ב-Prog Biophus Mol Biol משנת 1996). נמצא ש-LRG1 מתבטא במהלך ההתמיינות (דיפרנציאציה) של גרנולוציטים (O’Donnell וחב' ב-J Leuko Biol משנת 2002). החלבון LRG-1 מקודד באדם על ידי הגן LRG1 הממוקם באתר 19p13.3. על פי O’Donnellבמאמרו משנת 2002 גן זה מכיל 2 אקסונים. לעומת זאת הגן של LRG-1 בעכברים מופה בכרומוזום 11. במחקרם זה של O’Donnell וחב', התגלו עותקים (transcripts) של LRG-1 בנויטרופילים של אדם ובתאי progenitor, אך לא בתאים מונונוקלארים בדם היקפי.
LRG-1 מאדם בודד לראשונה על ידי Haupt ו-Baudner בשנת 1977 ופורסם ב-Hoppe Seylers Z Physiol Chem, והאנליזה של ריצוף הפפטיד של LRG-1 פורסמה על ידי Takahashi וחב' בשנת 1985 ב-Proc Nat Acad Sci. ל-LRG-1 שבודד מנסיוב של אדם יש משקל מולקולארי של 34,350 דלטון, המבוסס על החלק הפפטידי בלבד ללא מרכיב שרשרות הסוכרים של גליקופרוטאין זה, המכיל 312 חומצות אמינו, מתוכן 66 שיירים של leucine. לפי Takahashiהמשקל המולקולארי של הגליפרוטאין השלם כולל השרשרות הסוכריות שלו מגיע ל-45,000 דלטון.
ל-LRG-1 יש 2 קשרים די-סולפידיים תוך-שרשרתיים: קשר די-סולפידי אחד בין 2 שיירי ציסטאין בעמדות 8 ו-21, וקשר די-סולפידי שני בין 2 שיירי ציסטאין בעמדות 268 ו-294. בנוסף, יש לחלבון זה 5 שרשרות סוכריות, אחת מהן הקשורה על ידי N-acetyl-galactosamine בקשר O-גליקוזידי לחומצת אמינו בעמדה 2, ועוד 4 שרשרות סוכריות הקשורות על ידי N-acetyl-glucosamine בקשר N-גליקוזידי לחומצות האמינו בעמדות 44, 151, 234 ו-290.
כאמור, לאוצין מהווה למעלה מ-20% מחומצות האמינו של LRG-1, חלבון המכיל 8 רצפים חוזרים שכל אחד מהם מכיל 24 חומצות אמינו. רצפים אלה ממוקמים בין השיירים שלך חומצות אמינו בעמדות 58 עד 79, 82 עד 103, 106 עד 127, 130 עד 151, 154 עד 175, 178 עד 199, 202 עד 223 ו-226 עד 247. באנליזה של cDNA ממקור אדם ועכבר, מצאו O’Donnell וחב' הומולוגיה של 66% בין רצפי חומצות האמינו של LRG-1 של אדם ועכבר. למולקולת LRG-1 יש רצף של 35 חומצות אמינו (signal peptide) המורחק על ידי ביקוע פרוטאוליטי בזימוגן המקורי המכיל 347 חומצות אמינו.
אנליזה על ידי Northern blot של רקמות עכבר מבוגר, גילתה כמויות גדולות של LRG-1 מבוטאות בכבד, וכמויות נמוכות בהרבה ברקמת הלב, וכמויות זעירות ביותר בטחול ובריאות. לא ניתן היה למצוא כלל LRG-1 במוח, בשריר השלד, בכליות ובאשכים. O’Donnell גילה ביטוי של LRG-1 במקטע הנויטרופילי של מח העצם ושל הדם ההיקפי, וכן במקטע של תאים מונונוקלאריים במח העצם.
תפקוד הגן
באנליזת Northern blot של ביטוי LRG-1 בעכבר, התגלה ביטוי החלבון כבר 16 שעות מרגע שהתחילו להשרות התמיינות בגרנולוציטים על ידי טיפול בתאים אלה עם G-CSF או granulocyte colony stimulating factor, כאשר הביטוי של LRG-1 עלה פי-80 לאחר 5 ימים. כאשר השוו את פרקי הזמן הנדרשים להשריית ביטוי של LRG-1 לאלה של גנים אחרים שפעילותם משתדרגת במהלך ההתמיינות של גרנולוציטים, נמצא שהביטוי של LRG-1 מתחיל מוקדם יחסית בתהליך המוזכר.
השרייה של התמיינות גרנולוציטים על ידי DMSO של תאים קדם-מיאלוציטים באדם (הידועים כתאי HL-60), הייתה כרוכה עם עלייה בביטוי LRG-1. ביטוי מוגבר של LRG-1 התגלה כמו כן בתאים מטופלים עם GCSF שמקורם המטופל עם מפגע מיאלו-פרוליפרטיבי. לעומת זאת, ביטוי מופחת של LRG-1 התגלה לאחר תהליך השרייה עם PMA או phorbol 12-myristate 13-acetate, והתמיינות מונוציטית של תאי HL-60. ראוי לציין שהאזור בו מופה של הגן hLRG באתר 19p13.3, הוא איזור בו מופו הגנים של מספר אנזימים נויטרופיליים-גרנולוציטיים.
Wang וחב' (ב-Nature משנת 2013), זיהו ביטוי-יתר של LRG-1 ב-transcriptome של נימיות דם ברשתית של עכברים עם מחלת רשתית שמקורה בפתולוגיה וסקולארית. חוקרים אלה הדגימו שבנוכחות של transforming growth factor-β1 או TGFβ1, החלבון LRG-1 הוא מיטוגני לתאי אנדותל, ומעודד בהם אנגיוגניות. עכברים טרנסגניים בהם יש חסר של LRG-1, פיתחו פנוטיפ וסקולארי שונה ברשתית העין, עם הפחתה משמעותית בתהליך האנגיוגני הפתולוגי בעין. LRG-1 נקשר ישירות ל-endoglin שהוא קולטן נלווה של TGF-β, ובנוכחות של TGF-β1, גורם לעידוד המסלול המאותת Smad1/5/8, המעודד אנגיוגניות. שימוש בנוגדן החוסם LRG-1 מביא לחחלשת האנגיוגניות. Wang וחב' מעריכים שנתונים אלה מצביעים על כך ש-LRG-1הוא מווסת של תהליך האנגיוגניות, והוא עושה זאת על ידי מודולציה של האיתות של TGF-β.
החלבון LRG-1 השתמר מאוד מבחינה אבולוציונית, והראייה לכך היא ההומולוגיה הגדולה יחסית בהרכב מולקולה זו באדם ובעכבר. יש לחלבון זה מעורבות מנגנונית במספר תרחישים פתולוגיים (Li וחב' משנת 1997), מה שמשתמע מהעלייה הסימולטאנית ברמת LRG-1, ברמת TGFβ1 וכן ברמת TGFβ receptor II. חוקרים אחרים זיהו את היותו של LRG-1 ליגנד הנקשר לציטוכרום C המהווה משרה וכן מגביר את תהליך האפופטוזיס, כך שעל ידי התקשרותו לציטוכרום C משחק LRG-1 תפקיד בהישרדותם של תאים.
האם LRG-1 יכול לשמש מדד בשתן לדלקת התוספתן (appendicitis) בילדים?
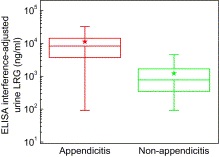
מספר פרסומים הופיעו לאחרונה הבוחנים אפשרות של מדידת רמת LRG-1 בשתן כמדד אבחנתי לדלקת התוספתן בילדים. Kentsis וחב' מהרווארד, פרסמו ביולי 2012 ב- Ann Emerg Med את תוצאות מחקרם בנושא על ידי שמדדו בדגימות שתן של 49 מטופלים את רמות LRG-1 בשיטת ELISA וב-selected ion monitoring mass spectrometry. ברוב הדגימות השתן שעברו מיהול נמצאה עליה של LRG-1 באותם מקרים שאובחנו היסטו-פתולוגית כמקרי appendicitis, בהשוואה לדגימות שתן שנשללה בהם אבחנה זו. מחקרם של Kentsis וחב' קבע ששיטת ELISA פחות מועדפת לכימות LRG-1 בשתן, בשל נוכחות אפשרית של חלבון שיש לו cross reactivity עם LRG-1 ב-immunoassay זה, ויש צורך לבצע מיהולי שתן עד פי-100 להימנע מה-interferenceהאמור. לעומת זאת לא קיימת כל הפרעה מצד חלבון לא רלוונטי אם LRG-1 נמדד בשיטת selected ion monitoring mass spectrometry.
מסקנות ניסוי זה שלKentsis וחב' הן שמדידה ישירה של רמת LRG-1 או של פפטידים של חלבון זה בשיטת selected ion monitoring mass spectrometry, הראתה ש-LRG-1 היה מוגבר בשתן של מאובחנים עם אפנדיציטיס חריפה פי-100 ומעלה, ועם ROC של 0.98, בהשוואה לממצאים בדגימות שתן של אלה ללא מפגע זה. רמות LRG-1 בשתן נמצאו במתאם טוב עם החומרה ההיסטולוגית של דלקת התוספתן. חוקרים אלה מצאו גם מתאם טוב בין רמת LRG-1 בשתן לבין רמת חלבון ברקמת התוספתן.

מחקר נוסף בנושא זה של Kharbanda וחב' התפרסם ב-2012 ב-Acad Emerg Med. היה זה מחקר פרוספקטיבי של 176 ילדים בגילים שבין 3 ו-8 שנה, שהגיעו לחדר מיון פדיאטרי, עם חשד ל-appendicitis. נלקחו דגימות דם ושתן בהם נעשתה מדידת LRG-1 בשיטת ELISA. האבחנה הסופית נעשתה על ידי היסטו-פתולוגיה. מתוך 176 הפרטים, 58 מתוכם (34%) אובחנו עם דלקת התוספתן. ממצאי ניסוי זה היו שהרמה הממוצעת של LRG-1 בנסיוב ובשתן, היו גבוהות משמעותית בדלקת תוספתן בהשוואה למצב של חוסר דלקת (p<0.008). נמצא שהרמות הממוצעות שלLRG-1 בנסיוב ובשתן. היו גבוהות יותר במקרים של אפנדיציטיס עם התנקבות (perforation) מאשר במקרים של אפנדיציטיס ללא התנקבות (p<0.05). רמות LRG-1 בנסיוב שמתחת לריכוז של 40 מיקרוגרם/מ"ל, וריכוזי LRG-1 בשתן של מתחת 42 ננוגרם למ"ל, סיפקו רגישות וערך ניבוי שלילי של 100% בזיהוי ילדים עם סיכון נמוך לדלקת התוספתן, אך הספציפיות הייתה נמוכה (23-35%). לעומת מדד LRG-1 ספירה סטנדרטית של כדוריות-דם לבנות בדם, השיגה בניסוי זה רגישות של 100% וספציפיות גבוהה מזו של LRG-1.
זיהוי LRG-1 כמדד פוטנציאלי לאבחון NSCLC
Li וחב' במחקרם שפורסם ב-2011 ב-Electrophoresis, ביקשו לסרוק שתנים של חולים עם non-small cell lung cancer כדי לגלות חלבונים המופרשים באקסוזומים בשתן והשוואתם בגישה פרוטאומית לעומת שתנים של אנשים בריאים. האקסוזומים בודדו על ידי אולטרה-צנטריפוגציה, וזוהו במיקרוסקופ אלקטרוני. לאחר אלקטרופרזה חד-ממדית ב-SDS-PAGE, נחתך מתוך הג'ל האזור של חלבונים במשקל מולקולארי של 35-45 אלף דלטון, ולאחר עיכול עם טריפסין זוהו 18 חלבונים בשיטת nano-HPLC-chip-MS/MS. הביטוי הדיפרנציאלי של LRG-1 אושש באקסוזומים מהשתן, על ידי Western blot, וכן ברקמת הריאה באימונו-היסטוכימיה. נמצא ש-LRG-1 היה מבוטא בריכוזים גבוהים יותר באקסוזומים בשתן וכן ברקמות ריאה מחולים עם NSCLC. תוצאות אלה מצביעות על אפשרות ש-LRG-1 יכול לשמש מדד בשתן למפגע סרטני זה.
באותו הקשר פרסמו Liu וחב' בשנת 2012 ב-PLoS One, תוצאות ניסוי אף הוא בגישה פרוטאומית המדגים קשר בין ביטוי מוגבר של LRG-1 בנסיוב, לבין NSCLC. החוקרים זיהו בשיטות חדשניות של tissue microarray analysis ו-multiple reaction monitoring לא פחות מ-647 חלבונים כאשר 101מתוכם הראו קשר משמעותי לסרטן ריאה זה. מתוך חלבונים אלה נמצא שבערך ב-100 מאובחנים עם NSCLC, היה ביטוי מוגבר של LRG-1 בדם כמו גם ברקמת השאת עצמה.
זיהוי LRG-1 כמדד פרוגנוסטי בלתי-תלוי לקרצינומה של רירית הרחם
בכתב העת Tumor Biol משנת 2014, התפרסם מחקרם של Sy וחב' על משמעות הביטוי של LRG-1 ב-endometrial carcinoma. החוקרים עשו אנליזה אימונו-היסטוכימית של רקמות ביופסיה שנלקחו מ-242 נשים עם מחלה מאובחנת. נמצא שביטוי LRG-1 היה כרוך בדרגת המחלה ובגרורות לבלוטות הלימפה. נמצא ש-LRG-1 יכול לשמש מדד פרוגנוסטי להישרדות בחולות אלו, במיוחד כאשר הוא משולב עם גורמי סיכון אחרים.
זיהוי LRG-1 בנסיוב כמדד לפעילות המחלה בקוליטיס כיבית (ulcerative colitis)
Serada וחב' פרסמו בנובמבר 2012 ב-Inflamm Bowel Dis, את תוצאות מחקרם שנועד לבחון האם רמות LRG-1 בנסיוב, שזוהה לאחרונה כמדד לפעילות במחלות קרוהן ו- rheumatoid arthritis, מראות מתאם עם פעילות קוליטיס כיבית. תוצאות מחקר זה הראו שרמות LRG-1 בנסיוב היו מוגברות באופן משמעותי במטופלי קוליטיס כיבית בפאזה פעילה של המחלה בהשוואה למטופלים בהפוגה (p<0.0001), וכן בהשוואה לאנשים בריאים (p<0.0001). מתאם זה נמצא טוב יותר מאשר מדידת CRP בתרחישים אלה. כמו כן נמצא ביטוי מוגבר של LRG-1 ברקמות "מודלקות" של המעי הגס בקוליטיס כיבית. במודל בחיות נמצא שרמות LRG-1 היו מוגברות בנסיוב של עכברים בהם הושרתה קוליטיס על ידי DSS או dextran disodium sulfate.
ממצאים פרלימינריים לגבי מעורבות LRG-1 ממצבים פתולוגיים שונים
רמות מוגברות של LRG-1 במצבים של זיהומים בקטריאליים מסווגים אותו כ-acute phase protein, אך באופן מעניין במהלך התגובה הדלקתית לזיהומים אלה, אין מתאם טוב בין רמות LRG-1 לאלו של CRP. החל משנת 2010 התפרסמו מספר מחקרים הכורכים את LRG-1 כמדד במספר מחלות סרטניות כדוגמת NSCLC, סרטן המעי הגס וסרטן הלבלב. כמו כן נמצא ש-LRG-1 מוגבר משמעותית בסרטן השחלה, כמשתמע ממחקרם של Andersen וחב' שהתפרסם בספטמבר 2010 ב-J Ovarian Res. בניסוי זה נבחנה בנסיוב רמת LRG-1 של נשים עם מחלה ממאירה לעומת נשים עם מחלות גינקולוגיות שפירות בשיטת ELISA, ואילו ברקמות שבודדו מרקמות סרטניות בשחלה כמו גם בשורות תאים שמקורם בסרטן השחלות, נמדד הביטוי של LRG-1 בשיטות של gene microarray, ב-Western blot, ב-RT-PCR, בשיטה אימונו-היסטוכימית וכן על ידי מס-ספקטרומטריה.
בניסוי זה נמצא שרמת LRG-1 בנסיוב של 58 נשים עם סרטן השחלות הייתה גבוהה משמעותית בהשוואה לרמתו ב-56 דגימות נסיוב של נשים בריאות (בממוצע 89.33 לעומת 42.99 מיקרוגרם/מ"ל, p=0.0008). כן נמצא שרמת LRG-1 הייתה הגבוהה ביותר בסרטן השחלה בשלב III/IV. בסדרה של 193 דגימות קדם-ניתוחיות, נמצא שרמת LRG-1 הייתה מוגברת משמעותית במטופלות עם serous ovarian cancer או באלו עם clear ovarian cancer (בממוצע 145.82 מיקרוגרם/מ"ל) לעומת נשים עם מחלות גינקולוגיות שפירות (בממוצע 82.53 מיקרוגרם/מ"ל, p<0.0001). נמצא מתאם לא גבוה בין רמות LRG-1 ואלו של CA125 כאשר r=0.47, ו-p<0001). כמו כן נמצא שה-mRNA של LRG-1 היה מוגבר ברקמה הסרטנית מאשר ברקמות תקינות.
LRG-1 במצבים של יצירת כלי דם חדשים (neovascularizatin)
LRG-1 נמצא כרוך בתמיכה לתהליכים של נאו-וסקולריזציה כמו תהליכי אנגיוגניות, על ידי שהוא גורם לשינוי-כיוון באיתות הנשלח על ידי TGFβ בתאי אנדותל. לפיכך LRG-1 עשוי לשמש יעד טיפולי-תרופתי פוטנציאלי באותן מחלות בהן נטייה לנאו-וסקולריציה קשורה לנזק. באופן יותר ספציפי, מדובר בפגיעות בעיניים כמו רתינופתיה על רקע סוכרת, retinal vein occlusion, ניוון המאקולה התלוי בגיל (ARMD) ו-macular telangiectasia. מפגעים וסקולאריים אלה מתפתחים על ידי צמיחת קפילארות דם חדשות מכלי דם קיימים ברשתית (אנגיוגניות), וההתפתחות של עיוותים וסקולאריים בכלי דם עיניים קיימים (telangiectasia).
חשיבות רבה יש לתהליכים של הנצת כלי דם חדשים מאלה הקיימים, כאשר תהליך אנגיוגני זה אותו הציע לראשונה יהודה פולקמן בבוסטון, מסייע לאספקת מזון לגידולים סולידיים בראשית התפתחותם, והגברת התהליך הסרטני. כיוון שנמצא שהביטוי של LRG-1 גדל בפלזמה של מטופלים עם גידולים סרטניים מסוימים, Ferrero וחב' הציעו בשנת 2009 במאמרם ב-Arch Gynecol Obstet, שהחלבון LRG-1 ישמש כסמן סרטני אפשרי.
קבוצת המחלות המאופיינות על ידי אי-סדירויות וסקולאריות כולל טלנגיאקטזות, מוטציות בקולטן האנדותליאלי הנלווה של TGFβ הידוע כ-endoglin, וכן בקולטן של TβR1 הידוע כ-ALK1 גורמות לתסמונות הידועות כ-HHT1 ו-HHT2 או Hereditary Hemorrhagic Telangiectasia הידועות גם כ-Osler-Rendu-Weber disease. בשנת 1999 הראו Spirin וחב' ב-Am J Pathol, ש-TGFβ מוגבר ברשתית של מטופלים עם רתינופתיה סוכרתית באזורים בהם בולט תהליך של remodeling וסקולארי. חוקרים אחדים הדגימו ש-LRG-1 משתדרג בכלי דם של מחלות רשתית הכרוכות בשינויים וסקולאריים.
מנגנון האיתות של βTGF בתאי אנדותל, יכול לפעול דרך הקולטן TGFβ receptor II תוך שהוא נעזר בקולטן activin receptor-like kinase 5 הידוע כ-KLK5, וכן ב-ALK1 הספציפי לאנדותל. איתותים אלה מבוקרים באופן חלקי על ידי TGFβ, וכן על ידי חלבונים השייכים למשפחת ה-effectorsהידועים כ-Smads, מתוכם Smad 2 ו-Smad 3 משופעלים על ידי ALK5, ואילו Smad 5 ,Smad 1 ו- Smad 8, משופעלים על ידי ALK1. נמצא שמולקולת LRG-1 נקשרת הן ל-TGFβRII ול-ALK1, ולכן משערים ש-LRG-1 הוא בעל תפקיד בקומפלקס של איתות על ידי TGFβ.
תמיכה בהשערה האחרונה מתקבלת מהממצא שעל ידי חסימת LRG-1 בתאי אנדותל על ידי siRNA, נבלם שגשוג התאים הללו על ידי TGFβ, ופוחת הזרחון של Smad5, בה בשעה שביטוי-יתר של LRG-1 מגביר שגשוג התאים, מפחית את ביטוי Smad2 ומגביר את זרחון Smad5. זו אחת הדרכים דרכן LRG-1 יכול לווסת את תהליך האנגיוגניות. אכן, על ידי שימוש בנוגדנים כנגד LRG-1 התקבל עיכוב של זרחון Smad5, מה שמרמז על כך שחסימת LRG-1 היא בעלת פוטנציאל לפגוע ברצף הריאקציות המשופעלות על ידי ALK1 הואסקולו-פתוגני, עם פגיעה קטנה יחסית ברצף הריאקציות הלא-פתוגני המשופעל על ידי ALK5.
ממצאים אלה הופכים את LRG-1 ליעד טיפולי תרופתי במקרים של וסקולאריזציה פתוגנית בעיניים ובאתרים אחרים. כמו כן, בניגוד ל-VEGF, נמצא ש-LRG-1 עשוי להיות מעורב רק בווסקולאריזציה פתוגנית בעין, ולא בתהליכי וסקולאריזציה תקינים.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק