נוירומלנין - Neuromelanin
הופניתם מהדף Neuromelanin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| נוירומלנין | |
|---|---|
| Neuromelanin | |
| |
| יוצר הערך | פרופ' בן-עמי סלע |
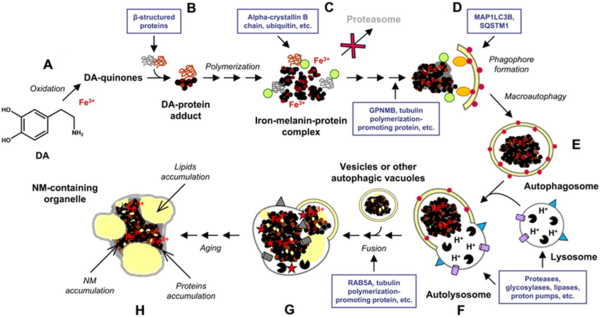
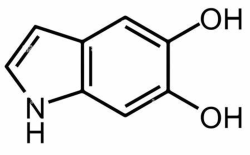
נוירומלנין (NM) הוא פיגמנט שחור הנמצא במוח הדומה במבנהו למלנין. מדובר בפולימר של מונומרים בעלי מבנה של dihydroxyindole 5,6 (Charkoudian ו-Franz ב-Inorganic Chem משנת 2006). NM נמצא בריכוזים גבוהים בתאים קטכולאמינרגיים של ה-substantia nigra pars compacta וה-locus coeruleus תוך שהם מקנים את הצבע השחור לאזורים אלה.
תכונות פיזיקליות ומבנה
נוירומלנין גורם לאזורי מוח ספציפיים כגון substantia nigra (להלן SN) או locus coeruleus את צבעם השחור. זהו סוג של מלנין ודומה לצורות אחרות של מלנין היקפי. NM אינו מסיס בתרכובות אורגניות, ויכול להיות מזוהה על ידי צביעת כסף. הוא מכונה נוירומלנין בגלל תפקידו ושינויי הצבע להם הוא גורם ברקמות המכילות אותו. הוא מכיל גרנולות של פיגמנט שחור/חום וניתן לזיהוי כבר לאחר 1–3 שנות חיים. משערים שהוא מגן על נוירונים ב-SN מעקה חמצונית המושרית על ידי ברזל. ההתייחסות שלו למלנין היא בשל המבנה הרדיקלי החופשי היציב שלו ויכולתו לגרום לכלציה עם מתכות.
מסלולים סינתטיים
נוירומלנין מסונתז ישירות מהקודמן של דופמין, L-DOPA, על ידי האנזימים tyrosine hydroxylase (להלן TH) ו-aromatic acid decarboxylase (להלן AADC). לחלופין, וזיקולות סינפטיות ואנדוזומים גורמים להצטברות של דופאמין ציטוזולי דרך onoamine transporter 2 וזיקולרי (להלן VMAT2) ומעבירים אותו למיטוכונדריה בה הוא עובר מטבוליזם על ידי monoamine oxidase. עודף של דופאמין ושל DOPA מתחמצנים על ידי קטליזה של ברזל והופכים ל-dopaquinones העוברים פגוציטוזיס ומאוחסנים בתא כ-NM (Rabey ו-Hefti ב-J Neural Transm משנת 1990). הביוסינתזה של NM מוחשת על ידי עודף cytosolic catecholamines ולא על ידי וזיקולות סינפטיות (Stepień וחב' ב-Wiadomosci Lekarskie משנת 2007).
תפקוד
NM מופיע בריכוזים גבוהים יותר באדם בהשוואה לפרימטים אחרים (Fedorow וחב' ב-Prog Neurobiol משנת 2005). ריכוזי NM גדלים עם הגיל, תוך רמיזה לתפקידם בהגנה נוירונית או ב-senescence. NM יכול לקשור מתכות ו-xenobiotics (Tribi וחב' ב-Mol Cell Proteom משנת 2009).
תפקיד במחלות
נוירונים המכילים NM ב-SN עוברים דגנרציה במחלת פרקינסון (להלן PD). תסמינים מוטוריים במחלה זו נגרמים על ידי מות תאים ב-SN, שעלול להיגרם בחלקו כתוצאה מעקה חמצונית. חמצון עשוי להיות מעוכב על ידי NM. מאובחנים עם PD הם בעלי 50% של כמות ה-NM ב-SN בהשוואה לאנשים בריאים באותו גיל. מותם של נוירונים המכילים NM ב-SN וב-locus coeruleus נכרך ל-PD, ונצפה in vivo על ידי הדמיה של NM ( Sasaki וחב' ב-NeuroREp משנת 2006). הודגם ש-NM נקשר למתכות נוירוטוקסיות העלולות לסייע לנוירו-דגנרציה.
היסטוריה
פיגמנטים שחורים ב־SN תוארו לראשונה בשנת 1838 על ידי Purkyně (Usunoff וחב' ב־Arch Physiol Biochem משנת 2002), והמושג נוירומלנין הוצע על ידי Lillie במאמר שפרסם ב־J Histochem Cytochem משנת 1957, מאז תפקידו הולך ומתברר. הקשר האפשרי לפתוגנזה של מחלת פרקינסון נחקר באופן נמרץ החל מתחילת שנות ה-2000 (Zecca וחב' ב־Molecular Pathology משנת 2001).
הנוירונים הפיגמנטריים של ה-SN בדרך כלל אובדים ב-PD, אם כי הקשר האפשרי בין הרגישות הנוירונלית ונוכחות NM עדיין לא הובהר לחלוטין. מחקרים היסטולוגיים מוקדמים הראו נוכחות של כמויות גדלות של NM ב-SN בהזדקנות של יונקים גבוהים. מחקרים היסטוכימיים הראו את הקשר בין NM וליפופוסקינים. מחקרים סיסטמטיים של המבנה, הסינתזה והאינטראקציות המולקולריות של NM בוצעו רק בעשור האחרון, והם זיהו את NM כמלנין עם כושר כלציה חזק לברזל וזיקה לתרכובות כגון ליפידים, פסטיצידים ו-+MPP. הזיקה של NM לטוקסינים אורגניים ואנאורגניים נכרכת עם התפקיד המגן של NM. גרנולות שחורות/חומות ב-CNS של האדם, נצפו משנות ה-30 של המאה ה-20 (Schrerer ב־J Comp Neurol משנת 1939). האזורים הפיגמנטריים ביותר הם שני אזורים מזנצפליים: ה-SN ו-locus coeruleus (Cotzias וחב' ב-Fed Proc משנת 1964, ו-Graham ב־Arch Pathol Lab משנת 1979). מחקרים היסטולוגיים הדגימו פיגמנטציה של ה-SN גם ביונקים נוספים, הקרובים לאדם פילוגנטית, כולל שימפנזות, קופי gibbon, ובבונים וכן בסוסים וכבשים (Adler ב־J Comp Neurol משנת 1942, Marsden ב-J Anat משנת 1961, ו-Cozzi ו-Tozzi ב-Arch Vet Ital משנת 1985). מחקרים היסטוכימיים ב-SN וב- locus coeruleus מצאו שהפיגמנט היה בעל תכונות דומות ל־melanins כולל אי-מסיסותם בסולבנטים אורגניים, הלבנתם על ידי מי חמצן וצביעתם על ידי צביעת כסף (Van Woert ו-Ambani ב-Adv Neurol משנת 1974, ו-Foley ו-Baxter ב־J Neuropathol Exp Neurol משנת 1958). לפיכך הפיגמנט נקרא NM.
מחקרים היסטולוגים הראו שגרנולות של NM היו ממוקמות בפריקריון הנוירונלי והיו מוקפות על ידי ממברנה כפולה (Duffy ו-Tennison ב-J Neuropathol Exp Neurol משנת 1965, Moses וחב' ב-Anat Rec משנת 1966 ו-Hirosawa וחב' ב-Z Zellforch Mikrosk Anat משנת 1968). באדם ובסוס, אנליזות היסטוכימיות הצביעו על קשר בין גרנולות NM ו-lipofuscin (Barden ב-J Neuropathol Exp Neurol משנת 1969, Cozzi ב-Anat Anz משנת 1988). ב-SN, NM עולה עם הגיל (Mann ו-Yates ב-Brain משנת 1974, ו-Bogerts ב-J Comp Neurol משנת 1981), ומזהים אותו לאחר 2–3 שנות חיים (Cowen ב-J Neuropathol Exp Neurol משנת 1986).
ביוסינתזה
תהליך היצירה של NM עדיין אינו ברור במלואו, אם כי התבררו מספר שלבים בתהליך זה (Sulzer וחב' ב-Proc Natl Acad Sci USA משנת 2000). בזמנו היה ויכוח האם הסינתזה של NM מתווכת על ידי אנזימים או שמדובר באוטו-אוקסידציה של נגזרי דופאמין. לצורך הסינתזה של eumelanin האנזים tyrosinase מקטלז את ההפיכה של tyrosine ל-L-dopa ולאחר מכן ל-dopa-quinone (Sanchez-Ferrer וחב' ב-Biochim Biophys Acta משנת 1995). מספר חוקרים הציעו ש-tyrosinase יכול להיות גם מעורב בביו-סינתזה של NM כיוון ש-tyrosinase mRNA התגלה ב-SN (Xu וחב' ב-Brain Res משנת 1997). עם זאת, tyrosinase לא התגלה ב-SN על ידי אימונוהיסטוכימיה (Ikemoto וחב' ב-Neurosci Lett משנת 1998). יתרה מזאת, לבקנים החסרים tyrosinase הם בעלי מבנה פיגמנטרי נורמלי של SN. הוצעו גם פעולות אנזימטיות חלופיות כולל חמצון של דופאמין המתווך על ידי tyrosine hydroxylase (Haavik וחב' ב-J Neurochem משנת 1997). במחקר אחר, peroxidase יצר קטליזה של חמצון טירוזין והפיכתו ל-dopa ולאחר מכן לדופאמין, וחמצון נוסף ל-quinones הרלוונטיים, שהם כנראה הקודמנים של NM (Okun ב-Physiol Chem Phys Med NMR משנת 1997). הוצע גם ש-prostaglandin H synthase, שהוא גם בעל פעילות peroxidase והוא ממוקם בממברנה של המיטוכונדריה, יכול לתווך בחמצון של דופאמין ל-dopamine-quinone שיכול לעבור ציקליזציה, ועל ידי תוספת של קבוצת אמין לטבעת הארומטית נוצר נגזר indole הקרוי dopainochrome (Mattammal וחב' ב-J Neurochem משנת 1995, ו-Hastings בואתו כתב עת מאותה שנה). בנוסף, פעילות אנזימטית של הגורם המעכב נדידה של מקרופאגים הוצעה לצורך הסינתזה של NM, כיוון שהוא הופך קטכולאמינים לנגזרות של dihydroxyindole שהן קודמנים פוטנציאליים של NM (Matsunaga וחב' ב-J Biol Chem משנת 1999).
אלטרנטיבית, NM יכול לנבוע מתהליך חמצון לא-אנזימטי. האוטו-חמצון של קטכולים ל-quinones עם הוספה של thiol הודגם במוח (Fornsted וחב' ב-Neuropharmacol משנת 1986). הסינתזה של NM, הושרתה בנוירונים ב-SN של חולדה ובתאי PC12 בתרבית על ידי חשיפה ל-L-dopa. הפיגמנט המיוצר במודל זה מכיל רדיקל חופשי יציב. בנוסף, במיקרוסקופ אור ובמיקרוסקופ אלקטרוני נמצא שהפיגמנט המסונתז בתאים אלה זהה ל-NM אנושי, והגרנולות מוקפות על ידי ממברנה כפולה בדומה ל-NM המופיע באופן טבעי ב-SN. בניסויים אלה, טיפול עם הכלטור של ברזל, desferrioxamine, גרם לעיכוב של סינתזת NM, לפיכך נראה שברזל מעורב בסינתזה של NM.
הפיזיולוגיה של NM
מחקרים נוירו-פתולוגיים בחנו את הנוכחות של NM חוץ-נוירונלי במטופלים עם PD אידיופתי ואינטוקסיקציה על ידי MPTP (McGeer וחב' ב-Neurology משנת 1988, ו-Langston וחב' ב-Ann Neurol משנת 1999). רוב ה-NM החוץ-נוירונלי עובר פגוציטוזיס על ידי תאי microglia וכרוך בשפעול של microglia ושל אסטרוציטים. ייתכן ש-NM משמש אפקטור של תהליך דלקתי כרוני ב-SN. אף על פי שבמחלת PD אידיופתית יש אובדן של נוירונים ב-SN וב-locus coeruleus, במטופלים שעברו אינטוקסיקציה על MPTP, הנוירונים ב-locus coeruleus שורדים. הבדלים שונים אלה ברגישות הנוירונלית יכולים להיות מוסברים על ידי הבדלים מבניים ב-NM של ה-SN ושל ה-locus coeruleus. אף על פי ש-NM עשוי לשחק תפקיד הגנתי על ידי נטרול של מתכות מחמצנות, של מתכות טוקסיות, ושל תרכובות אורגניות טוקסיות (Enochs וחב' ב-J Neural Transm משנת 1994), NM יכול להיות בעצמו מקור של רדיקלים חופשיים על ידי ריאקציה עם מי חמצן (Swartz וחב' ב-Ann Neurol משנת 1992). כאשר ברזל חופשי נוירונלי גדל לנקודת הרוויה של NM, הוא מתחיל לקטלז את יצירת רדיקלים חופשיים, באופן ש-NM הופך ציטוטוקסי (Zareba וחב' ב-Biochim Biophys Acta משנת 1995). יתרה מכך, כיוון שמי חמצן יכול לפרק NM, הפיגמנטים הנוירונליים עלולים לאבד את המולקולה המגינה הזו. כתוצאה מכך הברזל ומתכות ציטוטוקסיות אחרות עלולים להחיש מות נוירונים (Shima וחב' ב-Free Radic Biol Med משנת 1997).
במחקר עדכני של Zeeca וחב' שהופיע ב-Proc Natl Acad Sci USA משנת 2008, הם עשו שימוש בגישה מולטי-דיסציפלינרית לאפיון של פיגמנטים מלניים המופיעים באזורים אחרים של מוח האדם כולל בקליפת המוח, ב-putamen, במוחון וכדומה. הם מצאו שפיגמנטים מלניים היו מצויים ברקמות אלו, מושקעים בגרנולות ושתכולת פיגמנטים אלה הצטברה עם הגיל. במצבים פתולוגיים שיעור האובדן של NM מוחש במהירות בגין אובדן של נוירונים המכילים NM ובגין הכמות המופחתת של NM בנוירונים השורדים בחולי PD (Kastner וחב' ב-J Neurochem משנת 1992, ו-Zeeca וחב' ב-J Neural Transm משנת 2002). הסינתזה והנוכחות של NM באזורי מוח אחרים משרת את אותן מטרות, דהיינו קישור והרחקה של quinones ומתכות שעלולים להיות טוקסיים לרקמות אלו. המחקר של Zeeca וחב' ב-Proc Natl Acad Sci USA משנת 2008, עשה שימוש בגישות כימיות (HPLC כמו גם EPR ו-NMR spetroscopy לצורך אנליזה של מרכיבי NM. כן נעשה שימוש בשיטות פיזיקליות (transmission & scanning electron microscopy) לצורך אפיון של הגודל והמבנה של גרנולות NM, וגישות קומפלימנטריות לבחינה של תפקודם הפיזיולוגי, בעיקר בהקשר של הקישור למתכות טוקסיות. היבט מעניין מתייחס ליכולת היצירה של NM ברקמות מוחיות שונות שהרי האנזים tyrosinase חסר או מינימלי בריכוזו (Eisenhofer וחב' ב-FASEB J משנת 2003). ידוע ש-tyrosine hydroxylase נמצא ברקמות אלו והוא אחראי ליצירת DOPA הנחוץ לאפשר סינתזה של NM. ההבדל יכול להיות נעוץ בתפקוד של DOPA carboxylase, הגורם לדה-קרבוקסילציה של DOPA הנוצר, והופך אותו לדופאמין ב-SN וב-locus coerleus.
הנוכחות של מלנינים ברקמות השונות של הגוף, כגון האוזן הפנימית והמוח, אתגרה חוקרים במשך עשרות שנים, בהקשר של הבנת תפקידם ברקמות אלו. לא קשה להבין כיצד מלנינים בעור, בשיער ובעיניים משחקים תפקידים בהסוואה, בוויסות תרמי, ובהגנה מפני אור, בהשתוקקות מינית וכדומה. אך מה באשר לתפקידם בתוך הגוף, ורקמות שאינן נראות או נחשפות לסביבה בהן לצבע לא יהיה בעל יתרון כלשהו. בשלב זה, יש רק שמץ של הבנה של תפקיד מלנין בכיוונים בלתי צפויים, כגון תפקידם בהקשר של נוירונים ב-chiasm האופטי, או חשיבותם בנוירונים קטכולאמינרגיים הפגועים בחולי PD. הבנות עיקריות באשר לתפקיד המלנינים בנוירונים קטכולאמינרגיים הנמצאים ב-SN וב-locus coeruleus, התגלה במפנה המאה ה-21, כאשר התבררו התכונות הכימיות של מלנין בקישור למתכות טוקסיות, בהרחקת תרכובות טוקסיות, ובנטרול של ROS (Sulzer וחב' ב-Proc Natl Acad Sci USA משנת 2000, Zecca וחב' ב-Pigment Cell Res משנת 2004, ו-Double ב-J Neural Transm משנת 2006). פיגמנטים אלה המכונים MNs מסונתזים דרך מסלול קטכולאמין בו משתתפים tyrosine hydroxylase ו-DOPA decarboxylase. למעשה, פיגמנטים מלניים שנוצרו ב-SN וב-locus coerleus, נובעים מדופאמין ויוצרים פולימרים דמויי eumelanin ו-pheomelanin כאשר האחרון נוצר מתוצר ביניים של -cysteinyl-dopamine (Wakamatsu וחב' ב-J Neurochem משנת 2003).
PD הוא מפגע נוירו-דגנרטיבי הנגרם על ידי מוות סלקטיבי של נוירונים ב-SN הפיגנטרית, מה שגורם לחסר דופאמין ב-Neostriatum (Hornykiewicz ב-Adv Neurol משנת 1986, ו-Bernheimer וחב' ב-J Neurol Sci משנת 1973), וגורם לרעידות, קשיחות, והפרעות תנועה קשות. הנוירונים הפיגמנטרים ב-SN רגישים יותר מהנוירונים שאינם פיגמנטריים. עם זאת, שאלות חשובות נותרות בקשר התפקיד האפשרי של NM ב-SN, הן במצבים נורמליים ואף יותר מכך בפתוגנזה של PD. שיטות electron paramagnetic resonance (להלן EPR) למחקרים של אנליזת מתכות מצביעות על כך ש-NM הוא מלנין אמיתי כיוון שיש לו מבנה יציב של free radical והוא קושר מתכות בקלות (Enochs וחב' ב-J Neurochem משנת 1993, Zeeca ו-Swartz ב-J Neural Transm משנת 1993). אנליזת דגרדציה תוך שימוש באשלגן פרמנגנט והידרוליזה על ידי חומצה hydriodic, מראה ש-NM הוא בעל תכונות של pheomelanins ושל eumelanins (Carstam ו-Brink ב-Biochim Biophys Acta משנת 1991, ו-Odh וחב' ב-J Neurochem משנת 1994). אנליזות אלמנטליות של NM מגלות תכולת גופרית גבוהה (2.5-2.8%), מה שמצביע על נוכחות של קבוצות אליפטיות וטבעות בנזותיאזין. ספקטרוסקופיה אינפרה-אדומה של NM מגלה את הנוכחות של קבוצות אליפטיות ושל מרכיב ארומטי בעל עוצמה נמוכה, בעוד שבמלנינים סינתטיים הקבוצות האליפטיות לא מופיעות (Zeeca וחב' ב-Biochim Biophys Acta משנת 1992). מחקרים על פירוק כימי מראים ש-NM מכיל כמויות שוות של indole ושל benzothiazine.
NM מראה באופן עקבי מרכיב פפטידי בשיעור של 15%. חומצות אמינו יכולות לנבוע מריאקציה ישירה בין הפולימר המלני לבין חלבונים, או מולקולות דופמין הקשורות לשיירי ציסטאין של שרשרות פוליפפטידיות. אכן, הוצע שהקודמן של סינתזת NM הוא cysteinyl-dopamine (Rosengren וחב' ב-J Neural Transm משנת 1985, ו-Smythies ב-Proc R Soc London B Biol Sci משנת 1996), זאת אף על פי שמחקר שעשה שימוש בהידרוליזה של hydriodic acid נכשל בניסיון לזהות את תוצרי הידרוליזה זו (Wakamatsu וחב' ב-Neurosci Lett משנת 1991). יתרה מכך, ספקטרוסקופית NMR מצביעה על כך שהנוכחות של מימנים אליפטיים וארומטיים והיחס בין השניים גבוה יותר ב-NM מאשר במלנינים סינתטיים, מה ששולל אפשרות שדופאמין הוא הקודמן היחיד בסינתזה של NM.
NM במהלך ההזדקנות ובמחלת פרקינסון
באופן נורמלי רמת NM מצטברת עם הגיל בנוירונים של ה-SN (Bazelon ו־Fenichel ב-Neurology משנת 1967). בחולדות מאוד זקנות (בנות 23 חודש) אך לא בחיות צעירות, גרנולות של NM התגלו על ידי מיקרוסקופ אלקטרוני, ותוצאות דומות נמצאו בכלבים מזדקנים (DeMattei וחב' ב-Neurosci Lett משנת 1986). גרנולות של NM התגלו אף הן בתאי מוחון קטכולאמינרגיים של קופים מסוג Macaca, ונוכחותם תאמה את גיל הקופים. ב-SN באדם הגרנולות הקטנות החומות של NM היו גלויות בגיל 3-5 שנים (Fenichel ו-Bazelon ב-Neurology משנת 1968). הריכוז הגבוה ביותר של NM בנוירונים הוא הגבוה ביותר בבני 50-60 שנה, ולאחר מכן ריכוזיו פוחתים, ותופעה זו עשויה לשקף את איבוד הנוירונים במבנים אנטומיים אלה במהלך ההזדקנות. שיטה ספקטרופוטומטרית חדשה מראה ש-NM אינו ניתן לגילוי בשנת החיים הראשונה, אך מתחיל להצטבר מאוחר יותר באופן ליניארי, ומשיג ריכוזים של 2.3-3.7 מיליגרם לכל גרם של SN בנבדקים בני 50–90 שנה. נתוני הריכוזים ביחס לגיל זהים בין גברים ונשים. בחולי PD ערכי NM הם 1.2-1.5 מיליגרם לכל גרם של SN, ערכים הנמוכים בלמעלה מ-50% מאלה שבביקורת בריאה. יש גם הבדלים אתניים בתחום הזה, כאשר הודים נמצאים עם פחות נוירונים פיגמנטריים מאשר בני גילם באוכלוסיות מערביות.
תצפיות אלו מציעות שמפגעים נוירו-דגנטיביים מאופיינים על ידי אובדן של נוירונים ב-SN, כפי שמופיע ב-PD ובמחלת פרקינסון, אינו נגרם מהזדקנות מוקדמת, כפי ששיערו בעבר, כיוון שהריכוז של NM בנוירונים של ה-SN גדל, והמספר של נוירונים פיגמנטריים נשמר קבוע במשך החיים, נראה שהצטברות NM מתרחשת רק בתת-אוכלוסיות של נוירונים ב-SN, בשעה שנוירונים דופמינרגיים נותרים בלתי-פיגמנטריים. הירידה הנצפית של בריכוז NM המתרחש ב-SN של מטופלים עם מחלת פרקינסון מאשרת את העובדה שאיבוד נוירונים פימנטריים ב-SN של מטופלים אלה שדווחה במחקרים נוירופתולוגיים מוקדמים (McGeer וחב' ב-Arch Neurol משנת 1977, ו-Gibb וחב' ב-Adv Neurol משנת 1990). מחקרים אחרים מראים שערכי NM פוחתים בנוירונים השורדים ב-SN במחלת פרקינסון (Mann ו-Yates ב-Mech Aging Develop משנת 1983). זו יכולה להיות תוצאה של סינתזה מופחתת של NM, פירוק של NM, או עמידות מופחתת של נוירונים פיגמנטריים.
האינטראקציה של NM עם תרכובות אורגניות
NM מגיב עם מספר מולקולות אורגניות כולל ליפידים, פסטיצידים, ומולקולות טוקסיות. MPTP (או methyl-4-phenyl-1,2,3,6-tetrahydropyridine-1), הוא נוירוטוקסין הפוגע ב-SN דרך פעילות של monoamino-oxidase type B ההופך MPTP ל־methylphenylpyridine (+MPP) העוצר את השרשרת הנשימתית בשלב של NADH-CoQ1 reductase (Langston וחב' ב-Science משנת 1983, Singer וחב' ב-J Neurochem משנת 1987, ו-Adams ו-Odunze ב-Biochem Pharmacol משנת 1991). תהליך זה באדם ובמספר חיות גורם לתסמונת פרקינסונית בלתי הפיכה (Langston ו-Irwin ב-Clin Neuropharmacol משנת 1986). NM עשוי להפחית את הטוקסיות של MPTP על ידי הצטברות in vivo של המטבוליט הטוקסי שלו +MPP (D'Amato וחב' ב-Science משנת 1986). ה-herbicide הפופולרי paraquat הוא בעל מבנה מולקולרי הדומה לזה של MPTP, ואף הוצע כאחד הגורמים הטוקסיים של PD. פסטיציד זה מצטבר בתאי עצב המכילים NM, ונראה ש-paraquat המצטבר בנוירונים נספח על ידי NM, ובכך יש הגנה על נוירונים אלה מהנזק הטוקסי (Lindquist וחב' ב-Neurisci Lett משנת 1988). NM קושר chlorpromazine, haloperidol ו-imipramine וגורם לשליטה בריכוז חומרים אלה בתוך נוירונים (Salazar וחב' ב-Fed Proc משנת 1978).
האסוציאציה של NM עם ליפידים הודגמה במספר מחקרים (Aime וחב' ב-J Neurochem משנת 1964). אף על פי שמחקרים מוקדמים הציעו שליפידים הם חלק ממולקולת NM, מחקרים מאוחרים יותר מראים ש-NM מכיל בערך 20% ליפידים ספוחים. ייתכן ש-NM עצמו מקטלז את הסינתזה של ליפידים אלה. לחלופין, NM יכול לנבוע מ-lipofuscin עלמידי ריאקציה אנזימטית בליזוזומים, אף על פי שהשערה זו אינה נתמכת על ידי מחקר עדכני (Zecca ב-J Neurochem משנת 2000).
אינטראקציה של NM עם ברזל ומתכות אחרות
ריכוזים גבוהים של ברזל ושל מתכות לא-אלקליניות, מופיעים במספר גרעינים מוחיים (Hock וחב' ב-Brain משנת 1975, ו-Markesbery וחב' ב־Neurobiol Aging משנת 1984). NM ב-SN יכול להגיב עם יונים של מתכות כבדות רבות כגון אבץ, נחושת, מנגן, כרום, כספית וקדמיום; בנוסף הוא קושר ברזל באופן חזק במיוחד (Swartz וחב' ב-Ann Neurol משנת 1992, ו-Gerlach וחב' ב-J Neurochem משנת 1995). במהלך PD ותסמונות קשורות, הריכוז של ברזל ב-SN גדל ב-30 עד 35% (Dexter וחב' ב-J Neurochem משנת 1989, ו-Sofic וחב' באותו כתב עת משנת 1961). ההצטברות של ברזל ב-SN מתרחשת בתוך הגרנולות של NM: הריכוז של ברזל בגרנולות אלו, גבוה יותר בחולי PD מאשר באנשים בריאים (Good וחב' ב-Brain Res משנת 1992, ו-Jellinger וחב' ב-J Neurochem משנת 1992).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק