דלקת כבד נגיפית מסוג C - טיפול - 2014 - Hepatitis C - treatment
הופניתם מהדף New treatment for HCV לדף הנוכחי.
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפטיטיס#C
נגיף דלקת כבד C (HCV ,Hepatitis C Virus) הוא אחד הגורמים העיקריים למחלת כבד בעולם. הנגיף הוא הגורם העיקרי למחלות כבד כרוניות בעולם המערבי ומוביל להתפתחות שחמת (Cirrhosis) וסרטן כבד ראשוני. כמו כן, הוא מהווה אחת מהסיבות השכיחות להשתלת כבד [1].
לאחר שנים רבות של טיפול לא מספק כנד הנגיף, עם אחוזי תגובה נגיפית יציבה (SVR ,Sustained Virologic Response) נמוכים וריבוי תופעות לוואי, פותחו טיפולים בעלי אחוזי SVR של מעל 90%, אשר בנוסף הינם קלים ללקיחה ובעלי מיעוט תופעות לוואי.
פריצת הדרך בנושא הטיפול ב- HCV נובעת מהבנת המבנה ומחזור חיי הנגיף, וכתוצאה מכך זיהוי מטרות שונות בנגיף הניתנות לתקיפה. שתי תרופות מהדור החדש, Sovaldi (Sofosbuvir) ו- Olysio (Simeprevir) כבר אושרו על ידי גופי הבקרה בארצות הברית ובאירופה. האישור בוצע על סמך מחקרי שלב 3 אשר הדגימו SVR באחוזים גבוהים מאוד, גם באוכלוסיות אשר היסטורית היו קשות לטיפול. בנוסף לתרופות שכבר אושרו, מספר גדול של תרופות נמצאות בשלבי אישור סופיים וצפויות להיות זמינות לטיפול במהלך השנים הקרובות. בזכות טיפולים חדשים אלו, הכחדת הנגיף וריפוי מרבית הנשאים הפכו למטרות אפשריות, אף כי הדרך להשגתן עודנה ארוכה.
טיפולי העבר נגד HCV
בשנים הראשונות לאחר גילוי הנגיף התבסס הטיפול על Interferon alfa, אשר ניתן בזריקה תת-עורית מספר פעמים בשבוע, בתוספת Ribavirin פומי. הוספת שייר של פוליאתילן-גליקול (PEG ,Polyethylene Glycol) לאינטרפרון אפשרה מתן של התרופה בזריקה שבועית עם רמות יציבות לאורך זמן. הטיפול בשילוב של אינטרפרון עם שייר PEG ו- Ribavirin הביא לאחוזי SVR של כ- 50% והיווה את אבן הבסיס לטיפולים בנגיף בעשור האחרון.
משך הטיפול היה ארוך ונע בין 24 שבועות לגנוטיפים (Genotypes) 2-3 עד ל- 48 שבועות לגנוטיפ 1, ולעתים אף 72 שבועות בחולים שהגיבו בצורה איטית [2]. בנוסף היה הטיפול כרוך בתופעות לוואי רבות (כגון תסמינים דמויי-שפעת, תופעות פסיכיאטריות, הפרעות המטולוגיות, פגיעה בתפקודי בלוטת התריס, תופעות חיסון עצמי ועוד).
הרקע לכניסת הטיפולים התרופתיים החדשים
בשנת 2011 הוכנסו לשימוש שתי תרופות חדשות, הראשונות לדור חדש של טיפולים - תרופות הפועלות ישירות כנגד הנגיף (DAA ,Direct Acting Anti-Viral Agents), המכוונות נגד חלבוני הנגיף באופן ישיר. פיתוחן התאפשר כתוצאה מפיצוח מבנהו של הנגיף והבנת התפקוד של חלבוני הנגיף השונים. מעגל החיים של הנגיף כולל היצמדות וכניסה של הנגיף לתא הכבד, ולאחר מכן נחשפת החומצה הריבונוקלאית (RNA ,Ribonucleic Acid) הנגיפית, המשמשת תבנית ליצירת חלבון ארוך. בהמשך חלבון זה נחתך בסיוע פרוטאזות (Proteases) של הנגיף למספר חלבונים, מבניים ואחרים, שהם בעלי תפקיד חשוב בשעתוק (Transcription), הרכבה ושחרור של נגיפים חדשים. כל אחד מצעדים אלה במעגל חייו של הנגיף יכול להוות מטרה לטיפול נוגד-נגיפי [3].
הדור הראשון של ה- DAA כלל שני תכשירים תרופתיים הפועלים כנגד חלבון לא-מבני מסוג 3/4A (NS3/4A ,Nonstructural Protein 3/4A) שהינו פרוטאז של הנגיף. מנגנון הפעולה הקנה לקבוצת התרופות את שמה- "מעכבי פרוטאז" (PIS ,Protease Inhibitors). התרופות היו יעילות כנגד גנוטיפ 1 בלבד וניתנו ביחד עם אינטרפרון ו- Ribavirin. השימוש בשתי התרופות, Telaprevir ו- Victrelis (Boceprevir), העלה את סיכויי ההצלחה בטיפול לכ- 70%. יתרון גדול נוסף של תרופות אלו היה יעילותן במקרים של כישלון קודם בטיפול השגרתי [4][5]. התרופות ניתנו בפרוטוקולים מורכבים, כללו לקיחה של כמות גדולה של כדורים מדי יום והיו בעלות מתאר מורכב של יחסי-גומלין עם תרופות אחרות [6]. בנוסף, החולים היו חשופים לא רק לתופעות הלוואי של הטיפול השגרתי אלא גם לתופעות הלוואי של התרופות החדשות, שכללו אנמיה (Anemia) קשה, פריחות, טעם מר בפה ותופעות שונות בפי הטבעת ובחלחולת (Anorectal).
בשנת 2012 אושר הטיפול בתרופות אלו בישראל במסגרת סל הבריאות לחולים עם גנוטיפ 1 של הנגיף שלא טופלו בעבר- חולים נאיביים לטיפול (Treatment-naive patients), עם דרגת פיברוזיס (Fibrosis) 2-4, או חולים שטופלו בעבר (מנוסים) עם כל דרגת פיברוזיס [7].
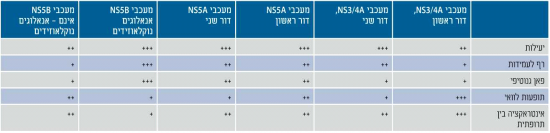
מאז אושרו לשימוש תרופות הדור הראשון, עמלו חברות התרופות הגדולות על פיתוח תרופות חדשות נגד הנגיף. הרצון היה שהתרופות החדשות יהוו שיפור תרופתי של מעכבי הפרוטאז מהדור הראשון או שיפעלו כנגד מטרות חדשות ושונות בגנום הנגיפי [8]. בין המטרות שנבחרו לטיפול ניתן למנות פרוטאזות נגיפיות (NS3/4A), חלבון לא-מבני מסוג 5A (NS5A ,Nonstructural Protein 5A) המהווה חלק ממערך השעתוק, חלבון לא-מבני מסוג 5B (NS5B ,Nonstructural Protein 5B) שהינו פולימרז נגיפי (Viral polymerase) ומספר מטרות במאכסן (HTA , Host Targeted Agents) אשר חשובות למחזור החיים הנגיפי. לבל אחת מהמטרות האלו יש תכונות שונות אשר משפיעות על יעילות הטיפול, הגנוטיפ המושפע, סף היווצרות העמידות ותופעות הלוואי.
המטרה הייתה ליצור תרופה או משלב תרופות עם יעילות גבוהה כנגד כל הגנוטיפים של הנגיף (Pan-genotypic), ללא צורך בשימוש באינטרפרון, עם עומס כדורים נמוך שיקל על נטילת הטיפול, סף גבוה לעמידות ומיעוט תופעות לוואי [9]. במהלך השנה האחרונה נכנסו לשימוש בעולם המערבי שתי תרופות מסוג DAA מהדור החדש, ובעתיד הקרוב צפויים להיכנס לשימוש מגוון רחב של תרופות ושילובים חדשים. הופעת התרופות החדשות לוותה בפרסום מאמרים רבים בעיתונות הרפואית המובילה של מחקרי שלב 3 אודות תרופות אלה. התרופות החדשות עומדות בציפיות שתלו בהן: הן יעילות מאוד, במרבית המקרים מביאות ל- SVR בלמעלה מ- 90% מהמטופלים, הן קלות לנטילה ובחלק מהמקרים מאפשרות לקיחה ללא אינטרפרון. בנוסף, הן בעלות מתאר בטיחות מצוין עם מיעוט תופעות לוואי [8].
סוגי הטיפולים התרופתיים החדשים
מעכבי פרוטאז נגיפי NS3/4A
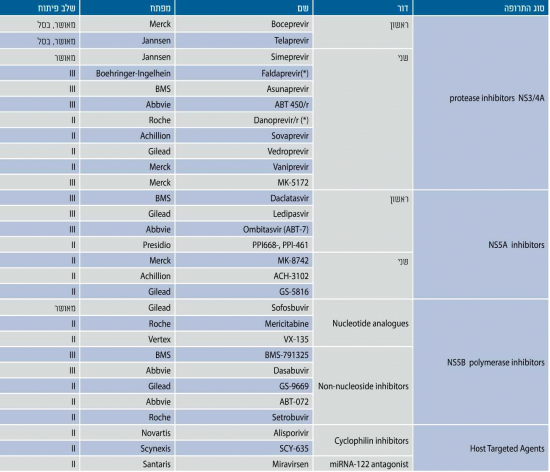
קבוצה זו הינה הנחקרת ביותר, כאשר תכשירים מהדור הראשון של מעכבי הפרוטאז היו הראשונים שאושרו לטיפול. תרופות הדור הראשון היו פעילות כנגד גנוטיפ 1 בלבד, בעלות סף נמוך להתפתחות עמידות ומגוון רחב של יחסי-גומלין בין-תרופתיים. חלק מחסרונות אלו הופחתו בדור השני הכולל את Olysio שכבר נמצאת בשימוש בארה"ב ואירופה. קיימים מעכבי פרוטאז רבים הנמצאים בשלבי אישור אחרונים לאחר שנבדקו במחקרים קליניים בשלב 3, ביניהם Faldaprevir, Sunvepra (Asunaprevir), 450-ABT ועוד.
מעכבי פרוטאז מהדור השני ניתנים בדרך כלל פעם עד פעמיים ביום וחלקם בעלי יעילות לגנוטיפים 2 ו- 4. עם זאת, הם עדיין סובלים מרף נמוך לעמידות ויחסי-גומלין בין-תרופתיים נרחבים. מרבית המחקרים בדקו את יעילות מעכבי הפרוטאז בשילוב עם אינטרפרון ו- Ribavirin, אך חלקם נבחנו גם בפרוטוקולים ללא שימוש באינטרפרון [10][11][12].
מעכבי חלבון ממערך השעתוק NS5A
חלבון NS5A הוא חלק ממערך השעתוק של הנגיף. פגיעה בו מעכבת הרכבה ושחרור של נגיפים מתאים נגועים. הדור הראשון של תרופות אלו כולל את Daklinza (Daclatasvir), Ombitasvir (ABT-267), Ledipasvir ועוד, ומתאפיין ביעילות כנגד גנוטיפים 1 ו- 4 עם רף בינוני לעמידות.
מעכבי NS5A מדור שני אשר נמצאים בשלבי פיתוח מוקדמים מראים יעילות גם כנגד גנוטיפים 2 ו- 3, אם כי עדיין ביעילות פחותה, ורף גבוה יותר לעמידות [13][14][15].
מעכבי פולימרז נגיפי NS5B
הפולימרז הנגיפי הינו החלבון השמור ביותר בין הגנוטיפים השונים ולכן מהווה מטרה מועדפת לטיפול. התרופות במשפחה זו מתחלקות לשתי קבוצות- אנלוגים לנוקלאוטידים-נוקלאוזידים (NUC ,Nucleotide/Nucleoside Analogs), ותכשירים שאינם אנלוגים לנוקלאוטידים-נוקלאוזידים (Non-NUC).
האנלוגים מצורפים על ידי הפולימרז הנגיפי לשרשרת ה- RNA הנגיפי וגורמים להפסקת תהליך השכפול. תרופות אלה יעילות נגד כל הגנוטיפים ובעלות רף עמידות גבוה מאוד, כיוון שתשניות (Mutations) שנוצרות בתהליך ברירה על ידי תרופות אלה יוצרות נגיפים בעלי יכולת שכפול פגומה. Sovaldi (Sofosbuvir) היא התרופה הראשונה שאושרה ממשפחה זו. התרופה היא בעלת יעילות גבוהה מאוד בחולים נאיביים, בחולים מנוסים ובחולים שאינם שחמתיים [16].
קבוצת Non-NUC תוקפת מטרות על גבי הפולימרז וגורמת לעיכוב פעולתו. תרופות אלו פעילות כנגד גנוטיפ 1 בלבד ורף העמידות שלהן נמוך [17].
תרופות נגד מטרות במאכסן
תרופות מקבוצה זו פועלות כנגד מטרות בתא המארח החיוניות למחזור החיים של הנגיף. לפיכך, הן יעילות כנגד כל הגנוטיפים ואינן גורמות להתפתחות עמידות.
הקבוצה הראשונה של תרופות אלה היא מסוג מעכבי ציקלופילין (Cyciophilin inhibitors). הציקלופילינים הם קבוצת אנזימים מסוג איזומרזות (Isomerase) אשר חיוניים לשכפול הנגיף. מספר תרופות אשר מעכבות את הציקלופילינים ללא יצירת דיכוי חיסוני נמצאות כעת בשלבי פיתוח [18].
קבוצת תרופות נוספת היא האנטגוניסטים ל- Mir-122 (Mir-122 antagonist), אשר פועלים כנגד RNA זעיר (Micro RNA) הנקשר לקצה '5 באזור הלא מתורגם (NTR-'5 ,Non-Translated Region-'5) של ה- RNA הנגיפי וחיוני להתחלה השעתוק לחלבון הארוך של הנגיף. קישור התרופה לאתר גורם לדיכוי שלב זה במחזור חיי הנגיף [19].
יעילות הטיפולים החדשים בשילוב אינטרפרון ו- Ribavirin עבור גנוטיפ 1
- Sovaldi (Sofosbuvir): התרופה אושרה לשימוש בארצות הברית ונמצאת בשימוש נרחב. השימוש בה מבוסס על מספר מחקרי שלב 3. מחקר NEUTRINOS [16] בדק את יעילות התרופה בטיפול ל- 12 שבועות בחולים נאיביים עם גנוטיפים 1 ו- 4 (ומספר מועט של חולים עם גנוטיפים 5 ו-6 ). ה- SVR הכללי עמד על 90%, עם יעילות מופחתת עבור גנוטיפ 1B (83%) ובחולים שחמתיים (80%). מתאר תופעות הלוואי לא היה שונה ממטופלים באינטרפרון ו- Ribavirin בלבד.
- Olysio (Simeprevir): התרופה שייכת לקבוצת מעכבי פרוטאז מהדור החדש. מחקרי ה- 1-2 QUEST [10][11] בדקו את יעילות הטיפול ב- Olysio, אינטרפרון (מסוג 2a ו- 2b) ו- Ribavirin לעומת אינטרפרון ו- Ribavirin בלבד בחולים נאיביים עם גנוטיפ 1, ומצאו SVR של כ- 80% בטיפול המשולב לעומת 50% בקבוצת האינטרפרון ו- Ribavirin בלבד. משך הטיפול ב- Olysio היה 12 שבועות, ומשך הטיפול באינטרפרון ו- Ribavirin נקבע לפי תגובה נגיפית (24 או 48 שבועות). 90% מהחולים הגיבו תגובה מהירה והיו יכולים להפסיק טיפול אחרי 24 שבועות. יעילות מופחתת הודגמה בחולים שחמתיים ובחולים עם גנוטיפ 1A והתשנית Q80K.
- מחקר PROMISE [23] בדק משלב דומה בחולים אשר טופלו בעבר, והדגים אחוזי SVR דומים. תופעות הלוואי העיקריות היו גרד ופריחה בכ- 10% מהחולים, ועליית רמות בילירובין (Bilirubin) בדם שיוחסה לחסימת משחלף בילירובין בצינורות המרה, ללא משמעות קלינית.
- Faldaprevir: שייכת לקבוצת מעכבי פרוטאז מהדור החדש. מחקרי ה- 1-3 STARTVerso [12] (מחקרים 1-2 עבור חולים נאיביים ומחקר 3 למנוסים) בדקו מינוני תרופה ומשכי טיפול שונים בגנוטיפ 1 בשילוב עם אינטרפרון ו- Ribavirin, ומצאו SVR של כ- 70%. לא הייתה השפעה משמעותית לתת-סוג הגנוטיפ או נוכחות התשנית Q80K. עקב אחוזי תגובה נמוכים יותר מתרופות אחרות בשוק, החליטה חברת BoehHnger-ingeihein שלא להמשיך עם שיווק התרופה בארץ.
- Sunvepra (Asunaprevir): שייכת לקבוצת מעכבי פרוטאז מהדור החדש [24]. מחקר בשלב 2 בדק את יעילות הטיפול ב- Sunvepra במינונים שונים עם אינטרפרון ו- Ribavirin למשך 48 שבועות בחולים נאיביים עם גנוטיפ 1. הטיפול היה יעיל, וערכי SVR נעו בין 80% ל- 92%, באשר תגובה טובה יותר נצפתה בגנוטיפ 1B.
- Daklinza (Daclatasvir): שייכת לקבוצת מעכבי NS5A. מחקרי COMMAND [13][14], מחקרי שלב 2, בדקו את יעילות הטיפול ב- Daklinza ביחד עם אינטרפרון ו- Ribavirin בגנוטיפים השונים ובמינונים שונים. הטיפול היה תלוי תגובה (Response guided therapy). תוצאות SVR שהתקבלו במחקר היו 59% עבור גנוטיפ 1A, 78-87% עבור גנוטיפ 1B, ,83% עבור גנוטיפ 2, 68% עבור גנוטיפ 3 ו- 67-100% עבור גנוטיפ 4.
- Mericitabine: התרופה שייכת לקבוצת מעכבי הפולימרז הנגיפי מסוג NUC [25]. התרופה נבדקה בשני מחקרים עם אינטרפרון ו- Ribavirin. מחקר JUMP-C בדק את יעילות השילוב מול אינבו (Placebo) בחולים נאיביים עם גנוטיפים 1 או 4. הטיפול היה תלוי תגובה ונמשך 24 או 48 שבועות [25]. תוצאות SVR היו 56% במטופלי Mericitabine, לעומת 36% במטופלי אינבו.
- במחקר נוסף, PROPEL, [26] נבדק טיפול קצר יותר של שמונה או 12 שבועות של Mericitabine במינונים שונים יחד עם אינטרפרון ו- Ribavirin מול אינבו. כל החולים המשיכו לקבל אינטרפרון ו- Ribavirin על פי תגובה לטיפול למשך 24 או 48 שבועות. תוצאות SVR בקבוצות הטיפול קצר-הטווח במינון הנמוך היו נמוכות מאלה של קבוצת הטיפול באינבו, ובקבוצת המינון הגבוה השתוו לקבוצת האינבו.
- שילובי תרופות: מספר מחקרים בדקו יעילות טיפול באינטרפרון, Ribavirin ושילוב של שתי תרופות חדשות (טיפול "מרובע"). מחקר שבדק טיפול ב- Sunvepra ו- Daklinza ביחד עם אינטרפרון ו- Ribavirin בעשרה חולים עם גנוטיפ 1 (מתוכם תשעה חולים עם גנוטיפ 1A) למשך 24 שבועות, הראה ערכי SVR של 95% [27].
- מחקר נוסף בדק את השילוב של Mericitabine ו- Danoprevir יחד עם אינטרפרון ו- Ribavirin והראה ערכי SVR גבוהים, אך המחקר אודות הטיפול בשתי התרופות הוקפא [28].
יעילות הטיפולים החדשים ללא אינטרפרון ו- Ribavirin עבור גנוטיפ 1
הטיפולים המאושרים כיום הם עדיין ברובם בשילוב עם אינטרפרון ו- Ribavirin. למרות זאת, שימוש מחוץ להתוויה (Off label) בשתי התרופות שכבר אושרו לטיפול מאפשר טיפול ללא אינטרפרון.
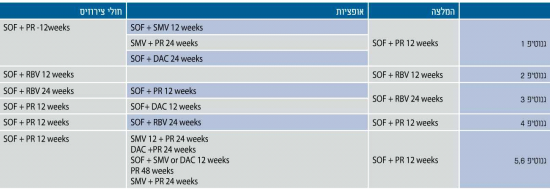
לאור היעילות הגבוהה, המתאר הבטיחותי הטוב ומיעוט יחסי-הגומלין הבין-תרופתיים של התרופות הישירות נגד HCV, קיימת אפשרות לשלב מספר תרופות יחד. בתקופה הקרובה צפוי אישור של שילובים רבים שהם פומיים וללא אינטרפרון, כאשר רובם יהיו גם ללא Ribavirin. השילוב הוא לרוב של מספר תרופות הפועלות באופן ישיר כנגד הנגיף ממשפחות שונות הפוגעות במטרות שונות בנגיף. שתי הגישות הקיימות כיום הן שילוב של תרופה עם רף גבוה לעמידות (בדרך כלל Sovaldi) עם תרופה בעלת רף נמוך לעמידות, או שילוב של שלוש תרופות ישירות נגד הנגיף עם רף נמוך לעמידות. שילובים אלה מקטינים מאוד את סכנת התפתחות זנים עמידים. קיימת גם אפשרות לשילוב תרופות ממשפחות שונות אשר פותחו בחברות שונות. ייתכן ומשלבים חדשים אלו יורכבו בעתיד באופן אישי לחולים לפי מאפיינים ייחודים להם.
- משלב Sovaldi ו- Ledipasvir: שתי תרופות אלו פותחו על ידי חברת Giiead, והשילוב כולל מעכב פולימרז מסוג NUC (Sovaldi) עם מעכב NS5A (Ledipasvir) בכדור בודד. מחקרי ה- ION [15][29][30] הם מחקרי שלב 3 רחבי היקף (1- חולים נאיביים, 2- חולים מנוסים) שבדקו את המשלב עם וללא Ribavirin למשך 12 ו- 24 שבועות. אחוז השחמתיים שהשתתפו במחקרים עמד על כ- 15%, וכ- 70% היו עם גנוטיפ 1A הנחשב לקשה יותר לטיפול. בכל המחקרים יעילות הטיפול הייתה 93-100%, ללא קשר לשימוש ב-Ribavirin או למשך הטיפול.
- מחקר ION-3 [15] בדק את האפשרות לטפל במשלב זה למשך שמונה שבועות בחולים נאיביים שאינם שחמתיים עם ובלי Ribavirin, לעומת טיפול למשך 12 שבועות. ערכי ה- SVR היו מעל 90% בכל קבוצות הטיפול. בקבוצת הטיפול הקצר ללא Ribavirin נצפו יותר אירועי חזרת הנגיף לאחר הפסקת הטיפול, אך ההבדל לא הגיע למובהקות סטטיסטית. המשלב הוגש לאישור מהיר במנהל המזון והתרופות האמריקאי (FDA ,Food and Drug Administration), אך עדיין לא אושר ואינו נמצא כרגע בשימוש קליני למעט בתכניות חמלה.
- מחקר ELRCTON-2 [31] בדק משלב זה עם ובלי Ribavirin למשך 12 שבועות בחולים לאחר כישלון טיפול קודם ב- Sovaldi ובחולים שחמתיים מתקדמים. תוצאות המחקר הראו SVR של כ- 65% בקבוצת השחמתיים, כאשר מרבית הכישלונות היו עקב חזרה הנגיף אחרי היעלמות ראשונית (Relapse).
- משלב Sovaldi ו- Olysio: מדובר בשילוב של תרופות המיוצרות על ידי חברות שונות (Janssen ו- Giiead בהתאמה), כצירוף של מעכב פולימרז (Sovaldi) ומעכב פרוטאז (Olysio). השילוב נבדק במחקרי 1-2 Cosmos עם ובלי Ribavirin למשך 12 או 24 שבועות בשתי קבוצות חולים עם גנוטיפ 1 [32]. הקבוצה הראשונה כללה חולים שלא הגיבו לטיפול קודם באינטרפרון ו- Ribavirin עם דרגת פיברוזיס נמוכה, והקבוצה השנייה כללה חולים נאיביים וחולים שלא הגיבו לטיפול קודם עם דרגת פיברוזיס גבוהה. לא נמצא הבדל בין גנוטיפים A ו- B, וכמו כן לא נמצא הבדל בין הקבוצות שטופלו עם וללא Ribavirin. חולים שחמתיים שנכשלו בטיפול בעבר נזקקו לטיפול ארוך יותר, והימצאות התשנית Q80K בגנוטיפ 1A הורידה את יעילות הטיפול. למרות שמדובר בטיפול שהוא מחוץ להתוויה בארצות הברית (מכיוון שהתרופות לא נרשמו לשימוש משותף אלא לטיפול עם אינטרפרון ו- Ribavirin עבור כל אחת מהן בנפרד), הרי שהשילוב נמצא בשימוש רחב בארצות הברית ובחלק מארצות אירופה.
- משלב Sovaldi ו- Daklinza: שילוב תרופות המיוצרות על ידי חברות שונות, Giiead (Sovaldi) ו- BMS (Daklinza, מעכב NS5A). מחקר A1444040 בדק את הטיפול במשלב זה בחולים עם גנוטיפ 1 שהיו נאיביים או שנכשלו בטיפול קודם במעכבי פרוטאז למשך 24 שבועות עם או ללא Ribavirib [33]. ערכי SVR היו מעל 95% בכל קבוצות החולים הללו. Daklinza אושרה לשימוש ביפן ומועמדת לאישור באירופה.
- משלב Ombitasvir, Dasabuvir ו- ABT-450/r: משלב של חברת Abbvie הכולל מעכב פרוטאז (ABT-450/r) מתוגבר על ידי Norvir (Ritonavir), שהיא תרופה שמטרתה להתחרות באנזים הקשור בחילוף החומרים של מעכב הפרוטאז ועל ידי כך מאפשרת שימוש במינון נמוך יותר של המעכב, ביחד עם מעכב NS5A (Ombitasvir) ומעכב פולימרז מסוג Non-NUC (Dasabuvir). התרופות נבדקו במחקר 2&1-SAPPHIRE, מחקר שלב 3 רחב היקף בחולים נאיביים או מנוסים ללא שחמת עם גנוטיפ 1 יחד עם Ribavirin למשך 12 שבועות [34][35], וכמו כן נבדק המשלב במחקר 3&2 PEARL ללא Ribavirin [36][37] ובמחקר 2-Torqouise בחולים שחמתיים מנוסים או נאיביים במשך 12 או 24 שבועות [38]. בכל המחקרים הללו אחוזי ה- SVR היו מעל 90%, עם מתאר היענות ותופעות לוואי מצוין. המחקרים הראו שבחולים שחמתיים מנוסים או בחולים עם גנוטיפ 1A הייתה יעילות מוגברת בהארכת הטיפול ל-24 שבועות [37].
- משלב Daklinza ו- Sunvepra: משלב של חברת BMS הכולל מעכב NS5A (Daklinza) ומעכב פרוטאז מהדור החדש (Sunvepra). במחקר HALLMARK-DUAL [39], מחקר שלב 3, נכללו חולים מגנוטיפ 1B בלבד, שהיו נאיביים או שנכשלו בעבר בטיפול באינטרפרון ו- Ribavirin (Null and partial respondent), או חולים שלא יכלו לקבל אינטרפרון ו- Ribavirin בגלל תופעות לוואי (ירידה ברמת הטסיות, הפרעות פסיכיאטריות ועוד). המחקר נמשך 24 שבועות. בעוד שבקבוצת החולים הנאיביים אחוזי ה- SVR עמדו על כ- 90%, בשתי הקבוצות האחרות האחוזים עמדו על כ- 80%. מתאר תופעות הלוואי היה נסבל ודומה בין קבוצות החולים השונות.
- 'משלב Daklinza, Sunvepra ו- BMS791325: שילוב של חברת BMS הכולל Daklinza ו- Sunvepra ביחד עם BMS79I325 שהוא מעכב פולימרז מסוג Non-NUC, ללא אינטרפרון וללא Ribavirin. נבדקו 66 חולים עם גנוטיפ 1 ללא שחמת, שטופלו למשך 12 או 24 שבועות. מרבית החולים היו עם גנוטיפ 1A ועם גנוטיפ שלא היה CC בגן ל- IL-28B, המאפיין אוכלוסיה קשה לטיפול. ערכי SVR היו 92% בכל האוכלוסיות במחקר וללא תופעות לוואי משמעותיות [40].
- משלב MK5172 ו- MK8742: משלב של חברת MSD הכולל מעכב פרוטאז מדור שני (MK5172) ומעכב NS5A מדור שני (MK8742). הטיפול נוסה בחולים נאיביים ללא שחמת למשך שמונה או 12 שבועות עם ובלי Ribavirin. ערכי SVR היו מעל 90% בקבוצות שטופלו במשך 12 שבועות ללא קשר לתוספת Ribavirin. לעומת זאת, בקבוצה שטופלה במשך שמונה שבועות, ערכי SVR עמדו על 83%. מחקר דומה אך למשך 12 ו- 18 שבועות מתנהל בתקופה זו בחולים שחמתיים וחולים שלא הגיבו לטיפול קודם. תוצאות ביניים מראות ערכי דיכוי נגיפי של מעל 95% תחת הטיפול [41].
סוגיות עתידיות
- העלות הגבוהה של הטיפולים החדשים תצריך דיון מקצועי וכלכלי בהתוויות ובתזמון להתחלת טיפולים אלו. מדובר בתרופות יקרות מאוד, וקורסים טיפוליים בתרופות שכבר אושרו מתומחרים בארצות הברית בעשרות אלפי דולרים [42]. מחירי התרופות שטרם אושרו לא פורסמו אך סביר להניח כי טווח המחירים לא יהיה שונה, ומשלבי תרופות יעלו אף יותר, לעתים מעל 100,000 דולר לטיפול. הערכות מדברות על עלות גבוהה ביותר בכדי לרפא את אוכלוסיית נשאי HCV העולמית, המונה כ- 200 מיליון אנשים. ניסיונות להורדת עלות הטיפול כוללים אישור ייצור תרופות סוגניות (Generic drugs) במדינות עולם שלישי [43], קיצור משך הטיפול, טיפול שלא בידי מומחה וסבסוד ממשלתי.
- למרות ההתקדמות האדירה שחלה בטיפול ב- HCV, קיימות עדיין מספר בעיות שלא באו על פתרונן. באוכלוסיות קשות לטיפול, כגון חולים שחמתיים שנכשלו בטיפול קודם, חולים עם נגיף מגנוטיפ 3 עם שתמת, חולים עם שחמת שאינה מפוצה על סיבוכיה (מיימת, אנצפלופתיה ועוד) וחולים עם מחלת כליות מתקדמת, אחוזי התגובה עדיין אינם טובים ומצריכים מחקר ופיתוח נוספים.
- הבעיה העיקרית היא זיהוי חולי HCV. מרבית החולים בעולם אינם יודעים כלל על נשאותם ולכן דגש מיוחד מכוון לסקירת האוכלוסייה (Screening) במטרה לזהות חולים אלה.
ביבליוגרפיה
- ↑ Hajarizadeh B, Grebely J, Dore GJ. Epidemiology and natural history of HCV infection.Nat Rev Gastroenterol Hepatol. 2013 Sep;10(9):553-62.
- ↑ Fried MW, Shiffman ML, Reddy KR, Smith C, Marinos G, Gonzales FL Jr, Haussinger D, Diago M, Carosi G, Dhumeaux D, Craxi A, Lin A, Hoffman J, Yu J. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med. 2002 Sep 26:347(131:975-82.
- ↑ Scheel TK, Rice CM. Understanding the hepatitis C virus life cycle paves the way for highly effective therapies. Nat Med. 2013 Jul;19(7):837-49. doi: 10.1033/ nm.3248.
- ↑ Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, Poordad F, Goodman ZD, Sings HL, Boparai N, Burroughs M, Brass CA, Albrecht JK, Esteban R; HCV RESPOND-2 Investigators. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med. 2011 Mar 31 ;364(131:1207-17,
- ↑ Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, Focaccia R,Younossi Z, Foster GR, Horban A, Ferenci P, Nevens F, Mullhaupt B, Pockros P.Terg R, Shouval D, van Hoek B, Weiland O, Van Heeswijk R, De Meyer S, LuoD.Boogaerts G, Polo R, Picchio G, Beumont M; REALIZE Study Team. Telaprevir forretreatment of HCV infection. N Engl J Med. 2011 Jun 23;364(25):2417-28.
- ↑ 6. Hezode C, Fontaine H, Dorival C, Zoulim F, Larrey D, Canva V, De Ledinghen V, Poynard T, Samuel D, Bourliere M, Alric L, Raabe JJ, Zarski JP, Marcellin P, Riachi G, Bernard PH, Loustaud-Ratti V, Chazouilleres O, Abergel A, Guyader D, Metivier S, Tran A, Di Martino V, Causse X, Dao T, Lucidarme D, Portal I, Cacoub P, Gournay J, Grando-Lemaire V, Hillon P, Attali P, Fontanges T, Rosa I, Petrov-Sanchez V, Barthe Y, Pawlotsky JM, Pol S, Carrat F, Bronowicki JP; CUPIC Study Group. Effectiveness of telaprevir or boceprevir in treatment-experienced patients with HCV genotype 1 infection and cirrhosis .Gastroenterology, 2014 J ul;147(1 ):132-142
- ↑ 1/12 'משרד הבריאות, חוזר המנהל הבדלי מס. http://www.health.gov.il/hozer/mk01_2012.pdf. Retrieved 29.6.2014
- ↑ 8.0 8.1 Pawlotsky JM. New hepatitis C therapies: the toolbox, strategies, and challenges. Gastroenterology. 2014 May;146(5):1176-92. Epub 2014 Mar 12.
- ↑ Gane E, Future perspectives: towards interferon-free regimens for HCV, AntivirTher, 2012;17:1201-10.
- ↑ 10.0 10.1 Jacobson I, Dore GJ, Foster GR, et al. Simeprevir (TMC435) with peginterferon/ribavirin for chronic HCV genotype-1 infection in treatment-naive patients: results from QUEST-1, a phase III trial. J Hepatol 2013:58:5574.
- ↑ 11.0 11.1 Manns M, Marcellin P, Poordad F, et al. Simeprevir (TMC435) with peginterferon/ribavirin for treatment of chronic HCV genotype-1 infection in treatment-naive patients: results from QUEST-2, a phase III trial.J Hepatol 2013:58:5568.
- ↑ 12.0 12.1 Jensen DM, Asselah T, Dieterich DT, et al. A pooled analysis of two randomized, double-blind placebo controlled phase III trials (STARTVerso 1 & 2) of faldaprevir plus pegylated interferon alfa-2a and ribavirin in treatment-na'ive patients with chronic hepatitis C genotype-1 infection. Hepatology 2013;58(Suppl 1): 734A-735A.
- ↑ 13.0 13.1 Hezode C, Hirschfield GM, Ghesquiere W, et al. Daclatasvir, an NS5A replication complex inhibitor, combined with peginterferon alfa-2a and ribavirin in treatment-naive HCV genotype 1 or 4 subjects: phase 2b COMMAND-1 5VR12 results. Hepatology 2012; 56(Suppl 1):553A-554A.
- ↑ 14.0 14.1 Dore GJ, Lawitz E, Hezode C, et al. Daclatasvir combined with peginterferon alfa-2a and ribavirin for 12 or 16 weeks in patients with HCV genotype 2 or 3 infection: COMMAND GT2/3 study. J Hepatol 2013:58: S570-S571.
- ↑ 15.0 15.1 15.2 Kowdley KV, Gordon SC, Reddy KR, Rossaro L, Bernstein DE, Lawitz E, ShiffmanML, Schiff E, Ghalib R, Ryan M, Rustgi V, Chojkier M, Herring R, Di Bisceglie AM, Pockros PJ, Subramanian GM, An D, Svarovskaia E, Hyland RH, Pang PS, Symonds WT, McHutchison JG, Muir AJ, Pound D, Fried MW; ION-3 Investigators. Ledipasvir and sofosbuvir for 8 or 12 weeks for chronic HCV without cirrhosis.N Engl J Med. 2014 May 15;370(20}:1879-88
- ↑ 16.0 16.1 Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013;368:1878-1887.
- ↑ Gentile I, Buonomo AR, Borgia G. Dasabuvir: A Non-Nucleoside Inhibitor of NS5B for the Treatment of Hepatitis C Virus Infection. Rev Recent Clin Trials. 2014 May 29. [Epub ahead of print]
- ↑ Madan V, Paul D, Lohmann V, Bartenschlager R. Inhibition of HCV replication by cyclophilin antagonists is linked to replication fitness and occurs by inhibition of membranous web formation. Gastroenterology. 2014 May;146(5);1361-72.e1-9.
- ↑ Janssen HL, Reesink HW, Lawitz EJ, Zeuzem S, Rodriguez-Torres M, Patel K, van Der Meer AJ, Patick AK, Chen A, Zhou Y, Persson R, King BD, Kauppinen S, Levin AA, Hodges MR. Treatment of HCV infection by targeting microRNA. N Engl J Med.2013 May 2;368(18):1685-94.
- ↑ AASLD / IDSA Recommendations for Testing, Managing, and Treating Hepatitis C. http://www.hcvguidelines.org/printpdf/28 accessed 24.6.2014
- ↑ 28. Miller MH, Agarwal K, Austin A, Brown A, Barclay ST, Dundas P, Dusheiko GM, Foster GR, Fox R, Hayes PC, Leen C, Millson C, Ryder SD, Tait J, Ustianowski A, Dillon J F. Review article: 2014 UK consensus guidelines - hepatitis C management and direct-acting anti-viral therapy. Aliment Pharmacol Ther, 2014 Jun;39(12
- ↑ EASL Recommendations on Treatment of Hepatitis C 2014 J Hepatol. 2014 May 10. http://www.easl.eu/_newsroom/latest-news/easl-recomrr1endations-on-treatment-of-hepatitis-c-2014 accessed 24.6.2014
- ↑ Forns X, Lawitz E, Zeuzem S, Gane E, Bronowicki JP, Andreone P, HorbanA, Brown A, Peeters M, Lenz O, Ouwerkerk-Mahadevan S, Scott J, De La Ross G.Kalmeijer R, Sinha R, Beumont-Mauviel M. Simeprevir With Peginterferon and Ribavirin Leads to High Rates of SVR in Patients With HCV Genotype 1 Who Relapsed After Previous Therapy: A Phase 3 Trial. Gastroenterology. 2014 Jun;146(7):1669-1679
- ↑ Bronowicki JP, Pol S, Thuluvath PJ, Larrey D, Martorell CT, Rustgi VK, Morris DW, Younes Z, Fried MW, Bourliere M, Hezode C, Reddy KR, Massoud 0, Abrams GA, Ratziu V, He B, Eley T, Ahmad A, Cohen D, Hindes R, McPhee F, Reilly B, Mendez P, Hughes E. Randomized study of asunaprevir plus pegylated interferon-a andribavirin for previously untreated genotype 1 chronic hepatitis C. AntivirTher. 2013;18(7):885-93
- ↑ 25.0 25.1 Torres DM, Harrison SA. Small steps toward a better treatment for chronic hepatitis C infection: mericitabine, pegylated interferon, and ribavirin in the PROPEL and JUMP-C trials. Hepatology. 2013 Aug;58(2):488-90.
- ↑ Jensen D, Wedemeyer H, Herring R, et al. High rates of early viral response, promising safety profile and lack of resistance-related breakthrough in HCV GT 1/4 patients treated with RG7128 plus PeglFN alfa-2a (40KDI/RBV: planned week 12 interim analysis from the PROPEL study. Hepatology 2010; 52 (Suppl. 4): A360
- ↑ Lok AS, Gardiner DF, Hezode C, Lawitz EJ, Bourliere M, Everson GT, Marcellin P, Rodriguez-Torres M, Pol S, Serfaty L, EleyT, Huang SP, Li J, Wind-Rotolo M,Yu F, McPhee F, Grasela DM, Pasquinelli C. Randomized trial of daclatasvir and asunaprevir with or without PeglFN/RBV for hepatitis C virus genotype 1 null responders. J Hepatol. 2014 Mar;60(3):490-9
- ↑ Feld JJ, Jacobson IM, Jensen DM, et al. Up to SVR4 100% rates with ritonavir-boosted danoprevir (DNVr), mericitabine (MCB) and ribavirin (R) /- peginterferonalfa-2a (40KDI
- ↑ Afdhal N, Zeuzem S, Kwo P, Chojkier M, Gitlin N, Puoti M, Romero-Gomez M, Zarski JP, Agarwal K, Buggisch P, Foster GR, Brau N, Buti M, Jacobson IM, Subramanian GM, Ding X, Mo H, Yang JC, Pang PS, Symonds WT, McHutchison JG, Muir A J, Mangia A, Marcellin P; ION-1 investigators. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N Engl J Med. 2014 May 15;370(20}:1S89-98.
- ↑ Afdhal N, Reddy KR, Nelson DR, Lawitz E, Gordon SC, Schiff E, Nahass R, Ghalib R, Gitlin N, Herring R, Lalezari J, Younes ZH, Pockros PJ, Di Bisceglie AM, AroraS, Subramanian GM, Zhu Y, Dvory-Sobol H, Yang JC, ־ang PS, Symonds WT,McHutchison JG, Muir AJ, Sulkowski M, Kwo P; ION-2 Investigators. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med. 2014 Apr 17;370{l6):1483-93
- ↑ Gane E et al. Sofosbuvir/ledipasvir fixed dose combination is safe and effective in difficult to treat populations including geneotype-3 patients, decompensated genotype-1 patients and genotype-1 patients with prior sofosbuvir treatment experience. 49th EASL, 9-13 April 2014, London, Oral abstract 06. http://www.natap.org/2014/EASL/EASL_23.htm
- ↑ Jacobson I, Ghalib RH, Rodriguez-Torres M, et al. SVR results of a once-daily regimen of simeprevir (TMC435) plus sofosbuvir (GS-7977) with or without ribavirin in cirrhotic and non-cirrhotic HCV genotype 1 treatment naive and prior null responder patients; the COSMOS study. Hepatology 2013;58(Suppl 1):1379A.
- ↑ Bari K, Sharma P. Combination of Daclatasvir and Sofosbuvir for Hepatitis C Genotypes 1, 2, and 3.Gastroenterology.2014 Jun 19.pii: 50016-5085(14)00777-X.doi: 10.1053/j.gastro.2014.06.016. [Epub ahead of print]
- ↑ Feld JJ, Kowdley KV, Coakley E, Sigal S, Nelson DR, Crawford D, Weiland O, Aguilar H, Xiong J, Pilot-Matias T, DaSilva-Tillmann B, Larsen L, Podsadecki T, Bernstein B. Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med. 2014 Apr 24;370(17):1594-603.
- ↑ Zeuzem S, Jacobson IM, Baykal T, Marinho RT, Poordad F, Bourliere M, Sulkowski MS, Wedemeyer H, Tarn E, Desmond P, Jensen DM, Di Bisceglie AM, Varunok P, Hassanein T, Xiong J, Pilot-Matias T, DaSilva-Tillmann B, Larsen L, Podsadecki T, Bernstein B. Retreatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med. 2014 Apr 24;370
- ↑ Ferenci P, Bernstein D, Lalezari J, Cohen D, Luo Y, Cooper C, Tarn E, Marinho RT, Tsai N, Nyberg A, Box TD, Younes Z, Enayati P, Green S, Baruch Y, Bhandari BR, Caruntu FA, Sepe T, Chulanov V, Janczewska E, Rizzardini G, Gervain J, Planas R, Moreno C, Hassanein T, Xie W, King M, Podsadecki T, Reddy KR. ABT-450/r-ombitasvir and dasabuvir with or without ribavirin tor HCV. N Engl J Med. 2014 May 22;370(21
- ↑ 37.0 37.1 Andreone P, Colombo MG, Enejosa JV, Koksal I, Ferenci P, Maieron A, Miillhaupt B, Horsmans Y, Weiland O, Reesink HW, Rodrigies L Jr, Hu YB, Podsadecki T, Bernstein B. ABT-450, Ritonavir, Ombitasvir, and Dasabuvir Achieves 97% and 100% Sustained Virologic Response With or Without Ribavirin in Treatment-Experienced Patients With HCV Genotype lb Infection. Gastroenterology. 2014 May 9. pii:S0016-5085(14
- ↑ Poordad F, Hezode C, Trinh R, Kowdley KV, Zeuzem S, Agarwal K, Shiffman ML, Wedemeyer H, Berg T, Yoshida EM, Forns X, Lovell SS, Dasilva-Tillmann B, Collins CA, Campbell AL, Podsadecki T, Bernstein B. ABT-450/r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med. 2014 May 22;370(21):l973-82
- ↑ All-Oral Dual Therapy With Daclatasvir and Asunaprevir in Patients With HCV Genotype lb Infection: Phase 3 HALLMARK-DUAL Study Results.49th EASL, 9-13 April 2014, London. Oral abstract 0166. http://www.natap.org/2014/ EASL/EASL_25.htm
- ↑ Everson GT, Sims KD, Rodriguez-Torres M, Hezode C, Lawitz E, Bourliere M, Loustaud-Ratti V, Rustgi V, Schwartz H, Tatum H, Marcellin P, Pol S, Thuluvath PJ, Eley T, Wang X, Huang SP, Mc Phee F, Wind-Rotolo M, Chung E, Pasquinelli C, Grasela DM, Gardiner DF. Efficacy of an interferon- and ribavirin-free regimen of daclatasvir, asunaprevir, and BMS-791325 in treatment-naive patients with HCV genotype 1 infection. Gastroenterology. 2014 Feb;146(2):420-9.
- ↑ C Hezode, L Serfaty, JM Vierling, et al. Safety and efficacy of the all-oral regimen of MK-5172/MK-8742 +/- ribavirin in treatment-naive, non-cirrhotic, patients with hepatitis C virus genotype 1 infection: the C-WORTHY study. 49th EASL, 9-13 April 2014, London. Oral Abstract O10. http://www.natap.org/2014/EASL/EASL_15.htm
- ↑ Hoofnagle JH, Sherker AH. Therapy for hepatitis C--the costs of success. N Engl J Med. 2014 Apr 17;370(16):1552-3
- ↑ Jayasekera CR, Barry M, Roberts LR, Nguyen MH. Treating hepatitis C in lower-income countries. N Engl J Med. 2014 May 15;370(20):1869-71.
קישורים חיצוניים
- חידושים בטיפול בנגיף דלקת הכבד מטיפוס C, TheMEDICAL
המידע שבדף זה נכתב על ידי ד"ר אורן שבולת וד"ר עידו בר ישי, יחידת הכבד, המכון למחלות דרכי העיכול והכבד, המרכז הרפואי ת"א


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק