מחלת פומפה - מחלת אגירת גליקוגן מסוג 2 - Pompe disease - glycogen storage disease type 2
הופניתם מהדף Pompe disease לדף הנוכחי.
| מחלת פומפה - מחלת אגירת גליקוגן מסוג 2 | ||
|---|---|---|
| Pompe disease - glycogen storage disease type 2 | ||
| ||
| שמות נוספים | GSD-II, Glycogen storage disease type II | |
| ICD-10 | Chapter E 74.0 | |
| ICD-9 | 271.0 | |
| MeSH | D006009 | |
| יוצר הערך | פרופ' חנה מנדל | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות אגירה
מחלת פומפה (Pompe disease), המוכרת גם כמחלת אגירת גליקוגן מסוג II (Glycogen storage disease type II), שייכת לקבוצת מחלות השריר המטבוליות (Metabolic muscle diseases). אגירת ה-Glycogen נובעת מחסר מלידה, מלא או חלקי, של האנזים הליזוזומלי (Lysosomal enzyme) Acid α (alpha)-glucosidase, הקרוי גם Acid maltase, ואחראי לאחד השלבים בפירוק ה-Glycogen בתוך תת-היחידה בתא הנקראת Lysosome. ה-Glycogen שנאגר ב-Lysosome גורם להרס הקרום שעוטף את ה-Lysosome. הפגיעה בקרום מאפשר לאנזימים הרבים, שמצויים בתוך ה-Lysosome בסביבה חומצית מאוד, לצאת אל תוך ה-Cytoplasm של התא. פריצת האנזימים מה-Lysosome אל התא פוגעת בתא ובאברונים השונים שבו, ומביאה ולהרס מתקדם של רקמת השריר.
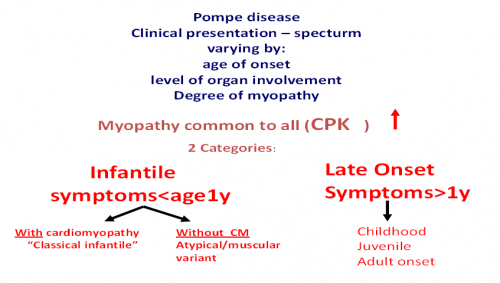
למחלת פומפה היקף קליני נרחב הכולל פגיעה מתקדמת בשרירי השלד, הנשימה ובשריר הלב. ניתן לחלק את ה-Phenotype הקליני של מחלת פומפה לשתי צורות עיקריות:
- Infantile onset ("הצורה הינקותית") - מחלה המופיעה בתינוק, על פי רוב מהלידה או בחודשי החיים הראשונים, ומערבת שרירי שלד, שרירי נשימה ואת שריר הלב
- Late-onset Pompe disease ("הצורה המאוחרת") - מחלה המערבת שרירי שלד ונשימה ללא מעורבות שריר הלב ויכולה להתבטא לראשונה בכל גיל (תינוק, פעוט, ילד ומבוגר)
ההבדלים העיקריים בין שתי הצורות הקליניות הם המעורבות הלבבית הקשה שקיימת רק בצורה הינקותית ואיננה קיימת במבוגרים ובקצב התקדמות המחלה. הצורה הינקותית, שמתבטאת בתוך ימים עד שבועות מהלידה, מתקדמת במהירות ודורשת אבחנה מהירה ומתן טיפול בזמן. הצורה המאוחרת מתקדמת לאט יותר, וקצב ההתקדמות שונה מפרט לפרט, ולכן העיתוי להתחלת טיפול מבוסס על התסמינים הקליניים של החולה (תמונה 1).
כמעט בכל החולים מוצאים עלייה ברמת ה-CPK (Creatine PhosphoKinase) בבדיקת דם ביוכימית "שגרתית" (על פי רוב מוצאים עלייה גם באנזימים ALanine aminoTransferase) ALT), AST (ASpartate aminoTransferase) , ו-LDH (Lactate DeHydrogenase) שיכולים להצביע על מעורבות כבד ו/או שריר, בעוד שעלייה ברמת ה-CPK מצביעה באופן ספציפי על מחלת שריר שלד ו/או לב).
מתחילת שנות האלפיים קיים טיפול למחלת פומפה באמצעות האנזים החלופי Myozyme (Sanofi-Genzyme). תרופה זו שינתה את מהלך המחלה ממחלה חשוכת-מרפא שממנה נפטרו בעבר תינוקות רבים לפני גיל שנה, למחלת שריר כרונית (Chronic). יעילות הטיפול מותנית בראש ובראשונה באבחון מהיר ובמתן טיפול בזמן. אולם, במהלך השנים הולך ומצטבר בספרות הרפואית מידע אודות גורמים שונים, גנטיים (Genetic), סביבתיים ואחרים, המשפיעים על מהלך המחלה ועל ההסתמנות הקלינית ארוכת השנים.
אפידמיולוגיה
מחלת פומפה היא מחלה נדירה (מחלה יתומה) אשר שכיחותה באוכלוסיה הכללית מוערכת כ-1:40,000 [1], [2]. שכיחותה בישראל, בקרב הציבור הערבי והדרוזי, מוערכת בכ-1:20,000, בשל האחוז הגבוה של נישואי קרובים במגזר זה. שכיחותה של מחלת פומפה בקרב המגזר היהודי נמוכה מזו המצויה במגזר הערבי והדרוזי.
עם זאת, ייתכן ששכיחות נמוכה זו נגרמת בשל העדר מודעות מספקת להסתמנות הקלינית של המחלה בצורתה המאוחרת (בילדים ובמבוגרים בגילאים שונים).
אטיולוגיה
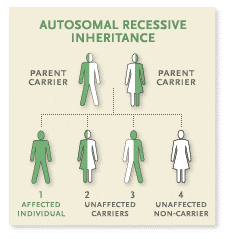
מחלת פומפה מועברת בתורשה Autosomal recessive. כלומר, שני הורים נשאים למוטציה (Mutation) בגן ה-α-glucosidase. מכאן, שבכל הריון, הסיכון ללידת ילד חולה להורים ששניהם נשאים למוטציה הוא 4:1 (או 25 אחוזים) (תמונה מספר 2).
זיהוי המוטציות הגורמות למחלת פומפה במגזרים השונים בישראל מאפשר מתן ייעוץ גנטי לבני משפחה קרובים ורחוקים, ובעתיד ניתן יהיה לכלול נתונים אלה במרכזים הגנטיים בישראל.
קליניקה
סימני המחלה וקצב הופעתם יהיו שונים באם יחלו ביטויים בשנת החיים הראשונה או לאחריה. לפיכך, כאמור, נהוג לחלק את המחלה לשתי צורות עיקריות: צורת ההופעה הינקותית, כאשר סימני המחלה מופיעים בשנה הראשונה לחיי הילד, ולמעשה בחודשים הראשונים לחייו, וכוללת Cardiomyopathy. לעומתה, צורת ההופעה המאוחרת (Late onset) המערבת שרירי שלד ונשימה, ועלולה להסתמן לראשונה בכל גיל: תינוקות, ילדים, נוער ומבוגרים.
הופעה ינקותית - Infantile onset Pompe disease
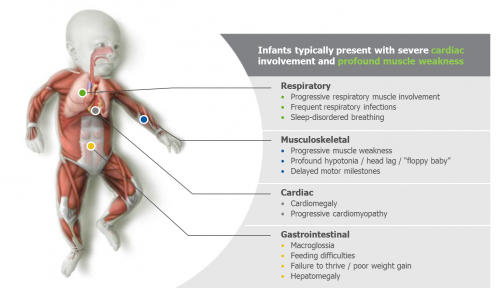
תינוקות אלה יופיעו עם חולשת שרירים והיפוטוניה (Hypotonia), המכונה גם Floppy baby, קוצר נשימה, וסימנים מתקדמים לאי ספיקת לב כבר בשבועות או בחודשים הראשונים לחייהם. לעתים קושי ביניקה, Macroglossia (לשון גדולה ומעובה), חוסר עלייה מספקת במשקל, ואיחור בהשגת אבני דרך התפתחותיות, הקשורים גם הוא בחולשת שרירים, עשויים לכוון לאבחנה. בתינוק עם היפוטוניה וחולשת שרירים יש לשלול Cardiomyopathy על ידי אקו לב (Echocardiogram) ואקג (Electrocardiogram, ECG). ב-94 אחוזים מהמקרים תתגלה Cardiomyopathy אשר תוביל לאי ספיקת לב מתקדמת. בתרשים ה-ECG ניתן למצוא מרווחי PR קצרים ומרווחי QRS רחבים [3]. סימן נוסף המחשיד למחלה מטבולית הוא הגדלת הכבד עקב צבירת Glycogen או כסימן מוקדם לאי ספיקת לב בתינוק. תינוקות אלה עלולים לסבול מזיהומים חוזרים במערכת הנשימה וקשיים בשינה על רקע של אוורור ריאתי לקויי וחולשת סרעפת.
התסמינים המופיעים על פי רוב בימים או בשבועות הראשונים לחיי התינוק מתוארים בתמונה מספר 3. ללא אבחון וטיפול מהיר ימותו תינוקות אלה בשנה הראשונה לחייהם מכשל לבבי או נשימתי[1]. לפיכך, קיימת חשיבות מכרעת למתן טיפול מהיר אשר יעילותו הרבה הוכחה כגורמת להקטנת מסת שריר הלב ובשיפור תפקודי הריאות, ובכך הוא מונע את המוות המוקדם [4], [5], [6].
הצירוף הקליני של תינוק ערני ויוצר קשר חברתי ביחד עם Macroglossia, היפוטוניה קשה של הגו ו-Cardiomyopathy, מעלים בראש ובראשונה חשד למחלת פומפה הינקותית.
הופעה מאוחרת – Late-onset Pompe disease
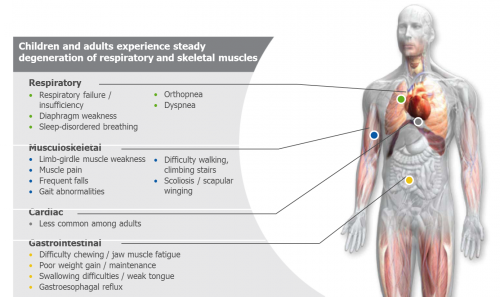
מחלת שרירים מתקדמת שאיננה מערבת את שריר הלב ועלולה להתבטא בתינוקות, ילדים ומבוגרים. החשד למחלת פומפה ייכלל באבחנה מבדלת בילדים ומבוגרים אשר סובלים מאחד או יותר מהתסמינים הבאים: חולשת שרירי שלד (בעיקר שרירים קריבניים), עייפות, קושי בעלייה במדרגות ובביצוע פעילות ספורטיבית, בעיות בהליכה, עצמות שכם שמוטות (Scapular winging), עקמת (Scoliosis), עיכוב התפתחותי, עיכוב בעלייה במשקל, בעיות בשינה (קוצר נשימה בעת שינה המתבטא באירועים רבים של יקיצה בלילה בשל תחושת חוסר אוויר), עייפות וכאבי ראש במהלך היום, וזיהומים חוזרים במערכת הנשימה [1], [7], [2], [3], [8].
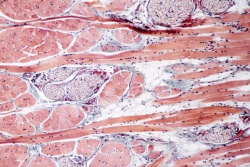
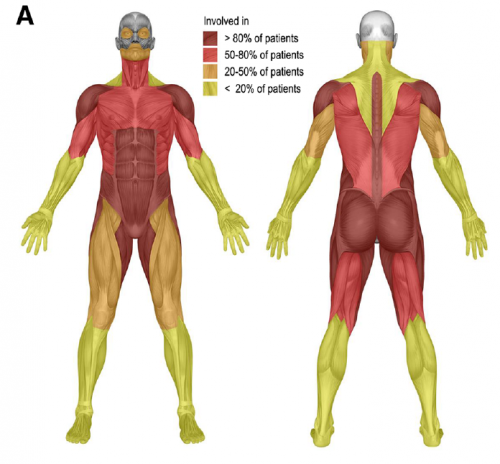
חולשת השרירים במחלת פומפה היא בעיקר חולשת שרירים קריבנית וחולשה של שרירי הנשימה (תמונה מספר 4). אין בהכרח התאמה בין הופעת חולשת השרירים הפרוקסימאלית והתסמינים הקשורים בחולשת שרירי הנשימה. בבדיקת EMG (Electromyography) ניתן יהיה לראות Myotonic discharges בשרירים הפרוקסימאלים והפאראספינאלים ׁ(Paraspinal muscles) (תמונה מס' 5) [9]. בבדיקת דם, חיוני לכלול בדיקת רמת האנזים CPK. עם זאת, רמת האנזים במחלת פומפה אינה מרשימה ועומדת על ערכים של פי 5-2 מהתקין[10]. יש חולים בהם רמת CPK עשויה להיות תקינה. לכן, במקרה של Myopathy בלתי מאובחנת, מומלץ לכלול בדיקת האנזים α-glucosidase בטיפת דם יבשה או בתאי דם הלבנים המופקים מדגימת דם ב-EDTA (Ethylenediaminetetraacetic acid).
אבחנה
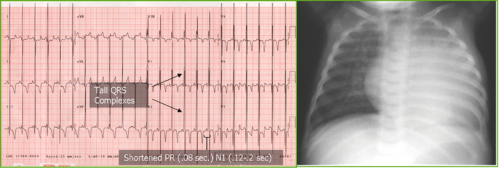
השלב הראשון באבחון מחלת פומפה הוא אנמנזה (Anamnesis) ובדיקה גופנית לזיהוי תסמינים ו/או ממצאים אשר מקורם במערכות הגוף השונות המעורבות במחלה: לב (בצורה הינקותית), שרירי שלד ונשימה, ריאות ומערכת העיכול. השלב הבא כולל בדיקות עזר: צילום חזה, ECG, ואקו-לב. בדיקות אלו חיוניות בעיקר בצורה הינקותית של מחלת פומפה. בצילום חזה ניתן לראות צל לב מוגדל, ב-ECG ניתן למצא מרווח PR מקוצר וקומפלקסים גבוהים של QRS (תמונה מס' 6). באקו לב נמצא Hypertrophic cardiomyopathy עם או ללא חסימה של מוצא חדר שמאל.
בכל הצורות של מחלת פומפה חיוני לכלול בבדיקות הדם בדיקת אנזימים כולל AST, ALT ו-CPK. רמה גבוהה של CPK בנסיוב (Serum) הוא סמן רגיש מאוד במחלת פומפה למרות שהבדיקה אינה סגולית. רמת ה-CPK בנסיוב בחלק מחולי פומפה בקבוצת ה-Late-onset עשויה להיות תקינה. הבירור של מחלת שריר כולל גם EMG והולכת עצב[12].
בחשד קליני למחלת שריר (בשילוב עם CPK מוגבר בדם), מומלץ לבדוק רמת פעילות האנזים α-glucosidase. בדיקת האנזים α-glucosidase מבוצעת בטיפת דם יבשה (במעבדה לביוכימיה קלינית בבית החולים רמב"ם, חיפה) ובדיקת פעילות ה- α-glucosidase בתאים לבנים מבוצעת בדגימת דם במבחנת EDTA (מבוצע במעבדה לאנזימים במחלקה לגנטיקה בהדסה עין כרם, ירושלים).
אישור האבחנה של פומפה מבוסס על ריצוף הגן GAA (Glycine-Alanine-Alanine) ועל זיהוי המוטציה/המוטציות גורמות המחלה. במקרה שהבדיקה האנזימטית לא נתנה אבחנה חד משמעית, ניתן לבצע ביופסיית (Biopsy) שריר להיסטולוגיה (Histology), היסטוכימיה (Histochemistry) ובדיקת רמת פעילות ה-GAA. בכ-20 אחוזים מחולי פומפה המבוגרים ביופסיית שריר עלולה להיות תקינה אם נלקחה מאזור שריר שלא נפגע במחלה. מומלץ ביצוע MRI (Magnetic Resonance Imaging) לשרירים ולבחור אזור חשוד כמעורב במחלה שממנו תילקח דגימת השריר [9].
אבחנה מבדלת:
האבחנה המבדלת של Myopathy כוללת רשימה ארוכה של מחלות עצב-שריר (ראו טבלה מספר 1) הכוללת, בין השאר, מחלת אגירת Glycogen מסוג IV ,V ו-III, מחלות מקבוצת ה-Dystrophies כולל Duchenne, או Limb girdle muscular dystrophy. המכנה המשותף לרוב מחלות השריר הוא רמת CPK מעל הנורמה (בין 400 ל-2,500).
| סימנים ותסמינים משותפים | אבחנה מבדלת |
|---|---|
| היפוטוניה, חולשת שרירים קריבניים מתקדמת, היעדר החזרים גידיים | Werdnig-Hoffmann disease Spinal Muscular Atrophy
(SMA type 1) |
| היפוטוניה, Macroglossia | תת-תריסיות |
| קוצר נשימה, קושי באכילה, Cardiomegaly, אי ספיקת לב | Endocardial fibroelastosis |
| Cardiomegaly | Myocarditis |
| היפוטוניה קשה וחולשת שרירים | Congenital muscular dystrophy |
| Cardiomegaly, Myopathy, רמה גבוהה של CPK | מחלת אגירת Glycogen מסוג III ומסוג IV |
| Hepatomegaly, חולשת שרירים, Cardiomegaly, רמה גבוהה של CPK | מחלות Mitochondrial / פגמים בשרשרת הנשימה |
| Cardiomegaly, Cardiomyopathy, Myopathy, Vacuolar glycogen storage | Danon disease |
| סימנים ותסמינים משותפים | אבחנה מבדלת |
|---|---|
| חולשת שרירים מתקדמת באגן, ברגליים ובכתפיים | Limb-girdle muscular dystrophy |
| חולשה מתקדמת של שרירים קריבניים, קושי מתקדם בנשימה, קשיים בהליכה, רמה גבוהה של CPK | Becker muscular dystrophy |
| חולשת שרירים מתקדמת מאחורי הברכיים ובכתפיים | Scapuloperoneal syndrome |
| חולשת שרירים כללית | Myasthenia gravis |
| חולשת שרירים לא-מאוזנת, ניוון של שרירים רצוניים | Spinal muscular atrophy |
| חולשת שרירים בלתי מוסברת | Polymyositis |
| היפוטוניה, Hepatomegaly, חולשת שרירים, רמה גבוהה של CPK | מחלת אגירת Glycogen מסוג III, IV, V, VII |
| Hypertrophic cardiomyopathy, Myopathy של שרירי השלד, Vacuolar glycogen storage | Danon disease |
| נוקשות/ כאבים בעת מאמץ שרירים | דלקת מפרקים שיגרונית (Rheumatoid arthritis) |
| היפוטוניה, החזרים גידיים חלשים, Hepatomegaly, ייתכן Hypertrophic cardiomyopathy, חולשת שרירים, רמה גבוהה של CPK | Mitochondrial myopathies |
טיפול
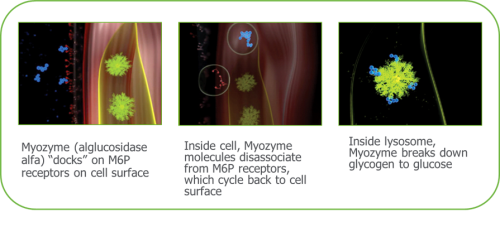
מחלת הפומפה היא מחלת השריר הראשונה שקיים עבורה טיפול. התרופה מבוססת על ייצור האנזים החסר α-glucosidase בשיטות Biotechnology מתקדמות. העיקרון באנזים החליפי הוא קישור של Mannose-6-phosphate לחלבון ה-Recombinant. סוכר זה מזוהה על ידי הקולטנים על קרומי התאים וה-Lysosome וכך מאפשר כניסת האנזים מזרם הדם אל תוך התאים (תמונה מס' 7).
הטיפול במחלת פומפה מבוסס על מתן אנזים חליפי, Myozyme, טיפול תומך המחייב צוות מומחים רב-תחומי למתן מענה לבעיות הרב-מערכתיות שהחולים מציגים [מומחה במחלות מטבוליות, נוירולוג (Neurologist), קרדיולוג (Cardiologist), מומחה ריאות, גסטרואנטרולוג (Gastroenterologist), פיזיותרפיסט (Physiotherapist) ודיאטנית קלינית].
הטיפול באנזים החליפי Myozyme, אשר פותח ומיוצר על ידי חברת Sanofi-Genzyme בשיטות של הנדסה גנטית, ניתן באמצעות עירוי, פעם בשבועיים במינון של 20 מיליגרם לקילוגרם. מאחר שמדובר בחולים הסובלים מירידה בתפקודי הריאות ולעתים גם מבעיות לבביות, הטיפול ניתן כיום רק במסגרת רפואית או במקום שבו קיימת זמינות לאמצעי החייאה [13].
מוטציות הגורמות למחלת פומפה והטיפול באנזים החליפי Myozyme:
כאמור, מחלת פומפה עוברת בתורשה Autosomal recessive. עד היום זוהו בעולם בסביבות 400 מוטציות מסוגים שונים הגורמות למחלה. ניתן לחלק את המוטציות לשתי קבוצות עיקריות:
- מוטציות "קשות" הגורמות לחסר מוחלט של יצירת חלבון ה-α-glucosidase
- מוטציות הגורמות לחסר חלקי ביצירת החלבון ולפגיעה בתפקודו
לעובדה זו חשיבות מרכזית בהחלטה על הפרוטוקול של הטיפול ב-Myozyme.
חולים עם מוטציות קשות שאינם מייצרים כלל את חלבון ה-α-glucosidase זכו לכינוי CRIM-negative (Cross Reactive Immune Material). חולה שאיננו מייצר כלל את החלבון α-glucosidase יזהה את ה-Myozyme כ"חלבון זר" ומערכת החיסון של החולה תגיב ביצירת נוגדנים כנגד ה-Myozyme. לכן, לפני העירוי הראשון של האנזים, חיוני לקבוע את המוטציה/ות וסטטוס ה-CRIM של החולה. חולים המסווגים כ-CRIM-negative מקבלים כיום קורס של טיפול Immunomodulators הכולל Rituximab, Methotrexate ו-IVIG (IntraVenous ImmunGlobulin)[14]. המעקב אחרי חולים אלה כולל בין השאר בדיקת רמת נוגדנים בנסיוב. מקרים נדירים מאוד של חולי פומפה שאינם CRIM שלילי פיתחו רמות גבוהות של נוגדנים ל-Myozyme שחייבו שינוי בפרוטוקול (Protocol) שמטרתו למנוע המשך יצירת נוגדנים ועיכוב השפעת הנוגדנים הקיימים.
בעולם הרחב רוב חולי הפומפה שייכים לקבוצה של ה"הופעה המאוחרת" ואחוז גבוה מהם נושאים מוטציה שכיחה c.-32-13 T > G שלא זוהתה בקרב החולים ממוצא ערבי ודרוזי בישראל. יותר מזה, רוב חולי פומפה בישראל סובלים מהצורה הינקותית או הצורה המאוחרת שהתגלתה בילדים צעירים בין גיל שנה עד חמש שנים. עד היום אובחנו בישראל רק שתי חולות בגיל 18 ובגיל 29 שנים. לא מן הנמנע שרק הגברת המודעות למחלת פומפה מסוג ה"הופעה המאוחרת" תאפשר אבחון חולים נוספים.
פרוגנוזה
המעקב הרפואי אחרי חולי פומפה בישראל מתקיים היום במספר מרכזים רפואיים ברחבי הארץ. בראש כל מרכז עומד רופא אשר התמחה באבחון ובטיפול במחלה פומפה (רופא מומחה במחלות מטבוליות, נוירולוג מומחה במחלות שריר או כל רופא מומחה אחר בתחומו). מאחר שמדובר במחלה רב-מערכתית, מומלץ להקים צוות של מומחים רב-תחומי שיכלול, בין השאר, קרדיולוג ילדים, נוירולוג, מומחה ריאות, פיזיותרפיסט, רופא אף אוזן גרון, מומחים בריפוי בעיסוק וקשיים בדיבור ודיאטנית מטבולית. בשל הנטייה לזיהומים בדרכי הנשימה, חשוב להקפיד על מתן חיסונים כולל חיסוני שפעת בגילים השונים וחיסון נגד Respiratory Syncytial Virus) RSV) (בתינוקות עם וללא Cardiomyopathy) וחיסוני שפעת עונתיים על פי המלצת משרד הבריאות בכל שנה.
במהלך העשור הראשון של המאה ה-21 טופלו 25 חולי פומפה ב-Myzozyme מישראל ומהרשות הפלשתינאית (Palestinian Authority). בחלק מהמשפחות מתו תינוקות רבים לפני עידן הטיפול באנזים החליפי. מרביתם מתו לפני גיל שנה. כיום, כל החולים מקבלים טיפול ב-Myzozyme פעם בשבועיים. מעקב אחרי החולים המטופלים מלמד שרובם לא רק ששרדו את שנות החיים הראשונות, אלא אף רכשו אבני דרך התפתחותיות בדרגות שונות כולל ישיבה, עמידה והליכה (הישגים שלא היו לפני עידן הטיפול באנזים החליפי). חלק מהמטופלים מתפקדים כילדים בריאים בני גילם (משתתפים במשחק כדורגל, קראטה ושחייה). עם זאת, במהלך מעקב רב שנים אחרי חולי פומפה בישראל למדנו להכיר Phenotype "חדש" לכאורה של חולי פומפה המטופלים באנזים חליפי במשך שנים רבות. "Phenotype חדש" זה מתאפיין בין השאר בירידה בשמיעה, דיבור אפי וחולשת שרירים מתקדמת בדרגות שונות (שרירי שלד ושירי נשימה). תסמינים אלה מכוונים לצורך להמשיך ולחקור ללא לאות את ה-Pathogenesis של המחלה ולחתור למציאת טיפולים חדשים עבור החולים. לאחרונה מצטברות עדויות שהכפלת המינון של ה-Myzozyme ל-40 מיליגרם לקילוגרם פעם בשבועיים עשויה לשפר את הפרוגנוזה של החולים [15].
יחד עם רופאים מומחים במחלת פומפה ברחבי העולם זוהו בעיות חדשות שנחשפו עם הזמן. בעיות אלו מחייבות מעקב וטיפול מתמיד של צוות מומחים רב-תחומי.
דגלים אדומים
ביבליוגרפיה
- Zhang et al. Clinical Chemistry 54:101725–1728 (2008)
- van der Beek et al. Orphanet Journal of Rare Diseases 2012, 7:88
- Vissing J, et al. JAMA Neurol. 2013 Jul;70(7):923-7
- ↑ 1.0 1.1 1.2 van der Ploeg Lancet. 2008 11;372(9646):1342-53.
- ↑ 2.0 2.1 Dasouki et al. Neurol Clin. 2014;32(3):751-76
- ↑ 3.0 3.1 Bembi et al. Neurology. 2008 2; 71:S12-36
- ↑ Kishnani et al. Neurology 2007; 68;99-109.
- ↑ Kishnani et al. Pediatr Res 2009;66;329-55
- ↑ Prater et al.; Genet Med 2012:14(9):800–810
- ↑ Lim et al. Front Aging Neurosci. 2014 23;6:177
- ↑ Toscano et al. Acta Myol. 2013;32(2):78-81.
- ↑ 9.0 9.1 Tania et al. Neurology 2014;82;e73-e75
- ↑ Desnuelle C et al. Curr Opin Neurol. 2011;24(5):443-8.
- ↑ מתוך המאמר van der Beek et al. Orphanet Journal of Rare Diseases 2012, 7:88.12
- ↑ Kishnani PS et al. Genet Med 2006;276-288
- ↑ SPC - EMA
- ↑ Banugaria SG et al. PLoS One. 2013 Jun 25;8(6)
- ↑ Case L.E et al. Neuromuscular Disorders 25 (2015) 321–332
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' חנה מנדל - מנהלת המרכז המטבולי לאבחון, טיפול, הוראה וחקר מחלות ביוכימיות- גנטיות, ורופאת ילדים ב"מאייר" - בית החולים לילדים שליד הקריה הרפואית רמב"ם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק