Uromodulin
| מדריך בדיקות מעבדה | |
| Uromodulin | |
|---|---|
| שמות אחרים | THP, Tamm-Horsfall protein, UMODADMCKD2, FJHN, HNFJ, HNFJ1, MCKD2, THG. |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | אבחון מפגעי כליה |
| טווח ערכים תקין | בדם-מעל 100 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
הגילוי והביולוגיה של UMOD
UMOD תואר לראשונה באופן עקיף על ידי Morner כבר בשנת 1895 ב-Skand Arch Physiol, אך חלפו למעלה מ-50 שנה עד שהעניין בו התעורר מחדש. בסוף שנות ה-40 חקר הוירולוג Igor Tamm מאוניברסיטת Rockefeller שיטות לעיכוב הדבקה על ידי נגיפים שונים, וגילה באקראי ביחד עם Frank Horsfall בשתן של אנשים בריאים חומר המעכב את ההמאגלוטינציה על ידי נגיפים, והם אפיינו חומר זה כ-mucoprotein ודווחו על כך ב- Proc Soc Exp Biol Med משנת 1950. שנתיים לאחר מכן פרסמו חוקרים אלה ב-J Exp Med שמוּקוֹפרוטאין זה הוא למעשה גליקופרוטאין המגיב עם נגיפים כגון influenza, mumps ונגיף New-Castle, ומאז נושא חלבון זה את שמם.
בהמשך נמצא שהחלבון THP נמצא בדגימות שתן של כל היונקים שנבדקו, ולא זו בלבד, אלא שבתנאים פיזיולוגיים הוא החלבון השכיח ביותר בשתן של האדם (Kumar ו-Muchmore ב-Kidney Int משנת 1990, ו-Nagaraj ו-Mann ב-J Proteome Res משנת 2011). בשנת 1985 דווחו Muchmore ו-Decker ב-Science על בידוד משתן של אישה בהיריון של גליקופרוטאין בעל משקל מולקולארי של 85,000 דלטון, וכינו אותו uromodulin על היותו בעל יכולת מודולציה ועיכוב של תגובה חיסונית in vitro. חלפו שנתיים ו-Pennica וחב' פרסמו ב- Science על זהות מוחלטת בין Tamm-Horsfall protein ו-Uromodulin, תוך שהדגישו שחלבון זה מבוטא רק בכליה, על ידי שיטות היברידיזציה שהראו נוכחות של UMOD-mRNA באופן בלעדי בתאים של הזרוע העבה העולה של לולאת Henle, עם התפשטות לאבוביות הדיסטאליות המפותלות (convoluted) במספר בעלי חיים.
רצף חומצות האמינו ומבנה המקטעים (domains) של UMOD
UMOD מסונתז כמולקולת קודמן (precursor) המורכבת מ-640 חומצות אמינו. הגליקופרוטאין הידוע כחלבון Tamm-Horsfall (להלן THP), הידוע גם כ-uromodulin (להלן UMOD), מקודד באדם על ידי הגן UMOD הממוקם על הזרוע הקצרה של כרומוזום 16, בעמדה 16p12.3 ולפי גרסה אחרת בעמדה p13.1116 (ע"פ Jeanpierre וחב' ב-Cytogenet Cell Genet משנת 1993). מסתבר ש-UMOD הוא החלבון המופרש בשתן בריכוזים הגבוהים מכל חלבון אחר במצבי בריאות מלאה (Lau וחב' ב-Int J Biol Sci משנת 2008).
החלבון UMOD נכנס למסלול ההפרשה שלו כאשר הוא קשור ל-GPI, כאשר הוא כבר עבר את תהליך הגליקוזילציה, וכאשר הוא ממוקם בממברנה האפיקאלית של תאי האפיתל. הצעד המגביל את קצב ההבשלה של UMOD, הוא תהליך העיבוד שלו ברטיקולום האנדופלזמי, כנראה בגלל מורכבות המבנה התלת-ממדי שלו המכיל יחסית הרבה שיירי ציסטאין (מדובר על 48 שיירי Cys המהווים 7% מהמספר הכולל של חומצות האמינו שלו). כל 48 שיירים אלה יוצרים 24 קשרים די-סולפידיים תוך-מולקולאריים מה שהופך את מולקולת לחלבון מאוד מכונס וקומפקטי (Serafini-Cessi וחב' ב-Biochem Biophys Res Commun משנת 1993). במרוצת 60 השנים האחרונות פורסמו מספר גרסאות לגבי המשקל המולקולארי של UMOD החל מ-85,000 דלטון, עבור ב-97,000 דלטון וכלה בגרסה העדכנית של 105,000 דלטון, מתוכם כ-30% הוא החלק הסוכרי הקשור לשלד הפפטידי על ידי N-גליקוזילציה וכן על ידי מיעוט קשרים על ידי O-גליקוזילציה (Easton וחב' ב-J Biol Chem משנת 2000). הנוכחות של חלק קרבוהידרטי כה ניכר במולקולת UMOD, חיונית לתכונותיו הפיזיקו-כימיות של חלבון זה כמו גם לתפקודיו הפיזיולוגיים (Hard וחב' ב-Eur J Biochem משנת 1992). ההרכב העשיר בסוכרים מקל על ספיחת החלבון למגוון גדול של ליגנדים, כמו תאים, גבישים, יונים, אימונוגלובולינים, חלבוני מיאלומה, וציטוקינים כגון IL-1 ו-TNF (ע"פ Kumar ו-Stein ב-Acute Renal Failure משנת 1995 עמ' 267-286, ו-Hession ב-Science משנת 1987). פוטנציאלית ישנן 8 נקודות על פני UMOD, בהו יכולה להתרחש N-גליקוזילציה, ומכאן אחוז הגליקוזילציה הגבוה יחסית של NMOD.
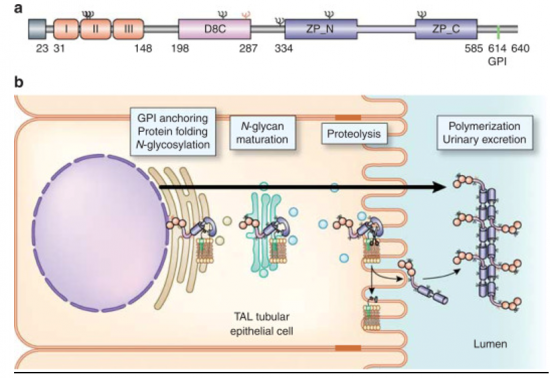
מבנה המקטעים (domains) של UMOD כולל בקצה ה-N טרמינאלי שלו את ה-leader peptide, המכוון את כניסת UMOD למסלול ההפרשה שלו, ואשר עובר ביקוע בשייר 23, ולאחריו שלושה מקטעים דמויי-EGF המסומנים בתרשים למטה כ-II, I, ו-III (חומצות אמינו 31-146) כאשר ההשערה היא שמתוך שלושת אלה, המקטעים EGF-II ו-EGF-III משמשים לקישור סידן. אחרי 3 מקטעי ה-EGF מופיע מקטע מרכזי בעל תפקיד בלתי ידוע המכונה C8C וזאת כיוון שהוא מכיל 8 שיירי ציסטאין, הנמשך מחומצת אמינו 198 עד 287), ואחריו 2 מקטעים המכונים ZP או zona pellucida), האחד מהם ZP_N ולאחריו ZP_C, ולקראת הקצה ה-C טרמינאלי בעמדה של חומצת אמינו 614 מתקיים הקישור של UMOD ל-glycosylphosphtidylinositol.
מקטעים דמויי-EGF נמצאים בחלבונים מופרשים וחוץ-תאיים רבים, וסבורים שתפקידם הוא בתהליכי ספיחה (adhesion), קואגולציה, וקישור ליגנדים לקולטניהם. ב-UMOD מקטעים דמויי-EGF אלה חיוניים לאינטראציות עם חלבונים אחרים. מקטע ZP מצוי במגוון של חלבונים חוץ-תאיים בבעלי חיים הנחשבים eukaryotic, והם חיוניים לפולימריזציה של חלבונים (Jovine וחב' ב-Nat Cell Biol משנת 2002). ואמנם, UMOD מופיע בשתן בעיקר כפולימר גבה-מולקולארי יכול להגיע עד משקל מולקולארי של מיליון דלטון, שמופיע במיקרוסקופ אלקטרוני כמשתית (matrix) המורכבת מפיברילות, ברוחב של כ-100 אנגסטרום, ואורך שיכול להגיע ל-25,000 אנגסטרום. בתלות בחוזק היוני של השתן, המשתיות של UMOD יכולות ליצור מבנים דמויי-ג'ל שאינם חדירים למים, אך מאפשרים תנועת יונים (Wiggins ב-Clin Chim Acta משנת 1987).
המבנה וההבשלה של uromodulin :
a) סכמת המבנה של UMOD; נקודות N- גליקוזילציה מסומנות בשחור. השייר של Asn בעמדה 274 אליו נקשרת השרשרת העתירה ב-mannose מסומן בצהוב. בינואר 2016 המבנה התלת-ממדי של UDOP נקבע לראשונה על ידי חוקרים במכון Karolinska .
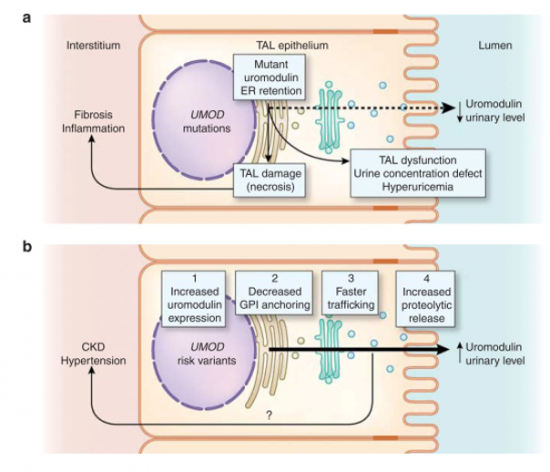
b) תהליך ההבשלה, ההפרשה והפולימריזציה של UMOD. חלבון זה מסונתז בתאי האפיתל של החלק העליון העבה של הזרוע העולה של לולאת Henle. לאחר תרגום החלבון הוא מוחדר לרטיקולום האנדופלזמי שם נוצרים הקשרים הדי-סולפידים הפנימיים שלו, מתרחשת ה-N גליקוזילציה שלו, כמו גם קישורו ל-GPI. ב-Golgi מתרחשת מודיפיקציה של השרשרות הקרבוהידרטיות, פרט לשרשרת עתירת ה-mannose הקשורה ל-Asn 274. הגעתו של UMOD לממברנת תאי האפיתל מתבצעת כאשר החלבון הוא בקונפורמציה של פולימר, הנשמרת על ידי האינטראקציה בין 2 ה-motifs ההידרופוביים (מסומנים באדום), שאחד מהם בתוך מקטע ZP, והשני ממוקם בין מקטע ZP לבין שייר 614 הנקשר ל-GPI. ביקוע פרוטאוליטי "פותח" את האינטראקציה ההידרופובית ליצירת מונומר המוחדר לפילמנטים הפולימריים.
התפקיד הפיזיולוגי של UMOD
UMOD הוא חלבון ספציפי של הכליה המיוצר ומבוטא באופן בלעדי על ידי שכבת תאי האפיתל של החלק העליון העבה של הזרוע העולה של לולאת Henle שהיא המשכית לאבובית המקורבת (proximal tubule) (ע"פ Bachmann וחב' ב-Histochemistry משנת 1990). UMOD ממוקם בעיקר בצד האפיקאלי של הממברנה (Bachmann וחב' ב-Histochemistry משנת 1985), יש גם עדויות למציאותו בצד הבאזו-לאטראלי של הזרוע העולה העבה (Peach וחב' ב-Histochem J משנת 1988). השחרור שלUMOD מהצד הבאזו-לאטראלי השתמע ממחקרים על נדידתו לאורך תאים אפיתליאליים, וכן מהעובדה שריכוזיו בדם נמוכים ביותר (Jennings וחב' ב- J Am Soc Nephrol משנת 2007). הפרשת UMOD בשתן מתקיימת לאחר ביקוע פרוטאוליטי של המקטע החיצוני של הקומפלקס בו מעוגןUMOD ל-GPI או glycophosphatidylinositol הממוקם על שטח הפנים הלומינאלי של לולאת Henle (ע"פ Rindler וחב' ב-J Biol Chem משנת 1991).
המציאות של UMOD ניתנת לגילוי כבר ביום ה-16.5 של הכליה המתפתחת בעובר של עכבר (Chen וחב' ב-BMC Nephrol משנת 2006). באדם,UMOD ניתן לזיהוי משבוע ההיריון ה-16 באנליזה אימונו-היסטוכימית, והחל משבוע 20 להיריון על ידי גילויו בנוזל מי השפיר (Zimmerhack וחב' ב-Pediatr Nephrol משנת 1996). הביטוי העוברי של UMOD גדל בהדרגה במקביל להבשלת החלק העליון העבה של הזרוע העולה של לולאת Henle עד לאחר הלידה. תקופת מחצית החיים של UMOD קצרה יחסית (בערך 9 שעות בארנבת ו-16 שעות באדם ע"פ Grant ו-Neuberger ב-Biochem J משנת 2003), זאת בגלל קצב הפרשתו הניכר לשתן שהוא 30-100 מיליגרם ליום במבוגר בתנאים פיזיולוגיים (Serafini-Cessi וחב' ב-Amer J Kidney Dis משנת 2003).
UMOD מופרש מהצד האפיקאלי של ממברנת תאי האפיתל לתוך ה-lumen של אבוביות הכליה, לאחר ביקוע פרוטאוליטי (Santambrogio וחב' ב-Biochem Biophys Res Commun משנת 2008). הביקוע חיוני לפולימריזציה של UMOD, כיוון שהוא משחרר motif מעכב המונע התכנסות (assembly) של החלבון טרם-עת (Schaeffer וחב' ב-Mol Biol Cell משנת 2009).
תפקידו הפיזיולוגי של חלבון זה עדיין לוט בערפל. הייתה השערה שיש לו תפקיד במאזן מים/אלקטרוליטים בזרוע העולה של לולאת Henle, שהייתה מבוססת על יכולת ההתמצקות שלו (הג'ליפיקציה), כמו גם על תכונות פיזיקו-כימיות שלו, ועל הראיות שהביטוי שלו גדל על ידי טיפול כרוני במשתן furosemide (שם מותג Lasix) הפועל על לולאת Henle בנפרון (Ying ו-Sanders ב-Kidney Int משנת 1998). אך ראיה ישירה יותר מגיעה ממחקרם של Renigunta וחב' ב-J Biol Chem משנת 2010, שהראו שהביטוי של UMOD מגדיל משמעותית את הפעילות של תעלת ROMK2 (שהיא תעלת האשלגן בכליה), על ידי אינטראקציה ישירה עם תעלה זו וסיוע להגעת התעלה לממברנת התאים. בעכברי knockout בהם קיים חסר של UMOD, גרם דווקא ל-upregulation של ROMK2, שנובע מהפחתת כמות תעלה זו בממברנת התא, והצטברותה במאגר הווסיקולארי. יחד עם זאת הספציפיות של השפעה זו של UMOD דורשת מחקרים נוספים, כיוון שהטרנספוטרים של יונים כגון Na-Cl נמצאו גם כן עוברים upregulation בעכברים נטולי-UMOD (ע"פ Bachmann וחב' ב-Am J Physiol Renal Physiol משנת 2005).
תפקידו המשוער של UMOD בזיהומים בדרכי השתן (UTI)
בשנת 1992 פרסמו Reinhart וחב' ב-Int Urogynecol J מחקר בו נמצא שחיידקים הנושאים שוטונים (fimbriae) הרגישים לסוכר mannose, נקשרים ל-UMOD או לתאים אורו-אפיתליאליים המצופים בחלבון זה. כך נולדה ההשערה ש-UMOD עשוי למנוע ממיקרואוגניזסמים הנושאים שוטונים המכילים את הסוכר mannose מיצירת מושבות בתאי אפיתל של המערכת של דרכי השתן. דוגמה נאותה להשערה זו מתייחסת להגנה שמספק UMOD מפני UTI עם החיידק Proteus mirabilis. גם Weichart וחב' תומכים בהשערה זו במאמרם משנת 2005 ב-Klin Wochenschr Wien. לדעתם, כיוון שהמסלול האורו-גניטלי אינו מכיל מחסומים פיזיים אופייניים כמו רירית, או אפיתיליום משׂוּער (ciliated), נראה שלחלבון UMOD יש תפקיד בפעילות אנטי-בקטריאלית. גישה זו נתמכת על ידי הנתון לפיו בחיות טרנסגניות ללא UMOD נמצא זיהום חמור בנוסח של pyelonephritis. על פי Reinhart וחב' מעבר לפעילות האנטי-בקטריאלית הישירה של UMOD, חלבון זה משיג את מטרתו על ידי שהוא משפעל את מערכת החיסון התאית לפעול נגד החיידקים.
מחקרים בעכברי knockout הראו של-UMOD יש תפקיד הגנתי כנגד זיהומים בדרכי השתן (Bates וחב' ב-Kiney Int משנת 2004, ו-Mo וחב' ב-Am J Physiol Renal Physiol משנת 2004). תפקיד אחרון זה נובע מיכולת החלבון להיקשר לפתוגנים בדרכי השתן, לדוגמה ל-E. coli type 1 נושאי שערות קצרצרות (fimbriated E.coli) קישור המסתייע על ידי השיירים העשירים ב-mannose (ע"פ Pak וחב' ב-J Biol Chem משנת 2001). ל-UMOD יש גם תפקיד במניעת אבני כליות. מספר מחקרים in vitro (ע"פ Chen וחב' ב-Urol Int משנת 2001) שנתמכו גם על ידי מחקר in vivo בחולדות יוצרות אבני כליות (Miyake וחב' ב-Br J Urol משנת 1998), הראו ש-UMOD מפחית את האיגור (aggregation) של גבישי סידן.
לבסוף, הוצע גם ש-UMOD הוא בעל תפקיד בהגנה הטבעית (innate immunity) של הכליות. מספר מחקרים in vitro הדגימו ש-UMOD יכול להיקשר למולקולות הכרוכות במנגנון החסינות כגון IgG, המשלים C1q, ו-TNF-α (ע"פ Rhodes וחב' ב-Kidney Int משנת 1995, ו- Rhodes ב-Immunol Cell Biol משנת 2000 כמו גם Hession וחב' ב-Science משנת 1987). תפקידים נוספים שלUMOD נובעים מהיותו chemoattractant (ע"פ Schmid וחב' ב- Cell Physiol Biochem משנת 2010) וכמולקולה המסייעת לדלקת (proinflammatory), המסוגלת להגיב ולשפעל מרכיבים של מערכת החיסון כמו מונוציטים ונויטרופילים, ותאים דנדריטיים-מיאלואידיים דרך הקולטן דמוי toll-4 (ע"פ Saemann וחב' ב-J Clin Invest משנת 2005).
מתן UMOD לארנבות, חולדות ועכברים משרה בהם tubulointerstitial nephritis (ע"פ Berke וחב' ב-I Immunol משנת 1982, ו-Hoyer ב-Kidney Int משנת 19809). בעכברים, ממצא זה מלווה ביצירת נוגדנים anti-UMOD, התלויים בתפקוד של toll-like receptor 4 . כל הנתונים הללו רומזים לכך ש-UMOD עשוי לשמש מולקולה המזהירה מפני סכנה, ומסוגלת לעורר תגובה דלקתית כתגובה למצבים הגורמים נזק לנפרון, על ידי הפרשת UMOD בחללים האינטרסטיציאליים בכליה. אך גם כאן, התפקיד התומך בדלקת של UMOD שנוי במחלוקת, כאשר El-Achkar וחב' הראו ב- Am J Physiol Renal Physiol משנת 2008, שכעכברים החסרים UMOD מפתחים יותר נזקים היסטולוגיים ותפקודיים לאחר תרחיש של איסכמיה וזליפה מחדש (ischemia–reperfusion injury ), בהשוואה לעכברי wild-type.
מחלות כליה הכרוכות ב-UMOD
מוטציות בגן המקודד ל-UMOD, גורמות ל- medullary cystic kidney disease type 2 (להלן MCKD2) כמו גם ל- familial juvenile hyperuricemic nephropathy שהן מחלות אוטוזומאליות-דומיננטיות טובולו-אינטרסטיציאליות . כיוון ש-2 מחלות אלו הן מפגעים אלליים, הן נחשבות כמחלות כליה הקשורות ל-UMOD, או UMOD-associated kidney disease (להלן UAKD) ע"פ Hart וחב' ב-J Med Genet משנת 2002). נראה ש-UAKD הן מחלות נדירות עם שכיחות של 1/100,000, ועד כה אותרו כ-50 מוטציות גן זה. התסמונת המוקדמת ביותר במטופלים עםUAKD היא לעתים קרובות hyperuricemia (ב-80% מהמטופלים), הנובעת מהפרשה מופחתת של חומצת שתן, ובמקביל מופיע במטופלים אלה שיגדון (gout) (ע"פ Bleyer ו-Hart ב-QJM משנת 2003).
במטופלים עם חסר UMOD מוצאים יכולת מתונה בלבד לרכז את השתן, מה שבא לביטוי לעתים ב-polyuria וב-polydipsia (ע"פ Dahan וחב' ב-J Am Soc Nephrol משנת 2003). כשל כליות כרוני בדרך כלל מתרחש בין העשורים השני והרביעי לחיים, כאשר אנליזה היסטולוגית מראה ש-UAKD מתאפיין על ידי פיברוזיס דיפוזי טובולו-אינטרסטיציאלי, וכן על ידי תהליך דלקתי מתון עם אטרופיה טובולארית (Rampoldi וחב' ב-Hum Mol Genet משנת 2003). ציסטות כלייתיות (בקוטר של 0.5-3.0 ס"מ) לעתים מתגלות, בעיקר בצומת הקורטיקו-מדולארית (Nasr וחב' ב-Kidney Int משנת 2008).
Uromodulin ומחלות כרוניות של הכליה:
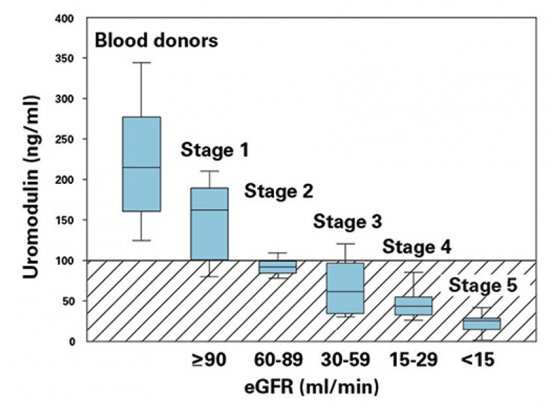
(a) במחלות כליה הקשורות ל-UMOD, מוטציות בחלבון זה מביאות להצטברותו ברטיקולום האנדופלזמי, וליצירת צברים שלו. תופעה זו מוליכה לתפקוד לקוי של הזרוע העבה העולה של לולאת Henle, ולפגם ביכולת לריכוז השתן וכן לירידה דרמטית ברמת UMOD בשתן, כאשר רמת UMOD בשתן נמצאת במתאם חיובי עם קצב ההסננה הגלומרולארי GFR (תרשים למטה) (ע"פ Steubl וחב' ב-Medicine משנת 2016).
(b) מחקרים במסגרת ה-GWAS או genom-wide association studies, זיהו ואריאנטים של UMOD, המגבירים את הסיכון של מחלות כליה כרוניות, יתר לחץ-דם ומחלות קרדיו-וסקולאריות. ואריאנטים אלה קשורים דווקא ברמות מוגברות של UMOD בשתן, שיכולות לנבוע מביטוי מוגבר של UMOD, מהפחתה ביעילות הקישור של החלבון לעוגן הממברנאלי שלו-GPI, לנדידה מוגברת של UMOD לממברנה האפיקאלית, או להגברת הביקוע הפרוטאליטי והפרשת UMOD.
היחס בין רמות UMOD בדם ל-eGFR : תוצאות אלה מראות ש-UMOD מראה קינטיקה הפוכה לזו של סמנים קונבנציונאליים כגון קראטינין או ציסטאטין C, שרמתם בדם דווקא עולה עם הדעיכה בפעילות הכלייתית. יתרה מכך, רמות UMOD בדם מתחילות לרדת כבר בשלבים מוקדמים של מחלת כליות כרונית, כאשר עדיין לא מורגשים תסמינים קליניים ראשוניים, עוד לפני שמתחיל עלייה ברמת קראטינין. נראה מנתוני טבלה זו שמדידת UMOD עשויה לסייע בניטור מאפייני חיוניות של כליות מושתלות, ואולי אף לתת אינדיקציה מוקדמת לדחיית השתל.
האנליזה של UMOD בביופסיה כלייתית או בדגימות שתן של מטופלים עם UAKD גילתה מספר נתוני מפתח: בדיקה אימונו-היסטוכימית של ביופסיות מילדים עם MCKD type 2, הדגימה נוכחות של צברים (aggregates) תוך-תאיים גדולים של UMOD בתוך התאים בזרוע העבה העולה של לולאת Henle (ע"פ Bleyer וחב' ב-Pediatr Nephrol משנת 2005), או בבדיקה דומה של מטופלים עם תסמונת FJHN/MCKD (ע"פ Vylet'al וחב' ב-Kidney Int משנת 2006, ו-Scolari וחב' ב-Am J Kidney Dis משנת 2004). כיוון שצברים תוך-תאיים אלה ממוקמים בחפיפה עם סמנים של הרטיקולום האנדופלזמי, הדבר מרמז על כך שהמוטציות משפיעות על התנועה של UMOD לממברנת התא (Bernascone וחב' ב-Hum Mol Genet משנת 2010). הטרנפורט הפגום של UMOD מהרטיקולום האנדופלזמי לממברנת התאים, מודגם בעצם הירידה בהפרשה של UMOD בשתן של חולים עם UAKD (ע"פ Bleyer וחב' ב-Kidney Int משנת 2004).
מחקרים in vitro
עד היום, התגלו 51 מוטציות של UMOD, מתוכן 48 מוטציות missense עם שינוי בחומצת אמינו בודדת, כאשר 28 ממוטציות missense אלו קשורות לשיירי ציסטאין, רוב מכריע של מוטציות אלו, (94%) מרוכזות באקסונים 3 ו-4 המקודדים למחצית ה-N טרמינאלית של UMOD. רק 3 מוטציות אותרו הקשורות או לאקסון 5 (מוטציה C347G), או לאקסון 7 (מוטציות A461E ו-G488R) משפיעות על שיירים בתוך מקטע ZP, ע"פ Tinschert וחב' ב-Nephrol Dial Transplant משנת 2004, וכן Williams וחב' ב-Hum Mol Genet משנת 2009 ו-Lee וחב' ב-J Korean Med Sci משנת 2010, שכולם בחנו מוטציות של UMOD ב-FJHN או Familial Juvenile Hyperuracaemic Nephropathy.
רוב המוטציות ב-UMOD גורמות לשינויים בהתקפלות התלת-ממדית של החלבון, או על ידי השפעה על מבנה של הקשרים הדי-סולפידיים, או על ידי מניעת הייצוב של מבנה המקטעים דמויי-EGF. נראה שהשפעת המוטציות על צורת הקיפול של UMOD היא אחת הסיבות להפרעה לתנועתו לכיוון ממברנת התא, ועיכובו ברטיקולום האנדופלזמי (Bernascone וחב' ב-Traffic משנת 2006). מוטציות ב-UMOD במודלים תאיים דווחו ככאלו המסוגלות לגרום לאפופטוזיס, שניתן היה למנוע על ידי טיפול בקולכיצין או ב-sodium 4-phnylbutyrate (ע"פ Choi וחב' ב-J Am Soc Nephrol משנת 2005).
מודלים in vivo
שני מודלים של עכברי knockout נחקרו באופן אינטנסיבי. עכברים אלה חשופים ופגיעים יותר ל-UTI, כמו גם מועמדים טובים יותר ליצירת אבני כליות ול-nephrocalcinosis. יחד עם זאת, חיות החסרות UMOD מראות רק סימנים מעטים, אם בכלל, של UAKD. אכן, לא מוצאים בחיות אלו פיברוזיס אינטרסטיציאלי, מצבי דלקת או ציסטות כלייתיות עד גיל של 3 שנים (Raffi וחב' ב-Am J Nephrol משנת 2005). עכברי knockout ב-UMOD, מראים רק פגם מתון ביכולת ריכוז השתן שלהם במבחן מניעת המים (water deprivation test), שיכול להיות תוצאה של פגם ביכולת הספיגה מחדש בזרוע העבה העולה של לולאת Henle, השערה הנתמכת על ידי כמות מופחתת של תעלות ROMK2 בממברנה של חיות אלה. עכבר המבטא את הוואריאנט A227T של UMOD, נוצר על ידי טיפול במוטגן ethylnitrosourea. עכבר זה הראה מספר מאפיינים של UAKD, כגון נוכחות של צברי UMOD בתאי הזרוע העבה העולה של לולאת Henle, פגם ביכולת ריכוז השתן, והפחתה בהפרשה בשתן של uric acid. יחד עם זאת, עכבר UmodA227T זה, לא הראה מאפייני דלקת ופיברוזיס (Kemter וחב' ב-Am J Physiol Renal Physiol משנת 2009).
מודל UAKD נוסף של עכברים נוצר לאחרונה, המבטא מוטציה C147W התואמת את המוטציה C148W באדם, שאותרה בחולים עם UAKD. השוואה בין הפנוטיפ של העכבר עם מוטציה C147W לבין עכבר wild-type העלתה שהעכבר המוטנט הראה סימנים פרוגרסיביים של נזק כלייתי כגון tubulointerstitial fibrosis, עם הסננה דלקתית של תאים והרחבה של האבוביות. בדומה לאנשים עם UAKD גם לעכברי C147W היה פגם בריכוז השתן, המקדים את הכשל הכלייתי. גם ההצטברות של UNMOD מוטנטי ברטיקולום האנדופלזמי ניכרה בעכבר המוטנטי, אך יחד עם זאת, לא נמצאה בו hyperuricemia, זאת כנראה כיוון שעכברים מבטאים את האנזים urate oxidase, המקטלז את הפיכת uric acid ל-allantoin, אנזים שאינו קיים בפרימאטים דוגמת האדם.
הקשר של UMOD לתרחישים פתולוגיים כלייתיים נוספים
מחקרים אחדים מצאו קשר בין אי-סדירות של UMOD לתרחישים פתולוגיים של הכליה. אלה כוללים הצטברות של UMOD ב-cast nephropathy ונוכחות של משקעי החלבון באינטרסטיציום הכלייתי במצב של reflux nephropathy, דחיית שתל כלייתי ומחלות אינטרסטיציאליות (Resnick וחב' ב-Lab Invest משנת 1978, ו-Zager וחב' באותו כתב-עת מאותה שנה, כמו גם Cotran ו-Galvanek ב-Contrib Nephrol משנת 1979). בנוסף, הפרשת UMOD בשתן נמצאת במתאם חיובי עם glomerulonephritis, נפרופתיה סוכרתית, לופוס נפריטיס, tubulointerstitial nephropathy וכן עם מחלה פוליציסטית של הכליות (Vilet'al וחב' משנת 2010). יחד עם זאת, האפשרות להשתמש במדד של UMOD כסמן של מחלת כליה לא נראית סבירה לאור ממצאי מחקר של Prajczer וחב' ב-Nephrol Dial Transplant משנת 2010, בו נמצא באנליזה של רמת UMOD בשתן של 77 חולים עם מחלת כליות כרונית, שב-22% מתוכם רמות UMOD נמצאו נורמאליות.
ממצאים על UMOD ממחקרים של Genome-wide association studies או GWAS
מספר מחקרים במסגרת GWAS, זיהו אתרים גנומיים הכרוכים בממצאים פתולוגיים של תפקוד הכליות, בכל הקשור לחלבון UMOD, כמו גם בסיכון של יתר לחץ-דם. יש לציין שכל מחקרי GWAS אלה נעשו באוכלוסיות אירופיות, או בפרטים ממוצא אירופי, כאשר הרף של eGFR לתפקוד כליות תקין נקבע כמקובל כ-eGFR הגבוה מ-60 מ"ל לדקה ל-1.73 מ2, ואילו יתר לחץ-דם הוגדר כמינימום של 2 קביעות ברצף של מדידות לחץ-דם סיסטולי של מעל 160 מ"מ כספית, ולחץ דם דיאסטולי של לפחות 100 מ"מ כספית, בגיל שמתחת ל-63 שנה. לאחרונה, הצליח ה-Global BPGen Consortium לזהות לוקוס rs13333226 של UMOD, הקשור ליתר לחץ-דם (Padmanabhan וחב' ב-PLoS Genet משנת 2010). ואריאנט אחרון זה של UMOD, היה כרוך גם בתופעות קרדיו-וסקולאריות לטווח ארוך בקרב 26,654 נבדקים באוכלוסייה שוודית.
בניסיון להעריך את הקשר התפקודי בין ואריאנטים של UMOD, הרמה של חלבון זה בשתן, והסיכון לפתח מחלת כליות כרונית, Kottgen וחב' דווחו ב-J Am Soc Nephrol משנת 2010, על מחקר שנערך בקרב 200 משתתפים במחקר הלב של Framingham עם מחלת כליות כרונית שנמצאו במעקב 9.9 שנים, בממוצע. נמצא שרמת UMOD בבסיס המחקר הייתה גבוהה ב-51% באלה עם מחלת כליות כרונית, מאשר בנבדקים ללא מחלת כליות. גם מחקר GAWS זה הצביע על רמת UMOD בשתן כסמן אפשרי של מחלת כליות כרונית.
שלושה מפגעים כלייתיים, nephronopatisis או NPHP, וכן medullary cystic kidney disease או MCKD כמו גם familial juvenile hyperuricemic nephropathy או FJHN, הם מפגעים עם תסמינים קליניים חופפים בחלקם. לאחרונה החלו להתברר מנגנוני הפתוגניות של 3 מפגעים אלה כמו שמבהיר מחקרם של Jennings וחב' ב-J Am Soc Nephrol משנת 2007. תסמונת NPHP כוללת אטרופיה של אבוביות הכליה, פיברוזיס אינטרסטיציאלי, ציסטות קורטיקו-מדולאריות, וכשל כליה פרוגרסיבי. שיגדון (gout) אינו מאפיין בתסמונת זו. ב-NPHP תוארו 4 תת-סוגים, כאשר הכשל הכלייתי בארבעת תת-סוגים אלה מתרחש בגילאי 13 שנה, שנה אחת, 19 שנה ו-11-34 שנה, בהתאמה.
במחקרם של Jennings וחב' נמצא שרמות UMOD בשתן היו נמוכות בחלק מהנבדקים עם FJHN, ולעומת זאת רמות חלבון זה היו מוגברות בנסיוב של 3 מתוך 4 נבדקים עם התסמונת האחרונה. חוקרים אלה יצרו DNA constructs של עכברים wild-type ושל עכברים מוטנטים ב-UMOD, ש"הושתלו" בתרבית תאי כליה, ומצאו שהחלבון UMOD התקין כמו גם הפגום הופרשו יותר בצד האפיקאלי מאשר בצד הבזולטראלי של תאי הכליה בתרבית. בעלי המחקר הציעו ש-UMOD מוטנטי בכליותיהם של מטופלים עם FJHN, עשויים להשרות תגובה חיסונית ל-UMOD זה, מה שעלול לגרום לנזק טובולארי ולפיברוזיס אינטרסטיציאלי. במחקרים in vitro הייתה לUMOD – היכולת לשפעל לימפוציטים (Yu וחב' ב-Immunopharmacol משנת 1993), לשפעל נויטרופילים (Kreft וחב' ב-Infect Immun משנת 2002), כמן גם לשפעל את התאים מציגי-האנטיגן, הדנדריטים (Saemann וחב' ב-J Clin Invest משנת 2005). עוד ראויה לציון העובדה שהזרקה תוך-ורידית שלUMOD לחיות מעבדה גרמה להם להופעת נפריטיס טובולו-אינטרסטיציאלית (Hoyer ב-Kidney Int משנת 1980,ו-Mayrer וחב' ב-J Immunol משנת 1982). ביופסיות כלייתיות של בני-אדם עם מחלה טובולו-אינטרסטיציאלית גילו משקעים אינטרסטיציאליים של UMOD (ע"פ Zager וחב' ב-Lab Invest משנת 1978.
תסמונת MCKD המוליכה לכשל כלייתי פרוגרסיבי, תוארה לראשונה כבר בשנת 1944 ב-N Eng J Med על ידי Thorn וחב' כ"נפריטיס של איבוד מלח", והיא מאופיינת על ידי פיברוזיס כלייתי וכשל כליות פרוגרסיבי המגיע ל-ESRD בגיל שבין 30-60 שנה. בתרחיש מוצאים לעתים קרובות hyperuricemia ו-gout. ההיסטולוגיה הכלייתית דומה לזו של NPHP. ל-MCKD יש 2 ואריאנטים , type 1 ו-type 2, הדומים מאוד אחד לשני קלינית, עם ההבדל הקטן ש-type 2 מתפתח לשלב של ESRD בגיל צעיר יותר (Bleyer וחב' ב-Pediatr Nephrol משנת 2005). בעוד שהפגם בגן המוביל MCKD type 1 לא זוהה אם כי מופה לכרומוזום 1q21 (ע"פ Christodoulou וחב' ב-Hun Mol Genet משנת 1998), נמצא ש-MCKD type 2 קשור למוטציות בגן של Tamm-Horsfall protein (ע"פ Turner וחב' ב-J Clin Endocrinol Metabol משנת 2003).
FJHN תואר לראשונה על ידי Duncan ו-Dixon ב-Q J Med משנת 1960, והוא דומה קלינית והיסטולוגית ל-MCKD type 2. ברוב המשפחות עם FJHN, אם כי לא בכולן, הראו מחקרים גנטיים מוטציות בגן UMOD. מטופלים עםFJHN בהם לא נמצאו מוטציות ב-UMOD, עדיין מוצאים רמות נמוכות של חלבון זה בשתן, מה שמצביע על מעורבות של UMOD באטיולוגיה של FJHN (ע"פ Vylet'al וחב' ב-Kidney Int משנת 2006). בספרות הרפואית מתפתח קונצנזוס לפיו FJHN ו-MCKD type 2 הן אותה מחלה עצמה (Dahan וחב' ב-J Am Soc Nephrol משנת 2001, ו-Scolari וחב' ב-Am J Kidney Dis משנת 2004). שני מפגעים אלה, MCKD type 2 ו-FJHN מתאפיינים בגילוי המוקדם של hyperuricemia בגיל הבחרות, שיגדון וכשל כליות פרוגרסיבי.
השפעת UMOD במניעה של יצירת אבני כליות מסוג קלציום-אוקסלאט
בשנת 2004 פרסמו Mo וחב' ב-Kidney Int את ממצאיהם על הפוטנציאל של UMOD למנוע יצירת גבישי calcium oxalate בכליות. הנוזל האבובי הכליות של יונקים לעתים קרוב רווי על ידי מלחים מינראליים, את התגבשות מלחים אלה נמנעת לרוב בתנאים נורמאליים. היכולת הייחודית של הכליות למנוע יצירה גבישים אלה יוחסה זמן רב לפעילות המעכבת התגבשות של מלחים, על ידי מאקרו-מולקולות , למרות שרק מחקרים מעטים in vivo התבצעו לבחון השערה זו. Mo וחב' השתמשו בעכברי knockout עם פגם ב-UMOD, שנבחנו ליכולתם לייצר ספונטאנית אבני סידן זאת לאחר שהם הושקו באתילן גליקול שהוא קודמן של אוקסלאט, המגביר ספיגת סידן במעי. תוצאות הניסוי הראו שאינאקטיבציה של הגן של UMOD, גרמה ליצירה ספונטאנית של גבישי סידן בעכברי knockout אלה בהשוואה לעכברי wild-type.
מחקר נוסף בנושא זה של Cavalho וחב' ב-Braz J Med Biol Res משנת 2002, הניב תוצאות דומות. בעלי מחקר סבורים שהחומצה הסיאלית הממוקמת תמיד בקצה השרשרת הקרבּוֹ-הידרטית חיונית ללהשפעה השלילית של UMOD על יצירת אבני CaOx בגלל מטענם החשמלי השלילי, בדומה להשפעה המעכבת של חומצת לימון (Lau וחב' ב-Int J Biol Sci משנת 2008). ואמנם, כאשר מטפלים ב-UMOD באנזים neuraminidase, המרחיק את שיירי הקצה של חומצה סיאלית, מתבטלת ההשפעה המעכבת של UMOD על יצירת גבישי CaOx.
חסר שלUMOD בעכברי knockout הביא ליצירת גבישי סידן בכליות ולהסתיידות הדרגתית של שלהן (Mo וחב' ב-Kidney Int משנת 2004, ו-Mo וחב' ב- Am J Physiol Renal Physiolמשנת 2010). החלבון UMOD משיג את השפעתו המגינה בפעולה סינרגיסטית עם osteopontin, כפי שהודגם בעכברי knockout בהם נגרם חסר של 2 החלבונים, UMOD ו-osteopontin (ע"פ Mo וחב' ב-- Am J Physiol Renal Physioמשנת 2007). יחד עם זאת, למרות הראיות מניסויים עם עכברי knockout, הרלוונטיות שלUMOD כמולקולה המגינה מפני יצירת אבני כליות עדיין אינה ברורה. ולמעשה אנשים עם רמות מופחתות ביותר של UMOD בשתן, כמו גם אנשים הנושאים מוטציות ב-UMOD, אינם לוקים בהכרח בשיעורים מוגברים של דלקות בדרכי השתן, או של יצירת אבני כליות.
ביצוע מדידת UMOD
המדידה מתבצעת בפלזמה או בנסיוב, לכן דגימת הדם יכולה להילקח במבחנה כלשהי, ללא צורך בצום או בהכנות מיוחדות. הבדיקה מתבצעת בשיטת ELISA המבוצעת עם פלטת 96 בארות מצופים עם נוגדנים כנגד UMOD. גורמים חיצוניים כמן משקל הגוף, מסת השרירים, או סוג הדיאטה אינם צריכים להילקח בחשבון בהתייחסות לתוצאות המדידה המתקבלות, כפי שנהוג לגבי סמנים קלאסיים בדם. מדידת רמת UMOD בדם, חוסכת את התהליך הלא-נוח וממושך של איסוף שתן משך 24 שעות.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק