Vascular endothelial growth factor
| מדריך בדיקות מעבדה | |
| Vascular Endothelial Growth Factor | |
|---|---|
| שמות אחרים | VEGF, VEGF-α, vascular permeability factor |
| מעבדה | כימיה בדם |
| תחום | תאי אנדותל, אנגיוגניות, ואבחון תסמונת POEMS |
| טווח ערכים תקין | מתחת ל-96.2 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכה של מטופלים עם חשד לתסמונת POEMS (polyneuropathy, organomegaly, endocrinopathy, monoclonal gammopathy, and skin changes), בעיקר כמדד הבדלה מצורות אחרות של polyneuropathy ומפגעים של תאי פלזמה חד-שבטיים. כמו כן יכולה בדיקה זו לשמש לניטור של התגובה לטיפולים באלה עם אבחנה ודאית של תסמונת POEMS.
VEGF
VEGF הוא מאפנן (modulator) קריטי של תהליך האנגיוגניות (צמיחת כלי-דם חדשים) (Olsson וחב' ב-Nat Rev Mol Cell Biol משנת 2006). ביונקים ישנם 5 חברים במשפחת VEGF, כאשר VEGF-A הוא הנחקר ביותר מתוכם. VEGF-A מסייע לתהליך ה-angiogenesis על ידי שהוא משרה נדידה של תאי אנדותל, מסייע למיטוזה של תאים אנדותליאליים, ומגביר את הפעילות של matrix metalloproteinase (להלן MMP) על פי Otrock וחב' ב-Blood Cells, Mol Dis משנת 2007. VEGF-A מווסת על ידי תרחיש של היפוקסיה, כאשר הוא מבוטא באופן מוגבר כאשר התאים מזהים מיקרו-סביבה דלת חמצן. באופן פיזיולוגי, VEGF משרה יצירה של כלי-דם חדשים במהלך ההתפתחות האמבריונית, או לאחר פציעה רקמתית, או בתגובה לחסימה בכלי דם סמוכים.
כמו כן, VEGF גם מווסת יצירה של כלי-דם פתולוגיים, כמו במצבים של שגשוג גידול סרטני ויצירת גרורות. תהליך האנגיוגניות במהלך התפתחות של גידול הוא תהליך מסובך, למרות שברור ש-VEGF משחק בו תפקיד מפתח. VEGF מווסת גם את האנגיוגניות במצבי מחלות אחרות כולל rheumatoid arthritis (Afuwape וחב' ב- Histol Histopathol משנת 2003), סוכרת, osteoarthritis, ו-AMD או ניוון המאקולה התלוי בגיל (Hoeben וחב' ב-Pharm Rev משנת 2004). בנוסף, ריכוזי VEGF בצירקולציה מוגברים באלה עם monoclonalgammopathy, endocrinopathy, organomegaly, polyneuropathy ו-שינויים בעור, חמשת המפגעים הנכללים בתסמונת POEMS, הנגרמת ממפגע של תא פלזמה חד-שבטי (D'Souza וחב' ב-Blood משנת 2011). למרות שתפקידו של VEGF ב-POEMS אינו ברור, מדידת VEGF נחשבת מדד שימושי להערכת התגובה לטיפול בתסמונת POEMS. ירידה בריכוז VEGF בפלזמה באופן רצוף בחולה עם POEMS, יכולה להתאים לתגובה טובה לטיפול. עם זאת, רמות נורמאליות של VEGF אינן שוללות אבחון של POEMS.
גילויו של VEGF
בשנת 1983 פרסמו Senger וחב' ב-Science על כך שתאי סרטן מפרישים vascular permeability factor המעודד הצטברות נוזל כתוצאה מהופעת מיימת. הגילוי הזה נעשה בחזירי-ים, באוגרים ובעכברים. גורם זה נוקה ושובט בהמשך על ידי Ferrara ו-Henzel בשנת 1989 והם הגדירו אותו ב- Biochem Biophys Res Commun. כ-heparin-binding growth factor המופרש מתאים פוליקולאריים בהיפופיזה הספציפי לתאי אנדותל בדופן כלי הדם. בשנת 1991 פרסמו Tische וחב' ב-J Biol Chem שהגן המקודד באדם ל-VEGF מסוגל לייצר מספר צורות של החלבון הזה במנגנון של שחבור חליפי (Alternative splicing) שהיא צורה של שעתוק גנים, בה משועתקים קטעים שונים של RNA ממקטע DNA יחידי. בין השנים 97–1996 הצליחו Christinger ו-De Vos לייצר גבישים של VEGF, בתחילה ברזולוציה של 2.5Å ובהמשך השיגו אף גבישים ברזולוציה של 1.9Å וחב' Muller) וחב' ב-Proc Natl Acad Sci USA משנת 1997, ו-Muller וחב' ב-Structure מאותה שנה).
מנגנון הפעולה של VEGF
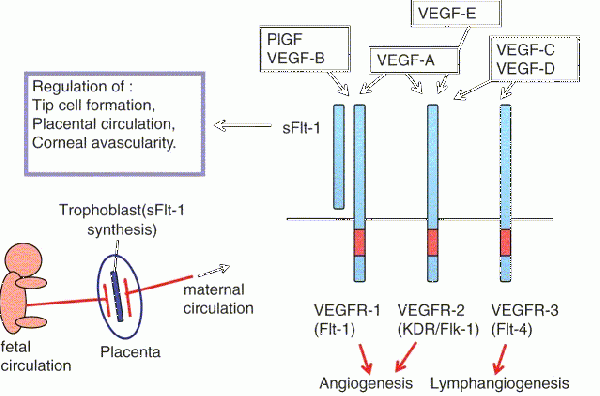
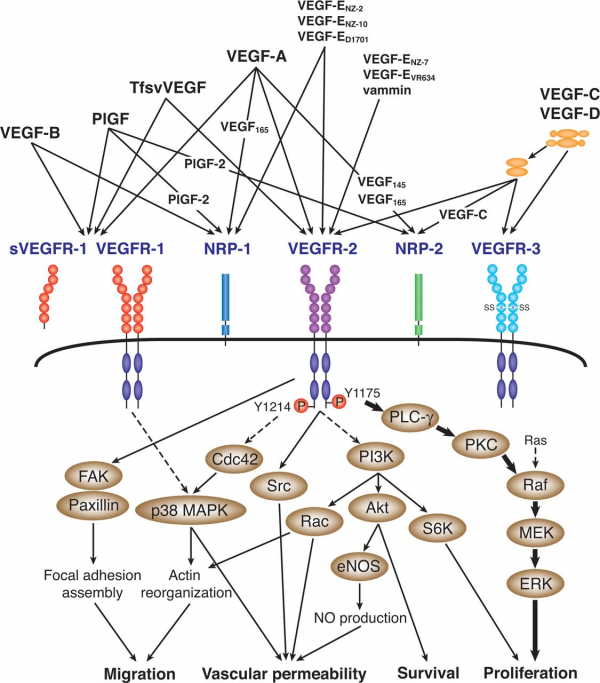
כל החברים במשפחת VEGF מעודדים תגובות תאיות על ידי התקשרות לקולטנים על פני התא המכילים טירוזין קינאז, מה שגורם ל-2 קולטנים סמוכים לעבור דימריזציה ולהיות משופעלים על ידי טרנס-פוספורילציה. הקולטנים של VEGF הם בעלי חלק חוץ-תאי המורכב מ-7 מקטעים (domains) דמויי-אימונוגלובולין, וכן מחלק אחד טרנס-ממברנלי החוצה את ממברנת התא, וכן מחלק אחד תוך-תאי המכיל את המקטע המפוצל של tyrosine kinase. החלבון VGEF-A נקשר ל-2 קולטנים, VEGFR1 (הידוע גם כ-Flt-1) ו-VEGFR-2 (הידוע גם כ-KDR/Flk-1) על פי Holmes וחב' ב-Cell Signal משנת 2007. הקולטן VEGFR-2 מסתמן כמי שמתווך כמעט בכל התגובות התאיות ל-VEGF. התפקיד של VEGFR-1 פחות ברור, אם כי סבורים שהוא מאפנן את האיתות הנגרם על ידי קישור הליגנד לקולטן VEGFR-2 על פי Karkkainen ו-Petrova ב-Oncogen משנת 2000.
תפקיד נוסף של הקולטן VEGFR-1 יכול להיות בהיותו משמש קולטן "הסחה" (decoy) על ידי מניעת הקישור של VEGF לקולטן VEGFR-2 [מה שעשוי להיות חשוב במיוחד במהלך יצירת כלי הדם (vasculogenesis) בשלב העוברי]. VEGF-C ו-VEGF-D, אך לא VEFG-A, הם ליגנדים הנקשרים לקולטן השלישי (VEGFR-3 הידוע גם כ-Flt4), המתווך ב-lymphangiogenesis (תהליך יצירת כלי הדם הלימפטיים במנגנון שנראה דומה לזה של אנגיוגנסיס). VEGF-C יכול לתמוך בתהליך ה-lymphangiogenesis בהיקשרו לקולטן VEGFR-3 ולעודד גם את תהליך ה-angiogenesis בהיקשרו לקולטן VEGFR-2. הקולטן VEGFR-3 התגלה בתאים אנדותליאליים לימפטיים של מינים רבים בנוסף לאדם, כגון בבקר, בתאו ובקופים (Ali וחב' ב-Theriogenology משנת 2013).
בנוסף להתקשרות לקולטניו, VEGF נקשר גם לקומפלקסים של קולטנים המורכבים מ-VEGFRs ומ-neuropilins. קומפלקס קולטני זה מגביר את פעילות העברת המסרים של VEGF בתאי אנדותל (Soker וחב' ב-Cell משנת 1998, ו-Herzog וחב' ב-Mol Biol Cell משנת 2011). ה-neuropilins (להלן (NRP הם קולטנים פלאוטרופיים ולכן מולקולות אחרות יכולות להפריע עם הסיגנל של קומפלקס הקולטנים NRP/VEGFR. לדוגמה, semaphorins class 3 מתחרים עם VEGF על הקישור ל-NRP, ולכן הם יכולים לווסת את הפעילות האנגיוגנית של VEGF (Mecollari וחב' ב-Frontiers Cell Neurosci משנת 2014). בשנת 1992 דווחו Ferrara וחב' ב-Science על Flt-1 (או Fms-like tyrosine kinase-1) כקולטן נוסף של VEGF. באותה שנה דווחו Terman וחב' ב- Biochem Biophys Res Communעל כך ש-KDR או kinase insert domain receptor משמש גם כן קולטן של VEGF.
VEGF הוא חלבון "מאותת" המיוצר על ידי תאים המעודדים יצירת כלי-דם בשלב העוברי, בהתפתחות הפדיאטרית, לאחר פציעה, וכן יצירת כלי-דם חדשים לעקיפת כלי-דם סתומים collateral circulation. באופן ספציפי יותר, VEGFs היא תת-משפחה של גורמי גדילה, כגון זו של PDGF או platelet-derived growth factor. ה-VEGF הוא גם חלק מהמערכת המשחזרת אספקת חמצן לרקמות כאשר צירקולצית הדם נפגעת כמו במצבים של היפוקסיה (Palmer וחב' ב-Mol Cell Endocrinol משנת 2014). הריכוזים של VEGF בנסיוב גבוהים באסתמה ברונכיאלית אך גם בסוכרת (Cooper וחב' ב-Diabetes משנת 1999).
כאשר VEGF מבוטא ביתר, הוא עלול לגרום למפגעים בריאותיים, כגון האצת תהליכים גרורתיים של גידול סרטני ויצירת עודף כלי-דם ברשתית העין, או באזורי גוף אחרים. תכשירים כגון aflibercept, bevacizumab, ranibizumab ו-pegaptanib sodium (שם מותג Macugen) יכולים לעכב פעילות VEGF ולהאט התפתחות כלי דם מזיקים אלה.
הסיווג של חמשת החברים במשפחת VEGF
משפחת VEGF מורכבת מ-5 גורמי גדילה: VEGF-D ,VEGF-C ,VEGF-B, VEGF-A ו-PGF (או placenta growth factor). מספר חלבונים הדומים ל-VEGF התגלו גם כן והם מיוצרים על ידי נגיפים (VEGF-E) או מופיעים בארס של מספר נחשים (VEGF-F). להלן פעילותם של סוגי VEGF השונים:
VEGF-A משרה אנגיוגניות על ידי הגברת התנועתיות של תאי אנדותל, הגברת המיטוזה של תאי אנדותל, הגברת הפעילות של metalloproteinases, הגברת הפעילות של αvβ3 (שהוא סוג של integrin המשמש קולטן ל-vitronectin המופיע על טסיות-דם), יצירת הנהור (lumen) של כלי-דם, ויצירה של פנסטרציה (חשיפה או חירור ברקמות שונות). כמו כן, VEGF-A מהווה חומר כימוטקטי לגבי מקרופאגים וגרנולוציטים, וכן מרחיב כלי-דם (ואזו-דילטנט) באופן בלתי-ישיר על ידי הגברת הפרשה של NO. למרות שפעילותו של VEGF-A נחקרה בעיקר בהקשר של תאי-אנדותל, יש לו השפעה גם על מספר סוגי תאים אחרים, כגון סטימולציה של הנדידה של מונוציטים ומקרופאגים, השפעה על נוירונים תאי-סרטן, ותאים אפיתליאליים של הכליות.
VEGF-B המשחק תפקיד באנגיוגנזיס בעובר המתפתח ובעיקר ברקמה המיוֹ-קרדיאלית.
VEGF-C שתפקידו בתהליך ה-lymphangiogenesis.
VEGF-D הנחוץ להתפתחות כלי-הדם המקיפים את הסִמְפונות הזעירים המסתעפים משני סמפונות הריאה הראשיים (bronchioles).
PGF (גורם הגדילה בשלייה) חיוני לאנגיוגניות ולווסקולוגניות העוברית. המקור העיקרי של PGF במהלך הריון, הם הטרופובלסטים בשלייה, אך הוא בא לביטוי גם בטרופובלסטים של סיסים (villi). באופן ספציפי, PGF משחק תפקיד בשגשוש ובהתמיינות (דיפרנציאציה) של תאים טרופובלסטים, כאשר תאים אלה הנמצאים מחוץ לסיסי השלייה אחראיים לחדירה לעורקים של האם. התפתחות נאותה של כלי-דם בשלייה חיונית להתפתחות העובר. בתנאים פיזיולוגיים תקינים, PGF מופיע גם בריכוזים נמוכים באיברים נוספים כמו בלב, בריאות, בבלוטת התריס, ובשריר השלד.
הרמות בנסיוב של PGF ושל sFlt-1 משתנות בנשים עם preeclampsia. מחקרים מראים שבשלבים מוקדמים אך גם מאוחרים של preeclampsia, ריכוזי -sFlt-1 בנסיוב גבוהים יותר ואילו ריכוזי PGF נמוכים יותר בנשים עם preeclampsia. בנוסף, הרמות של sFlt-1 בשלייה מוגברות משמעותית ואילו רמות PGF נמוכות בנשים עם preeclampsia בהשוואה לנשים עם הריון תקין. נתונים אלה תואמים את ההשערה שהשלייה היא המקור העיקרי של sFlt-1 ושל PGF במהלך ההיריון.
איזופורמים של VEGF
קיים מגוון של איזופורמים של VEGF-A הנובע מ-alternative splicing של mRNA מאקסון-8 יחיד בגן VEGF-A. איזופורמים אלה משובצים ל-2 קבוצות שההתייחסות אליהן נובעת מנקודת החיתוך (splicing) באקסון-8: נקודת ה-splice הקריבנית (VEGFxxx) או נקודת ה-splice הרחיקנית (VEGFxxxb). בנוסף, תהליך alternate splicing של אקסונים 6 ו-7 משנה את זיקת הקישור שלהם להפארין ואת מספר חומצות האמינו באיזופורמים השונים. באדם מוצאים איזופורמים כגון VEGF121, VEGF121b, VEGF145, VEGF165, VEGF165b, VEGF189 ו-VEGF206. הגנים ל-VEGF במינים אחרים (orthlogs) כגון מכרסמים, קצרים בחומצת אמינו אחת. בנוסף, הכללה או השמטה של אקסונים 6 ו-7, משמעותית לגבי האינטראקציות עם heparan sulfate proteoglycans ועם קולטני neuropilin על שטח פני התא, ובכך הם מגבירים את היכולת להיקשר ולשפעל את קולטני VEGF (Cébe Suarez וחב' ב- Cell Mol Life Sciמשנת 2006). VEGF-C נמצא מהווה משרן חשוב של נוירוגנזה באזור התת-ונטריקולארי של מכרסמים, בלי להביא להשפעה אנגיוגנית (Shin וחב' ב-J Neuroimmunol משנת 2010).
ביטוי של VEGF
הייצור של VEGF-A יכול להיות מושרה בתאים עם אספקת חמצן לא מספקת (Holmes וחב' ב-Cell Signaling משנת 2007). כאשר תא לוקה בחסר חמצן, הוא מייצר HIF או hypoxia-inducible factor, שהוא גורם שעתוק המעודד הפרשה של VEGF-A, בין יתר הפעילויות של HIF כגון מודולציה של אריתרופויאזיס. הביטוי של angiopoietin-2 בהיעדר VEGF גורם למות תאי אנדותל ולרגרסיה וסקולארית (Harmey ב-VEGF & Cancer משנת 2004). לעומת זאת, מחקר גרמני של Oltmanns וחב' ב- AJP: Endocrinology and Metabolism משנת 2006, שהתבצע in vivo מצא שריכוזי VEGF למעשה פוחתים לאחר ירידה של 25% בצריכת חמצן למשך 30 דקות. HIF1α ו-HIF1β מיוצרים באופן מתמיד, אם כי HIF1α מאוד בלתי יציב בנוכחות O2, לכן במצבים אירוביים גורם זה נהרס. לעומת זאת, כאשר התא הוא היפוקסי, HIF1α מתקיים, והקומפלקס HIF1alpha/beta מעודד הפרשה של VEGF.
משמעות קלינית בתחלואות שונות
VEGF וקולטניו עוברים במהירות שדרוג לאחר פציעה טראומטית במערכת העצבים המרכזית (CNS). VEGF מתבטא באופן בולט בשלבים חריפים ותת-חריפים של פגיעה ב-CNS, אך עם הזמן ביטוי חלבון זה פוחת בהדרגה. משך הזמן של ביטוי מוגבר זה של VEGF תואם את היכולת לגרום ל-re-vascularization לאחר פגיעה (Mecollari וחב' ב- Frontiers Cell Neurosc משנת 2014). נתון זה מרמז לכך ש-VEGF-A/VEGF165 יכול לשמש כיעד לעידוד אנגיוגניות לאחר פגיעות טראומטיות ב-CNS. עם זאת, ישנם ממצאים מדעיים סותרים על השפעת טיפולים ב-VEGF-A במודלים של פגיעה ב-CNS.
VEGF-A הוזכר בהקשר של פרוגנוזה גרועה במקרים של סרטן השד. מספר מחקרים הראו ירידה בהישרדות כאשר גידולים סרטניים המבטאים VEGF באופן מוגבר. ביטוי מוגבר של VEGF-A יכול להיות צעד מוקדם בתהליך של יצירת גרורות, כתוצאה מאתחול התהליך האנגיוגני. למרות שיש הכורכים VEGF-A עם פרוגנוזת הישרדות גרועה, המנגנון המדויק בו פועל חלבון זה באשר להתקדמות התהליך הסרטני, אינו ברור. VEGF-A מופרש כמו כן ב-rheumatoid arthritis בתגובה ל-TNF-α המגביר חדירות של תאי האנדותל ונפיחות, וגם כן מעודד אנגיוגניות. VEGF-A חשוב גם בתהליך הגורם ל-diabetic retinopathy. הבעיות של המיקרו-צירקולציה ברשתית העין בחולים סוכרתיים, יכולים לגרום לאיסכמיה ברשתית, המביאה להפרשת VEGF-A, ולשינוי בשיווי המשקל בין הפרשת-יתר של איזופורמים קדם-אנגיוגניים מסוג VEGFxxx, בהשוואה להפרשה של האיזופורמים המבוטאים באופן נורמאלי מסוג VEGFxxxb. האיזופורם VEGFxxx יכול לגרום ליצירה של כלי-דם חדשים ברשתית העין, ולפגיעה בראייה.
VEGF-A משחק גם תפקיד בצורה "הרטובה" של AMD (age-related macular degeneration), הסיבה המובילה לעיוורון בקשישים במדינות המתועשות. הפתולוגיה הווסקולארית של AMD, היא בעלת מאפיינים משותפים עם רתינופתיה סוכרתית, למרות שהסיבה למחלה והמקור הספציפי לווסקולריזציה בשתי תסמונות אלה שונות. הרמות בנסיוב של VEGF-D מוגברות משמעותית ב-angiosarcoma (Amo וחב' ב- Br J Dermatolמשנת 2004).
מרגע הפרשתו VEGF-A מסוגל לגרום למספר תגובות. הוא יכול לגרום לתא לשרוד, לנוע, או לעבור התמיינות נוספת. כתוצאה מתכונות אלו, VEGF הוא יעד פוטנציאלי לטיפול בסרטן. התרופה הראשונה המכוונת נגד VEGF, הייתה הנוגדן החד-שבטי bevacizumab, שאושר לשימוש בשנת 2004. בערך 10-15% מהמטופלים מפיקים תועלת מהטיפול ב- bevacizumabאם כי לא ידועים עדיין סמנים לבטא את יעילות התרופה. מחקרים עדכניים מראים ש-VEGFs אינם מהווים רק סייעים לאנגיוגניות. במיוחד FGF2 ו-HGF הם גורמים פוטנציאליים של אנגיוגניות. מטופלים הסובלים מ- pulmonary emphysema, נמצאו מכילים רמות נמוכות יותר של VEGF בעורקי הריאות. בכליות, ביטוי מוגבר של VEGF-A בפקעיות הכליה, גורם ישירות להיפרטרופיה גלומרולארית הגורמת לפרוטאינוריה ( Liu וחב' ב- J Am Soc Nephrolמשנת 2007). שינויים ברמות VEGF יכולים לנבא התחלה מוקדמת של pre-eclampsia (Andraweera וחב' ב- Human Reproduction Updateמשנת 2012).
טירוזין 1175 (מסומן כ-Y1175), ו-טירוזין 1214 (מסומן כ-Y1214) הם 2 אתרי הפוספורילציה העצמית העיקריים הקשורים ל-VEGFR-2. PLC-γ נקשר ל-Y1175, וגורם לפוספורילציה ולשפעול של חלבון זה. Y1214 מסתמן כמרכיב חיוני בשפעול הרציף של Cdc42 ושל p38MAPK. חלבונים תוך-תאיים רבים משופעלים על ידי VEGFR-2 במנגנונים לא מפוענחים, כולל חלבונים כ-FAK, P13K, ו-Src. השפעול והזרימה של מולקולות האיתות גורמת לתאי אנדותל למספר פעילויות כמו נדידה, חדירות וסקולארית, הישרדות ושגשוג.
הוראות לביצוע הבדיקה
יש לדגום דם למבחנת ספירת-דם (EDTA פקק בצבע סגלגל). ל-VEGF יציבות מוגבלת, לכן מיד לאחר סרכוז דגימת הדם, יש להקפיא את הפלזמה או לאחסנה בקירור. הסרכוז למשך 10 דקות במהירות 1,500g בצנטריפוגה מקוררת. בקירור רגיל הדגימה יציבה רק ל-24 שעות, ולאחר מכן יש להקפיאה. פלזמה הנשמרת שעות אחדות בטמפרטורת החדר אינה ראויה לבדיקה. מבחנת פלזמה (ב-EDTA) יציבה בהקפאה עד 21 יום. יש לפסול דגימות פלזמה המוליטיות מאוד אך ניתן לעשות שימוש בדגימות עם המוליזה קלה. אין להשתמש במבחנות הפארין או ציטארט. דגימות פלזמה ליפמיות מאוד או איקטריות מאוד ראויות לבדיקה. הבדיקה עצמה מתבצעת בשיטת Electrochemiluminescence .
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק