Venetoclax - תכשיר ביולוגי לטיפול בממאירויות המטולוגיות - Biological therapy for hematologic malignancies
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סל תרופות 2018
מוות תאי מתוכנן, האפופטוזיס, הוא אחד המנגנונים החשובים המפקחים על מעגל החיים של התא התקין. האפופטוזיס יכול להתרחש כתוצאה מגירוי חיצוני או עקב גירויים תוך תאיים. מנגנון האפופטוזיס הפנים תאי נמצא תחת בקרה קפדנית ומשפחת חלבונים תוך תאיים, ה-2-BCL, היא חלק חשוב מאוד בבקרה זאת.
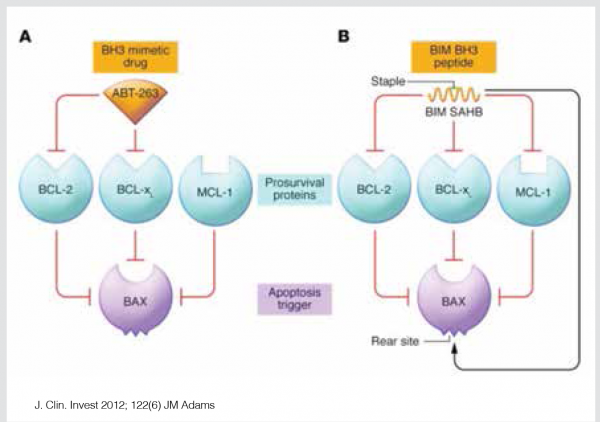
משפחת חלבוני 2-BCL מורכבת ממספר חלבונים, חלקם פרו-אפופטוטיים ה-Bak, Bax ואחרים האנטי-אפופטוטיים, ה-BCL-2, MCL-1, BCL-XL וחלבונים המווסתים את פעילותם. התוצאה הסופית, חיים או מוות של התא, נקבעת על ידי אינטראקציה בין החלבונים הללו, כשהחלבונים האנטי-אפופטוטיים מעכבים את פעילות החלבונים הפרו-אפופטוטיים (ראו ציור 1).
אחד המנגנונים המעניקים לתאי הסרטן "יתרון הישרדותי" הוא "מצב אנטי-אפופטוטי" המתקיים הודות לביטוי יתר של החלבונים האנטי-אפופטוטיים ממשפחת ה-2-BCL, ואכן בסוגים רבים של תאי סרטן, בפרט בממאירויות המטולוגיות, לעיתים קרובות ניתן למצוא ביטוי עודף של 2-BCL, לדוגמה, תאי לויקמיה מיאלואידית חריפה (AML - Acute Myeloid Leukemia), מחלות לימפופרוליפרטיביות שונות - לימפומות הודג׳קין ולימפומות שאינן הודג׳קין של תאי B ו-T, לויקמיה לימפוציטית כרונית (CLL - Chronic Lymphocytic Leukemia), לויקמיה של תאים שעירים (Hairy cell leukemia), מיאלומה נפוצה (ראו טבלה 1).
הטיפול
ראו גם – לוקמיה מיאלואידית חריפה - טיפול ב-Venetoclax
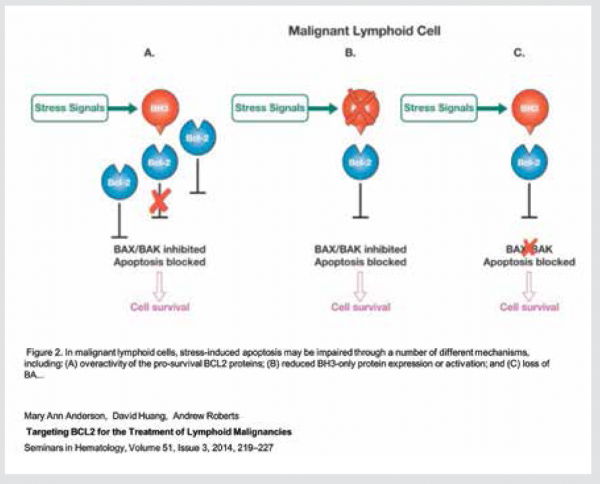
רוב התרופות הכימותרפיות וקרינה אינן הורגות את התאי הסרטן באופן ישיר, אלא גורמות נזקים לממברנה, ל-DNA (Deoxyribo-Nucleic Acid), ל-Cytoskeleton. נזקים אלה גורמים להפעלת חלבוני האפופטוזיס דרך חלבון ה־P53 "השומר של הגנום". ביטוי יתר של חלבונים אנטי-אפופטוטיים, חסר או מוטציות ב־P53 עוזרים לתאים להתחמק מאפופטוזיס למרות הנזקים, כלומר הופכים אותם לעמידים לתרופות הכימותרפיות (ראו תמונה 2).
זאת הסיבה שחלבוני 2-BCL הוגדרו כ"מטרה טיפולית" ומחקר ופיתוח של תרופות המעכבות את הפעילות האנטי-אפופטוטית שלהם החלו לפני שנים רבות. פיתוח מעכבי תרגום החלבונים הללו (Antisense) ברמת ה-DNA במחלות לימפופרוליפרטיביות לא הוכיח את עצמו במחקרים קליניים פאזה 3 ופיתוחם הופסק.
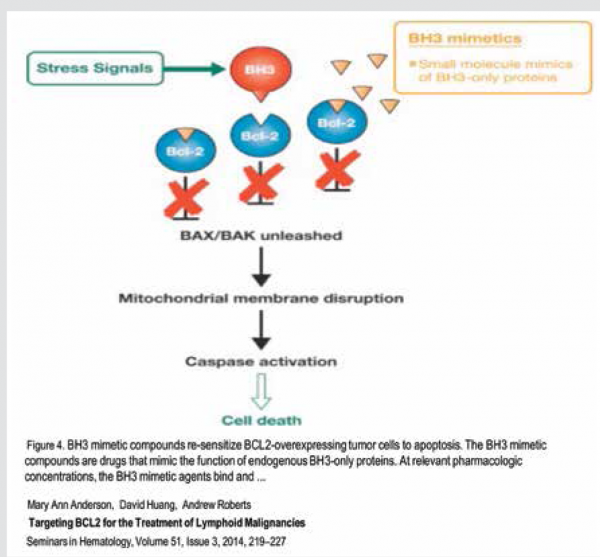
שימוש בטכנולוגיות מתקדמות בחקר מבנה החלבונים והאינטראקציה ביניהם הוביל לפיתוח מולקולות קטנות המחקות את פעילות מולקולות 3-BH, שהן האנטגוניסט הטבעי של חלבוני 2-BCL אנטיאפופטוטיים (BH-3 mimetic). חשיפת תאים סרטניים עם ביטוי יתר של 2-BCL למולקולות אלו הובילה למותם באפופטוזיס (ראו ציור 3).
ה-(199-Venetoclax (ABT מעכבת באפיניות גבוהה וספציפית את חלבון 2-BCL בלי לעכב את החלבון BCL-XL שעיכובו גורם לטרומבוציטופניה קשה. התרופה נספגת היטב דרך מערכת העיכול.
באפריל 2016, על סמך עבודה מאוסטרליה שפורסמה ב-New England Journal of Medicine התרופה אושרה על ידי הרשות האמריקאית למזון ולתרופות (FDA - Food and Drug Administration) לטיפול בחולי CLL עם חוסר בזרועה הקצרה של כרומוזום 17 (-17p) שקיבלו לפחות קו טיפולי אחד קודם. כחצי שנה לאחר מכן בדצמבר 2016 היא אושרה גם על ידי הרשות האירופאית לטיפול ב-"CLL קשה לטיפול" גם ללא השינוי בכרומוזום 17.
פורסמו תוצאות מחקר בחולי AML מבוגרים שלא מועמדים לטיפול כימותרפי אגרסיבי אשר טופלו במשלב של Venetoclax עם מינון נמוך של Cytosar, התרופה הוכרזה "על מסלול מהיר" (Breakthrough Designation) לקראת אישור ה-FDA באינדיקציה נוספת: לויקמיה מיאלואידית חריפה במבוגרים.
ב-2017 המשיכו לחקור את התרופה במחלות המטו-אונקולוגיות שונות, CLL - שילובה עם תרופות ביולוגיות נוספות, שילובה עם נוגדנים ועם תרופות כימותרפיות בחולים עם מחלה נשנית או עמידה לטיפול, מקומה בטיפול בחולים שמחלתם עמידה לתרופות ביולוגיות אחרות - Ibrutinib, Idelalisib, שילובה בטיפול בחולים בקו ראשון שלא טופלו בעבר. AML - שילוב עם כימותרפיה בחולים מבוגרים, ממאירויות המטולוגיות אחרות - מיאלומה נפוצה, לימפומה. כמו כן ממשיך פיתוח פרוטוקולים טיפוליים תוך מעקב אחר שארית מחלה מינימלית (MRD - Minimal Residual Disease) כמדד ליעילות הטיפול ואפשרות הפסקתו. ההנחיות לטיפולים הביולוגיים נמשכים כל עוד הם יעילים ועלות התרופות היקרות הללו לטווח ארוך גבוהה מאוד. כמו כן נחקרת עמידות לתרופה זו - מנגנונים וגורמי סיכון. בעיתונים מובילים ובכנס ה-EHA (European Hematology Association) של האיגוד ההמטולוגי האירופאי השנה הוצגו מספר עבודות:
CLL
- מתנהל מחקר פאזה 2 אקראי וכפול סמיות של משלב Ibrutinib עם Venetoclax בחולים עם CLL/SLL (Small Lymphocytic Lymphoma) שלא טופלו בעבר. המחקר בוצע במרכז לחקר הסרטן MD Andersen ביוסטון. השילוב של שתי התרופות הגיוני מאוד - Ibrutinib יעיל ביותר ב"ניקוי" המחלה מבלוטות לימפה ומטחול, גורם ללימפוציטוזיס של מספר שבועות עד חודשים, Venetoclax משפיע קודם על המחלה במח העצם ובדם הפריפרי
- קבוצת מחקר CLL גרמנית (GCLLSG) הציגה בכנס האיגוד האירופאי להמטולוגיה פרוטוקול טיפול חדשני לחולי CLL שלא טופלו בעבר ולחולים עם הישנות ומחלה עמידה. הפרוטוקול מבוסס על תפישת Sequential Tripple-T של מיכאל האלק מ־2013 המתבסס על הכוונה והתאמה של הטיפול לחולה ולתגובה. הטיפול כלל שני קורסים של כימותרפיה - Bendamustine להורדת מסת המחלה במקרי הצורך, אינדוקציה עם נוגדן אנטי CD20, Obinutuzumab (Gazyva) אחת לחודש יחד עם Venetoclax לשישה מחזורים וטיפול אחזקה עם Obinutuzumab כל 3 חודשים והמשך Venetoclax יומי עד להשגת הפוגה ללא שארית מינימלית של המחלה או סך הכל כ־24 חודשים. גויסו 66 חולים - 34 שלא טופלו בעבר ו־29 עם מחלה נשנית. כל החולים שלא טופלו (100 אחוזים) וכל אלה שטופלו מלבד שניים (93 אחוזים) הגיבו. סך שיעור התגובה - ORR (Overall Response Rate) של 97 אחוזים בסוף האינדוקציה. התגובות של שארית מחלה מינימלית שלילית (MRD negativity) בדם הושגו ב־89 אחוזים מהחולים. הטיפול נסבל היטב עם תופעות לוואי משמעותיות בעיקר בחולים עם הישנות המחלה. תגובה לעירוי Obinutuzumab, זיהומים, כולל שני מקרי זיהום פאטלי בחולים עם מחלה נשנית ותופעות המטולוגיות כצפוי בטיפולים מהסוג הזה, היו ב־5 חולים עם Tumor lysis מעבדתי שטופל בהתאם וחלף. לא היו מקרי TLS (Tumor Lysis Syndrome) קליני. נראה שמדובר בפרוטוקול יעיל מאוד בשתי אוכלוסיות החולים
- התרופות הביולוגיות החדשות מראות תוצאות מצוינות בחולים עם CLL נשנית ועמידה לכימותרפיה, כולל חולים עם מאפיינים ציטוגנטיים גרועים. עם זאת, עדיין קיימת תופעה של אי סבילות לתרופות אלו ואף התפתחות עמידות לטיפול. A.R. Mato וחברים פרסמו ב-Annals of Oncology השנה עבודה רטרוספקטיבית על רצף טיפול אופטימלי בין Ibrutinib, Idelalisib ו־Venetoclax; נאספו 683 חולים, הממצאים מראים כי Ibrutinib עדיף על Idelalisib כתרופה ביולוגית ראשונה; במצב של כישלון אחת מהן, מתן השנייה או Venetoclax עדיף על כימו-אימונותרפיה; במצב של כישלון Ibrutinib, השימוש ב-Venetoclax נראה עדיף על Idelalisib
- במאמר How I mannage ibrutinib refractiry CLL ב-BLOOD במרץ השנה ממליצה Jennifer Woyach על שימוש ב-Venetoclax במקרים שמתפתחת עמידות ל-Ibrutinib ומסתמכת על ספרות המראה תוצאות טובות משמעותית בטיפול זה
- פרופ' סטילנגבאואר מהקבוצה הגרמנית למחקר ב-CLL הציג בכנס ה-EHA האחרון את המעקב של תוצאות ו-MRD בחולים עם CLL נשנית או עמידה עם del17p עם Venetoclax. מתוך 158 חולים, שיעור התגובה היה 77 אחוזים, הפוגה מלאה ב־18 אחוזים הישרדות ללא התקדמות (PFS - Progression Free Survival) 52 אחוזים והישרדות סך הכל (OS - Overall Survival) 72 אחוזים בשנתיים. התוצאות בחולים נאיביים היו אף יותר מרשימות. תופעות הלוואי השכיחות היו נויטרופניה, בחילה, שלשול, אנמיה ועייפות. התופעות החמורות השכיחות ביותר היו נויטרופניה, טרומבוציטופניה ואנמיה. האבסטרקט סוכם כך: טיפול יחיד עם Venetoclax מניב שיעור תגובה גבוה, תגובות הנמשכות לאורך זמן באוכלוסיית חולים בעלי מחלה עם סיכון גבוה, כולל אלה שקיבלו בעבר תרופות ביולוגיות אחרות
- באותו הכנס הצגה עבודה מאנגליה על ידי Peter Hillman שנתן דיווח ראשוני על מחקר (Clarity trail) של שילוב Ibrutinib עם Venetoclax בחולים עם מחלת CLL נשנית או עמידה לטיפול. גם כאן הטיפול התחיל עם Ibrutinib בלבד ל־8 שבועות ואז הוסף ה-Venetoclax עם עליית מינון הדרגתית כמקובל. הטיפול נסבל היטב. מתוך 35 חולים שגויסו, היה מקרה אחד של TLS מעבדתי. נצפתה ירידה מהירה ברמות CLL בדם. התוצאות נראות מבטיחות, המחקר ממשיך וסיכום ראשון של תוצאות במח עצם צפוי לאחר 6 חודשי טיפול משולב
- ב-Lancet Oncology בפברואר השנה פורסם מחקר פאזה 1B מאוסטרליה של ג'ון סימור וחבריו על שילוב של Rituximab עם Venetoclax ב-R/R CLL (Reccurent/Relapsing CLL). מסך 49 חולים שגויסו, 42 הגיבו לטיפול (86 אחוזים), כולל 51 אחוזים תגובה מלאה (CR - Complete Response). הערכות של הישרדות ללא התקדמות (PFS) ותגובה מתמשכת של שנתיים היו 82 אחוזים ו־89 אחוזים בהתאמה. ב־20 חולים (80 אחוזים) הושגה הפוגה ללא שארית מינימלית של מחלה, 13 מהחולים הללו הפסיקו כל טיפול, 11 חולים שהיו ללא מחלה מינימלית ממשיכים בהפוגה מלאה ללא כל טיפול שנתיים ובשני חולים, שהיו עם שארית מחלה וחוו הישנות, חידוש הטיפול הביא לתגובה מצוינת
- ב־״Blood" השנה התפרסמה עבודה של Anderson וחברים על התכונות הקליניקופתולוגיות והתוצאות של חולים עם התקדמות CLL על טיפול עם Venetoclax. מבין 67 חולים עם R/R CLL שהשתתפו במחקר המקורי על השפעת התרופה, 25 הדגימו התקדמות (37 אחוזים) בהם 17 עם טרנספורמציה ללימפומה אגרסיבית (ריכטר) ו־8 עם התקדמות CLL/SLL. טרנספורמציית ריכטר קרתה מוקדם יותר - תוך חציון של 7.9 חודשים עם טיפול לעומת התקדמות המחלה שקרתה תוך זמן חציון 23.4 חודשים. עמידות ל-Fludarabine וריבוי שינויים ציטוגנטיים (Complex karyotype) היו קשורים באופן מובהק להתקדמות ואילו del17p או מוטציה ב-TP53 לא. הישרדות חציונית לאחר ההתקדמות הייתה 13 (49.9-1) חודשים
AML
גם בלויקמיה מיאלואידית חריפה פורסמו מספר עבודות של שילוב Venetoclax עם תרופות נוספות בחולים מבוגרים שאינם מיועדים לטיפול כימותרפי אגרסיבי:
- בעבודה מג'ון הופקינס של Keith Pratz וחברים, על שילוב Venetoclax עם Decitabine או Azacitidine בחולים מבוגרים (<65) עם AML שלא טופלו בעבר, גויסו 100 חולים, 50 בכל זרוע. שכיחות תופעות הלוואי הייתה דומה בכל החולים, הן כללו בחילה, שלשול, חום ונויטרופניה, עצירות ועייפות. תופעות אלו מוכרות בחולים אלה גם בטיפולים אחרים. סך שיעור התגובה היה 68 אחוזים, זמן מעקב 5.4 חודשים. לאור מה שנראה כפרוטוקול יעיל, מתוכנן מחקר פאזה 3
- עבודה מסטאנפורד של Andrew Wei ושותפיו להערכת בטיחות ויעילות של משלב Venetoclax עם מינון נמוך של ARA-C (Ven+ldac) בחולים מבוגרים מעל גיל 65 שלא טופלו בעבר ואינם מועמדים לטיפול אינדוקציה סטנדרטי. 61 חולים השתתפו במחקר, גילם החציון 74, תופעות הלוואי שנצפו היו בחילה, היפוקלמיה, שלשול וירידה בתיאבון ב־72-40 אחוזים. תופעות לוואי חמורות היו חום ונויטרופניה, הפרעות אלקטרוליטים ויתר לחץ דם. תמותה של 30 ו־60 ימים הייתה 3 אחוזים ו־15 אחוזים בהתאמה. סך שיעור התגובה היה 61 אחוזים, מתוכם 54 אחוזים תגובה מלאה. הישרדות של החולים שהשיגו תגובה הייתה ארוכה יותר מאלה שלא הגיבו לטיפול. גם כאן מתוכנן מחקר פאזה 3
- אותה הקבוצה מסטאנפורד פרסמה מאמר ביולי 2017 Leukemias עם ממצאים פרה-קליניים המעידים כי בתאי לויקמיה קיים סינרגיזם בפעילות של Venetoclax עם תרופות כימותרפיות - Cytarabine ו-Idarubicin כנראה על ידי דיכוי פעילות חלבון אנטי-אפופטוטי 1-MCL ממשפחת 271-BCL. פגיעה כפולה ב-2-BCL וב-MCL-1, אך לא כל אחד לחוד, העריכה הישרדות עכברים עם לויקמיה
MULTIPLE MYELOMA
מחקרים מוקדמים הראו כי Venetoclax מראה שיעורי תגובה מרשימים בחולים עם מחלה מתקדמת ו־(14;11)t כתרופה יחידה. גם שילובה עם Bortezomib ו-Dexamethasone מראה שיעור תגובות מעל 60 אחוזים בחולים לאחר קווי טיפול רבים וגם בכאלה שהיו עמידים ל-Bortezomib.
עבודה שהוצגה על ידי Phillip Moureu ב־2017 EHA הראתה טיפול משולב של Venetoclax עם Vel-Dex בחולים עם מיאלומה נשנית ועמידה. גויסו 66 חולים, שיעור התגובה היה 67 אחוזים (44/66), 28 חולים (42 אחוזים) השיגו הפוגה חלקית טובה מאוד (VGPR - Very Good Partial Response) או יותר. זמן חציון עד התקדמות היה ארוך יותר בחולים ללא עמידות ל-Bortezomib (כ־10 לעומת 3 חודשים). מבחינת תופעות לוואי, הטיפול נסבל היטב ומתוכנן מחקר פאזה שלישית במשלב הזה.
LYMPHOMA
בעשור השני של המאה ה-21 התפרסמו עבודות העוסקות בהשפעה של Venetoclax בלימפומה. מדובר בעבודות פרה-קליניות וקליניות מוקדמות, אחת מהן התפרסמה לפני כחודש ב-Cancer research ועסקה בסינרגיזם בין Venetoclax לרדיותרפיה - הקרנות או רדיואימונותרפיה. בשורות תאים ובמודל עכבר של Mantle Cell Lymphoma ו-ABC type DLBCL (Diffuse Large B Cell Lymphoma) נצפו התוצאות הטובות ביותר.
עבודה ראשונה בבני אדם התפרסמה ב-Leukemia & Lymphoma ביולי השנה. בעבודה זו נמצא קשר בין חשיפה גדולה יותר ל-Venetoclax כתרופה יחידה לבין סבירות לתגובה, שרידות ללא התקדמות בחולים עם סוגים שונים של NHL (Non-Hodgkin Lymphoma), בלי קשר לרמת ביטוי ה-2-BCL בצביעות אימונוהיסטוכימיות.
גם בממאירויות לא המטולוגיות, כמו סרטן ריאות של תאים קטנים, יש תוצאות מעניינות מאוד בשילוב Venetoclax עם תרופות כימותרפיות וביולוגיות.
לסיכום, הסקירה מתארת שנה נוספת של התקדמות בטיפולים ביולוגיים לממאירויות המטולוגיות המתבססים על מחקר והבנת התהליכים התוך תאיים שמאפשרים חיים והתרבות לא מבוקרת לתאי סרטן, פיתוח פרוטוקולים טיפוליים המתבססים על שילוב כימותרפיה עם טיפולים ביולוגיים עם ירידה בטוקסיות הטיפולים ושיפור בתוצאותיהם.
ביבליוגרפיה
- Atan Gross, James M. McDonnell and Stanley J. Korsmeyer. 1999. BCL-2 family members and the mitochondria in apoptosis. Genes & Development. 13:1899-1911
- Meike Volger. 2014.Targeting BCL-2 Proteins for the treatment of Solid Tumors. Advances in Medicine.2014:1-14
- Gregory L. Verdine and Loren D. Walensky. 2007. The Challenge of Drugging Undruggable Targets in Cancer: Lessons Learned from Targeting BCL-2 Family Members. Clin Cancer Res.13(24) December 15:7264-7270
- Asher Mullard. 2016. Pioneering apoptosis-targeted cancer drug poised for FDA approval. Nature Reviews/ Drug Discovery. 15:147-149
- Shundong Cang, Chaitanya Iragavarapu, John Savooji, Yongping Song and Delong Liu. 2015 ABT-199 (venetoclax) and BCL-2 inhibitors in clinical development. Journal of Hematology and Oncology 8:129-136
- Andrew W. Roberts et al. 2016. Targeting BCL-2 with Venetoclax in Relapsed Chronic Lymphocytic Leukemia. The New England Journal of Medicine 374(4):311-322
- Stephan Stilgenbauer et al. 2016. Venetoclax in Relapsed/Refractory Chronic Lymphocitic Leukemia with 17p Deletion: a Phase 2, Open Label, Multicenter study. Lancet Oncology. 17(6):768-78
- Shou Ma et al. 2015. Deep and Durable Responses Following Venetoclax (ABT-199/GDC-0199) Combined with Rituximab in Patients with Relapsed/Refractory CLL: RESULTS FROM pHASE 1b Study. ASH 2015, Abstract 830
- Sven de Vos et al. 2015. A Dose-Escalation Study of Venetoclax (ABT-199/GDC-0199) in Combination with Bendamustine and Rituximab in Patients with Relapsed or Refractory Non-Hodgkin’s Lymphoma. ASH, 2015. Abstract 255
- Kirsten Fischer et al. 2015. Results of the Safety Run-in Phase of CLL-14 (BO25323): A Prospective, Open Label, Multicenter Randomized Phase III Trail to Compare the Efficacy and Safety of Obinutuzumab and Venetoclax with Obinutuzumab and Chlorambucil in Patients with Previouslu Untreated CLL and Coexisting Medical Conditions. ASH 2015, Abstract 496
- Courtney DiNardo et al. 2015. A Phase 1b Study of Venetoclax (ABT-199/GDC-0199) in Combination with Decitabine or Azacitidine in Treatment-Naive Patients with Acute Myelogenous Leukemia Who Are > 65 Years 1 and Not Eligible for Standard Induction Therapy. 2015. ASH 2015, Abstract 327
- Jeffrey Jones et al. 2016. Venetoclax is Active in CLL P0atients Who Have Relapsed After or Refractory to Ibrutinib or Idelalisib. ASCO 2016, Abstract 7519
- Ghia, P., Tam, C. S., Siddiqi, T., Stevens, D., Flinn, I. W., Russell, K., ... & Wierda, W. G. (2017). AN ONGOIN PHASE 2 STUDY OF IBRUTINIB COMBINED WITH VENETOCLAX IN PATIENTS WITH TREATMENT-NAIVE CLL/SLL. Hematological Oncology, 35(S2), 428-428.
- Seymour, J. F., Ma, S., Brander, D. M., Choi, M. Y., Barrientos, J., Davids, M. S., ... & Prine, B. (2017). Venetoclax plus rituximab in relapsed or refractory chronic lymphocytic leukaemia: a phase 1b study. The Lancet Oncology, 18(2), 230-240.
- Mato, A. R., Hill, B. T., Lamanna, N., Barr, P. M., Ujjani, C. S., Brander, D. M., ... & Pu, J. J. (2017). Optimal sequencing of ibrutinib, idelalisib, and venetoclax in chronic lymphocytic leukemia: results from a multicenter study of 683 patients. Annals of Oncology, 28(5), 1050: 1056.
- Cramer, P., Langerbeins, P., Eichhorst, B., & Hallek, M. (2016). Advances in first-line treatment of chronic lymphocytic leukemia: current recommendations on management and first-line treatment by the German CLL Study Group (GCLLSG). European journal of haematology, 96(1), 9-18.
- Woyach, J. A. (2017). How I manage ibrutinib-refractory chronic lymphocytic leukemia. Blood, 129(10), 1270-1274.
- Cramer, P., Hallek, M., & Eichhorst, B. (2016). State-of-the-art treatment and novel agents in chronic lymphocytic leukemia. Oncology research and treatment, 39(1-2), 25-32.
- Anderson, M. A., Tam, C., Lew, T. E., Juneja, S., Juneja, M., Westerman, D., ... & Seymour, J. F. (2017). Clinico- pathological features and outcomes of progression of CLL on the BCL2 inhibitor venetoclax. Blood, blood! 2017.
- Teh, T. C., Nguyen, N. Y., Moujalled, D. M., Segal, D., Pomilio, G., Rijal, S., ... & Thompson, E. (2017). Enhancing venetoclax activity in acute myeloid leukemia by co-targeting MCL1. Leukemia.
- Podar, K., & Pecherstorfer, M. (2017). Current and developing synthetic pharmacotherapy for treating relapsed/refractory multiple myeloma. Expert Opinion on Pharmacotherapy, (just-accepted).
- O’Steen, S., Green, D. J., Gopal, A. K., Orozco, J. J., Kenoyer, A. L., Lin, Y., ... & Gooley, T. A. (2017). Venetoclax Synergizes with Radiotherapy for Treatment of B cell Lymphomas. Cancer Research, canres-0082.
- Parikh, A., Gopalakrishnan, S., Freise, K. J., Verdugo, M. E., Menon, R. M., Mensing, S., & Salem, A. H. (2017). Exposure-response evaluations of venetoclax efficacy and safety in patients with non-Hodgkin lymphoma. Leukemia & Lymphoma, 1-9.
- Inoue-Yamauchi, A., Jeng, P. S., Kim, K., Chen, H. C., Han, S., Ganesan, Y. T., ... & Hellmann, M. D. (2017). Targeting the differential addiction to anti-apoptotic BCL-2 family for cancer therapy. Nature Communications, 8.
- Wei, A., Strickland, S. A., Roboz, G. J., Hou, J. Z., Fiedler, W., Lin, T. L., ... & Darden, D. E. (2016). Safety and efficacy of venetoclax plus low-dose cytarabine in treatment-naive patients aged> 65 years with acute myeloid leukemia.
- S. Stingelbauer et al (2017) Venetoclax in R/R CLL with 17p deletoin: outcome and MRD from the full population of pivotal M13-981 Trail. EHA 2017, (abs S771)
- P. Hillmen et al (2017) The initial report of the bloodwise TAP CI^RITY Study of combining Ibrutinib with Venetoclax in R/R CLL shows acceptable safety and promising early efficacy. EHA 2017( abs S770)
- K. Pratz et al (2017) Safety and Efficacy of Venetoclax in combination with Decitabine or Azacitidine in treatment naive elderly patients with AML. EHA 2017
- A. H. Wei et al (2017) Updated safety and efficacy results of phase 1/2 study of venetoclax+LDAC in treatment-naive AML patients Age>65 and unfit for standart induction treatment. EHA 2017 (abs 473)
- P. Moreau et al (2017) Phase 1B study of Venetoclax combined with BOR/DEX in patients with R/R MM. EHA 2017 (abs S460)
המידע שבדף זה נכתב על ידי ד"ר ריבה פיינמן, מנהלת השירות להמטולוגיה אמבולטורית, המערך ההמטולוגי, הקרייה הרפואית רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק