סרטן שד דלקתי - Inflammatory breast cancer
| סרטן שד דלקתי | ||
|---|---|---|
| Inflammatory breast cancer | ||
| 250px | ||
| יוצר הערך | ד"ר גיאורגיטה פריד וד"ר שלומית סטרולוב שחר | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
סרטן שד דלקתי הוא תת-סוג נדיר ואגרסיבי ביותר של סרטן השד, המאובחן אצל 5%-1% מכלל החולות בסרטן השד. התיאור הראשון של סרטן שד דלקתי פורסם בספרות המדעית ב-1814 על ידי סר צ'ארלס בל (Bell), והמונח הוטבע לראשונה ב-1924 על ידי החוקר לי טננבאום (Tannenbaum)[1].
סרטן מסוג זה מוגדר כתת-סוג קליני ופתולוגי, המתאפיין בעור אדמומי המתפרש על כשליש משטח השד או יותר, בליווי חום ו/או בצקת של העור, במראה המזכיר קליפת תפוז (Peau d'orange). השינויים העוריים נגרמים בשל תסחיפי גידול בכלי הלימפה העוריים, למרות שמאפיין זה לא תמיד ניתן לזיהוי בביופסיה של העור. יחד עם זאת, התמונה הקלינית (בנוכחות ביופסיה שמדגימה סרטן שד), מספיקה לצורך אבחון סרטן שד דלקתי, גם בהיעדר ממצאים בביופסיה של העור.
לגידול זה ביולוגיה אגרסיבית, חדירות גבוהה לכלי דם ונטייה לשלוח גרורות. שיעורי ההישרדות לחמש שנים בסרטן שד דלקתי לפני עידן הכימותרפיה היו פחות מ-5%. תוצאות דומות הושגו על ידי ניתוח רדיקלי או על ידי רדיותרפיה כאשר שילוב בין השניים שיפר שליטה מקומית בלבד בגידול. לאור זאת, ניתן להסיק שמדובר במחלה מערכתית כבר בשלב האבחנה.
עם זאת, ב-40 השנים האחרונות חל שיפור בסיכויי ההישרדות, הודות לטיפול רב-מערכתי בו נעשה שימוש בכימותרפיה טרום ניתוחית, ניתוח, הקרנות וטיפול הורמונלי ו\או ביולוגי משלים (לפי מצב קולטנים). שיעורי ההישרדות לאחר טיפול משולב, עליהם דווח, עמדו על חמש שנים ל-56% מהחולות, כאשר 41% מהן שרדו עשר שנים[2].
אפידמיולוגיה
סרטן שד דלקתי מאובחן בשיעור שנע בין 1% ל-5% מכלל חולות סרטן השד בצפון אמריקה, ואילו בצפון אפריקה, לפי דיווחים ממצרים ומתוניס, מגיע שיעור החולות במחלה זו ל-7% עד 15%. עוד עולה מהדיווח ממדינות אלה, כי שכיחות המחלה נמצאת בעליה, גיל האבחנה הממוצע נמוך יותר, והפרוגנוזה גרועה יותר ביחס לסרטן שד לא דלקתי.
אבחנה
בשל העובדה שמדובר במחלה אגרסיבית, זמן האבחנה הוא קריטי, על מנת לאפשר טיפול מתאים שתוצאותיו ישפיעו לטווח ארוך. פעמים רבות, האבחנה מתעכבת בשל הדמיון לדלקת זיהומית של השד (מסטיטיס).
קליניקה
- הופעה מהירה של אודם, חום מקומי, בצקת, "עור קליפת תפוז" עם או בלי גוש ניתן למישוש בשד, רטרקציה או שינוי בפטמה.
- היסטוריה של מסטיטיס שלא הגיבה לטיפול אנטיביוטי במשך שבוע.
- התפתחות תוך פחות משישה חודשים.
- אודם שנראה בבדיקה פיזיקלית, שתופס לפחות שליש משטח השד, עם או בלי מסה, או בלוטות נמושות בבית השחי.
בשונה מדלקת בשד, מורסה בשד, גרורות בשד ממקור אחר ודרמטיטיס לאחר קרינה, סרטן שד דלקתי אינו תהליך זיהומי ואינו גורם לחום וללויקוציטוזיס[3].
פתולוגיה
היסטולוגיה של סרטן שד דלקתי אינה שונה מסרטן שד לא דלקתי, ובדרך כלל היא מסוג צינורי (Ductal carcinoma), בדרגת התמיינות נמוכה וללא קריטריונים היסטולוגיים מסוימים לאבחון. בסרטן שד דלקתי קיים מרכיב של תסחיף גידולי לימפו-וסקולרי תוך-רקמתי (Intraparenchymal) ותבנית גדילה דחוסה פחות מבסרטן שד לא דלקתי, עם אזורים גדולים ללא גידול ואזורים קטנים עם קרצינומה חודרנית, המקיפים לעיתים תסחיף גידולי בכלי הדם.
למרות שם הגידול, אין הסננה של תאי דלקת ברקמה. השינויים הדלקתיים בעור נגרמים בשל חדירה לכלי הלימפה של העור, היוצרת מצב בו החללים הלימפו-וסקולריים העוריים מתמלאים בתסחיף גידולי, אשר גורם להפרדה בין השכבה בה הם נמצאים מהשכבה האנדותליאלית ההיקפית. מצב זה נחשב לסימן ההיכר ההיסטולוגי של סרטן שד דלקתי, שמוביל לחסימת כלי לימפה. במקרים של ספק או חשד לסרטן שד דלקתי, מומלץ לבצע ביופסיה של העור ככלי עזר אבחוני, אולם היעדר מעורבות לימפטית של העור אינה שוללת את האבחנה בנוכחות הסימנים הקליניים[4].
קולטנים להורמונים
סרטן שד דלקתי אינו מבטא קולטנים להורמונים באחוז גבוה של המקרים, העלול להגיע עד ל-83%. נתון זה תואם את מהלך המחלה האגרסיבי, וההישרדות הנמוכה יותר של חולות עם סרטן שד דלקתי[5]. במחקר שפורסם בהתבסס על הנתונים של מאגר ה-SEER (Surveillance, Epidemiology, and End Results) נמצא הבדל משמעותי בהישרדות בין סרטן שד דלקתי חיובי לקולטנים להורמונים לבין סרטן שד דלקתי שלילי לקולטנים להורמונים (חציון של ארבע שנים לעומת שנתיים).
נתונים מהספרות המקצועית תומכים בכך שלקולטנים להורמונים תפקיד פרוגנוסטי וטיפולי חשוב בסרטן שד דלקתי. אצל 60%-36% מהחולות בסרטן שד דלקתי נמצא ביטוי יתר של HER2 (2 Human Epidermal Growth Factor). עם זאת, טרם הוכח כי קיים הבדל במהלך המחלה ובהישרדות בין חולות אצלן נמצא ביטוי יתר של HER2, לבין חולות ללא ביטוי כזה[6].
מרכיבים מולקולריים
מחקרים רבים התמקדו בזיהוי שינויים גנטיים אופייניים לתהליך הדלקתי של הסרטן המכונים "חתימה מולקולרית דלקתית". בחלק גדול מהמקרים בהם התגלה סרטן שד דלקתי, נמצא ביטוי גבוה של גורמי צמיחה המעורבים בהתהוות כלי דם (אנגיוגנזה): FGF, קולטנים ל-VEGF (Vascular Endothelial Growth Factor) ורמות גבוהות של הציטוקינים 8-IL ו-IL-6 . נתון זה מסביר את נוכחותם של כלי דם צעירים ורבים בתוך הגידול. רמה גבוהה של החלבון E-Cadherin (שאחראי להידבקות התאים) וביטוי יתר של MUC1 לא פעיל, אחראיים לפיזור הגרורתי הנפוץ.
שינויים גנטיים
בכמחצית מהמקרים בהם התגלה סרטן שד דלקתי, נמצא אצל החולות אובדן הטרוזיגוטיות (LOH ,Loss of Heterozygosity) - תהליך כרומוזומלי הגורם לאיבוד גן שלם. בסדרת בדיקות שנערכה ל-64 חולות עם סרטן שד דלקתי שטופלו במרכז אחד, נמצאו דפוסי LOH שונים ונמצאה נוכחות יתר בגידול אצל חולות עם תהליך דלקתי נרחב ופרוגנוזה גרועה.
הגן p53 אחראי על מניעת מוטציות ועל שמירה על יציבות הגנום. גן זה נמצא מוטנטי בכ-41% מהמקרים של סרטן שד דלקתי, ונוכחותו מצביעה על מקרים עם מחלה מתקדמת יותר, סיכון מוגבר לגרורות ופרוגנוזה גרועה.
במקרים רבים של סרטן שד דלקתי - בשיעור של 90% - נמצאה נוכחות מוגברת של Rho C (חלק מקבוצת האונקוגנים Ras), המהווה גורם משמעותי ביצירת גרורות. לעומת זאת בקרב נשים שאובחנו כחולות בסרטן שד לא דלקתי, נצפתה נוכחות מוגברת של Rho C אצל 38% מהחולות בלבד.
הגן WISP3 ידוע כמדכא גדילה, והוא אחראי על יצור IGFBPrP (Insulin-Like Growth Factor Binding Protein - Related Protein). גן זה נמצא חסר ב-80% מהמקרים של סרטן שד דלקתי, לעומת 20% בסרטן שד לא דלקתי[7].
בדיקות עזר
ממוגרפיה יכולה להדגים גוש עם שינוי בארכיטקטורה של השד או הסתיידויות פתולוגיות. במרבית המקרים (80%) מופיע עיבוי של העור ושינוי בארכיטקטורה של קוריות השד. במחקר רטרוספקטיבי שבדק מאפיינים ממוגרפיים, הודגם גידול ראשוני רק ב-15% מהמקרים[8]. בעידן הממוגרפיה הדיגיטלית, הממצאים הפתולוגים השכיחים יותר בממוגרפיה הם שינוי בקוריות השד, עיבוי של העור וסמיכות יתר של רקמת השד.
על מנת לזהות אזורים חשודים (גידול או עיוות בקוריות השד), מומלץ לבצע ממוגרפיה דו-צדדית לצורך סקירה של השד השני, וכן לצורך ביופסיה המכוונת על ידי על-קול (אולטרסאונד). בדיקת אולטרסאונד תורמת לאבחון מעורבות של בלוטות הלימפה האזוריות, לפני הטיפול הכימותרפי, לצורך תכנון טיפול קרינתי משלים לכל האזורים המעורבים.
השימוש בדימות תהודה מגנטית (MRI ,Magnetic Resonance Imaging) של השדיים אינו מומלץ כבדיקה שגרתית, אלא במקרים בהם לא ניתן למצוא נגעים בבדיקת אולטרסאונד או בממוגרפיה[9].
בירור מערכתי ודירוג המחלה
מרבית הנשים שחלו בסרטן שד דלקתי מאובחנות כחולות במחלה מקומית מתקדמת, כאשר 30% מהן סובלות ממחלה גרורתית. מסיבה זו מומלץ לבצע בעת האבחנה בירור מערכתי הכולל טומוגרפיה ממוחשבת (CT ,Computed Tomography) כלל-גופית ומיפוי עצם.
השימוש בבדיקת PET-CT (Positron Emission Tomography - Computed Tomography) לצורך בירור מערכתי בסרטן שד דלקתי, שנוי במחלוקת. במחקר רטרוספקטיבי שבדק את תרומתה של בדיקה זו לאבחון סרטן שד דלקתי, בוצעה בדיקה זו לאחר שהחולות עברו בדיקת CT ומיפוי עצם. אחוז הנשים שאובחנו בבדיקת PET-CT כחולות במחלה גרורתית שלא אובחנה ב-CT רגיל, הגיע לשיעור של 17%[10]. במחקר אחר נמצא שיפור בהישרדות אצל חולות סרטן שד דלקתי שעברו PET-CT בעת האבחנה. תוצאות אלו מוסברות על ידי שינוי דירוג המחלה (Stage) לפי המידע שהתקבל בעקבות בדיקה זו (Stage migration effect). בנוסף, גילוי ממצאים בבלוטות לימפה אזוריות, יכול לסייע בתכנון הטיפול הקרינתי[11].
סרטן שד דלקתי מדורג לפי שיטת TNM, שיטה המשקללת את גודל הגידול (T ,Tumor), מעורבות הבלוטות (N ,Nodes) ונוכחותן של גרורות (M ,Metastases). מחלה זו מוגדרת תמיד כ-T4d, ולפי מצב מעורבות קשרי הלימפה (N0 עד N3) ובהיעדר פיזור גרורתי, הגידולים ידורגו כ-Stage IIIB (T4dN0-2) או כ-Stage IIIC (T4dN3).
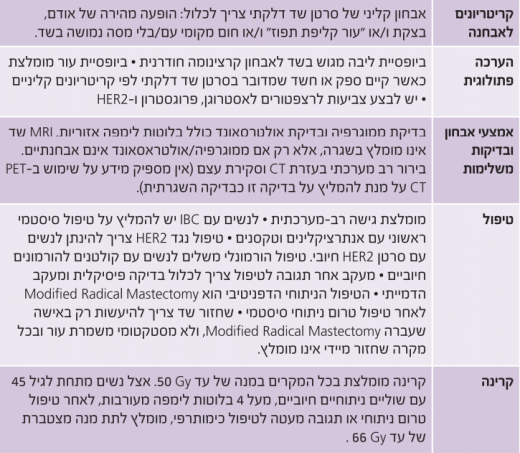
טיפול
כאשר מדובר בסרטן שד דלקתי, הגישה הטיפולית המומלצת היא גישה רב-מערכתית, הכוללת טיפול כימותרפי מערכתי טרום ניתוחי עם אנתרציקלינים וטקסנים, ניתוח, קרינה משלימה וטיפול משלים הורמונלי.
טיפול כימי סיסטמי
אצל מרבית החולות שחלו בסרטן שד דלקתי, אובחנה המחלה בשלב מקומי מתקדם עם מעורבות נרחבת של העור. במקרים אלו מומלץ לטפל באמצעות כימותרפיה טרום ניתוחית, על מנת לאפשר ניתוח סופי. אין מחקרים פרוספקטיביים נרחבים על טיפול כימותרפי טרום ניתוחי בסרטן שד דלקתי, ולכן ההמלצות היום נשענות על מחקרים פרוספקטיביים קטנים, מחקרים רטרוספקטיביים וחיוץ ממחקרים על סרטן שד לא דלקתי.
במחקר שכלל את מספר הנשים הגבוה ביותר שחלו בסרטן שד דלקתי, טופלו החולות באמצעות שילוב בין כימותרפיה שכללה אנתרציקלינים, וטיפול קרינתי שניתן בהמשך. נמצא כי 40% מהחולות שרדו חמש שנים, ואילו 30% מהן שרדו במשך עשר שנים[12]. תוספת של טקסנים לאנתרציקלינים תורמת לשיפור בתגובה, והעלאת אחוזי תגובה פתולוגית מלאה (Pathological complete response)[13].
טיפול ביולוגי
אצל חולות עם סרטן שד דלקתי וביטוי יתר ל-HER2, הראו המחקרים כי תוספת של Herceptin (Trastuzumab), לטיפול כימותרפי טרום ניתוחי, שיפרה את אחוזי התגובה הקלינית והעלתה את אחוזי התגובה הפתולוגית המלאה[14][15][16][17]. במחקר הפרוספקטיבי בשלב השלישי NOAH (NeOAdjuvant Herceptin), אשר בדק משלב מבוסס אנתרציקלינים וטקסנים בתוספת Herceptin למשך שנה (טרום ובתר-ניתוחי), בקרב נשים עם מחלה מתקדמת מקומית עם ביטוי יתר ל-HER2, נכללו גם 76 חולות סרטן שד דלקתי, והודגם בצורה מובהקת שיפור בתגובה הפתולוגית המלאה בחולות שקיבלו Herceptin לעומת חולות שלא קיבלו טיפול כזה (54.8% לעומת 19.3%)[18]. ניתן לסכם ולומר כי מומלץ על לפחות שישה מחזורים של טיפול כימותרפי טרום ניתוחי, הכולל אנתרציקלינים וטקסנים, במשך ארבעה עד שישה חודשים. הטיפול המומלץ לחולות עם ביטוי יתר של HER2 הוא מתן Herceptin בשילוב עם כימותרפיה בהמשך, למשך כשנה.
לעיתים יינתן לחולה עם ביטוי יתר של HER2 טיפול באמצעות שילוב בין Herceptin ו-Perjeta (Pertuzumab), נוגדן חד-שבטי הנקשר לחלק החוץ-תאי של הקולטן HER2 באפיטופ שונה מזה של Herceptin. מכיוון ששתי התרופות נקשרות לאפיטופים שונים על גבי הקולטן, נמצא כי השילוב של שתיהן הביא לחסימה יעילה יותר של HER2 מאשר כל תרופה בנפרד. במחקר בשלב השני NeoSphere נבדק השילוב של Taxotere (Docetaxel) עם Herceptin, Perjeta, או שניהם, בטיפול טרום-ניתוחי בסרטן שד עם HER2 חיובי. מתוך 417 חולות שהשתתפו במחקר נמצא כי בקבוצת החולות שקיבלו את הטיפול המשולש, 45.8% השיגו תגובה פתולוגית מלאה בעת הניתוח, לעומת 29% ו-24% בקבוצת ה-Herceptin וה-Taxotere וקבוצת ה-Perjeta וה-Taxotere בהתאמה. בקבוצה הרביעית במחקר זה, ניתן טיפול ביולוגי בלבד של Herceptin ו-Perjeta - ובו נצפתה תגובה פתולוגית מלאה ב-16.8% מהמקרים בלבד[19].
טיפול ניתוחי
הטיפול הניתוחי המומלץ לאחר טיפול כימותרפי טרום ניתוחי הוא כריתה נרחבת מותאמת של השד (כריתת שד ובלוטות לימפה בבית השחי). ניתוח כריתה משמרת עור או ניתוחים משמרי שד אינם מומלצים, אלא במסגרת מחקרית בלבד. ניתן לבצע ניתוח שחזור שד, אך תזמון השחזור שנוי במחלוקת מכיוון ששחזור מיידי עלול לפגוע באיכות הטיפול הקרינתי הבתר-ניתוחי ועל כן לא מומלץ לבצע זאת בשגרה, אלא רק במסגרת מחקרית.
הממצא הניתוחי צריך לעבור הערכה פתולוגית הכוללת הערכה של השוליים הניתוחיים, גודל הממצא השיירי (הערכת תגובה פתולוגית לטיפול הטרום ניתוחי), הערכת קשריות הלימפה והערכה נוספת של מצב קולטנים להורמונים HER2 במידה ואלה נמצאו שליליים בביופסיה.
טיפול משלים
- טיפול קרינתי משלים - לנשים עם סרטן שד דלקתי אשר עברו כריתה נרחבת מותאמת של השד מומלץ טיפול קרינתי משלים לדופן החזה ולניקוז הלימפטי, כולל בלוטות בית השחי, השרשרת האינטרה-ממרית והבלוטות העל-בריחיות. אצל נשים מתחת לגיל 45 עם שוליים קרובים/חיוביים ו/או יותר מארבע בלוטות נגועות ו/או תגובה מעטה לטיפול הטרום ניתוחי, מומלץ להגיע למנה מצטברת של 66 Gy (גריי).
- טיפול תרופתי משלים - לכל אישה עם סרטן שד דלקתי וקולטנים חיוביים להורמונים, מומלץ להוסיף טיפול הורמונלי משלים למשך חמש עד עשר שנים ב-Tamoxifen ו/או מעכב ארומטאז לפי המצב המנופאוזלי. לחולות עם סרטן שד דלקתי וביטוי חיובי של HER2, מומלץ להוסיף טיפול משלים ב-Herceptin, למשך שנה.
מעקב בתר ניתוחי
בדיקות המעקב המומלצות מבוססות על הנחיות ASCO (American Society of Clinical Oncology) משנת 2006, וכוללות בדיקה גופנית כל 6-3 חודשים וממוגרפיה שנתית לשד השני (הבריא). ניתן לשקול גם ביצוע על-קול להערכת קשריות לימפה אזוריות, אחת לשנה. בדיקות דימות נוספות ובדיקות של סמני גידול לאבחון חזרה סיסטמית של המחלה אינן מומלצות.
בנוסף, אין המלצה לבצע כריתה מניעתית של השד השני באופן שגרתי, שכן היא אינה צפויה להשפיע על סיכויי ההחלמה, שנקבעים על פי מאפייני הגידול באבחנה.
יעוץ גנטי מומלץ לנשים עם היסטוריה משפחתית של סרטן שד ו/או שחלה, ולנשים שחלו לפני גיל 50.
המלצות מפתח לניהול מקרה סרטן שד דלקתי
ביבליוגרפיה
- ↑ Lee B, Tannenbaum E. Inflammatory carcinoma of the breast: a report of twenty-eight cases from the breast clinic of Memorial Hospital. Surg Gynecol Obstet. 1924; 39:580-95.
- ↑ Dawood S, et al. International expert panel on inflammatory breast cancer: consensus statement for standardized diagnosis and treatment. Ann Oncol. 2011 Mar;22(3):515-23.
- ↑ Hance KW, et al. Trends in inflammatory breast carcinoma incidence and survival: the surveillance, epidemiology, and end results program at the National Cancer Institute. J Natl Cancer Inst. 2005 Jul 6;97(13):966-75.
- ↑ Kim T, Lau J, Erban J. Lack of uniform diagnostic criteria for inflammatory breast cancer limits interpretation of treatment outcomes: a systematic review. Clin Breast Cancer. 2006 Dec;7(5):386-95.
- ↑ Harvey HA, Lipton A, Lawrence BV, et al. Estrogen receptor status in inflammatory breast carcinoma. J Surg Oncol. 1982 Sep;21(1 ):42-4.
- ↑ Zell JA, Tsang WY, Taylor TH, et al. Prognostic impact of human epidermal growth factor-like receptor 2 and hormone receptor status in inflammatory breast cancer (IBC): analysis of 2,014 IBC patient cases from the California Cancer Registry. Breast Cancer Res. 2009;11(1):R9.
- ↑ Overmoyer BA. Inflammatory breast cancer: novel preoperative therapies. Clin Breast Cancer. 2010 Feb;10(1):27-32.
- ↑ Gunhan-Bilgen I, Ustun EE, Inflammatory breast carcinoma: mammographic, ultrasonographic, clinical, and pathologic findings in 142 cases. Radiology. 2002 Jun;223(3):829-38.
- ↑ Yang WT, Le-Petross HT, Macapinlac H, et al. Inflammatory breast cancer: PET/CT, MRI, mammography, and sonography findings. Breast Cancer Res Treat. 2008 June; 109(3):417-26.
- ↑ Carkaci S, Macapinlac HA, Cristofanilli M, et al. Retrospective study of 18F-FDG PET/CT in the diagnosis of inflammatory breast cancer: preliminary data. J Nucl Med. 2009 Feb;50(2):231-8.
- ↑ Niikura N, Liu J, Hayashi N, et al. Treatment outcome and prognostic factors for patients with bone-only metastases of breast cancer: A single-institution retrospective analysis. The Oncologist 2011 ;16(2): 155-64.
- ↑ Ueno NT, Buzdar AU, Singletary SE, et al. Combined-modality treatment of inflammatory breast carcinoma: twenty years of experience at M.D. Anderson Cancer Center. Cancer Chemother Pharmacol. 1997;40(4):321-9.
- ↑ Cristofanilli M, Gonzalez-Angulo AM, BuzdarAU, et al. Paclitaxel improves the prognosis in estrogen receptor negative inflammatory breast cancer: The M.D. Anderson Cancer Center experience. Clin Breast Cancer. 2004 Feb;4(6):41 5-9.
- ↑ Hurley J, Doliny P, Reis I et al. Docetaxel, cisplatin, and trastuzumab as primary systemic therapy for human epidermal growth factor receptor 2-positive locally advanced breast cancer. J Clin Oncol. 2006 Apr;24(12):1831-8.
- ↑ Cristofanilli M, Boussen H, Baselga J, et al. A phase II combination study of lapatinib and paclitaxel as a neoadjuvant therapy in patients with newly diagnosed inflammatory breast cancer (IBC). Breast Cancer Res Treat. 2006;100:S14.
- ↑ Limentani SA, Brufsky AM, Erban JK et al. Phase II study of neoadjuvant docetaxel, vinorelbine and trastuzumab followed by surgery and adjuvant doxorubicin plus cyclophosphamide in women with human epidermal growth factor receptor 2-overexpressing locally advanced breast cancer. J Clin Oncol. 2007 Apr;25(10): 1232-8. Epub 2007 Feb 12.
- ↑ Burstein HJ, Harris LN, Gelman R, et al. Preoperative therapy with trastuzumab and paclitaxel followed by sequential adjuvant doxorubicin/cyclophosphamide for HER2 overexpressing stage II or III breast cancer: a pilot study. J Clin Oncol. 2003 Jan;21(1 ):46-53.
- ↑ Gianni L, Eiermann W, SemiglazovV, etal. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet. 2010 Jan 30;375(9712):377-84.
- ↑ Gianni L, Pienkovski T, Im YK, et al. Efficacy and safety of neoadjuvant pertuzaumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012 Jan; 13(1 ):25-32.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר גיאורגיטה פריד - מנהלת יחידת השד, וד"ר שלומית סטרולוב שחר - מתמחה מצטיינת מכון אונקולוגי, הקריה הרפואית לבריאות האדם רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק