הבדלים בין גרסאות בדף "גלקטוקינאז - Galactokinase"
(←ראו גם) |
|||
| (גרסת ביניים אחת של אותו משתמש אינה מוצגת) | |||
| שורה 14: | שורה 14: | ||
==האנזים galactokinase== | ==האנזים galactokinase== | ||
| − | + | האנזים galactokinase (להלן GALK) הוא למעשה פוספוטרנספראז המקטלז את הזרחון של α-D-galactose והפיכתו ל-galactose-1-phosphate כאשר תורם שייר הפוספאט הוא ATP ההופך ל-ADP. האנזים GALK מקטלז את השלב השני של מסלול Leloir, מסלול מטבולי שמוצאים ברוב האורגניזמים בהפיכת β-D-galactose ל-glucose-1-phosphate (על פי Frey ב-FASEB J משנת 1996). האנזים GALK בודד לראשונה מכבד יונקים, ונלמד בהמשך באופן נמרץ בשמר Saccharomyces cerevisiae (על פי Schell וחב' ב-J Biol Chem משנת 1979), בצמחים (Fogliettiet וחב' ב-Biochimie משנת 1976) ובאדם (Dey ב-Eur J Biochem משנת 1983, ו-Holden וחב' ב-Cell Mol Life Sci משנת 2004). בניגוד למטבוליזם של גלוקוזה, התלוי בתחילתו באנזים [[hexokinase]] שהספציפיות שלו היא כלפי הקסוזות שונות, במקרה של המטבוליזם של גלקטוזה, מוצאים ספציפיות מצומצמת יותר של GALK. | |
| − | האנזים galactokinase (להלן GALK) הוא למעשה פוספוטרנספראז המקטלז את הזרחון של α-D-galactose והפיכתו ל-galactose-1-phosphate כאשר תורם שייר הפוספאט הוא ATP ההופך ל-ADP. האנזים GALK מקטלז את השלב השני של מסלול Leloir, מסלול מטבולי שמוצאים ברוב האורגניזמים בהפיכת β-D-galactose ל-glucose-1-phosphate (על פי Frey ב-FASEB J משנת 1996). האנזים GALK בודד לראשונה מכבד יונקים, ונלמד בהמשך באופן נמרץ בשמר Saccharomyces cerevisiae (על פי Schell וחב' ב-J Biol Chem משנת 1979), בצמחים (Fogliettiet וחב' ב-Biochimie משנת 1976) ובאדם (Dey ב-Eur J Biochem משנת 1983, ו-Holden וחב' ב-Cell Mol Life Sci משנת 2004). | ||
==מבנה האנזים GALK== | ==מבנה האנזים GALK== | ||
| שורה 90: | שורה 89: | ||
==ראו גם== | ==ראו גם== | ||
| − | |||
* [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
* [[אבחון מחלות ומפגעים מטבוליים-גנטיים|בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | * [[אבחון מחלות ומפגעים מטבוליים-גנטיים|בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | ||
גרסה אחרונה מ־09:40, 21 במאי 2023
| מדריך בדיקות מעבדה | |
| גלקטוקינאז | |
|---|---|
| Galactokinase | |
| שמות אחרים | GALK |
| מעבדה | כימיה בדם |
| תחום | הערכה של גלקטוזמיה מוּלדת |
| טווח ערכים תקין | בתינוקות מתחת גיל שנתיים 15.1-115.0 mU/g Hb או 0.92-4.4 μmol/hr/g Hb; בילדים ונערים בגיל 2-18 שנה-11.5-46.3mU/g Hb או 0.62-1.93 μmol/hr/g Hb; במבוגרים מעל גיל 18 שנה-12.1-39.7 mU/g Hb. ערכי GALK בתינוקות גבוהים פי 3-4 מאשר במבוגרים. |
| יוצר הערך | פרופ' בן-עמי סלע |
האנזים galactokinase
האנזים galactokinase (להלן GALK) הוא למעשה פוספוטרנספראז המקטלז את הזרחון של α-D-galactose והפיכתו ל-galactose-1-phosphate כאשר תורם שייר הפוספאט הוא ATP ההופך ל-ADP. האנזים GALK מקטלז את השלב השני של מסלול Leloir, מסלול מטבולי שמוצאים ברוב האורגניזמים בהפיכת β-D-galactose ל-glucose-1-phosphate (על פי Frey ב-FASEB J משנת 1996). האנזים GALK בודד לראשונה מכבד יונקים, ונלמד בהמשך באופן נמרץ בשמר Saccharomyces cerevisiae (על פי Schell וחב' ב-J Biol Chem משנת 1979), בצמחים (Fogliettiet וחב' ב-Biochimie משנת 1976) ובאדם (Dey ב-Eur J Biochem משנת 1983, ו-Holden וחב' ב-Cell Mol Life Sci משנת 2004). בניגוד למטבוליזם של גלוקוזה, התלוי בתחילתו באנזים hexokinase שהספציפיות שלו היא כלפי הקסוזות שונות, במקרה של המטבוליזם של גלקטוזה, מוצאים ספציפיות מצומצמת יותר של GALK.
מבנה האנזים GALK
האנזים GALK מרכב מ-2 מקטעים (domains) המופרדים ביניהם על ידי שסע נרחב. שני מקטעים אלה ידועים כמקטעי C-טרמינאל ו-N-טרמינאל, וטבעת ה-adenine של ATP נקשרת ל"כיס" ההידרופובי הממוקם בין 2 המקטעים האמורים. מקטע ה-N-טרמינאל מכיל 5 גדילים של β-sheet ו-5 פתלים (helices) מסוג α. מקטע C-טרמינאל מאופיין על ידי 2 שכבות של β-sheets אנטי-מקבילים ו-6 פתלי α (על פי Megarity וחב' ב-Cell Mol Life Sci משנת 2011). האנזים GALK אינו משתייך למשפחת קינאזות הסוכרים, אלא דווקא לקבוצה של אנזימים התלויים ב-ATP, הידועה כמשפחת העל GHMP (על פי Tang וחב' ב-Chem Biol Interact משנת 2010). GHMP מייצג ראשי תיבות של 4 קינאזות החברות במשפחה זו: galactokinase, homoserine kinase, mevalonate kinase ו-phosphomevalonate kinase. לארבעת אנזימים אלה דמיון ניכר במבנה התלת-ממדי שלהם, למרות שיש רק 10-20% הומולוגיה ביניהם ברצף חומצות האמינו. לארבעת אנזימים אלה יש שלושה motifs שמורים היטב (II, I ו-III) כאשר השני מתוכם כרוך בקישור לנוקלאוטידים והוא בעל רצף של Pro-X-X-X-Gly-Leu-X-Ser-Ser-Ala (על פי Thoden וחב' ב-J Biol Chem משנת 2003).
ה-promoter של GALK1 מכיל אלמנטים רבים המשותפות גם לגנים אחרים האמורים לשמֵר את התפקוד של גן זה (housekeeping genes), כולל תכולה גבוהה של GC, מספר עותקים של אזור הקישור של גורם השעתוק Sp1, והיעדר ה-motifs המוכרים כ-TATA-box ו-CCAAT-box המתאפיינים בנוכחותם ב-promoters של polymerase II באאוקריוטים. אנליזה על ידי RACE PCR-'5, מצביעה על כך שה-mRNA של GALK הוא הטרוגני בקצה ה-'5, כאשר מוקדי שעתוק רבים נמצאים בין 21bp ל-61bp במעלה נקודת ההתחלה ATG של אזור הקידוד. ניסויי תרגום in vitro, של cDNA של GALK1, הצביעו על כך שהאנזים GALK הוא ציטוזולי ואינו קשור לממברנה של הרטיקולום האנדופלזמי (Kalaydjieva וחב' ב-Am J Hum Genet משנת 1999).
הספציפיות הסוכרית של GALK
אנזים GALK ממקור אדם או חולדה מסוגלים לזרחן גם deoxy-D-galactose-2 (על פי Timson וחב' ב-BMC Biochem משנת 2003, ו-Walker וחב' ב-Biochem J משנת 1968). לעומת זאת GALK מ-S. cerevisiae ספציפי ביותר ל-D-galactose ואינו מסוגל לזרחן גלוקוזה, mannose, arabinose , fucose ,galacticol או deoxy-D-galaactose-2. יתרה מכך, גם התכונות הקינטיות של GALK שונות בין המינים השונים, וניתן לערוך שינויים בספציפיות של GALK לסוכרים שונים בשיטות של enzyme engineering (על פי Yang וחב' ב-Chem Biol משנת 2005, ו-Williams וחב' ב-Curr Opin Chem Biol משנת 2008).
מנגנון הפעולה של GALK
לאחרונה התברר תפקידם של השיירים באתר הפעילות של האנזים. שייר Asp בעמדה 186, מסיר פרוטון מעמדה C1-OH של α-D-galactose, וה-alkoxide nucleophile הנוצר תוקף את שייר γ-phosphorous של ATP. קבוצת פוספאט מועברת לסוכר, ו-Asp-186 יכול לעבור דה-פרוטונציה על ידי מים. שייר Arg-187 הסמוך מייצב את Asp-186, בצורתו האניונית, מה שנמצא חיוני לפעילות GALK, בניסויים בהם הׅשרו מוטציה נקודתית בנקודה זו. נמצא ש-2 השיירים Asp-186 ו-Arg 187 נשמרו היטב באבולוציה בין הגלקטו-קינאזות השונות.
התפקיד הביולוגי של GALK
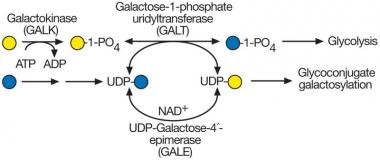
מסלול Leloir מקטלז את ההמרה של של גלקטוזה לגלוקוזה. מוצאים גלקטוזה במוצרי חלב, כמו גם בפירות ובירקות, וסוכר זה יכול להיווצר גם באופן אנדוגני על ידי הפירוק של גליקופרוטאינים וגליקוליפידים. שלושה אנזימים נדרשים לפעולה במסלול Leloir, והם: galactokinase, galactose-1-phosphate uridylyltransferase ו-UDP-galactose 4 epimerase. האנזים GALK כאמור אחראי לשלב הראשון בקטבוליזם של גלקטוזה, דהינו זרחון סוכר זה ל-gal-1-phosphate (על פי Holden וחב' ב-J Biol Chem משנת 2003).
חוסר האנזים GALK
חוסר אנזים זה הוא גורם לצורה השנייה בשכיחותה של גלקטוזמיה הידועה כ-galactosemia type-2, ומתרחש בערך ב-1 מכל 120,000 לידות-חי, כאשר שכיחותו גבוהה בהרבה בצוענים משבט Roma. פרטים עם גלקטוזמיה על רקע חוסר ב-KALK מראים תסמינים מתונים יותר של גלקטוזמיה, מאשר אלה שמוצאים בגלקטוזמיה קלאסית עם חוסר האנזים galactose-1-phosphate uridylyltransferase (להלן GALT). התסמין הקליני העיקרי הוא ירוד (cataract) דו-צדדי המופיע בגיל מאוד רך של השבועות הראשונים לחיים, וניתן למניעה או אף להתפוגגות על ידי דיאטה נטולת גלקטוזה או לקטוזה.
קטרקט בגלקטוזמיה type 2 נגרם באופן הבא: בתאי העדשה בעין האנושית, האנזים aldose reductase הופך galactose ל-galactitol. כיוון ש-galactose אינו מומר לגלוקוזה בגלל המוטציה ב-GALK, יש הצטברות של galactitol, ויצירת גרדיאנט של האחרון דרך ממברנת תאי העדשה מגרה קליטה אוסמוטית של מים, מה שמביא להתנפחות העדשה וגרימת אפופטוזיס של תאי עדשה (Timson וחב' ב-Eur J Biochem משנת 2003, ו-Levy וחב' ב-Am J Ophthalmol משנת 1972). מחקרים אחרונים אלה ובנוסף מחקרם של Colin וחב' ב-Arch Fr Pediatr משנת 1976, מצאו שבתלות בכמות החלב הנצרכת מאוחר יותר בחיים, גם הטרוזיגוטים נשאים של הגן GALK הפגום, הם בדרגת סיכון גבוהה יותר לפתח קטרקט בגיל 20-50 שנה המוגדר כ-presenile cataract.
בתרחיש של חוסר GALK, רמת galactose-1-phosphate באריתרוציטים בדרך כלל נורמאלית, ורמות גלקטוזה בפלזמה בדרך כלל מוגברות. האבחון נעשה על ידי הדגמה של פעילות ירודה של GALK באריתרוציטים. בדיקת פעילות האנזים תתבצע כאשר קיים חשש קליני לגלקטוזמיה, זאת לאחר שנשללה האפשרות של חוסר באנזים GALT.
סוג זה של גלקטוזמיה הוא מפגע מטבולי אוטוזומאלי-רצסיבי (Asada וחב' ב-J Hum Genet משנת 1999), הנגרם מהצטברות גלקטוזה וגלקטיקול באופן שניוני להמרה מופחתת של של גלקטוזה לגלקטוזה-1-פוספאט בגין החוסר ב-GALK (על פי Beutler וחב' ב-N Eng J Med משנת 1973). המפגע מופיע באופן שווה בין 2 המינים. המפגע נגרם כתוצאה ממוטציה בגן המקודד ל-GALK, גן המסומן כ-GALK1 ממוקם על הזרוע הארוכה של כרומוזום 17 בעמדה 17q24. המיקום המדויק של גן זה הוא בין bp 75,757,937 לבין bp 75,765,199, כלומר מדובר בגן שאורכו בערך 7.3kb, והוא מכיל 8 אקסונים של DNA גנומי. למעלה מ-20 מוטציות זוהו עד כה בגן GALK1 המקודד לאנזים GALK, שגורמות להופעת ואריאנטים שונים של האנזים (Kerr וחב' ב-Arch Dis Child משנת 1971).
המקרה הראשון של גלקטוזמיה type 2 על רקע חוסר ב-GALK, התגלה בשנת 1965 בגבר צעיר עם קטרקט, neurofibromatosis והפרשת גלקטוזה מרובה בשתן (galactosuria) שבאה לביטוי במיוחד לאחר שתיית חלב. גם אמו של מקרה 0 זה סבלה מנירו-פיברומטוזיס, ומנת המשכל שלו הייתה תקינה, כאשר נראה שהסבוכים הנוירולוגיים שלו נבעו מהנוירו-פיברומטוזיס ולא מגלקטוזמיה. מקרה זה תואר על ידי Gitzelmann ב-Lancet בשנת 1965 ועל ידי אותו חוקר ב-Pediatr Res בשנת 1967. סוג זה של התבטאות קלינית ומעבדתית נראה שונה ממה שמוצאים בגלקטוזמיה קלאסית במספר היבטים חשובים: לא נמצאו סימנים של פיגור שכלי או של hepatosplenomegaly. כאשר לא נמצאה הצטברות של galactose-1-phosphate למרות הצטברות של גלקטוזה, השתמע מכך שמדובר בחוסר של אנזים המתווך בזרחון של גלקטוזה בעמדה 1.
מקרא לתרשים: סינתזה של UDP-galactose וגלקטוזמיה. צורת גלקטוזמיה השכיחה ביותר נובעת מחוסר של האנזים GALT או galactose-1-phosphate uridylyltransferase. בהיעדר האנזים GALT, מצטבר galactose-1-phosphate כמו גם גלקטוזה ותוצרי החמצון או החיזור של סוכר זה כגון galacticol ו-galactonate. בחוסר של GALT יכולה להשתבש גם הסינתזה של UDP-galactose, שכן האנזים GALE או UDP-galactose-4'-epimerase יכול לייצר UDP-galactose מ-UDP-glucose, ויכול לספק את ה-donor לגלקטוזיל-טרנספרזות הדרושים לביוסינתזה של glycoconjugates.
התבטאות קלינית במצבי חוסר ב-GALK
בניגוד לצורה הקלאסית של גלקטוזמיה הנובעת מחוסר האנזיםgalactose-1-phosphate uridylyltransferase, הבאה באי-טיפול ודיאטה מתאימים לביטוי בהפרעות נפשיות, פגיעה בהתפתחות מוטורית, dyspraxia שהיא הפרעה בהפעלת מיומנויות מוטוריות וקשיים בקואורדינציה, וכן קושי מסוים בקשב ובלמידה, וכן דיספקסיה מילולית של הפרעות בדיבור והגיית מלים, הפאטו-ספלנומגליה, ו-hypergonadotropic hypogonadisme, הרי שגלקטוזמיה type 2 מתאפיינת באופן מובהק ועקבי רק בהופעת קטרקט זמן קצר לאחר הלידה (Holton ב-J Inherit Metab Dis משנת 1990). על פי Bosch וחב' באותו כתב עת משנת 2002, במדגם של 32 מטופלים עם חוסר ב-GALK הופיע קטרקט ב-24 מתוכם (75%).
ההבדלים בתסמינים הקליניים בין 2 סוגי הגלקטוזמיה מהותיים. בגלקטוזמיה הקלאסית עם חוסר טרנספראז מוצאים בשבועות החיים הראשונות בין השאר כוח יניקה דל, הקאות, שלשולים, הפאטומגליה, FTT, צהבת, לתרגיה, ואף ספסיס, שבחוסר טיפול נאות בדיאטה וכו' עלולים להתפתח למחלת כבד בלתי הפיכה ולפיגור שכלי. בחוסר GALK רק קטרקט הוא סימן ההיכר המובהק. כמובן שמבחינה ביוכימית יש בחוסר GALT הצטברות של galactose-1-phosphate, בעוד שבאלה עם חוסר GALK , יש חסם ביצירת מטבוליט זה. ראוי לציין שבעוד שמאובחנים עם חוסר ב-GALK, מוצאים בכבד הצטברות של galactitol בכמויות דומות לאלה שמוצאים בחוסר GALT, הנזק לכבד בא לביטוי רק באחרונים.
כל שאר המפגעים הקליניים שדווח עליהם בהקשר של גלקטוזמיה type 2 מתרחשים בתדירות נמוכה, ואין כלל ביטחון שהם נובעים מהפגם באנזים המדובר או שהם מבטאים epi-phenomenon. כך לדוגמה פיגור שכלי הופיע רק ב-3 מתוך 43 מקרים של GALK המהווים 7%, אך שניים מתוך שלושה מקרים אלה נמצאו ב-2 אחים, שדוווחו על ידי Segal וחב' בשנת 1979 ב-J Pediatr. רק במקרה אחד מתוך 43 מקרים דווח גם על אפילפסיה (2%) בנערה עם נסיגה נוירולוגית לאחר שאובחנה עם אפילפסיה בגיל 17 (על פי Pickering ו-Howel ב-J Pediatr משנת 1972). באותו מדגם של 43 מקרים של חוסר GALK נמצאו 2 מקרים עם רישום בלתי סדיר של EEG על ידי Dahlqvist וחב' ב-Acta Pediatr Scand משנת 1970, ו-Kaloud וחב' ב-Klin Pediatr משנת 1972).
התדרדרות נוירולוגית נרשמה רק במקרה אחד מתוך 43 המקרים, ואילו pseudotumor cerebri התגלה ב-2 מטופלים מתוך 43 על ידי Litman וחב' ב-J Pediatr משנת 1975. לידה טרם-עת (prematurity) ותופעה של תשניק (asphyxia) נרשמו רק במקרה אחד מתוך 43 פרטים עם חוסר ב-GALK (על פי Kerr וחב' ב-Arch Dis Child משנת 1971, וכן על ידי Pickering ו-Howel ב-J Pediatr משנת 1972). שלושה ילדים נולדו קטנים ביחס למשך ההיריון )המהווים 7% מהמדגם), כאשר אחד מהם סבל מ-FTT (על פי Linneweh וחב' ב-Klin Wochenschr משנת 1970), וב-2 ילדים (המהווים 5% מהמדגם) אובחן hepatosplenomegaly, עם אנזימי כבד תקינים. רק בתינוק אחד בן 8 שבועות אובחנה hypoglycemia של 32 מיליגרם/ד"ל (Cook וחב' ב-Arch Dis Child משנת 1971). במקרה אחד נרשם חוסר של C2 complement.
אפידמיולוגיה
בארה"ב באופן מסורתי, רוב תכניות הסקר לאיתור הפגמים המולדים נבנו באופן שיזהה את גלקטוזמיה type 1 עם חוסר GALT, מה שעלול לגרום להחמצה של הצטברות גלקטוזה בדגימות הדם הנסקרות (Bosch וחב' ב-J Inherit Metab Dis משנת 2002). יחד עם זאת, עם ההתקדמות בתחום העלות-יעילות של טכנולוגיית tandem mass spectrometry (MS/MS) לצורך בדיקות סקר של יילודים, הכובשת מקום בשגרת סקר זה בארה"ב וברחבי העולם המערבי, יש שיפור גם בגילוי חוסר ב-GALK, כפי שצפה Gitzelmann כבר בשנת 1967 ב-Pediatr Res). כיוון שטכנולוגיית סקר זו חדשה יחסית, הנתונים אינם מספיקים לתת הערכה מדויקת באשר לשכיחות של חוסר מולד של GALK, אם כי אין ספק שההערכה המקובלת של חוסר האנזים ב-1 לכל 250,000 לידות-חי יכולה להיחשב כהערכת-חסר, וכיום מקובלת יותר הערכת שכיחות של GALK בארה"ב ב-1 לכל 50,000-100,000 לידות-חי.
עד כה מגזר האוכלוסייה היחיד בו נמצא אחוז גבוה במיוחד של הפגם, הם כאמור צוענים משבט Roma, זאת על בסיס מוטציית founder שהוגדרה כ-P28T (על פי Hunter וחב' ב-Pediatr Res משנת 2002). בצוענים משבט Roma מוערך פגם זה כ-1 לכל 5,000 לידות חי (Kalaydjieva וחב' ב-Am J Hum Genet משנת 1999).
ההערכה של שכיחות גלקטוזמיה type 2 לוקה בשוֹנוּת ניכרת בין הדיווחים השונים, ובמרוצת השנים הופיעו הערכות מאוד שונות על שכיחות מפגע זה. כבר בשנת 1968 בחנו Thalhammer וחב' 35,770 דגימות במסגרת תכנית סקר יילודים, ומצאו מקרה אחד בלבד, ודווחו על כך ב-Pediatrics. באותה שנה Mayes ו-Guthrie בחנו פעילות GALK באוכלוסייה לבנה ברובה, וקבעו ששכיחות הטרוזיגוטים לפגם האמור עומדת על מקרה אחד לכל 107 נבדקים, מה שניתן על פי חישוב לגרום להומוזיגוטיות לפגם זה ב-1 מכל 40,000 עד 50,000 איש (פרסום ב-Biochem Genet).
בשנת 1980 פרסם Levy בפרק Screening for galactosemia בספר Inherited Disorders of Carbohydrate Metabolism, על כך שנמצאו רק שישה תינוקות עם חוסר GALK בסקר יילודים שכלל 6 מיליון תינוקות. האופי הגנטי-מנדליאני של פגם זה בא לביטוי הולם במחקר של Bosch וחב' בהולנד, בו נמצאו 9 מקרים של הומוזיגוטיות של פגם ב-GALK1 ב-9 תינוקות מתוך 36 אחאים במספר משפחות עם פגם זה המהווים 26%.
אינדיקציה לביצוע בירור מעבדתי לחוסר GALK
בדיקה תתבצע במקרים של רמת galactose-1-phosphate תקינה כמו גם פעילות תקינה של GALT, אך עם אבחון קטרקט, רמת גלקטוז מוגברת בתאים ובשתן, רמת galactitol מוגברת בשתן וגלקטוזוריה.
בדיקות מעבדה
רוב בתי החולים משתמשים ב-Clinitest לאבחון חוסר ב-GALK, והוא מייצג את הבדיקה המעבדתית הפשוטה ביותר הזמינה לגלות בשתן סוכרים מחזרים (כגון גלוקוזה, לקטוזה או פרוקטוזה) המחזרים מלחי נחושת הנכללים בטבליות Clinitest. באופן חלופי גלקטוזה יכול להיות מזוהה בשתן ישירות על ידי כרומטוגרפיה על נייר או על ידי גאז-כרומטוגרפיה. אם מוצאים גלקטוזה בשתן, יש צורך למדוד את ריכוזו של galactose-1-phosphate, על מנת לשלול באופן מוחלט מצב של גלקטוזמיה type 1 על רקע חוסר באנזים טרנספראז. אבחון ביוכימי מוחלט מבוסס על קביעה ישירה של פעילות GALK באריתרוציטים.
שיטת מדידת פעילות האנזים GALK
השיטה היא רדיו-איזוטופית. כדוריות-דם אדומות עוברות המוליזה בתמיסה היפוטונית, וההמוליזאט מודגר עם גלקטוזה המסומנת בפחמן רדיואקטיבי-C14. תוצר הדגרה זו C14-galactose-1-phosphate-1, עובר כימות לאחר קישור לנייר כרומטוגרפיה DEAE (על פי Beutler וחב' ב-Biochem Med משנת 1971).
הוראות לביצוע הבדיקה
יש לדגום את הדם במבחנת סודיום הפארין (פקק ירוק), ולהעביר למעבדה לא יאוחר מ-48 שעות לאחר דגימת הדם. אין לדגום דם בתקופה של לפחות 4 חודשים לאחר קבלת תרומת דם. יש לקרר את הדם המלא במקרר אך לא בהקפאה. אין לסרכז את דגימת הדם. יש לפסול דגימות מאוד המוליטיות אך לא כאלה בהן יש המוליזה קלה. בדומה יש לפסול דגימת דם מאוד ליפמית, אך לא ליפמית באופן מתון.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק