הבדלים בין גרסאות בדף "סרטן ערמונית גרורתי עמיד לסירוס - טיפול ב- Metastatic prostate cancer resistant to castration - therapy with - Lutetium 177 PSMA"
| (8 גרסאות ביניים של 3 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=Diagram showing the position of the prostate and rectum CRUK 358.svg |
|כיתוב תמונה= | |כיתוב תמונה= | ||
| − | |שם עברי=סרטן ערמונית גרורתי עמיד לסירוס - טיפול ב- Lutetium 177 PSMA | + | |שם עברי=סרטן ערמונית גרורתי עמיד לסירוס - טיפול ב-Lutetium 177 PSMA |
|שם לועזי=Metastatic prostate cancer resistant to castration - therapy with - Lutetium 177 PSMA | |שם לועזי=Metastatic prostate cancer resistant to castration - therapy with - Lutetium 177 PSMA | ||
|שמות נוספים=הטיפול בלוטיציום 177 PSMA כקו חדשני נוסף לחולים עם סרטן ערמונית גרורתי עמיד לסירוס | |שמות נוספים=הטיפול בלוטיציום 177 PSMA כקו חדשני נוסף לחולים עם סרטן ערמונית גרורתי עמיד לסירוס | ||
| שורה 8: | שורה 8: | ||
|ICD-9={{ICD9|185}} | |ICD-9={{ICD9|185}} | ||
|MeSH=D011471 | |MeSH=D011471 | ||
| − | |יוצר הערך=ד"ר שניר דקלו, | + | |יוצר הערך=ד"ר שניר דקלו, פרופ' ניקולא מבג'יש |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
{{הרחבה|ערכים=[[סרטן הערמונית]], [[סל תרופות 2018]]}} | {{הרחבה|ערכים=[[סרטן הערמונית]], [[סל תרופות 2018]]}} | ||
| − | '''סרטן ערמונית''' הוא המחלה | + | {{ראו גם|סרטן ערמונית גרורתי - טיפול מכוון מטרה באמצעות לוטיציום PSMA}} |
| + | '''סרטן ערמונית''' הוא המחלה ה[[ממאירויות|ממאירה]] הנפוצה ביותר בקרב גברים בעולם המערבי. נכון למועד כתיבת המאמר חיים בישראל 27,573 גברים שאובחנו עם סרטן של הערמונית מאז 1990, מהם 11,899 גברים שאובחנו בחמש השנים (2014-2010). בשנת 2014 חלו במחלה 2,237 גברים. עיקר התחלואה היא בבני 65 ומעלה. הגם שמרבית המקרים מאופיינים במחלה ממוקמת בעלת מהלך איטי יחסית וכזו המאפשרת טיפול לצורך ריפוי, יש מקרים רבים שבהם המחלה מתפתחת או מתגלה כבר בשלב גרורתי שאינו מאפשר ריפוי. | ||
| − | למחלה הגרורתית מוצעים מספר קווי טיפול מוכחים המאריכים את חיי החולה ומשפרים את הסימפטומים מהם הוא סובל. קו הטיפול הראשון הוא טיפול הורמונלי מסרס שברוב המקרים מעכב באופן משמעותי את המחלה ותסמיניה אך לאחר שלב מסוים המחלה הופכת עמידה לסירוס (castration resistant). בשלב זה מוצעים קווי טיפול נוספים ומפותחים רבים אחרים על מנת לשפר את ההישרדות ואיכות החיים של החולה. עדיין אין מענה לצורך הקיים לטיפול | + | למחלה הגרורתית מוצעים מספר קווי טיפול מוכחים המאריכים את חיי החולה ומשפרים את הסימפטומים מהם הוא סובל. קו הטיפול הראשון הוא טיפול הורמונלי מסרס שברוב המקרים מעכב באופן משמעותי את המחלה ותסמיניה אך לאחר שלב מסוים המחלה הופכת עמידה לסירוס (castration resistant). בשלב זה מוצעים קווי טיפול נוספים ומפותחים רבים אחרים על מנת לשפר את ההישרדות ואיכות החיים של החולה. עדיין אין מענה לצורך הקיים לטיפול ב[[סרטן ערמונית]] גרורתי עמיד להורמונים. |
==הטיפול בלוטיציום 177 PSMA== | ==הטיפול בלוטיציום 177 PSMA== | ||
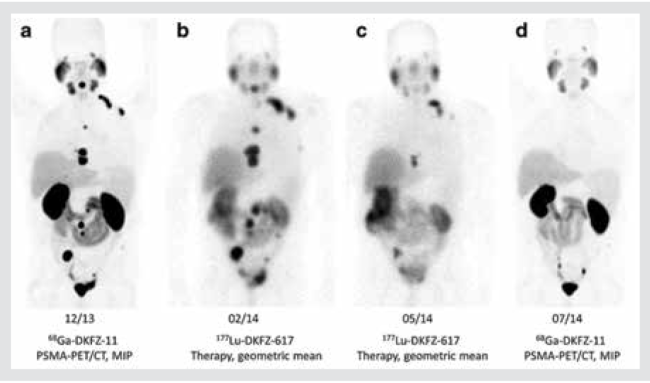
| − | הטיפול בלוטיציום 177 PSMA הוא טיפול המשתמש בתכונות של שני החומרים על מנת לפגוע באופן מדויק בתאי הסרטן הגרורתי והעמיד לסירוס | + | הטיפול בלוטיציום 177 PSMA הוא טיפול המשתמש בתכונות של שני החומרים על מנת לפגוע באופן מדויק בתאי הסרטן הגרורתי והעמיד לסירוס. |
| − | + | PSMA{{כ}} (Prostate Specific Membrane Antigen) הוא חלבון הממוקם באופן טבעי בממברנות של תאי אפיתל הערמונית ומתפקד כאנזים המעורב בקליטה התאית של חומצה פולית. בסרטן הערמונית, יש ביטוי יתר של PSMA (עד פי 1,000) על פני תאי הסרטן וגרורותיו בהשוואה לתאי ערמונית שפירים וברקמות אחרות, דוגמת מעי דק ובלוטות רוק. PSMA מתבטא במרבית תאי סרטן הערמונית ב-90–95 אחוזים מהמקרים. גם לאחר קווי טיפול מרובים, ריכוז PSMA נשאר גבוה בתאי המחלה הגרורתית. | |
| − | + | התכונות הייחודיות של האנזים מאפשרות פיתוח כלים אבחוניים וטיפוליים כאחד. טיפול זה מהווה חלק מגישה טכנולוגית חדשה - "טרגנוסטיקה", שילוב בין תרפיה לדיאגנוסטיקה, שבאמצעותה ניתן הן לסמן את האזור הנגוע על ידי הכוונה של מולקולה ביולוגית ספציפית (במקרה הזה PSMA) עבור הדמיה ו[[טיפול קרינתי]] ממוקד על ידי לוטיציום. | |
| + | לוטיציום 177 הוא הרדיונוקליד הנפוץ ביותר בשימוש אונקולוגי בשל תכונותיו המאפשרות לו פליטת גלי בטא בטווח קצר ובשל כך פגיעה בגידולים קטנים תוך שמירה על הרקמה הסובבת אותם. ליגנד ל-PSMA, המחובר ללוטיציום 177, הוא טיפול מבטיח המכוון ישירות לתאי הגידול והגרורות. הטיפול ניתן דרך הווריד כאשר יש שונות במינונים הניתנים במרכזים השונים בעולם (בין 6Gbq ל-7.4Gbq). מקובל לחלק את הטיפול לשישה קורסים בהפרשים של 6–8 שבועות בין הטיפולים. עקב הפינוי הכלייתי של החומר במהלך 48 שעות הראשונות, לאחר הטיפול יש לתת הידרציה נאותה (לפני ואחרי הטיפול). בנוסף יש לבצע שינויי מינון על פי [[תפקודי כליות|תפקודי הכליות]] של כל מטופל ומטופל. | ||
| − | [[קובץ:Lutetium1.png|ממוזער|מרכז| | + | [[קובץ:Lutetium1.png|ממוזער|מרכז|650px|תמונה 1]] |
==יעילות ובטיחות הטיפול== | ==יעילות ובטיחות הטיפול== | ||
הספרות הקיימת מכילה בעיקר עבודות רטרוספקטיביות בקרב קבוצות קטנות. עם זאת, התוצאות הראשוניות הללו מכילות נתונים מעודדים לגבי יעילות ובטיחות הטיפול. | הספרות הקיימת מכילה בעיקר עבודות רטרוספקטיביות בקרב קבוצות קטנות. עם זאת, התוצאות הראשוניות הללו מכילות נתונים מעודדים לגבי יעילות ובטיחות הטיפול. | ||
| − | במספר מחקרים שבדקו את ירידת ערכי ה-Prostate Specific Antigen) PSAT) | + | במספר מחקרים שבדקו את ירידת ערכי ה-Prostate Specific Antigen) PSAT) בכ-50 אחוזים לפחות (ההגדרה המקובלת לתגובה ביוכימית לטיפול), עולה כי טווח התגובה נע בין 31 אחוזים{{כ}}{{הערה|שם=הערה1|Rahbar K, Schmidt M, Heinzel A, et al (2016) Response and Tolerability of a Single Dose of 177Lu-PSMA-617 in Patients with Metastatic Castration-Resistant Prostate Cancer: A Multicenter Retrospective Analysis. J Nucl Med 57:1334-1338. doi: 10.2967/jnumed.116.173757}} ל-61 אחוזים{{כ}}{{הערה|שם=הערה2|Zechmann CM, Afshar-Oromieh A, Armor T, et al (2014) Radiation dosimetry and first therapy results with a (124) I/ (131)I-labeled small molecule (MIP-1095) targeting PSMA for prostate cancer therapy. Eur J Nucl Med Mol Imaging 41:1280-92. doi: 10.1007/s00259-014-2713-y}}. מספרים אלה דומים לתגובה לטיפולים הכימותרפיים המקובלים לאחר שהממאירות הופכת עמידה לסירוס (דוגמת [[Docetaxel]]). עבודה נוספת שסקרה טיפול בכ-56 גברים הדגימה ירידת PSA מסוימת בקרב 80 אחוזים מהמשתתפים{{הערה|שם=הערה3|Baum RP, Kulkarni HR, Schuchardt C, et al (2016) 177Lu-Labeled Prostate-Specific Membrane Antigen Radioligand Therapy of Metastatic Castration-Resistant Prostate Cancer: Safety and Efficacy. J Nucl Med 57:1006-13. doi: 10.2967/jnumed.115.168443}}. עבודה אחרת{{הערה|שם=הערה4|Ahmadzadehfar H, Essler M, Schafers M, Rahbar K (2016) Radioligand therapy with (177)Lu-PSMA-617 of metastatic prostate cancer has already been arrived in clinical use. Nucl Med Biol 43:835. doi: 10.1016/j. nucmedbio.2016.08.003}} בדקה תגובה לטיפול בהתבסס על תוצאות הדמיית PET-PSMA גם עבודה זו הדגימה תגובה חלקית לפחות ב-80 אחוזים מהמקרים. עם זאת, כלל העבודות הדגימו גם התקדמות משמעותית של המחלה וחוסר תגובה לטיפול, אחוזי הכישלון נעו בין 11 אחוזים{{כ}}{{הערה|שם=הערה3}} ל-32 אחוזים{{כ}}{{הערה|שם=הערה5|Heck MM, Retz M, D’Alessandria C, et al (2016) Systemic Radioligand Therapy with 177Lu Labeled Prostate Specific Membrane Antigen Ligand for Imaging and Therapy in Patients with Metastatic Castration Resistant Prostate Cancer. J Urol 196:382-391. doi: 10.1016/j.juro.2016.02.2969}}. |
| − | }} | ||
| − | עבודות שבחנו הפגת כאב והפחתת סימפטומים העלו כי בין 30 | + | עבודות שבחנו הפגת כאב והפחתת סימפטומים העלו כי בין 30 אחוזים ל-70 אחוזים מהמטופלים ייהנו מהפחתת הכאב{{הערה|שם=הערה3}}{{הערה|שם=הערה5}}{{הערה|שם=הערה6|Yadav MP, Ballal S, Tripathi M, et al (2017) Post-therapeutic dosimetry of 177Lu-DKFZ-PSMA-617 in the treatment of patients with metastatic castration-resistant prostate cancer. Nucl Med Commun 38:91-98. doi: 10.1097/MNM.0000000000000606}},, |
| − | קשה לחזות מי הם המטופלים שיגיבו בצורה הטובה ביותר לטיפול, אך אין ספק שדרישת סף עבור קבלת הטיפול צריכה להיות קליטה של PSMA ברקמה הגידולית על סמך הדמיה פונקציונלית שנעשית בדרך כלל בבדיקת 68Ga-PSMA | + | קשה לחזות מי הם המטופלים שיגיבו בצורה הטובה ביותר לטיפול, אך אין ספק שדרישת סף עבור קבלת הטיפול צריכה להיות קליטה של PSMA ברקמה הגידולית על סמך הדמיה פונקציונלית שנעשית בדרך כלל בבדיקת 68Ga-PSMA PET-CT. מספר עבודות גם העלו את הסברה כי הטיפול יעיל יותר בגרורות ויסרליות לעומת גרורות גרמיות{{הערה|שם=הערה3}}. |
לא ניתן להתייחס להארכת הישרדות אודות לטיפול בלוטיציום 177 PSMA עקב המחסור בעבודות פרוספקטיביות רנדומליות. | לא ניתן להתייחס להארכת הישרדות אודות לטיפול בלוטיציום 177 PSMA עקב המחסור בעבודות פרוספקטיביות רנדומליות. | ||
| − | מבחינת תופעות לוואי ורעילות העבודות הרטרוספקטיביות מציגות נתונים מעודדים. התגובה המשמעותית ביותר הייתה ירידת המוגלובין כלשהי בקרב עד 25 | + | מבחינת תופעות לוואי ורעילות העבודות הרטרוספקטיביות מציגות נתונים מעודדים. התגובה המשמעותית ביותר הייתה ירידת [[המוגלובין]] כלשהי בקרב עד 25 אחוזים מהמטופלים שהיא הפיכה עם הפסקת הטיפול{{הערה|שם=הערה4}}. נראה כי חולים עם גרורות גרמיות רבות היו עיקר הסובלים מבעיה זו ותופעה זו מוסברת, ככל הנראה, על ידי קרינה משנית למח העצם במקרים אלה. ירידה בשורות אחרות (טסיות, [[לויקוציטים|כדוריות דם לבנות]]) הייתה מתונה ובאחוזים נמוכים בהרבה. תופעות לוואי נוספות שצוינו וכוללות [[עייפות]], [[בחילה]] ופה יבש הופיעו בעיקר ב-48 השעות שלאחר ההזרקה. |
| − | '''לסיכום''', התוצאות הראשוניות מראות סימנים חיוביים לגבי התגובה לטיפול וסבילותו. אין ספק כי דרושות עבודות פרוספקטיביות ורנדומליות על מנת לבסס נתונים אלה ולבדוק את יעילות הטיפול אל מול קווים אחרים המוצעים בשלב כה מתקדם של סרטן הערמונית. נציין כי | + | '''לסיכום''', התוצאות הראשוניות מראות סימנים חיוביים לגבי התגובה לטיפול וסבילותו. אין ספק כי דרושות עבודות פרוספקטיביות ורנדומליות על מנת לבסס נתונים אלה ולבדוק את יעילות הטיפול אל מול קווים אחרים המוצעים בשלב כה מתקדם של סרטן הערמונית. נציין כי ה-FDA (Food and Drug Administration) אישר השנה מעבר מחקר לפאזה שנייה בתחום זה. אנו משערים כי אישור זה יניע גיוס של מטופלים רבים יותר למחקרים מתאימים. |
| − | מדינת ישראל היא בין המדינות הראשונות שאימצה את הטיפול כקו אחרון עד שיאושר בעולם באופן מלא. הטיפול ניתן בשלושה מרכזים רפואיים: איכילוב, שיבא ורמב"ם. | + | מדינת ישראל היא בין המדינות הראשונות שאימצה את הטיפול כקו אחרון עד שיאושר בעולם באופן מלא. הטיפול ניתן בשלושה מרכזים רפואיים: איכילוב, שיבא ורמב"ם. |
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
{{הערות שוליים|יישור=שמאל}} | {{הערות שוליים|יישור=שמאל}} | ||
| + | {{ייחוס|ד"ר שניר דקלו, פרופ' ניקולא מבג'יש, מחלקה אורולוגית, המרכז הרפואי תל אביב ע"ש סוראסקי, תל אביב}} | ||
| − | + | <center>'''פורסם במגזין מדיק לסל שירותי הבריאות 2018, נובמבר 2017'''</center> | |
| − | + | [[קטגוריה:אונקולוגיה]] | |
| − | + | [[קטגוריה:אורולוגיה]] | |
| + | [[קטגוריה:פרמקולוגיה קלינית]] | ||
גרסה אחרונה מ־06:01, 9 באוקטובר 2024
| סרטן ערמונית גרורתי עמיד לסירוס - טיפול ב-Lutetium 177 PSMA | ||
|---|---|---|
| Metastatic prostate cancer resistant to castration - therapy with - Lutetium 177 PSMA | ||

| ||
| שמות נוספים | הטיפול בלוטיציום 177 PSMA כקו חדשני נוסף לחולים עם סרטן ערמונית גרורתי עמיד לסירוס | |
| ICD-10 | Chapter C 61. | |
| ICD-9 | 185 | |
| MeSH | D011471 | |
| יוצר הערך | ד"ר שניר דקלו, פרופ' ניקולא מבג'יש | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – סרטן הערמונית, סל תרופות 2018
ראו גם – סרטן ערמונית גרורתי - טיפול מכוון מטרה באמצעות לוטיציום PSMA
סרטן ערמונית הוא המחלה הממאירה הנפוצה ביותר בקרב גברים בעולם המערבי. נכון למועד כתיבת המאמר חיים בישראל 27,573 גברים שאובחנו עם סרטן של הערמונית מאז 1990, מהם 11,899 גברים שאובחנו בחמש השנים (2014-2010). בשנת 2014 חלו במחלה 2,237 גברים. עיקר התחלואה היא בבני 65 ומעלה. הגם שמרבית המקרים מאופיינים במחלה ממוקמת בעלת מהלך איטי יחסית וכזו המאפשרת טיפול לצורך ריפוי, יש מקרים רבים שבהם המחלה מתפתחת או מתגלה כבר בשלב גרורתי שאינו מאפשר ריפוי.
למחלה הגרורתית מוצעים מספר קווי טיפול מוכחים המאריכים את חיי החולה ומשפרים את הסימפטומים מהם הוא סובל. קו הטיפול הראשון הוא טיפול הורמונלי מסרס שברוב המקרים מעכב באופן משמעותי את המחלה ותסמיניה אך לאחר שלב מסוים המחלה הופכת עמידה לסירוס (castration resistant). בשלב זה מוצעים קווי טיפול נוספים ומפותחים רבים אחרים על מנת לשפר את ההישרדות ואיכות החיים של החולה. עדיין אין מענה לצורך הקיים לטיפול בסרטן ערמונית גרורתי עמיד להורמונים.
הטיפול בלוטיציום 177 PSMA
הטיפול בלוטיציום 177 PSMA הוא טיפול המשתמש בתכונות של שני החומרים על מנת לפגוע באופן מדויק בתאי הסרטן הגרורתי והעמיד לסירוס.
PSMA (Prostate Specific Membrane Antigen) הוא חלבון הממוקם באופן טבעי בממברנות של תאי אפיתל הערמונית ומתפקד כאנזים המעורב בקליטה התאית של חומצה פולית. בסרטן הערמונית, יש ביטוי יתר של PSMA (עד פי 1,000) על פני תאי הסרטן וגרורותיו בהשוואה לתאי ערמונית שפירים וברקמות אחרות, דוגמת מעי דק ובלוטות רוק. PSMA מתבטא במרבית תאי סרטן הערמונית ב-90–95 אחוזים מהמקרים. גם לאחר קווי טיפול מרובים, ריכוז PSMA נשאר גבוה בתאי המחלה הגרורתית.
התכונות הייחודיות של האנזים מאפשרות פיתוח כלים אבחוניים וטיפוליים כאחד. טיפול זה מהווה חלק מגישה טכנולוגית חדשה - "טרגנוסטיקה", שילוב בין תרפיה לדיאגנוסטיקה, שבאמצעותה ניתן הן לסמן את האזור הנגוע על ידי הכוונה של מולקולה ביולוגית ספציפית (במקרה הזה PSMA) עבור הדמיה וטיפול קרינתי ממוקד על ידי לוטיציום.
לוטיציום 177 הוא הרדיונוקליד הנפוץ ביותר בשימוש אונקולוגי בשל תכונותיו המאפשרות לו פליטת גלי בטא בטווח קצר ובשל כך פגיעה בגידולים קטנים תוך שמירה על הרקמה הסובבת אותם. ליגנד ל-PSMA, המחובר ללוטיציום 177, הוא טיפול מבטיח המכוון ישירות לתאי הגידול והגרורות. הטיפול ניתן דרך הווריד כאשר יש שונות במינונים הניתנים במרכזים השונים בעולם (בין 6Gbq ל-7.4Gbq). מקובל לחלק את הטיפול לשישה קורסים בהפרשים של 6–8 שבועות בין הטיפולים. עקב הפינוי הכלייתי של החומר במהלך 48 שעות הראשונות, לאחר הטיפול יש לתת הידרציה נאותה (לפני ואחרי הטיפול). בנוסף יש לבצע שינויי מינון על פי תפקודי הכליות של כל מטופל ומטופל.
יעילות ובטיחות הטיפול
הספרות הקיימת מכילה בעיקר עבודות רטרוספקטיביות בקרב קבוצות קטנות. עם זאת, התוצאות הראשוניות הללו מכילות נתונים מעודדים לגבי יעילות ובטיחות הטיפול.
במספר מחקרים שבדקו את ירידת ערכי ה-Prostate Specific Antigen) PSAT) בכ-50 אחוזים לפחות (ההגדרה המקובלת לתגובה ביוכימית לטיפול), עולה כי טווח התגובה נע בין 31 אחוזים[1] ל-61 אחוזים[2]. מספרים אלה דומים לתגובה לטיפולים הכימותרפיים המקובלים לאחר שהממאירות הופכת עמידה לסירוס (דוגמת Docetaxel). עבודה נוספת שסקרה טיפול בכ-56 גברים הדגימה ירידת PSA מסוימת בקרב 80 אחוזים מהמשתתפים[3]. עבודה אחרת[4] בדקה תגובה לטיפול בהתבסס על תוצאות הדמיית PET-PSMA גם עבודה זו הדגימה תגובה חלקית לפחות ב-80 אחוזים מהמקרים. עם זאת, כלל העבודות הדגימו גם התקדמות משמעותית של המחלה וחוסר תגובה לטיפול, אחוזי הכישלון נעו בין 11 אחוזים[3] ל-32 אחוזים[5].
עבודות שבחנו הפגת כאב והפחתת סימפטומים העלו כי בין 30 אחוזים ל-70 אחוזים מהמטופלים ייהנו מהפחתת הכאב[3][5][6],,
קשה לחזות מי הם המטופלים שיגיבו בצורה הטובה ביותר לטיפול, אך אין ספק שדרישת סף עבור קבלת הטיפול צריכה להיות קליטה של PSMA ברקמה הגידולית על סמך הדמיה פונקציונלית שנעשית בדרך כלל בבדיקת 68Ga-PSMA PET-CT. מספר עבודות גם העלו את הסברה כי הטיפול יעיל יותר בגרורות ויסרליות לעומת גרורות גרמיות[3].
לא ניתן להתייחס להארכת הישרדות אודות לטיפול בלוטיציום 177 PSMA עקב המחסור בעבודות פרוספקטיביות רנדומליות.
מבחינת תופעות לוואי ורעילות העבודות הרטרוספקטיביות מציגות נתונים מעודדים. התגובה המשמעותית ביותר הייתה ירידת המוגלובין כלשהי בקרב עד 25 אחוזים מהמטופלים שהיא הפיכה עם הפסקת הטיפול[4]. נראה כי חולים עם גרורות גרמיות רבות היו עיקר הסובלים מבעיה זו ותופעה זו מוסברת, ככל הנראה, על ידי קרינה משנית למח העצם במקרים אלה. ירידה בשורות אחרות (טסיות, כדוריות דם לבנות) הייתה מתונה ובאחוזים נמוכים בהרבה. תופעות לוואי נוספות שצוינו וכוללות עייפות, בחילה ופה יבש הופיעו בעיקר ב-48 השעות שלאחר ההזרקה.
לסיכום, התוצאות הראשוניות מראות סימנים חיוביים לגבי התגובה לטיפול וסבילותו. אין ספק כי דרושות עבודות פרוספקטיביות ורנדומליות על מנת לבסס נתונים אלה ולבדוק את יעילות הטיפול אל מול קווים אחרים המוצעים בשלב כה מתקדם של סרטן הערמונית. נציין כי ה-FDA (Food and Drug Administration) אישר השנה מעבר מחקר לפאזה שנייה בתחום זה. אנו משערים כי אישור זה יניע גיוס של מטופלים רבים יותר למחקרים מתאימים.
מדינת ישראל היא בין המדינות הראשונות שאימצה את הטיפול כקו אחרון עד שיאושר בעולם באופן מלא. הטיפול ניתן בשלושה מרכזים רפואיים: איכילוב, שיבא ורמב"ם.
ביבליוגרפיה
- ↑ Rahbar K, Schmidt M, Heinzel A, et al (2016) Response and Tolerability of a Single Dose of 177Lu-PSMA-617 in Patients with Metastatic Castration-Resistant Prostate Cancer: A Multicenter Retrospective Analysis. J Nucl Med 57:1334-1338. doi: 10.2967/jnumed.116.173757
- ↑ Zechmann CM, Afshar-Oromieh A, Armor T, et al (2014) Radiation dosimetry and first therapy results with a (124) I/ (131)I-labeled small molecule (MIP-1095) targeting PSMA for prostate cancer therapy. Eur J Nucl Med Mol Imaging 41:1280-92. doi: 10.1007/s00259-014-2713-y
- ↑ 3.0 3.1 3.2 3.3 Baum RP, Kulkarni HR, Schuchardt C, et al (2016) 177Lu-Labeled Prostate-Specific Membrane Antigen Radioligand Therapy of Metastatic Castration-Resistant Prostate Cancer: Safety and Efficacy. J Nucl Med 57:1006-13. doi: 10.2967/jnumed.115.168443
- ↑ 4.0 4.1 Ahmadzadehfar H, Essler M, Schafers M, Rahbar K (2016) Radioligand therapy with (177)Lu-PSMA-617 of metastatic prostate cancer has already been arrived in clinical use. Nucl Med Biol 43:835. doi: 10.1016/j. nucmedbio.2016.08.003
- ↑ 5.0 5.1 Heck MM, Retz M, D’Alessandria C, et al (2016) Systemic Radioligand Therapy with 177Lu Labeled Prostate Specific Membrane Antigen Ligand for Imaging and Therapy in Patients with Metastatic Castration Resistant Prostate Cancer. J Urol 196:382-391. doi: 10.1016/j.juro.2016.02.2969
- ↑ Yadav MP, Ballal S, Tripathi M, et al (2017) Post-therapeutic dosimetry of 177Lu-DKFZ-PSMA-617 in the treatment of patients with metastatic castration-resistant prostate cancer. Nucl Med Commun 38:91-98. doi: 10.1097/MNM.0000000000000606
המידע שבדף זה נכתב על ידי ד"ר שניר דקלו, פרופ' ניקולא מבג'יש, מחלקה אורולוגית, המרכז הרפואי תל אביב ע"ש סוראסקי, תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק