הבדלים בין גרסאות בדף "אבחון גנטי של פוליפוזיס אדנומטוטי משפחתי"
(←מבוא) |
|||
| (13 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 6: | שורה 6: | ||
|שם לועזי= | |שם לועזי= | ||
|שמות נוספים= | |שמות נוספים= | ||
| − | |ICD-10={{ICD10|C|18||c|15}}, {{ICD10|D|12||d|10}} | + | |ICD-10={{ICD10|C|18||c|15}}, {{ICD10|D|12||d|10}} |
| − | |ICD-9={{ICD9|211.3}} | + | |ICD-9={{ICD9|211.3}} |
| − | |MeSH=D011125 | + | |MeSH=D011125 |
|יוצר הערך=ניצן שרון שוורצמן, אלינה קורולפ, פרופ' משנה קליני חגית בריס-פלדמן | |יוצר הערך=ניצן שרון שוורצמן, אלינה קורולפ, פרופ' משנה קליני חגית בריס-פלדמן | ||
|אחראי הערך= | |אחראי הערך= | ||
| − | }} | + | }} |
{{הרחבה|פוליפוזיס אדנומטוטי משפחתי}} | {{הרחבה|פוליפוזיס אדנומטוטי משפחתי}} | ||
==מבוא== | ==מבוא== | ||
פוליפוזיס אדנומטוטי משפחתי (Familial adenomatous polyposis - FAP) הוא תסמונת המאופיינת בריבוי פוליפים במעי הגס ובסיכון יתר לממאירות באיבר זה. קיים סיכון יתר לתסמינים נוספים, כפי שמפורט במאמרים [[פוליפוזיס אדנומטוטי משפחתי בילדים]] ו[[פוליפוזיס אדנומטוטי משפחתי – רפואת בוגרים]] . | פוליפוזיס אדנומטוטי משפחתי (Familial adenomatous polyposis - FAP) הוא תסמונת המאופיינת בריבוי פוליפים במעי הגס ובסיכון יתר לממאירות באיבר זה. קיים סיכון יתר לתסמינים נוספים, כפי שמפורט במאמרים [[פוליפוזיס אדנומטוטי משפחתי בילדים]] ו[[פוליפוזיס אדנומטוטי משפחתי – רפואת בוגרים]] . | ||
| − | ההורשה של FAP היא אוטוזומלית דומיננטית, כלומר אין מדובר במחלה הקשורה למין המטופל, ומוטציה בודדת על עותק אחד של הגן, האבהי או האימהי, מספיקה על מנת לגרום למחלה. האבחון הגנטי של FAP מתבסס על זיהוי שינוי גנטי גורם מחלה (=מוטציה) בגן Adenomatous polyposis coli) APC). ב-75% מהמקרים מדובר במוטציה המורשת מאחד ההורים, וב-25% מדובר במוטציה חדשה {{הערה|שם=הערה1|Jasperson, KW, Patel SG, Ahnen DJ. APC-Associated Polyposis Conditions. In: Pagon RA, Adam MP, Ardinger HH, et al. (eds.) GeneReviews® [Internet]. Seattle (WA): University of Washington, 1993. [updated 2017 Feb 2]. Available from: https://www.ncbi.nlm.nih.gov/books/ NBK1345. [Accessed 19 June, 2017].}}. לאבחון הגנטי של פוליפוזיס אדנומטוטי משפחתי יש חשיבות רבה, שכן אבחון כזה בחולה משמעותו בראש ובראשונה אפשרות להתאים פרוטוקול מעקב ומניעה לחולה עצמו, יחד עם אפשרות לזהות בני משפחה נוספים הנשאים לתסמונת, כולל ילדים, לפני הופעת תסמינים קליניים. אבחון מוקדם מאפשר, מחד, התאמת פרוטוקול מעקב מתאים לבני המשפחה שנמצאו נשאים, ומאידך, לפטור ממעקב, שכרוך בבדיקות חודרניות ויקרות, את אלו שלא ירשו את המוטציה המשפחתית | + | ההורשה של FAP היא אוטוזומלית דומיננטית, כלומר אין מדובר במחלה הקשורה למין המטופל, ומוטציה בודדת על עותק אחד של הגן, האבהי או האימהי, מספיקה על מנת לגרום למחלה. האבחון הגנטי של FAP מתבסס על זיהוי שינוי גנטי גורם מחלה (=מוטציה) בגן Adenomatous polyposis coli) APC). ב-75% מהמקרים מדובר במוטציה המורשת מאחד ההורים, וב-25% מדובר במוטציה חדשה{{הערה|שם=הערה1|Jasperson, KW, Patel SG, Ahnen DJ. APC-Associated Polyposis Conditions. In: Pagon RA, Adam MP, Ardinger HH, et al. (eds.) GeneReviews® [Internet]. Seattle (WA): University of Washington, 1993. [updated 2017 Feb 2]. Available from: https://www.ncbi.nlm.nih.gov/books/ NBK1345. [Accessed 19 June, 2017].}}. לאבחון הגנטי של פוליפוזיס אדנומטוטי משפחתי יש חשיבות רבה, שכן אבחון כזה בחולה משמעותו בראש ובראשונה אפשרות להתאים פרוטוקול מעקב ומניעה לחולה עצמו, יחד עם אפשרות לזהות בני משפחה נוספים הנשאים לתסמונת, כולל ילדים, לפני הופעת תסמינים קליניים. אבחון מוקדם מאפשר, מחד, התאמת פרוטוקול מעקב מתאים לבני המשפחה שנמצאו נשאים, ומאידך, לפטור ממעקב, שכרוך בבדיקות חודרניות ויקרות, את אלו שלא ירשו את המוטציה המשפחתית. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | קורלציית גנוטיפ-פנוטיפ | + | ==הגן APC== |
| + | APC משתייך לקבוצת גנים הקרויים "גנים מדכאי סרטן" (tumor suppressor genes), והוא ממוקם על הזרוע הארוכה של כרומוזום 5 (5q21-q22). הגן מורכב מ-15 אקסונים, כאשר אקסון 15 מהווה כ-75% מהאזור המקודד לחלבון של הגן ובו מרוכזות רוב המוטציות הידועות, הן המורשות והן הנרכשות. הגן APC מקודד לחלבון שמורכב מ-2,843 חומצות אמינו, שקשור למסלול העברת הסיגנל של ה- Wnt/β-catenin. החלבון מתפקד כמדכא סרטן באמצעות היזון שלילי של פעילות האונקוגן catenin-{{כ}}β ושמירה על יציבות המיקרוטובולי, התורם ליציבות הכרומוזומלית{{הערה|שם=הערה2|Leoz ML, Carballal S, Moreira L, et al. The genetic basis of familial adenomatous polyposis and its implications for clinical practice and risk management. Appl Clin Genet. 2015 Apr 16;8:95-107.}}. | ||
| + | |||
| + | ==אפיון המוטציות בגן APC== | ||
| + | מאז זיהוי הגן APC ב-1991 זוהו יותר מ-1,100 מוטציות שונות בגן זה. רוב המוטציות הללו גורמות לקטיעת החלבון (מוטציות פסק, חסרים/הכפלות קטנים). במיעוט המקרים (כ-3%) מדובר במוטציות תשנית (missense), שמחליפות חומצה אמינית אחת באחרת, ובכ- 13% מהמקרים מדובר על חסרים/הכפלות גדולים שכוללים אקסון אחד או מספר אקסונים של הגן, ובמקרים נדירים יותר גם כל הגן. | ||
| + | |||
| + | קיימות שתי מוטציות שמהוות "מוקדים חמים" (hotspots). מוטציות אלה ממוקמות באקסון 15 של הגן, בקודונים 1309 ו-1061, והן אחראיות ל-17% ול- 11% מהמוטציות הגרמינליות - המורשות במשפחה בגן APC, בהתאמה{{הערה|שם=הערה2}}. | ||
| + | |||
| + | כ-25% מהמקרים של FAP הם כתוצאה ממוטציה חדשה. אחוז נכבד מאותם מקרים חדשים נובעים ממוטציה שנמצאת במצב של פסיפס (מוזאיקה), דהיינו המוטציה אינה נמצאת בכל התאים בגוף ואינה נובעת משינוי בתאי הנבט אלא ממוטציה סומאטית, שפוגעת רק בחלק מהתאים בגוף{{הערה|שם=הערה1}}. לפי מחקרים עדכניים, מוטציות בגן APC זוהו בכ-80% מהמקרים בהם המופע הקליני היה מאופיין בקיום מעל 1,000 פוליפים אדנומטוטיים, בכ-56% מהחולים עם 100–999 פוליפים אדנומטוטיים, בכ-10% מהחולים עם 20–99 פוליפים אדנומטוטיים ובכ-5% מהחולים עם 10–19 פוליפים אדנומטוטיים{{הערה|שם=הערה3|Grover S, Kastrinos F, Steyeberg E, et al. Prevalence and phenotypes pf APC and MUTYH mutations in patients with multiple colorectal adenomas. JAMA. 2012 Aug 1;308(5):485-92.}}. | ||
| + | |||
| + | ==קורלציית גנוטיפ-פנוטיפ== | ||
ישנו שוני בביטוי הקליני-הפנוטיפי בין חולי FAP, הן בהתייחס לכמות הפוליפים, גיל ההופעה ולביטויים מחוץ למעי הגס. הניסיון לבסס קורלציה של גנוטיפ-פנוטיפ הוא בעל חשיבות במתן המלצות מותאמות למעקב, מניעת סרטן והפחתת סיכונים המבוססים על סוג המוטציה שיש למטופל. | ישנו שוני בביטוי הקליני-הפנוטיפי בין חולי FAP, הן בהתייחס לכמות הפוליפים, גיל ההופעה ולביטויים מחוץ למעי הגס. הניסיון לבסס קורלציה של גנוטיפ-פנוטיפ הוא בעל חשיבות במתן המלצות מותאמות למעקב, מניעת סרטן והפחתת סיכונים המבוססים על סוג המוטציה שיש למטופל. | ||
| − | ישנם שני היבטים מרכזיים בקורלציית גנוטיפ-פנוטיפ (תרשים מס' | + | ישנם שני היבטים מרכזיים בקורלציית גנוטיפ-פנוטיפ (תרשים מס' 1): |
| + | |||
| + | [[קובץ:פוליפוזיס1.jpg|600 פיקסלים|ממוזער|מרכז|תרשים מס' 1: קורלציית גנוטיפ-פנוטיפ]] | ||
| + | |||
| + | *'''מידת הפוליפוזיס וגיל הופעת התסמינים:''' מספר רב מאוד של פוליפים (אלפים) וגיל הופעה מוקדם יחסית (בתחילת העשור השני לחיים) קשורים במוטציות בקודונים 1250–1464, ובעיקר hotspots בקודון 1309. הביטוי הקליני "המוחלש" יותר של FAP, המכונה attenuated FAP, אשר כולל מספר מצומצם יותר של פוליפים (עשרות) וגיל הופעה מאוחר יותר (סביב 40), קשור בעיקר במוטציות המצויות בשני קצוות הגן או באקסון 9 (בין הקודונים 213–412). שאר אזורי הגן קשורים במופע ביניים, שנע בין המופע החריף יותר למופע המתון יותר | ||
| + | *'''ביטויים מחוץ למעי הגס''': | ||
| + | :*'''CHRPE''' {{כ}}(congenital hypertrophy of the retina pigment epithelium) נמצא קשור יותר למוטציות בין הקודונים 311 ל-1465 | ||
| + | :*'''גידולים דסמואידיים''' - קשורים יותר למוטציות במורד הזרם לקודון 1400 | ||
| + | :*'''הפטובלסטומה''' - כ-95% מהמקרים בהם מופיע גידול זה בחולי FAP נמצאו קשורים למוטציות בקודונים 141–1751 | ||
| + | :*'''גידולים בבלוטת המגן''' - נמצאו קשורים למוטציות בקודונים 140–1309 | ||
| + | :*'''פוליפים מרובים בקיבה''' GAPPS {{כ}}(gastric adenocarcinoma and proximal polyposis of the stomach) - מצב כזה, שכולל פוליפים מרובים מסוג fundic glands polyps, ועלייה בסיכון לסרטן קיבה עם מעורבות מינימלית של המעי הגס, זוהה במספר משפחות כקשור במוטציות באזור המקדם (=פרומוטר) הקרוי 1B של הגן APC{{כ}}{{הערה|שם=הערה1}} {{הערה|שם=הערה4|Nieuwenhuis MH, Vasen HFA. Correlations between mutation site in APC and phenotype of familial adenomatous polyposis (FAP): a review of the literature. Crit Rev Oncol Hematol. 2007 Feb;61(2):153-61.}} {{הערה|שם=הערה5|Ballhausen W. Genetic testing for familial adenomatous polyposis. Ann N Y Acad Sci. 2000;910:36-49.}} | ||
| − | + | ==המוטציה I1307K== | |
| − | + | המוטציה הידועה בשם I1307K בגן APC היא בעלת שכיחות של 10-6% ביהודים ממוצא אשכנזי, ושכיחות נמוכה יותר של כ-3% ביהודים ממוצא ספרדי ובאוכלוסיות ממוצא אחר. מוטציה זו, הגורמת להחלפת החומצה האמינית איזולאוצין בליזין בקודון 1307 של הגן, אינה קשורה במופע של פוליפוזיס. עם זאת, באוכלוסייה האשכנזית מוטציה זו נמצאה כמעלה פי 2 את הסיכון לפתח סרטן מעי גס לאורך החיים, בהשוואה לאוכלוסייה הכללית, דהיינו לנשאי המוטציה סיכון של 20-10% לפתח סרטן מעי גס במהלך החיים. בפרטים נשאי שינוי זה נהוג להתחיל מעקב מעי גס באמצעות קולונוסקופיה החל מגיל 40 בתדירות של כל 3–5 שנים, לעומת ההמלצות באוכלוסייה הכללית למעקב מעי גס באמצעות דם סמוי בצואה החל מגיל 50 {{כ}}{{הערה|שם=הערה6|Rozen P׳ Shomrat R, Strul H, et al. Prevalence of the I1307K APC gene variant in Israeli Jews of differing ethnic origin and risk for colorectal cancer. Gastroenterology. 1999 Jan;116(1):54-7.}}. | |
| − | + | ==קריטריונים להפניה לייעוץ גנטי ולבירור גנטי של FAP== | |
| + | לפי ההנחיות של ה-NCCN {{כ}}(National Cancer Comprehensive Network), איגוד אמריקני הכולל יותר מ-1,000 קלינאים | ||
| + | וחוקרים מ-27 מרכזים רפואיים מובילים בארצות הברית, יש להפנות לייעוץ גנטי, ובהתאם לאנמנזה מקיפה אישית ומשפחתית, שתילקח במהלך הייעוץ, ולרצון המטופל גם לשקול בירור גנטי בעזרת בדיקות דנ"א מולקולריות, בשאלה של FAP את כל מי שעונה על אחד מהקריטריונים הבאים: | ||
| + | *לפחות 10–20 פוליפים אדנומטוטיים (במצטבר) במעי הגס | ||
| + | *סיפור משפחתי של ריבוי פוליפים אדנומטוטיים (יותר מ-10 אם מדובר בפרט יחיד, או מספר נמוך יותר אם מדובר במספר בני משפחה, בייחוד אם אחד מהם אובחן בגיל צעיר) או סיפור משפחתי של ביטויים מחוץ למעי הגס כמפורט להלן. מידת התורשתיות במקרים אלו תיבחן בייעוץ גנטי שיקבע את נחיצות הבירור הגנטי | ||
| + | *גידול מסוג הפטובלסטומה | ||
| + | *מוקדים של יתר צבענות מלידה, דו-צדדי, באפיתל של רשתית העין (CHRPE) | ||
| + | *גידול מסוג דסמואיד (desmoid) - ריבוי פעיל של פיברובלסטים ברקמת החיבור של המזנטריום | ||
| + | *וריאנט נדיר של גידול פפילארי של בלוטת המגן, הקרוי cribriform-morular | ||
| + | *קיימים מצבים נוספים בהם יש לשקול הפניה לייעוץ גנטי, בהם: סרטן מעי גס בגיל צעיר גם בהיעדר פוליפים אדנומטוטיים מרובים, אבנורמליות דנטלית (בעיקר אודונטומה odontoma או שיניים עודפות supernumerary teeth), פוליפוזיס של הקיבה (fundic glands polyps) וגידולים כגון מדולובלסטומה {{הערה|שם=הערה7|Provenzale D, Gupta S, Ahnen DJ, et al. Genetic/ familial high-risk assessment: colorectal version 1.2016, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2016 Aug;14(8):1010-30.}} | ||
| − | + | ==אופן הבירור הגנטי המולקולר׳== | |
| − | + | יש להפנות לייעוץ גנטי מסודר כל אדם שעונה על הקריטריונים המפורטים לעיל. בייעוץ הגנטי ייאסף מידע רפואי רלוונטי מקיף על אודות המטופל ומשפחתו, יינתן הסבר מפורט על הבעיה ומשמעותה, ויוסברו כל דרכי הבירור הגנטי האפשריות תוך ציון היתרונות, המגבלות וההשלכות של הבירור הגנטי על המטופל וקרובי משפחתו שבסיכון. בהתאם לזאת, יוכל המטופל (או האפוטרופוס אם מדובר בקטין או חוסה) לקבל החלטה מושכלת אם הוא מעוניין בבירור גנטי שמטרתו לאתר את המוטציה בגן האחראית לבעיה. כשמזוהה מוטציה בבן משפחה, לכל אחד מילדיו של אותו פרט יש 50% סיכון להיות נשאים של המוטציה. היות שסריקת המעי הגס בבדיקת קולונוסקופיה בפרטים בסיכון ל-FAP מומלצת כבר מגיל 10 שנים, מומלץ להפנותם לייעוץ ובהמשך לבירור גנטי בעזרת בדיקות דנ"א מולקולריות כבר בגיל 8. תרשים מס' 2 מדגים את האלגוריתם לאבחון הגנטי של FAP. | |
| + | [[קובץ:פוליפוזיס2.jpg|600 פיקסלים|ממוזער|מרכז|תרשים 2 - אבחון גנטי של FAP]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | השלב הראשון המומלץ באבחון הגנטי הוא ריצוף מלא של האזור המקודד של הגן, דהיינו כל 15 האקסונים, כולל אזורי השחבור (splice sites). הבירור מתבצע על דנ"א שמופק מלימפוציטים בדם פריפרי או מרוק. ישנן מעבדות שמבצעות בירור זה באמצעות ריצוף המבוסס על שיטת סנגר (Sanger) ואחרות המשתמשות בשיטות ריצוף מהדור החדש (next generation sequencing). אם ריצוף הגן APC נמצא תקין, מומלץ להתקדם לבירור שכולל בדיקת חסרים והכפלות בגן בטכנולוגיות אחרות, כגון MLPA {{כ}} (multiplex ligation-dependent probe amplification). שינויים מסוג זה מהווים כ-12-8% מהשינויים הפתוגניים בגן APC {{כ}}{{הערה|שם=הערה1}}. בחלק מהחולים התמונה הקלינית אינה מובהקת, והמחלה יכולה להיגרם ממוטציה בגן אחר. במקרים אלה יש לשקול בירור בעזרת ריצוף המתבסס על טכנולוגיות מהדור החדש, שכולל את ריצוף הגן APC במקביל לריצוף הגן MUTYH, או כחלק מפנלים רחבים, שכוללים סריקת גנים רבים הקשורים בתחלואה בסרטן . כך גם במקרים בהם הבירור ל-APC נמצא תקין יש לשקול המשך בירור בעזרת פנל גנים רחב לאיתור גן המדמה את תסמונת FAP. | |
| − | + | ||
| − | + | לנבדקים עם מופע קליני של ריבוי פוליפים בקיבה (GAPPS) ישנה חשיבות לכלול בבירור גם בדיקת ריצוף ואיתור של חסרים/הכפלות באזור הפרומוטר של הגן 1B{{כ}}{{הערה|שם=הערה1}}. | |
| − | + | ||
| − | + | במקרי FAP שאינם משפחתיים, דהיינו בהם נראה כי מדובר במוטציה חדשה (de novo), ואם ריצוף ובדיקת חסרים/הכפלות נמצאו תקינים, יש לשקול לחזור על הבירור בדגימת דנ"א ממקור אחר (לדוגמה, משטח מתאי רירית הלחי - (buccal swab) או אף בדנ"א שיופק מפוליפ שנדגם במעי). זאת בשל העובדה שבכחמישית מהמקרים של מוטציה חדשה בגן APC מדובר במצב של מוזאיקה. עם זאת, יש לזכור כי איכות וכמות הדנ"א שניתן להפיק מרקמות אלה לעיתים אינה מספקת לצורך ריצוף ובדיקת חסרים/ הכפלות בגן ואינה מהווה חלק מהליך האבחון השגרתי של המחלה{{הערה|שם=הערה1}}. | |
| − | השלב הראשון המומלץ באבחון הגנטי הוא ריצוף מלא של האזור המקודד של הגן, דהיינו כל 15 האקסונים, כולל אזורי השחבור (splice sites). הבירור מתבצע על דנ"א שמופק מלימפוציטים בדם פריפרי או מרוק. ישנן מעבדות שמבצעות בירור זה באמצעות ריצוף המבוסס על שיטת סנגר (Sanger) ואחרות המשתמשות בשיטות ריצוף מהדור החדש (next generation sequencing). | ||
| − | לנבדקים עם מופע קליני של ריבוי פוליפים בקיבה (GAPPS) ישנה חשיבות לכלול בבירור גם בדיקת ריצוף ואיתור של חסרים/הכפלות באזור הפרומוטר של הגן | ||
| − | במקרי FAP שאינם משפחתיים, דהיינו בהם נראה כי מדובר במוטציה חדשה (de novo), | ||
| + | ==אבחון טרום לידתי וטרום השרשתי== | ||
| + | כאשר ידוע על נשאות למוטציה בגן APC אצל אחד ההורים, ישנו סיכון של 50% להעברת המחלה לילדים. היות שמדובר במחלה אשר עלולה להתבטא כבר בילדות, וההמלצות למעקב הן מסוף העשור הראשון- תחילת העשור השני לחיים, קיימת אפשרות לבצע אבחון טרום לידתי בעובר במהלך ההיריון, בבדיקת סיסי שליה או מי שפיר. יש אפשרות נוספת, והיא ביצוע אבחון טרום השרשתי, שדורש היריון שיושג באמצעות הפריית מבחנה. אבחונים מסוג זה מעלים שאלות אתיות ומעוררים מחלוקת בקרב הקהילה הרפואית, כיוון שמדובר במחלה שברוב המקרים מתבטאת בבגרות ושמופעה וריאבילי. יש המטילים ספק אם נשאות למוטציה בגן APC ממלאת אחר כל הקריטריונים הנדרשים לאבחון טרום השרשתי או טרום לידתי{{הערה|שם=הערה8|Clancy T. A clinical perspective on ethical arguments around prenatal diagnosis and preimplantation genetic diagnosis for later onset inherited cancer predispositions. Fam Cancer. 2010 Mar;9(1):9-14.Epub 2009 Jul 31.}} {{הערה|שם=הערה9|Brandt AC, Tschirgi ML, Ready KJ, et al. Knowledge, attitudes, and clinical experience of physicians regarding preimplantation genetic diagnosis for hereditary cancer predisposition syndromes. Fam Cancer. 2010 Sep;9(3):479-87.}}. | ||
| + | ==סיכום== | ||
| + | האבחון הגנטי של פוליפוזיס אדנומטוטי משפחתי הוא תהליך מורכב, בייחוד לאור העובדה שגיל ההסתמנות הקלינית במקרים הקלאסיים הוא תחילת גיל ההתבגרות. האבחון הגנטי במצבים אלו משתלב בתוך התהליך הקשה של התמודדות המשפחה עם האבחנה, והחשש לבני משפחה נוספים בסיכון, שמתעצם כאשר מתקבלת "חותמת" של אבחנה גנטית. תהליך כזה דורש שיתוף פעולה מרבי בין כל הגורמים המטפלים במשפחה, מרופא הילדים/המשפחה, ועד הגסטרואנטרולוג, הכירורג, היועץ הגנטי ותוך עירוב גורמים פסיכו-סוציאליים שיסייעו למטופל ולמשפחה בהתמודדות עם האבחנה הלא פשוטה של תסמונת זו. אבחון מוקדם יאפשר מניעה של סרטן, ובהתאם לרצון המשפחה יכול גם למנוע הישנות התחלואה בהמשך הילודה. | ||
| − | + | ==ביבליוגרפיה== | |
| − | + | {{הערות שוליים|יישור=שמאל}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==קישורים חיצוניים== | ==קישורים חיצוניים== | ||
גרסה אחרונה מ־13:24, 25 במאי 2018
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| אבחון גנטי של פוליפוזיס אדנומטוט׳ משפחתי (FAP) | ||
|---|---|---|
| ' | ||
| ||
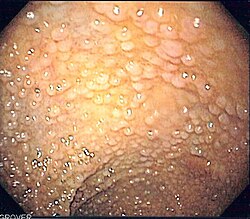
צילום אנדוסקופי של מעי גס של מטופל עם פוליפוזיס משפחתית
| ||
| ICD-10 | Chapter C 18., Chapter D 12. | |
| ICD-9 | 211.3 | |
| MeSH | D011125 | |
| יוצר הערך | ניצן שרון שוורצמן, אלינה קורולפ, פרופ' משנה קליני חגית בריס-פלדמן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פוליפוזיס אדנומטוטי משפחתי
מבוא
פוליפוזיס אדנומטוטי משפחתי (Familial adenomatous polyposis - FAP) הוא תסמונת המאופיינת בריבוי פוליפים במעי הגס ובסיכון יתר לממאירות באיבר זה. קיים סיכון יתר לתסמינים נוספים, כפי שמפורט במאמרים פוליפוזיס אדנומטוטי משפחתי בילדים ופוליפוזיס אדנומטוטי משפחתי – רפואת בוגרים .
ההורשה של FAP היא אוטוזומלית דומיננטית, כלומר אין מדובר במחלה הקשורה למין המטופל, ומוטציה בודדת על עותק אחד של הגן, האבהי או האימהי, מספיקה על מנת לגרום למחלה. האבחון הגנטי של FAP מתבסס על זיהוי שינוי גנטי גורם מחלה (=מוטציה) בגן Adenomatous polyposis coli) APC). ב-75% מהמקרים מדובר במוטציה המורשת מאחד ההורים, וב-25% מדובר במוטציה חדשה[1]. לאבחון הגנטי של פוליפוזיס אדנומטוטי משפחתי יש חשיבות רבה, שכן אבחון כזה בחולה משמעותו בראש ובראשונה אפשרות להתאים פרוטוקול מעקב ומניעה לחולה עצמו, יחד עם אפשרות לזהות בני משפחה נוספים הנשאים לתסמונת, כולל ילדים, לפני הופעת תסמינים קליניים. אבחון מוקדם מאפשר, מחד, התאמת פרוטוקול מעקב מתאים לבני המשפחה שנמצאו נשאים, ומאידך, לפטור ממעקב, שכרוך בבדיקות חודרניות ויקרות, את אלו שלא ירשו את המוטציה המשפחתית.
הגן APC
APC משתייך לקבוצת גנים הקרויים "גנים מדכאי סרטן" (tumor suppressor genes), והוא ממוקם על הזרוע הארוכה של כרומוזום 5 (5q21-q22). הגן מורכב מ-15 אקסונים, כאשר אקסון 15 מהווה כ-75% מהאזור המקודד לחלבון של הגן ובו מרוכזות רוב המוטציות הידועות, הן המורשות והן הנרכשות. הגן APC מקודד לחלבון שמורכב מ-2,843 חומצות אמינו, שקשור למסלול העברת הסיגנל של ה- Wnt/β-catenin. החלבון מתפקד כמדכא סרטן באמצעות היזון שלילי של פעילות האונקוגן catenin-β ושמירה על יציבות המיקרוטובולי, התורם ליציבות הכרומוזומלית[2].
אפיון המוטציות בגן APC
מאז זיהוי הגן APC ב-1991 זוהו יותר מ-1,100 מוטציות שונות בגן זה. רוב המוטציות הללו גורמות לקטיעת החלבון (מוטציות פסק, חסרים/הכפלות קטנים). במיעוט המקרים (כ-3%) מדובר במוטציות תשנית (missense), שמחליפות חומצה אמינית אחת באחרת, ובכ- 13% מהמקרים מדובר על חסרים/הכפלות גדולים שכוללים אקסון אחד או מספר אקסונים של הגן, ובמקרים נדירים יותר גם כל הגן.
קיימות שתי מוטציות שמהוות "מוקדים חמים" (hotspots). מוטציות אלה ממוקמות באקסון 15 של הגן, בקודונים 1309 ו-1061, והן אחראיות ל-17% ול- 11% מהמוטציות הגרמינליות - המורשות במשפחה בגן APC, בהתאמה[2].
כ-25% מהמקרים של FAP הם כתוצאה ממוטציה חדשה. אחוז נכבד מאותם מקרים חדשים נובעים ממוטציה שנמצאת במצב של פסיפס (מוזאיקה), דהיינו המוטציה אינה נמצאת בכל התאים בגוף ואינה נובעת משינוי בתאי הנבט אלא ממוטציה סומאטית, שפוגעת רק בחלק מהתאים בגוף[1]. לפי מחקרים עדכניים, מוטציות בגן APC זוהו בכ-80% מהמקרים בהם המופע הקליני היה מאופיין בקיום מעל 1,000 פוליפים אדנומטוטיים, בכ-56% מהחולים עם 100–999 פוליפים אדנומטוטיים, בכ-10% מהחולים עם 20–99 פוליפים אדנומטוטיים ובכ-5% מהחולים עם 10–19 פוליפים אדנומטוטיים[3].
קורלציית גנוטיפ-פנוטיפ
ישנו שוני בביטוי הקליני-הפנוטיפי בין חולי FAP, הן בהתייחס לכמות הפוליפים, גיל ההופעה ולביטויים מחוץ למעי הגס. הניסיון לבסס קורלציה של גנוטיפ-פנוטיפ הוא בעל חשיבות במתן המלצות מותאמות למעקב, מניעת סרטן והפחתת סיכונים המבוססים על סוג המוטציה שיש למטופל. ישנם שני היבטים מרכזיים בקורלציית גנוטיפ-פנוטיפ (תרשים מס' 1):
- מידת הפוליפוזיס וגיל הופעת התסמינים: מספר רב מאוד של פוליפים (אלפים) וגיל הופעה מוקדם יחסית (בתחילת העשור השני לחיים) קשורים במוטציות בקודונים 1250–1464, ובעיקר hotspots בקודון 1309. הביטוי הקליני "המוחלש" יותר של FAP, המכונה attenuated FAP, אשר כולל מספר מצומצם יותר של פוליפים (עשרות) וגיל הופעה מאוחר יותר (סביב 40), קשור בעיקר במוטציות המצויות בשני קצוות הגן או באקסון 9 (בין הקודונים 213–412). שאר אזורי הגן קשורים במופע ביניים, שנע בין המופע החריף יותר למופע המתון יותר
- ביטויים מחוץ למעי הגס:
- CHRPE (congenital hypertrophy of the retina pigment epithelium) נמצא קשור יותר למוטציות בין הקודונים 311 ל-1465
- גידולים דסמואידיים - קשורים יותר למוטציות במורד הזרם לקודון 1400
- הפטובלסטומה - כ-95% מהמקרים בהם מופיע גידול זה בחולי FAP נמצאו קשורים למוטציות בקודונים 141–1751
- גידולים בבלוטת המגן - נמצאו קשורים למוטציות בקודונים 140–1309
- פוליפים מרובים בקיבה GAPPS (gastric adenocarcinoma and proximal polyposis of the stomach) - מצב כזה, שכולל פוליפים מרובים מסוג fundic glands polyps, ועלייה בסיכון לסרטן קיבה עם מעורבות מינימלית של המעי הגס, זוהה במספר משפחות כקשור במוטציות באזור המקדם (=פרומוטר) הקרוי 1B של הגן APC[1] [4] [5]
המוטציה I1307K
המוטציה הידועה בשם I1307K בגן APC היא בעלת שכיחות של 10-6% ביהודים ממוצא אשכנזי, ושכיחות נמוכה יותר של כ-3% ביהודים ממוצא ספרדי ובאוכלוסיות ממוצא אחר. מוטציה זו, הגורמת להחלפת החומצה האמינית איזולאוצין בליזין בקודון 1307 של הגן, אינה קשורה במופע של פוליפוזיס. עם זאת, באוכלוסייה האשכנזית מוטציה זו נמצאה כמעלה פי 2 את הסיכון לפתח סרטן מעי גס לאורך החיים, בהשוואה לאוכלוסייה הכללית, דהיינו לנשאי המוטציה סיכון של 20-10% לפתח סרטן מעי גס במהלך החיים. בפרטים נשאי שינוי זה נהוג להתחיל מעקב מעי גס באמצעות קולונוסקופיה החל מגיל 40 בתדירות של כל 3–5 שנים, לעומת ההמלצות באוכלוסייה הכללית למעקב מעי גס באמצעות דם סמוי בצואה החל מגיל 50 [6].
קריטריונים להפניה לייעוץ גנטי ולבירור גנטי של FAP
לפי ההנחיות של ה-NCCN (National Cancer Comprehensive Network), איגוד אמריקני הכולל יותר מ-1,000 קלינאים וחוקרים מ-27 מרכזים רפואיים מובילים בארצות הברית, יש להפנות לייעוץ גנטי, ובהתאם לאנמנזה מקיפה אישית ומשפחתית, שתילקח במהלך הייעוץ, ולרצון המטופל גם לשקול בירור גנטי בעזרת בדיקות דנ"א מולקולריות, בשאלה של FAP את כל מי שעונה על אחד מהקריטריונים הבאים:
- לפחות 10–20 פוליפים אדנומטוטיים (במצטבר) במעי הגס
- סיפור משפחתי של ריבוי פוליפים אדנומטוטיים (יותר מ-10 אם מדובר בפרט יחיד, או מספר נמוך יותר אם מדובר במספר בני משפחה, בייחוד אם אחד מהם אובחן בגיל צעיר) או סיפור משפחתי של ביטויים מחוץ למעי הגס כמפורט להלן. מידת התורשתיות במקרים אלו תיבחן בייעוץ גנטי שיקבע את נחיצות הבירור הגנטי
- גידול מסוג הפטובלסטומה
- מוקדים של יתר צבענות מלידה, דו-צדדי, באפיתל של רשתית העין (CHRPE)
- גידול מסוג דסמואיד (desmoid) - ריבוי פעיל של פיברובלסטים ברקמת החיבור של המזנטריום
- וריאנט נדיר של גידול פפילארי של בלוטת המגן, הקרוי cribriform-morular
- קיימים מצבים נוספים בהם יש לשקול הפניה לייעוץ גנטי, בהם: סרטן מעי גס בגיל צעיר גם בהיעדר פוליפים אדנומטוטיים מרובים, אבנורמליות דנטלית (בעיקר אודונטומה odontoma או שיניים עודפות supernumerary teeth), פוליפוזיס של הקיבה (fundic glands polyps) וגידולים כגון מדולובלסטומה [7]
אופן הבירור הגנטי המולקולר׳
יש להפנות לייעוץ גנטי מסודר כל אדם שעונה על הקריטריונים המפורטים לעיל. בייעוץ הגנטי ייאסף מידע רפואי רלוונטי מקיף על אודות המטופל ומשפחתו, יינתן הסבר מפורט על הבעיה ומשמעותה, ויוסברו כל דרכי הבירור הגנטי האפשריות תוך ציון היתרונות, המגבלות וההשלכות של הבירור הגנטי על המטופל וקרובי משפחתו שבסיכון. בהתאם לזאת, יוכל המטופל (או האפוטרופוס אם מדובר בקטין או חוסה) לקבל החלטה מושכלת אם הוא מעוניין בבירור גנטי שמטרתו לאתר את המוטציה בגן האחראית לבעיה. כשמזוהה מוטציה בבן משפחה, לכל אחד מילדיו של אותו פרט יש 50% סיכון להיות נשאים של המוטציה. היות שסריקת המעי הגס בבדיקת קולונוסקופיה בפרטים בסיכון ל-FAP מומלצת כבר מגיל 10 שנים, מומלץ להפנותם לייעוץ ובהמשך לבירור גנטי בעזרת בדיקות דנ"א מולקולריות כבר בגיל 8. תרשים מס' 2 מדגים את האלגוריתם לאבחון הגנטי של FAP.
השלב הראשון המומלץ באבחון הגנטי הוא ריצוף מלא של האזור המקודד של הגן, דהיינו כל 15 האקסונים, כולל אזורי השחבור (splice sites). הבירור מתבצע על דנ"א שמופק מלימפוציטים בדם פריפרי או מרוק. ישנן מעבדות שמבצעות בירור זה באמצעות ריצוף המבוסס על שיטת סנגר (Sanger) ואחרות המשתמשות בשיטות ריצוף מהדור החדש (next generation sequencing). אם ריצוף הגן APC נמצא תקין, מומלץ להתקדם לבירור שכולל בדיקת חסרים והכפלות בגן בטכנולוגיות אחרות, כגון MLPA (multiplex ligation-dependent probe amplification). שינויים מסוג זה מהווים כ-12-8% מהשינויים הפתוגניים בגן APC [1]. בחלק מהחולים התמונה הקלינית אינה מובהקת, והמחלה יכולה להיגרם ממוטציה בגן אחר. במקרים אלה יש לשקול בירור בעזרת ריצוף המתבסס על טכנולוגיות מהדור החדש, שכולל את ריצוף הגן APC במקביל לריצוף הגן MUTYH, או כחלק מפנלים רחבים, שכוללים סריקת גנים רבים הקשורים בתחלואה בסרטן . כך גם במקרים בהם הבירור ל-APC נמצא תקין יש לשקול המשך בירור בעזרת פנל גנים רחב לאיתור גן המדמה את תסמונת FAP.
לנבדקים עם מופע קליני של ריבוי פוליפים בקיבה (GAPPS) ישנה חשיבות לכלול בבירור גם בדיקת ריצוף ואיתור של חסרים/הכפלות באזור הפרומוטר של הגן 1B[1].
במקרי FAP שאינם משפחתיים, דהיינו בהם נראה כי מדובר במוטציה חדשה (de novo), ואם ריצוף ובדיקת חסרים/הכפלות נמצאו תקינים, יש לשקול לחזור על הבירור בדגימת דנ"א ממקור אחר (לדוגמה, משטח מתאי רירית הלחי - (buccal swab) או אף בדנ"א שיופק מפוליפ שנדגם במעי). זאת בשל העובדה שבכחמישית מהמקרים של מוטציה חדשה בגן APC מדובר במצב של מוזאיקה. עם זאת, יש לזכור כי איכות וכמות הדנ"א שניתן להפיק מרקמות אלה לעיתים אינה מספקת לצורך ריצוף ובדיקת חסרים/ הכפלות בגן ואינה מהווה חלק מהליך האבחון השגרתי של המחלה[1].
אבחון טרום לידתי וטרום השרשתי
כאשר ידוע על נשאות למוטציה בגן APC אצל אחד ההורים, ישנו סיכון של 50% להעברת המחלה לילדים. היות שמדובר במחלה אשר עלולה להתבטא כבר בילדות, וההמלצות למעקב הן מסוף העשור הראשון- תחילת העשור השני לחיים, קיימת אפשרות לבצע אבחון טרום לידתי בעובר במהלך ההיריון, בבדיקת סיסי שליה או מי שפיר. יש אפשרות נוספת, והיא ביצוע אבחון טרום השרשתי, שדורש היריון שיושג באמצעות הפריית מבחנה. אבחונים מסוג זה מעלים שאלות אתיות ומעוררים מחלוקת בקרב הקהילה הרפואית, כיוון שמדובר במחלה שברוב המקרים מתבטאת בבגרות ושמופעה וריאבילי. יש המטילים ספק אם נשאות למוטציה בגן APC ממלאת אחר כל הקריטריונים הנדרשים לאבחון טרום השרשתי או טרום לידתי[8] [9].
סיכום
האבחון הגנטי של פוליפוזיס אדנומטוטי משפחתי הוא תהליך מורכב, בייחוד לאור העובדה שגיל ההסתמנות הקלינית במקרים הקלאסיים הוא תחילת גיל ההתבגרות. האבחון הגנטי במצבים אלו משתלב בתוך התהליך הקשה של התמודדות המשפחה עם האבחנה, והחשש לבני משפחה נוספים בסיכון, שמתעצם כאשר מתקבלת "חותמת" של אבחנה גנטית. תהליך כזה דורש שיתוף פעולה מרבי בין כל הגורמים המטפלים במשפחה, מרופא הילדים/המשפחה, ועד הגסטרואנטרולוג, הכירורג, היועץ הגנטי ותוך עירוב גורמים פסיכו-סוציאליים שיסייעו למטופל ולמשפחה בהתמודדות עם האבחנה הלא פשוטה של תסמונת זו. אבחון מוקדם יאפשר מניעה של סרטן, ובהתאם לרצון המשפחה יכול גם למנוע הישנות התחלואה בהמשך הילודה.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Jasperson, KW, Patel SG, Ahnen DJ. APC-Associated Polyposis Conditions. In: Pagon RA, Adam MP, Ardinger HH, et al. (eds.) GeneReviews® [Internet]. Seattle (WA): University of Washington, 1993. [updated 2017 Feb 2]. Available from: https://www.ncbi.nlm.nih.gov/books/ NBK1345. [Accessed 19 June, 2017].
- ↑ 2.0 2.1 Leoz ML, Carballal S, Moreira L, et al. The genetic basis of familial adenomatous polyposis and its implications for clinical practice and risk management. Appl Clin Genet. 2015 Apr 16;8:95-107.
- ↑ Grover S, Kastrinos F, Steyeberg E, et al. Prevalence and phenotypes pf APC and MUTYH mutations in patients with multiple colorectal adenomas. JAMA. 2012 Aug 1;308(5):485-92.
- ↑ Nieuwenhuis MH, Vasen HFA. Correlations between mutation site in APC and phenotype of familial adenomatous polyposis (FAP): a review of the literature. Crit Rev Oncol Hematol. 2007 Feb;61(2):153-61.
- ↑ Ballhausen W. Genetic testing for familial adenomatous polyposis. Ann N Y Acad Sci. 2000;910:36-49.
- ↑ Rozen P׳ Shomrat R, Strul H, et al. Prevalence of the I1307K APC gene variant in Israeli Jews of differing ethnic origin and risk for colorectal cancer. Gastroenterology. 1999 Jan;116(1):54-7.
- ↑ Provenzale D, Gupta S, Ahnen DJ, et al. Genetic/ familial high-risk assessment: colorectal version 1.2016, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2016 Aug;14(8):1010-30.
- ↑ Clancy T. A clinical perspective on ethical arguments around prenatal diagnosis and preimplantation genetic diagnosis for later onset inherited cancer predispositions. Fam Cancer. 2010 Mar;9(1):9-14.Epub 2009 Jul 31.
- ↑ Brandt AC, Tschirgi ML, Ready KJ, et al. Knowledge, attitudes, and clinical experience of physicians regarding preimplantation genetic diagnosis for hereditary cancer predisposition syndromes. Fam Cancer. 2010 Sep;9(3):479-87.
קישורים חיצוניים
- במה עמוד 44
המידע שבדף זה נכתב על ידי ניצן שרון שוורצמן, אלינה קורולפ, פרופ' משנה קליני חגית בריס-פלדמן - מכון גנטי, הקריה הרפואית רמב"ם; הטכניון, מכון טכנולוגי לישראל, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 
