הבדלים בין גרסאות בדף "פוליפוזיס אדנומטוטי משפחתי – רפואת בוגרים"
| (20 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 11: | שורה 11: | ||
|יוצר הערך=ד"ר רויטל קריב | |יוצר הערך=ד"ר רויטל קריב | ||
|אחראי הערך= | |אחראי הערך= | ||
| − | }} | + | }} |
| − | {{הרחבה|פוליפוזיס אדנומטוטי משפחתי}} | + | {{הרחבה|פוליפוזיס אדנומטוטי משפחתי}} |
==מבוא== | ==מבוא== | ||
| − | תהליכים סרטניים וטרום סרטניים במעי הגס בעלי רקע גנטי מהווים כ-20% מכלל המקרים. התסמונות התורשתיות נחלקות לאלו ללא ריבוי פוליפים (Hereditary non-polyposis colorectal cancer | + | תהליכים סרטניים וטרום סרטניים במעי הגס בעלי רקע גנטי מהווים כ-20% מכלל המקרים. התסמונות התורשתיות נחלקות לאלו ללא ריבוי פוליפים (HNPCC {{כ}}- Hereditary non-polyposis colorectal cancer, תסמונת סרטן מעי גס שאינה על רקע פוליפוזיס) ולאלו עם ריבוי פוליפים. מבין תסמונות הפוליפוזיס, הראשונה שתוארה כללה ריבוי פוליפים מסוג אדנומה על רקע מוטציות בגן APC {{כ}} (adenomatous polyposis coli). גן זה משתייך לגנים מסוג מעכבי גידול (tumor suppressor genes), ויש לו תפקיד חשוב בשלבים הראשונים של התפתחות סרטן המעי הגס: ב-90% מהפוליפים השפירים מסוג אדנומה נמצאים שינויים גנטיים בגן זה {{הערה|שם=הערה1|Su LK, Kinzler KW, Vogelstein B, et al. Multiple intestinal neoplasia caused by a mutation in the murine homolog of the APC gene. Science. 1992 May 1;256(5057):668-70.}} {{הערה|שם=הערה2|Syngal S, Brand RE, Church JM, et al. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62. Epub 2015 Feb 3.}} בניגוד לשינויים ומוטציות בגנים הנמצאים ברמת הפוליפ או הגידול (סומטיים) ואינם בהכרח מורשים, שינויים גנטיים של תאי הגוף, כולל תאי המין (germline), עשויים לעבור בתורשה - באופן רצסיבי (נסגני) או דומיננטי (שלטני). שינויים גנטיים משמעותיים בגן APC גורמים לתסמונת פוליפוזיס אדנומטוטי משפחתי (FAP {{כ}}-Familial adenomatous polyposis), שביטויה העיקרי הוא ריבוי פוליפים מסוג אדנומה לאורך צינור העיכול - בעיקר במעי הגס, אולם גם בתריסריון, ובשכיחות קטנה יותר גם בקיבה והמעי הדק. |
| − | |||
| − | שביטויה העיקרי | ||
| − | |||
| − | |||
| − | + | מאחר שהיבטים שונים של התסמונת, בעיקר אלו הקשורים לשנות הילדות והבגרות, מתוארים במאמר הסוקר את התסמונת בילדים, נתייחס כאן למידע הרלוונטי יותר לגיל הבוגר. | |
| + | ==אבחנה קלינית== | ||
| + | ===מרכיבי תסמונת FAP וביטוים=== | ||
| + | *פוליפים מסוג אדנומה וגידולי המעי הגס מהווים את עיקר התבטאות התסמונת. אלו הסבירו את רוב התחלואה בסרטן עד עידן הניתוחים (שיפורטו להלן). הפוליפים מופיעים בדרך כלל בעשור השני לחיים, ומספרם יכול לנוע בין מאות בווריאנט הקלאסי עד עשרות בווריאנט המתון, שביטויו עשוי להתחיל בעשור השלישי או הרביעי לחיים (תמונה מס' 1) | ||
| + | *פוליפים מסוג אדנומה וגידולי התריסריון בעיקר באזור הפפילה, מתחילים לרוב בשלב מאוחר מאלו שבמעי הגס | ||
| + | *גידולי דסמואיד - גידולים של תאי רקמת החיבור, הקרויים פיברובלסטים. גידולים אלו מוגדרים כשפירים מאחר שהם אינם שולחים גרורות, אולם הם יכולים לגדול מקומית בצורה אגרסיבית ולגרום לסיבוכים בחלל הבטן. מקום התפתחותם האופייני בתסמונת הוא שורש המזנטריום (בשונה מגידולי דסמואיד ספורדיים) - רקמת החיבור העוטפת את המעי בה עוברים כלי הדם המזינים אותו. סיבוכים אופייניים כוללים חסימת מעי או התנקבותו וחסימה של דרכי השתן. דסמואיד שכיח יותר בבנות ובנשים ובווריאנט של התסמונת הקרוי גרדנר (Gardner syndrome) (להלן). גדילת דסמואיד מואצת בעיקר בגיל ההתבגרות, לאחר הריונות (מאחר שהגידולים מושפעים מאסטרוגן), וכן לאחר ניתוחים לאור הדיסקציה המסיבית | ||
| + | *גידולי בלוטת המגן - גידולים מסוג פפילרי יכולים להופיע בנשאי התסמונת, ומכך נגזרת המלצה להמשך מעקב באולטרסאונד של בלוטת המגן | ||
| + | *אוסטיאומות וגידולי רקמה רכה (כגון פיברומות) - מופיעים בעיקר בווריאנט הנקרא גרדנר וקשורים בעלייה בסיכון לגידולי דסמואיד לאחר ניתוח. גידולי האוסטיאומה יכולים להופיע בכל מקום, אולם הם מופיעים בעיקר בגולגולת ובלסת | ||
| + | *גידולים אחרים - בתסמונת "תכנו באופן נדיר ביותר גם גידולי מוח, בווריאנט קליני הקרוי טורקוט (Turcot) | ||
| + | *תסמינים נוספים - שינויים פיגמנטריים מולדים ברשתית הקרויים CHRPE Congenital Hypertrophy of the Retinal) Pigment Epithelium) שאינם בעלי משמעות קלינית. הם שימשו טרם עידן האבחנה הגנטית לצורך אבחנתי בעיקר | ||
| − | [[קובץ: | + | [[קובץ:פוליפוזיס3.jpg|600 פיקסלים|ממוזער|מרכז|תמונה מס' 1: מראה אנדוסקופי של המעי הגס עם פוליפוזיס אדנומטוטי תורשתי {{הערה|שם=הערה11|HxBenefit. Familial Adenomatous Polyposis [image on the internet]. 2012 Dec 14 [cited 2017 Oct 8]. Available from: http://www.hxbenefit.com/familial- adenomatous-polyposis.html}}]] |
| + | ===תסמינים=== | ||
| + | אם לא ידועה תסמונת במשפחה, הנשאים בה עשויים להתגלות באופן מקרי. התסמינים העיקריים הם אנמיה, דמם רקטלי, כאבי בטן ועוד, אלא שלעיתים אין כל תסמינים לתסמונת. במשפחות בהן ידועה התסמונת, מבוצעות בדיקות גנטיות יזומות לאיתור נשאות ובדיקות אנדוסקופיות לגילוי מוקדם של המאפיינים. | ||
| + | |||
| + | ===סיכונים=== | ||
| + | הסיכון העיקרי בתסמונת הפוליפוזיס התורשתית הוא סרטן המעי הגס, אולם, לאור המעקב המובנה והניתוחים היעילים, חלה ירידה משמעותית בסיכון זה, והוא אינו מהווה גורם מוביל לתמותה באוכלוסייה זו. במקומו עלו מרכיבים אחרים בתסמונת כגורמי סיכון לתחלואה ולעיתים לתמותה, והם גידולי דסמואיד ופוליפים וכן גידולים של הפפילה ורירית התריסריון. | ||
| + | |||
| + | ==אבחנה גנטית== | ||
| + | בקצרה (פירוט במאמר בנושא), במשך שנים היה נהוג להתחיל את הבירור הגנטי של מטופלים עם ריבוי אדנומות במעי הגס באמצעות בדיקת ריצוף של הגן הבודד APC בשיטת סאנגר (Sanger sequencing), ואם היא שלילית, להמשיך ולבדוק מוטציות שכיחות בגן MUTYH. העידן של שיטת ריצוף הדור הבא - (next generation sequencing - NGS) טרף את הקלפים, בכך שבאותה עלות של ריצוף גן בודד ניתן להשיג ריצוף בפנל של עשרות גנים הקשורים לסרטן מערכת העיכול, בהם הגנים APC, GREM1 ו-MUTYH- וכן גנים חדשים, שתוארו כקשורים לריבוי אדנומות. | ||
| + | מציאת מוטציה בגן APC מספקת מספר נדבכים לטיפול בתסמונת ולהמשך ניהול מעקב רפואי של המטופל ומשפחתו: | ||
| + | *מאפיינים שונים של המוטציה עוזרים להעריך את חומרתה של התסמונת ומאפשרים התאמת טיפול מונע וטיפול ניתוחי | ||
| + | *ניתן לבדוק את בני המשפחה ולהחליט מי זקוק למעקב מונע סרטן | ||
| + | *אפשרות להציע אבחנה טרום השרשתית לצורך מניעת ההורשה של המוטציה (פירוט להלן) | ||
| + | *מוטציה ידועה מאפשרת הכללה במחקרים, שחלקם בודקים מוטציות מסוג ספציפי (פירוט להלן, בסיכום) | ||
| + | |||
| + | ==מעקב לנשאי התסמונת== | ||
| + | אחד הנושאים החשובים ביותר לנשאים עם תסמונות פוליפוזיס הוא ניהול מעקב רפואי מסודר. הוכח מחקרית כי מעקב מסודר בהתאם להנחיות מונע תחלואה וסרטן. מומלץ לבצע מעקב שכזה במרכז המתמחה בסרטן מעי גס תורשתי, לאור נדירות התסמונת והצורך במיומנות קלינית ואנדוסקופית. המעקב מתבצע בדרך כלל על ידי צוות רב-תחומי, המתמחה בנושא וכולל גסטרואנטרולוג, רופא ילדים (לפי הצורך), כירורג קולורקטלי ואונקולוג (לפי הצורך, בגידולי דסמואיד), ומעטפת תומכת הכוללת אחות, עובד/ת סוציאלי/ת ותזונאים, המלווים את המטופלים לאורך השנים, כולל באירועים משמעותיים כמו ניתוח, הריונות ועוד. הקביעות, הזמינות והאמון במטפלים ובמסגרת מהווים גורמים חשובים התורמים להיענות ולהתמדה במעקב ארוך השנים הצפוי לנשאים {{הערה|שם=הערה2}}. | ||
| + | |||
| + | ;המעקב למניעת סרטן כולל: | ||
| + | *מעקב באמצעות קולונוסקופיה מדי שנה או פחות, אם טרם בוצע ניתוח. לאחר ניתוח יתבצעו המעקבים בדרך כלל אחת לשנה עד שנתיים או בהתאם למצב הפוליפים והרקע האישי | ||
| + | *גסטרוסקופיה מומלצת אחת לשנה עד שנתיים כולל הסתכלות על הפפילה כדי לשלול התפתחות פוליפ, ומטרתה לעקוב אחר הופעת אדנומות בתריסריון ואחר פוליפים שפירים בכיפת הקיבה, שהם חלק מהתסמונת ולעיתים יכולים להכיל גם אדנומות | ||
| + | *מעקב בלוטת התריס באולטרסאונד מבוצע לאור הסיכון לפתח גידול פפילרי של בלוטת התריס ומומלץ אחת לשנה עד שנתיים | ||
| + | *מעקב תקופתי לגידולי דסמואיד בנשאים עם סיכון גבוה (וריאנט גרדנר או סיפור משפחתי של דסמואיד) מתבצע באמצעות הדמיה ב- [[CT]] או [[MRI]]. בכל מקרה, לפני ולאחר ניתוח כדאי לבצע, בהתאמה, הדמיית בסיס והדמיה חוזרת, כדי לראות אם לא התפתח גידול מסוג דסמואיד משני לניתוח, וכן לאחר היריון. אם התגלה גידול במראה הדמייתי מתאים, לא תמיד מבוצעת ביופסיה מאחר שזו יכולה להאיץ את הגידול. שכיח לראות מספר גידולים בתסמונת בניגוד למקרים אקראיים | ||
| + | |||
| + | ==טיפול מונע וטיפול== | ||
| + | *טיפול מונע - לרוב לא ניתן טיפול תרופתי לנשאים אצלם עדיין אין ביטוי קליני משמעותי של התסמונת, כגון פוליפים או גידולי דסמואיד. כמפורט להלן, במקרים נבחרים "נתן לנשאים בסיכון משמעותי טיפול מונע לגידולי דסמואיד טרם ניתוח | ||
| + | *טיפול בפוליפים וניתוחים - בעבר היה מקובל לחשוב כי כל מקרי FAP יטופלו בניתוח לכריתת המעי הגס. בתקופתינו קיימת התייחסות אישית לכל מקרה, והקווים המנחים הם עומס הפוליפים, דרגת חומרתם, הפוטנציאל הסרטני שלהם והיכולת להסירם אנדוסקופית. כאשר קיים עומס פוליפים משמעותי או מרבד פוליפים, המקשים על המעקב ואינם מאפשרים הסרה באנדוסקופיה, בדרך כלל יש להמליץ על ניתוח. גדילה מואצת עד כדי ריבוי פוליפים גדולים או מתקדמים, היא סוג של סימן אזהרה להתפתחות סרטן, המגדיל את הטיעונים בעד ניתוח | ||
| + | |||
| + | כשמספר הפוליפים אינו כה גדול (עשרות בודדות), ולאור ההתקדמות הטכנולוגית באנדוסקופיה, ניתן להסירם בפעולה אחת או בכמה פעולות, ולא תמיד יש גדילה מסיבית חוזרת. במקרים מתונים אלה ניתן לבצע מעקב וניהול באמצעות מעקב אנדוסקופ׳ צמוד לרוב, ההחלטה על ניתוח מתבצעת בדיון של צוות רב-תחומי. הממצאים הקליניים והאנדוסקופיים ממלאים תפקיד חשוב יותר בשיקול אם לבצע ניתוח מאשר האבחנה הגנטית. | ||
| + | |||
| + | ;סוגי הניתוחים לפוליפוזיס משפחתי כוללים: | ||
| + | *כריתה תת-שלמה של המעי הגס עם השארת רקטום והשקה (חיבור) בין הרקטום למעי הדק (subtotal colectomy with ileorectal anastomosis - IRA) | ||
| + | *כריתת כל המעי הגס והרקטום (total proctocolectomy) עם חיבור בין המעי הדק לפי הטבעת ויצירת מאגר (פאוץ') מלולאת מעי דק לשם יצירת "מכל " דמוי רקטום -ileo-anal pouch (תמונה מס' 2) {{הערה|שם=הערה3|McGuire BB, Brannigan AE, O'Connell PR. Ileal pouch- anal anastomosis. Br J Surg. 2007 Jul;94(7):812-23.}} | ||
| + | |||
| + | קיים ניסיון רב שנים בניתוחים אלה, והם מבוצעים גם בגישה פתוחה וגם בגישה לפרוסקופית. הבחירה בין הניתוחים תלויה במגוון שיקולים, ובעיקר בעומס הפוליפים ברקטום, ברקע הרפואי, בהעדפת המטופל, בניסיון המנתח ועוד. כריתה תת-שלמה של הרקטום מאפשרת צמיחה עתידית של פוליפים בגדם הרקטום, שניתנים לרוב להסרה אנדוסוקפית. עם זאת, ניתוח פאוץ' הוא נרחב יותר, ולעיתים מעלה את הסיכון לגידולי דסמואיד שעשויים לסכן את הפאוץ'. | ||
| + | |||
| + | כאשר קיימת אבחנה של סרטן המעי הגס בנוסף לפוליפים, ייכנסו שיקולים אונקולוגיים להחלטה לגבי סוג הניתוח וטיפולים נוספים, כגון כימותרפיה והקרנות. | ||
| + | |||
| + | [[קובץ:פוליפוזיס4.jpg|600 פיקסלים|ממוזער|מרכז|תמונה מס‘ 2 - ניתוח לכריתת כלל המעי הגס עם יצירת פאוץ‘ והשקת מעי דק לאנוס {{הערה|שם=הערה12|WebMD. Ulcerative surgery - what to expect [slideshow]. Ileal pouch anal anastomosis: no bags or valves [slide 4; image on internet]. [updated 2017 Aug 14; cited 2017 Oct 8]. Available from: https:// www.webmd.com/ibd-crohns-disease/ulcerative- colitis/ss/slideshow-surgery}}]] | ||
| + | |||
| + | ==מעקב לאחר הניתוח== | ||
| + | חשוב מאוד שגם המעקב אחרי הניתוח יתבצע בידי צוות מנוסה ומיומן בתסמונת, המנהל דיון משותף לצורך קבלת החלטות. חלק חשוב של המעקב הוא איתור גידולי דסמואיד, המואצים על ידי התהליך הניתוחי. גם לאחר הניתוח דרוש מעקב המשכי והדוק, ושהסיכון להתפתחות סרטן לא נעלם. | ||
| + | |||
| + | ==טיפול תרופתי== | ||
| + | כאשר יש גדילה בעומס הפוליפים, לפני או לאחר ניתוח, ניתן לשקול מתן טיפולים תרופתיים שהוכחו כמורידים את עומס הפוליפים. אלו כוללים בעיקר מעכבי האנזים 2-COX, סולינדק (קלינוריל - [[Clinoril]])* ואספירין - [[Aspirin]]{{כ}}{{הערה|שם=הערה4|Ricciardiello L, Ahnen DJ, Lynch PM. Chemoprevention of hereditary colon cancers: time for new strategies. Nat Rev Gastroenterol Hepatol. 2016 Jun;13(6):352-61. Epub 2016 Apr 20.}}. קיימים מחקרים המראים יעילות מסוימת גם לחומצות שומן מסוג [[אומגה 3]] ולכורכומין {{הערה|שם=הערה4}} {{הערה|שם=הערה5|West NJ, Clark SK, Phillips RK, et al. Eicosapentaenoic acid reduces rectal polyp number and size in familial adenomatous polyposis. Gut. 2010 Jul;59(7):918-25. Epub 2010 Mar 26.}}. | ||
| + | |||
| + | (*) או תרופות המכילות חומר פעיל זהה בעלות שמות מסחריים אחרים | ||
| + | ==טיפול בגידולי דסמואיד== | ||
| + | *טיפולים אנטיאסטרוגנים: טמוקסיפן - [[Tamoxifen]] (נולבדקס - Nolvadex)* | ||
| + | *טיפול במעכבי האנזים 2-COX, כגון סלקוקסיב - [[Celecoxib]] (סלברה - Celebra, סלברקס - Celebrex)* | ||
| + | *טיפולים כימיים: מקובל לתת טיפול בודד עם דוקסורוביצין הידרוכלוריד - [[Doxorubicin hydrochloride]] (דוקסורוביצין "אבווה" - Doxorubicin EBEWE)* או משלב של מטוטרקסאט - [[Methotrexate]] עם וינבלסטין - [[Vinblastine]] (וולבה - Velbe, וולבן - Velban)* או וינורלבין [[Vinorelbine]] - (נבלבין - Navelbine)* או משלב של דוקסורוביצין ו-DTIC | ||
| + | *טיפולים מכווני מטרה (ביולוגיים): כגון [[מעכבי קינאזות]], לדוגמה סוראפניב - [[Sorafenib]] (נקסאוואר - Nexavar)**, אימטיניב - [[Imatinib]] (גליבק - Gleevec/Glivec)**. | ||
| + | *טיפול ניתוחי | ||
| + | *השתלת מעי דק - אם מבוצעת כריתה ניתוחית נרחבת, הכוללת את שורש המזנטריום | ||
| − | + | שני הטיפולים הראשונים ניתנים כקו ראשון או לעיתים כמניעה, למרות היעדר הוכחות חותכות ליעילותם. אם קיימת התייצבות במצב הגידול או הגידולים, ממשיכים בטיפול ובמעקב הדוק. אם הגדילה ממשיכה או אם ישנם תסמינים משמעותיים - מתקדמים לאחד משני קווי הטיפול הבאים. | |
| − | + | קיימים חילוקי דעות לגבי הגישה הניתוחית מאחר שהיא עלולה להאיץ גדילה של גידולי דסמואיד חדשים. גישה זו נשמרת לגידולים בודדים ומוגדרים היטב בדופן הבטן ולא במזנטריום. אם קיים מצב מסכן חיים, ניתן לבצע כריתה רדיקלית, ואז קיים לעיתים צורך בהשתלת מעי דק {{הערה|שם=הערה4}} {{הערה|שם=הערה6|Lynch HT, Fitzgibbons R Jr. Surgery, desmoid tumors, and familial adenomatous polyposis: case report and literature review. Am J Gastroenterol. 1996 Dec;91(12):2598-601.}} {{הערה|שם=הערה7|Latchford AR, Sturt NJ, Neale K, et al. A 10-year review of surgery for desmoid disease associated with familial adenomatous polyposis. Br J Surg. 2006 Oct;93(10):1258-64.}}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | (*) או תרופות המכילות חומר פעיל זהה בעלות שמות מסחריים אחרים. | |
| − | + | ||
| − | + | (**) או תרופות המכילות חומר פעיל דומה בעלות שמות מסחריים אחרים | |
| − | + | ||
| − | + | ==תזונה ואורח חיים== | |
| − | + | מעטים, אם בכלל, המחקרים שבדקו את השפעת התזונה ואורח החיים, כגון עישון והשמנת יתר, על הביטוי הקליני של התסמונת. מאחר שלגורמים אלו חשיבות רבה בהופעת פוליפים וגידולי המעי באוכלוסייה הרחבה - לא מן הנמנע כי יש להם ערך משמעותי בנשאי התסמונת, ויש להדגיש בפניהם את החשיבות שבהימנעות מעישון, שמירה על משקל תקין, הרגלי אכילה וצריכת מזונות בריאים (בעיקר לגבי אלו שעבורם יש מידע מבוסס, כגון בשר מעובד וכמות סיבים תזונתיים נמוכה) {{הערה|שם=הערה8|Chao A, Thun MJ, Connell CJ, et al. Meat consumption and risk of colorectal cancer. JAMA. 2005 Jan 12;293(2):172-82.}}. | |
| − | + | ||
| − | + | ==אבחנה טרום-השרשתית - PGD{{כ}} (Pre-implantation genetic diagnosis )== | |
| − | + | טכנולוגיה זו נכנסה לשימוש עבור מחלות גנטיות קשות, כדי למנוע העברת שינויים גנטיים חמורים בתורשה {{הערה|שם=הערה9|Kuliev A, Verlinsky Y. Place of preimplantation diagnosis in genetic practice. Am J Med Genet A. 2005 Apr 1;134A(1):105-10.}}. בהליך מבוצעת הפריה חוץ גופית שבה נבדקים העוברים טרם החזרתם לרחם, לנשאיות המוטציה (תמונה מס' 3). בדיקה זו אינה פוגעת בעוברים, וכך ניתן לבחור את העוברים שאינם נושאים את השינוי הגנטי ולהבטיח כי הם לא יישאו את המוטציה הגנטית. הליך זה מעניק שקט נפשי לנשאים. עם זאת, עומדת בפני כל משפחה בחירה חופשית אם לבצעו או לא, וחלק מהמשפחות בוחרות שלא לבצעו. טכנולוגיה זו נמצאת בסל הבריאות לחולים בפוליפוזיס משפחתי ודורשת מוטציה מזוהה. המרכזים הרפואיים בארץ המבצעים אבחנה טרום-השרשתית הם תל אביב ע"ש סוראסקי, רבין, שערי צדק והדסה. | |
| − | + | ||
| − | + | [[קובץ:פוליפוזיס5.jpg|ממוזער|מרכז|600 פיקסלים|תמונה מספר 3 - דגימת טרום-עובר באבחון גנטי טרום השרשה {{הערה|שם=הערה13|מלכוב מ, בן יוסף ד, עמית ע, ואחרים, אבחון גנטי טרום השרשה למחלות סרטן תורשתיות. הרפואה. יוני 2011{{כ}}(150)6:{{כ}}496–501}}, באדיבות פרופ' דלית בן יוטף{{ש}}1. חירור המעטפת Zona pellucida של טרום־עובר בן שמונה תאים באמצעות קרן לייזר{{ש}}2,3. החדרת פיפטה דקה לתוך טרום־העובר ויצירת מגע עם אחד הבלטטומרים.{{ש}}4. משיכת הבלסטומר הבודד באמצעות מערכת מיקרומניפולציה, {{ש}}5. שחרור התא הבודד מחוץ לטרום־עובר, {{ש}}6. התא מוכן לאיטוף (בנפרד מטרום־העובר) לצורך אבחונו הגנטי.]] | |
| − | + | ||
| − | + | ==סיכום - עם הפנים לעתיד== | |
| − | + | FAP היא תסמונת גנטית נדירה וייחודית. לאורך השנים תסמונת זו אפשרה ומאפשרת לגסטרואנטרולוגים להבין את תהליכי היווצרות סרטן המעי הגס מבחינה מולקולרית, גנטית ואנדוסקופית, וכן גישות למניעת הופעה של פוליפים וסרטן במעי. התסמונת מתפקדת כ"מודל חי" לדינמיקה של פוליפים במעי הגס, בשל ריבוי הפוליפים שניתן לעקוב אחריהם לאורך זמן ובשל הבדיקות התדירות של הנשאים. מבחינה מחקרית, עצם העובדה כי הגן הגורם למחלה הוא קריטי גם בתהליכים גידוליים ספורדיים, הרי שמודלים בחיות ומודלים מעבדתיים של התסמונת הם בעלי ערך גם לכלל התהליכים הסרטניים במעי הגס. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | תזונה ואורח חיים | ||
| − | מעטים, אם בכלל, המחקרים שבדקו את השפעת התזונה ואורח החיים, כגון עישון והשמנת יתר, על הביטוי הקליני של התסמונת. מאחר | ||
| − | אבחנה טרום-השרשתית | ||
| − | Pre-implantation genetic) | ||
| − | טכנולוגיה זו נכנסה לשימוש | ||
| + | טיפולים רפואיים חדישים במחלות גנטיות מופיעים עם רלוונטיות לתסמונת, למשל טיפול במוטציות מסוג קודון פסק (stop codon mutations), הגורמות לעצירת תרגום החומר הגנטי לחלבון, והחלבון שנוצר אינו מתפקד. נמצא כי קיימים חומרים, בהם אנטיביוטיקה מסוגים מסוימים, היכולים להתערב ולהשפיע על הריבוזום למניעת השפעת קודון הפסק {{הערה|שם=הערה10|Zilberberg A, Lahav L, Rosin-Arbesfeld R. Restoration of APC gene function in colorectal cancer cells by aminoglycoside- and macrolide-induced read- through of premature termination codons. Gut. 2010 Apr;59(4):496-507. Epub 2009 Dec 1.}}. מחקר בנושא זה מתבצע במכון הגסטרו במרכז הרפואי תל אביב ע"ש סוראסקי. | ||
| − | + | מחקרים קליניים רלוונטיים פעילים או מתוכננים הם: | |
| + | *מניעה וטיפול בפוליפים בפוליפוזיס משפחתי על ידי כורכומין (מרכזים רפואיים: תל אביב ורמב"ם) | ||
| + | *מניעה וטיפול בפוליפים בפוליפוזיס משפחתי על ידי תכשיר של חומצות מסוג אומגה 3 (מספר מרכזים בארץ, עולמי) | ||
| + | *טיפול במוטציות פסק על ידי השימוש באנטיביוטיקה אריתרומיצין - [[Erythromycin]] למניעה וטיפול בפוליפים וגידולי דסמואיד (מרכז רפואי תל אביב) | ||
| − | + | ==הערות שוליים== | |
| − | + | {{הערות שוליים|יישור=שמאל}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==קישורים חיצוניים== | ==קישורים חיצוניים== | ||
גרסה אחרונה מ־20:53, 28 במאי 2018
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| פוליפוזיס אדנומטוט׳ משפחתי - רפואת בוגרים | ||
|---|---|---|
| ' | ||
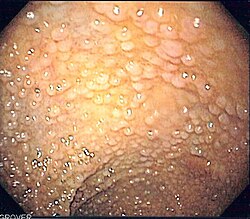
| ||
צילום אנדוסקופי של מעי גס של מטופל עם פוליפוזיס משפחתית
| ||
| ICD-10 | Chapter C 18., Chapter D 12. | |
| ICD-9 | 211.3 | |
| MeSH | D011125 | |
| יוצר הערך | ד"ר רויטל קריב | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פוליפוזיס אדנומטוטי משפחתי
מבוא
תהליכים סרטניים וטרום סרטניים במעי הגס בעלי רקע גנטי מהווים כ-20% מכלל המקרים. התסמונות התורשתיות נחלקות לאלו ללא ריבוי פוליפים (HNPCC - Hereditary non-polyposis colorectal cancer, תסמונת סרטן מעי גס שאינה על רקע פוליפוזיס) ולאלו עם ריבוי פוליפים. מבין תסמונות הפוליפוזיס, הראשונה שתוארה כללה ריבוי פוליפים מסוג אדנומה על רקע מוטציות בגן APC (adenomatous polyposis coli). גן זה משתייך לגנים מסוג מעכבי גידול (tumor suppressor genes), ויש לו תפקיד חשוב בשלבים הראשונים של התפתחות סרטן המעי הגס: ב-90% מהפוליפים השפירים מסוג אדנומה נמצאים שינויים גנטיים בגן זה [1] [2] בניגוד לשינויים ומוטציות בגנים הנמצאים ברמת הפוליפ או הגידול (סומטיים) ואינם בהכרח מורשים, שינויים גנטיים של תאי הגוף, כולל תאי המין (germline), עשויים לעבור בתורשה - באופן רצסיבי (נסגני) או דומיננטי (שלטני). שינויים גנטיים משמעותיים בגן APC גורמים לתסמונת פוליפוזיס אדנומטוטי משפחתי (FAP -Familial adenomatous polyposis), שביטויה העיקרי הוא ריבוי פוליפים מסוג אדנומה לאורך צינור העיכול - בעיקר במעי הגס, אולם גם בתריסריון, ובשכיחות קטנה יותר גם בקיבה והמעי הדק.
מאחר שהיבטים שונים של התסמונת, בעיקר אלו הקשורים לשנות הילדות והבגרות, מתוארים במאמר הסוקר את התסמונת בילדים, נתייחס כאן למידע הרלוונטי יותר לגיל הבוגר.
אבחנה קלינית
מרכיבי תסמונת FAP וביטוים
- פוליפים מסוג אדנומה וגידולי המעי הגס מהווים את עיקר התבטאות התסמונת. אלו הסבירו את רוב התחלואה בסרטן עד עידן הניתוחים (שיפורטו להלן). הפוליפים מופיעים בדרך כלל בעשור השני לחיים, ומספרם יכול לנוע בין מאות בווריאנט הקלאסי עד עשרות בווריאנט המתון, שביטויו עשוי להתחיל בעשור השלישי או הרביעי לחיים (תמונה מס' 1)
- פוליפים מסוג אדנומה וגידולי התריסריון בעיקר באזור הפפילה, מתחילים לרוב בשלב מאוחר מאלו שבמעי הגס
- גידולי דסמואיד - גידולים של תאי רקמת החיבור, הקרויים פיברובלסטים. גידולים אלו מוגדרים כשפירים מאחר שהם אינם שולחים גרורות, אולם הם יכולים לגדול מקומית בצורה אגרסיבית ולגרום לסיבוכים בחלל הבטן. מקום התפתחותם האופייני בתסמונת הוא שורש המזנטריום (בשונה מגידולי דסמואיד ספורדיים) - רקמת החיבור העוטפת את המעי בה עוברים כלי הדם המזינים אותו. סיבוכים אופייניים כוללים חסימת מעי או התנקבותו וחסימה של דרכי השתן. דסמואיד שכיח יותר בבנות ובנשים ובווריאנט של התסמונת הקרוי גרדנר (Gardner syndrome) (להלן). גדילת דסמואיד מואצת בעיקר בגיל ההתבגרות, לאחר הריונות (מאחר שהגידולים מושפעים מאסטרוגן), וכן לאחר ניתוחים לאור הדיסקציה המסיבית
- גידולי בלוטת המגן - גידולים מסוג פפילרי יכולים להופיע בנשאי התסמונת, ומכך נגזרת המלצה להמשך מעקב באולטרסאונד של בלוטת המגן
- אוסטיאומות וגידולי רקמה רכה (כגון פיברומות) - מופיעים בעיקר בווריאנט הנקרא גרדנר וקשורים בעלייה בסיכון לגידולי דסמואיד לאחר ניתוח. גידולי האוסטיאומה יכולים להופיע בכל מקום, אולם הם מופיעים בעיקר בגולגולת ובלסת
- גידולים אחרים - בתסמונת "תכנו באופן נדיר ביותר גם גידולי מוח, בווריאנט קליני הקרוי טורקוט (Turcot)
- תסמינים נוספים - שינויים פיגמנטריים מולדים ברשתית הקרויים CHRPE Congenital Hypertrophy of the Retinal) Pigment Epithelium) שאינם בעלי משמעות קלינית. הם שימשו טרם עידן האבחנה הגנטית לצורך אבחנתי בעיקר

תסמינים
אם לא ידועה תסמונת במשפחה, הנשאים בה עשויים להתגלות באופן מקרי. התסמינים העיקריים הם אנמיה, דמם רקטלי, כאבי בטן ועוד, אלא שלעיתים אין כל תסמינים לתסמונת. במשפחות בהן ידועה התסמונת, מבוצעות בדיקות גנטיות יזומות לאיתור נשאות ובדיקות אנדוסקופיות לגילוי מוקדם של המאפיינים.
סיכונים
הסיכון העיקרי בתסמונת הפוליפוזיס התורשתית הוא סרטן המעי הגס, אולם, לאור המעקב המובנה והניתוחים היעילים, חלה ירידה משמעותית בסיכון זה, והוא אינו מהווה גורם מוביל לתמותה באוכלוסייה זו. במקומו עלו מרכיבים אחרים בתסמונת כגורמי סיכון לתחלואה ולעיתים לתמותה, והם גידולי דסמואיד ופוליפים וכן גידולים של הפפילה ורירית התריסריון.
אבחנה גנטית
בקצרה (פירוט במאמר בנושא), במשך שנים היה נהוג להתחיל את הבירור הגנטי של מטופלים עם ריבוי אדנומות במעי הגס באמצעות בדיקת ריצוף של הגן הבודד APC בשיטת סאנגר (Sanger sequencing), ואם היא שלילית, להמשיך ולבדוק מוטציות שכיחות בגן MUTYH. העידן של שיטת ריצוף הדור הבא - (next generation sequencing - NGS) טרף את הקלפים, בכך שבאותה עלות של ריצוף גן בודד ניתן להשיג ריצוף בפנל של עשרות גנים הקשורים לסרטן מערכת העיכול, בהם הגנים APC, GREM1 ו-MUTYH- וכן גנים חדשים, שתוארו כקשורים לריבוי אדנומות. מציאת מוטציה בגן APC מספקת מספר נדבכים לטיפול בתסמונת ולהמשך ניהול מעקב רפואי של המטופל ומשפחתו:
- מאפיינים שונים של המוטציה עוזרים להעריך את חומרתה של התסמונת ומאפשרים התאמת טיפול מונע וטיפול ניתוחי
- ניתן לבדוק את בני המשפחה ולהחליט מי זקוק למעקב מונע סרטן
- אפשרות להציע אבחנה טרום השרשתית לצורך מניעת ההורשה של המוטציה (פירוט להלן)
- מוטציה ידועה מאפשרת הכללה במחקרים, שחלקם בודקים מוטציות מסוג ספציפי (פירוט להלן, בסיכום)
מעקב לנשאי התסמונת
אחד הנושאים החשובים ביותר לנשאים עם תסמונות פוליפוזיס הוא ניהול מעקב רפואי מסודר. הוכח מחקרית כי מעקב מסודר בהתאם להנחיות מונע תחלואה וסרטן. מומלץ לבצע מעקב שכזה במרכז המתמחה בסרטן מעי גס תורשתי, לאור נדירות התסמונת והצורך במיומנות קלינית ואנדוסקופית. המעקב מתבצע בדרך כלל על ידי צוות רב-תחומי, המתמחה בנושא וכולל גסטרואנטרולוג, רופא ילדים (לפי הצורך), כירורג קולורקטלי ואונקולוג (לפי הצורך, בגידולי דסמואיד), ומעטפת תומכת הכוללת אחות, עובד/ת סוציאלי/ת ותזונאים, המלווים את המטופלים לאורך השנים, כולל באירועים משמעותיים כמו ניתוח, הריונות ועוד. הקביעות, הזמינות והאמון במטפלים ובמסגרת מהווים גורמים חשובים התורמים להיענות ולהתמדה במעקב ארוך השנים הצפוי לנשאים [2].
- המעקב למניעת סרטן כולל
- מעקב באמצעות קולונוסקופיה מדי שנה או פחות, אם טרם בוצע ניתוח. לאחר ניתוח יתבצעו המעקבים בדרך כלל אחת לשנה עד שנתיים או בהתאם למצב הפוליפים והרקע האישי
- גסטרוסקופיה מומלצת אחת לשנה עד שנתיים כולל הסתכלות על הפפילה כדי לשלול התפתחות פוליפ, ומטרתה לעקוב אחר הופעת אדנומות בתריסריון ואחר פוליפים שפירים בכיפת הקיבה, שהם חלק מהתסמונת ולעיתים יכולים להכיל גם אדנומות
- מעקב בלוטת התריס באולטרסאונד מבוצע לאור הסיכון לפתח גידול פפילרי של בלוטת התריס ומומלץ אחת לשנה עד שנתיים
- מעקב תקופתי לגידולי דסמואיד בנשאים עם סיכון גבוה (וריאנט גרדנר או סיפור משפחתי של דסמואיד) מתבצע באמצעות הדמיה ב- CT או MRI. בכל מקרה, לפני ולאחר ניתוח כדאי לבצע, בהתאמה, הדמיית בסיס והדמיה חוזרת, כדי לראות אם לא התפתח גידול מסוג דסמואיד משני לניתוח, וכן לאחר היריון. אם התגלה גידול במראה הדמייתי מתאים, לא תמיד מבוצעת ביופסיה מאחר שזו יכולה להאיץ את הגידול. שכיח לראות מספר גידולים בתסמונת בניגוד למקרים אקראיים
טיפול מונע וטיפול
- טיפול מונע - לרוב לא ניתן טיפול תרופתי לנשאים אצלם עדיין אין ביטוי קליני משמעותי של התסמונת, כגון פוליפים או גידולי דסמואיד. כמפורט להלן, במקרים נבחרים "נתן לנשאים בסיכון משמעותי טיפול מונע לגידולי דסמואיד טרם ניתוח
- טיפול בפוליפים וניתוחים - בעבר היה מקובל לחשוב כי כל מקרי FAP יטופלו בניתוח לכריתת המעי הגס. בתקופתינו קיימת התייחסות אישית לכל מקרה, והקווים המנחים הם עומס הפוליפים, דרגת חומרתם, הפוטנציאל הסרטני שלהם והיכולת להסירם אנדוסקופית. כאשר קיים עומס פוליפים משמעותי או מרבד פוליפים, המקשים על המעקב ואינם מאפשרים הסרה באנדוסקופיה, בדרך כלל יש להמליץ על ניתוח. גדילה מואצת עד כדי ריבוי פוליפים גדולים או מתקדמים, היא סוג של סימן אזהרה להתפתחות סרטן, המגדיל את הטיעונים בעד ניתוח
כשמספר הפוליפים אינו כה גדול (עשרות בודדות), ולאור ההתקדמות הטכנולוגית באנדוסקופיה, ניתן להסירם בפעולה אחת או בכמה פעולות, ולא תמיד יש גדילה מסיבית חוזרת. במקרים מתונים אלה ניתן לבצע מעקב וניהול באמצעות מעקב אנדוסקופ׳ צמוד לרוב, ההחלטה על ניתוח מתבצעת בדיון של צוות רב-תחומי. הממצאים הקליניים והאנדוסקופיים ממלאים תפקיד חשוב יותר בשיקול אם לבצע ניתוח מאשר האבחנה הגנטית.
- סוגי הניתוחים לפוליפוזיס משפחתי כוללים
- כריתה תת-שלמה של המעי הגס עם השארת רקטום והשקה (חיבור) בין הרקטום למעי הדק (subtotal colectomy with ileorectal anastomosis - IRA)
- כריתת כל המעי הגס והרקטום (total proctocolectomy) עם חיבור בין המעי הדק לפי הטבעת ויצירת מאגר (פאוץ') מלולאת מעי דק לשם יצירת "מכל " דמוי רקטום -ileo-anal pouch (תמונה מס' 2) [4]
קיים ניסיון רב שנים בניתוחים אלה, והם מבוצעים גם בגישה פתוחה וגם בגישה לפרוסקופית. הבחירה בין הניתוחים תלויה במגוון שיקולים, ובעיקר בעומס הפוליפים ברקטום, ברקע הרפואי, בהעדפת המטופל, בניסיון המנתח ועוד. כריתה תת-שלמה של הרקטום מאפשרת צמיחה עתידית של פוליפים בגדם הרקטום, שניתנים לרוב להסרה אנדוסוקפית. עם זאת, ניתוח פאוץ' הוא נרחב יותר, ולעיתים מעלה את הסיכון לגידולי דסמואיד שעשויים לסכן את הפאוץ'.
כאשר קיימת אבחנה של סרטן המעי הגס בנוסף לפוליפים, ייכנסו שיקולים אונקולוגיים להחלטה לגבי סוג הניתוח וטיפולים נוספים, כגון כימותרפיה והקרנות.

מעקב לאחר הניתוח
חשוב מאוד שגם המעקב אחרי הניתוח יתבצע בידי צוות מנוסה ומיומן בתסמונת, המנהל דיון משותף לצורך קבלת החלטות. חלק חשוב של המעקב הוא איתור גידולי דסמואיד, המואצים על ידי התהליך הניתוחי. גם לאחר הניתוח דרוש מעקב המשכי והדוק, ושהסיכון להתפתחות סרטן לא נעלם.
טיפול תרופתי
כאשר יש גדילה בעומס הפוליפים, לפני או לאחר ניתוח, ניתן לשקול מתן טיפולים תרופתיים שהוכחו כמורידים את עומס הפוליפים. אלו כוללים בעיקר מעכבי האנזים 2-COX, סולינדק (קלינוריל - Clinoril)* ואספירין - Aspirin[6]. קיימים מחקרים המראים יעילות מסוימת גם לחומצות שומן מסוג אומגה 3 ולכורכומין [6] [7].
(*) או תרופות המכילות חומר פעיל זהה בעלות שמות מסחריים אחרים
טיפול בגידולי דסמואיד
- טיפולים אנטיאסטרוגנים: טמוקסיפן - Tamoxifen (נולבדקס - Nolvadex)*
- טיפול במעכבי האנזים 2-COX, כגון סלקוקסיב - Celecoxib (סלברה - Celebra, סלברקס - Celebrex)*
- טיפולים כימיים: מקובל לתת טיפול בודד עם דוקסורוביצין הידרוכלוריד - Doxorubicin hydrochloride (דוקסורוביצין "אבווה" - Doxorubicin EBEWE)* או משלב של מטוטרקסאט - Methotrexate עם וינבלסטין - Vinblastine (וולבה - Velbe, וולבן - Velban)* או וינורלבין Vinorelbine - (נבלבין - Navelbine)* או משלב של דוקסורוביצין ו-DTIC
- טיפולים מכווני מטרה (ביולוגיים): כגון מעכבי קינאזות, לדוגמה סוראפניב - Sorafenib (נקסאוואר - Nexavar)**, אימטיניב - Imatinib (גליבק - Gleevec/Glivec)**.
- טיפול ניתוחי
- השתלת מעי דק - אם מבוצעת כריתה ניתוחית נרחבת, הכוללת את שורש המזנטריום
שני הטיפולים הראשונים ניתנים כקו ראשון או לעיתים כמניעה, למרות היעדר הוכחות חותכות ליעילותם. אם קיימת התייצבות במצב הגידול או הגידולים, ממשיכים בטיפול ובמעקב הדוק. אם הגדילה ממשיכה או אם ישנם תסמינים משמעותיים - מתקדמים לאחד משני קווי הטיפול הבאים. קיימים חילוקי דעות לגבי הגישה הניתוחית מאחר שהיא עלולה להאיץ גדילה של גידולי דסמואיד חדשים. גישה זו נשמרת לגידולים בודדים ומוגדרים היטב בדופן הבטן ולא במזנטריום. אם קיים מצב מסכן חיים, ניתן לבצע כריתה רדיקלית, ואז קיים לעיתים צורך בהשתלת מעי דק [6] [8] [9].
(*) או תרופות המכילות חומר פעיל זהה בעלות שמות מסחריים אחרים.
(**) או תרופות המכילות חומר פעיל דומה בעלות שמות מסחריים אחרים
תזונה ואורח חיים
מעטים, אם בכלל, המחקרים שבדקו את השפעת התזונה ואורח החיים, כגון עישון והשמנת יתר, על הביטוי הקליני של התסמונת. מאחר שלגורמים אלו חשיבות רבה בהופעת פוליפים וגידולי המעי באוכלוסייה הרחבה - לא מן הנמנע כי יש להם ערך משמעותי בנשאי התסמונת, ויש להדגיש בפניהם את החשיבות שבהימנעות מעישון, שמירה על משקל תקין, הרגלי אכילה וצריכת מזונות בריאים (בעיקר לגבי אלו שעבורם יש מידע מבוסס, כגון בשר מעובד וכמות סיבים תזונתיים נמוכה) [10].
אבחנה טרום-השרשתית - PGD (Pre-implantation genetic diagnosis )
טכנולוגיה זו נכנסה לשימוש עבור מחלות גנטיות קשות, כדי למנוע העברת שינויים גנטיים חמורים בתורשה [11]. בהליך מבוצעת הפריה חוץ גופית שבה נבדקים העוברים טרם החזרתם לרחם, לנשאיות המוטציה (תמונה מס' 3). בדיקה זו אינה פוגעת בעוברים, וכך ניתן לבחור את העוברים שאינם נושאים את השינוי הגנטי ולהבטיח כי הם לא יישאו את המוטציה הגנטית. הליך זה מעניק שקט נפשי לנשאים. עם זאת, עומדת בפני כל משפחה בחירה חופשית אם לבצעו או לא, וחלק מהמשפחות בוחרות שלא לבצעו. טכנולוגיה זו נמצאת בסל הבריאות לחולים בפוליפוזיס משפחתי ודורשת מוטציה מזוהה. המרכזים הרפואיים בארץ המבצעים אבחנה טרום-השרשתית הם תל אביב ע"ש סוראסקי, רבין, שערי צדק והדסה.

1. חירור המעטפת Zona pellucida של טרום־עובר בן שמונה תאים באמצעות קרן לייזר
2,3. החדרת פיפטה דקה לתוך טרום־העובר ויצירת מגע עם אחד הבלטטומרים.
4. משיכת הבלסטומר הבודד באמצעות מערכת מיקרומניפולציה,
5. שחרור התא הבודד מחוץ לטרום־עובר,
6. התא מוכן לאיטוף (בנפרד מטרום־העובר) לצורך אבחונו הגנטי.
סיכום - עם הפנים לעתיד
FAP היא תסמונת גנטית נדירה וייחודית. לאורך השנים תסמונת זו אפשרה ומאפשרת לגסטרואנטרולוגים להבין את תהליכי היווצרות סרטן המעי הגס מבחינה מולקולרית, גנטית ואנדוסקופית, וכן גישות למניעת הופעה של פוליפים וסרטן במעי. התסמונת מתפקדת כ"מודל חי" לדינמיקה של פוליפים במעי הגס, בשל ריבוי הפוליפים שניתן לעקוב אחריהם לאורך זמן ובשל הבדיקות התדירות של הנשאים. מבחינה מחקרית, עצם העובדה כי הגן הגורם למחלה הוא קריטי גם בתהליכים גידוליים ספורדיים, הרי שמודלים בחיות ומודלים מעבדתיים של התסמונת הם בעלי ערך גם לכלל התהליכים הסרטניים במעי הגס.
טיפולים רפואיים חדישים במחלות גנטיות מופיעים עם רלוונטיות לתסמונת, למשל טיפול במוטציות מסוג קודון פסק (stop codon mutations), הגורמות לעצירת תרגום החומר הגנטי לחלבון, והחלבון שנוצר אינו מתפקד. נמצא כי קיימים חומרים, בהם אנטיביוטיקה מסוגים מסוימים, היכולים להתערב ולהשפיע על הריבוזום למניעת השפעת קודון הפסק [13]. מחקר בנושא זה מתבצע במכון הגסטרו במרכז הרפואי תל אביב ע"ש סוראסקי.
מחקרים קליניים רלוונטיים פעילים או מתוכננים הם:
- מניעה וטיפול בפוליפים בפוליפוזיס משפחתי על ידי כורכומין (מרכזים רפואיים: תל אביב ורמב"ם)
- מניעה וטיפול בפוליפים בפוליפוזיס משפחתי על ידי תכשיר של חומצות מסוג אומגה 3 (מספר מרכזים בארץ, עולמי)
- טיפול במוטציות פסק על ידי השימוש באנטיביוטיקה אריתרומיצין - Erythromycin למניעה וטיפול בפוליפים וגידולי דסמואיד (מרכז רפואי תל אביב)
הערות שוליים
- ↑ Su LK, Kinzler KW, Vogelstein B, et al. Multiple intestinal neoplasia caused by a mutation in the murine homolog of the APC gene. Science. 1992 May 1;256(5057):668-70.
- ↑ 2.0 2.1 Syngal S, Brand RE, Church JM, et al. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62. Epub 2015 Feb 3.
- ↑ HxBenefit. Familial Adenomatous Polyposis [image on the internet]. 2012 Dec 14 [cited 2017 Oct 8]. Available from: http://www.hxbenefit.com/familial- adenomatous-polyposis.html
- ↑ McGuire BB, Brannigan AE, O'Connell PR. Ileal pouch- anal anastomosis. Br J Surg. 2007 Jul;94(7):812-23.
- ↑ WebMD. Ulcerative surgery - what to expect [slideshow]. Ileal pouch anal anastomosis: no bags or valves [slide 4; image on internet]. [updated 2017 Aug 14; cited 2017 Oct 8]. Available from: https:// www.webmd.com/ibd-crohns-disease/ulcerative- colitis/ss/slideshow-surgery
- ↑ 6.0 6.1 6.2 Ricciardiello L, Ahnen DJ, Lynch PM. Chemoprevention of hereditary colon cancers: time for new strategies. Nat Rev Gastroenterol Hepatol. 2016 Jun;13(6):352-61. Epub 2016 Apr 20.
- ↑ West NJ, Clark SK, Phillips RK, et al. Eicosapentaenoic acid reduces rectal polyp number and size in familial adenomatous polyposis. Gut. 2010 Jul;59(7):918-25. Epub 2010 Mar 26.
- ↑ Lynch HT, Fitzgibbons R Jr. Surgery, desmoid tumors, and familial adenomatous polyposis: case report and literature review. Am J Gastroenterol. 1996 Dec;91(12):2598-601.
- ↑ Latchford AR, Sturt NJ, Neale K, et al. A 10-year review of surgery for desmoid disease associated with familial adenomatous polyposis. Br J Surg. 2006 Oct;93(10):1258-64.
- ↑ Chao A, Thun MJ, Connell CJ, et al. Meat consumption and risk of colorectal cancer. JAMA. 2005 Jan 12;293(2):172-82.
- ↑ Kuliev A, Verlinsky Y. Place of preimplantation diagnosis in genetic practice. Am J Med Genet A. 2005 Apr 1;134A(1):105-10.
- ↑ מלכוב מ, בן יוסף ד, עמית ע, ואחרים, אבחון גנטי טרום השרשה למחלות סרטן תורשתיות. הרפואה. יוני 2011(150)6:496–501
- ↑ Zilberberg A, Lahav L, Rosin-Arbesfeld R. Restoration of APC gene function in colorectal cancer cells by aminoglycoside- and macrolide-induced read- through of premature termination codons. Gut. 2010 Apr;59(4):496-507. Epub 2009 Dec 1.
קישורים חיצוניים
- במה עמ' 50
המידע שבדף זה נכתב על ידי ד"ר רויטל קריב - מנהלת השירות לגידולי מערכת העיכול, המכון למחלות דרכי העיכול והכבד, המרכז הרפואי תל אביב ע"ש סוראסקי


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק