הבדלים בין גרסאות בדף "Uridine diphosphate glucose 4-epimerase"
| שורה 76: | שורה 76: | ||
==הוראות לביצוע הבדיקה== | ==הוראות לביצוע הבדיקה== | ||
דגימות הדם נאספו במבחנת סודיום-הפארין (פקק ירוק), נשטפו בבופר פוספאט, סורכזו לקבלת פלט של אריתרוציטים ואוחסנו בטמפרטורה של 80°C-. נפח אחד של פלא אריתרוציטים שטוף הומס על ידי 3 נפחים של בופר lysis, ונמדד הריכוז של המוגלובין בהמוליזאט. האנליזה של פעילות GALE בהמוליזאט מתבצעת בטכנולוגיית LC-MS/MS כדלהלן: מס-ספקטרומטר (AB Sciex) מצויד ב-Shimadzu HPLC המורכב מ-2 משאבות LC-20AD XR, ודוגם אוטומטי מופעלים ב-ion mode שלילי. קולונת LC של חברת Waters מסוג BEH amide בגודל 2.1X50 מ"מ, והדוגם האוטומטי הורצו בטמפרטורת החדר. ממס A מורכב מ-10 מילימול/ליטר של אמוניום פורמאט באצטוניטריל ומים ביחס של 9:1; וממס B מורכב משני המרכיבים האחרונים ביחס של 20:80. שטחי השיאים (peaks) של LC-MS/MS עברו אינטגרציה עם תוכנת Analyst 4.0. | דגימות הדם נאספו במבחנת סודיום-הפארין (פקק ירוק), נשטפו בבופר פוספאט, סורכזו לקבלת פלט של אריתרוציטים ואוחסנו בטמפרטורה של 80°C-. נפח אחד של פלא אריתרוציטים שטוף הומס על ידי 3 נפחים של בופר lysis, ונמדד הריכוז של המוגלובין בהמוליזאט. האנליזה של פעילות GALE בהמוליזאט מתבצעת בטכנולוגיית LC-MS/MS כדלהלן: מס-ספקטרומטר (AB Sciex) מצויד ב-Shimadzu HPLC המורכב מ-2 משאבות LC-20AD XR, ודוגם אוטומטי מופעלים ב-ion mode שלילי. קולונת LC של חברת Waters מסוג BEH amide בגודל 2.1X50 מ"מ, והדוגם האוטומטי הורצו בטמפרטורת החדר. ממס A מורכב מ-10 מילימול/ליטר של אמוניום פורמאט באצטוניטריל ומים ביחס של 9:1; וממס B מורכב משני המרכיבים האחרונים ביחס של 20:80. שטחי השיאים (peaks) של LC-MS/MS עברו אינטגרציה עם תוכנת Analyst 4.0. | ||
| + | |||
| + | ==ראו גם== | ||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[אבחון תסמנות גנטיות|בדיקות מעבדה - אבחון תסמנות גנטיות]] | ||
| + | |||
| + | |||
| + | {{ייחוס בן עמי}} | ||
| + | |||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה - אבחון תסמנות גנטיות]] | ||
| + | [[קטגוריה:בדיקות מעבדה: גנטיקה]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
גרסה אחרונה מ־03:38, 11 במרץ 2023
| מדריך בדיקות מעבדה | |
| Uridine diphosphate glucose 4-epimerase | |
|---|---|
| שמות אחרים | UDP-galactose 4-epimerase, UDPG-4'-epimerase, GALE |
| מעבדה | כימיה בדם |
| תחום | גלקטוזמיה. |
| יוצר הערך | פרופ' בן-עמי סלע |
האנזים UDP-glucose 4-epimerase הידוע גם כ-UDP-galactose 4-epimeras ובקצרה GALE הוא אפימראז הומודימרי שנמצא בצמחים, שמרים, חיידקים ובתאי יונקים. אנזים זה אחראי לשלב הסופי של מסלול Leloir של המטבוליזם של galactose, בקטלוז המעבר ההפיך מ-UDP-galactose ל-UDP-glucose (Holden וחב' ב-J Biol Chem משנת 2003). אנזים זה קושר באופן הדוק nicotinamide adenine dinucleotide (להלן +NAD) שהוא קו-פקטור הנדרש לפעילות הקטליטית של האנזים (Liu וחב' ב-1996 משנת 1996).
בנוסף, איזופורמים של האנזים GALE באדם ובמספר חיידקים מקטלזים באופן הפיך את היצירה של UDP-N-acetylgalactosamine מ-UDP-N-acetylglucosamine בנוכחות של +NAD שהוא שלב ראשוני בסינתזה של גליקופרוטאינים וגליקוליפידים (Thoden וחב' ב-J Biol Chem משנת 2001). הביוכימאי הארגנטיני Luis Leloir גילה את התפקיד של GALE במטבוליזם של גלקטוזה, ואת תפקידם של נוקלאוטידים סוכריים בביוסינתזה של פחמימות (Leloir ב-Arch Biochem משנת 1951, ו-Kavanagh וחב' ב-Cell Mol Life Sci משנת 2008).
המבנה של GALE
אנזים זה שייך למשפחת העל של האנזים short-chain dehydrogenase/reductase (Thoden ו-Holden ב-Biochemistry משנת 1998). משפחה זו מאופיינת על ידי מוטיף משומר Tyr-X-X-X-Lys הנחוץ לפעילות האנזימטית, וכן על ידי היכולת לקשור +NAD. המבנה של GALE זוהה במספר מינים, כולל ב-E.coli (Liu וחב' ב-Biochemistry משנת 1997), ובאדם (Kingsley וחב' ב-Cell משנת 1986). האנזים GALE נמצא במינים שונים כהומודימר.
מבנה שלישוני
בעוד שהגודל של תת-היחידה נע בין 68 חומצות אמינו (Enterococcus faecalis) ל-584 חומצות אמינו (Rhodococcus ostii), רוב תת-היחידות של GALE הן באורך של 330 חומצות אמינו (Lai וחב' ב- IUBMB Life משנת 2009). כל תת-יחידה מכילה שני מקטעים נבדלים. מקטע N-טרמינלי המכיל 7 גדילים מקבילים (pleated sheet β) מאוגפים על ידי α-helices. מבנה זה מאפשר ל-GALE להיקשר בחוזקה למולקולת קו-פקטור יחידה של +NAD. המקטע ה-C-טרמינלי של GALE המורכב מ-6 גדילי β-sheet ו- α-helices 5 קושר מולקולת UDP, באופן שקישור תת-היחידה הזו אחראי לייצוב המדויק של UDP-glucose או של UDP-galactose לצורך הקטליזה.
האתר הפעיל
הגומחה בין הקצוות ה-N טרמינלי וה-C טרמינלי ב-GALE יוצרת את האתר הפעיל של האנזים. המוטיף המשומר Tyr-X-X-X-Lys חיוני לפעילות הקטליטית של GALE: באדם, מוטיף זה מיוצג על ידי Tyr157-Gly-Lys-Ser-Lys161, בעוד שב-E.coli המוטיף הזה של GALE מכיל Tyr149-Gly-Lys-Ser-Lys153 (Kingsley וחב' ב-N Eng J Med משנת 1986). הגודל והמבנה של האתר הפעיל של GALE שונה במינים השונים, מה שמאפשר ספציפיות משתנה למצע של GALE.
אינטראקציות ידועות בין שיירים של GALE עם UDP-glucose ו-UDP-galactose
- שיירים ALA216 ו-Phe218 מעגנים את טבעת ה-uracil לאנזים
- שייר Asp295 מגיב עם קבוצת ribose 2' hydroxyl
- שיירים Asn179, Arg321 ו-Arg292 מגיבים עם קבוצות UDP-phosphate
- שיירים Tyr299 ו-Asn179 מגיבים עם galactose 2' hydroxyl או עם glucose 6' hydroxyl
- שיירים Tyr177 ו-Phe178 מגיבים עם galactose 3' hydroxyl או עם glucose 6' hydroxyl
- שייר Lys153 מנמיך את ה-pKa של Tyr49 ומאפשר הוצאה או תרומה של אטום מימן ל- או מקבוצת sugar 4' hydroxyl
- שייר Tyr149 מוציא או תורם אטום מימן ל- או מקבוצת sugar 4' hydroxyl ומקטלז את יצירת תוצר הביניים 4-ketopyranose
הצורה הכללית של גלקטוזמיה על רקע חסר ב-epimerase תוארה רק בשני ילדים ממשפחות אסייתיות שונות (Henderson וחב' ב-J Inherit Metab Dis משנת 1983, ו-Sardharwalla וחב' באותו כתב עת משנת 1988). המופע ההתחלתי של התסמינים דומה לזה שבגלקטוזמיה קלאסית, ולמרות הטיפולים, ילדים אלה סבלו משגשוג דל ומקשיים מתונים בלימודים. בשלושה מהמקרים אובחנה חרשות נוירו-תחושתית, ובארבעה מקרים בלטו סממנים דיסמורפיים בולטים. בשתי נערות הייתה התפתחות מינית נורמלית. גלקטוזמיה נגרמת על ידי מפגעים העוברים בהורשה באחד משלושה אנזימים הקשורים במטבוליזם של galactose:
- galactose-1-phosphate uridyltransferase (להלן GALT)
- galactokinase (להלן GALK)
- uridine diphosphate galactose-4-epimerase (להלןGALE )
קיימות שתי צורות של חוסר GALE: חוסר מתון בכדוריות דם אדומות וחוסר חמור בכבד. בשני המקרים המתוארים היו רמות מוגברות של galactose-1-phosphate בעת אבחונם, GALT נורמלי ו-GALE בלתי ניתן לגילוי בתאי דם אדומים. אבחון של גלקטוזמיה כללית בהשוואה להיקפית, התבסס על חסר GALE בבפיברובלסטים של עור בתרבית או בחסר האנזים בתאי שלייה בתרבית.
כל הילדים הפגועים נולדו אחר הריונות תקינים שהגיעו למועדם, אך לאחר הלידה החלו מופיעים סממנים דומים לאלה המתגלים בגלקטוזמיה קלאסית עם חסר GALT, עם אכילה בעייתית, איבוד משקל ועדות למחלת כבד ולפגיעה באבוביות הכליה. סממנים אלה תוקנו לאחר הרחקת לקטוז מהמזון. היפוטוניה הייתה בולטת בכל התינוקות עם 2 סוגי הגלקטוזמיה אך לא תוקנה לאורך שנות הילדות למרות הסרת לקטוז מהדיאטה. אחד מהמאובחנים היה דיסמורפי באופן בולט. כל המאובחנים עם גלקטוזמיה היו נמוכי קומה, אף על פי ששגשוגם ברחם היה תקין. תפקוד בלוטת התריס היה תקין בכולם. בניגוד לגלקטוזמיה קלאסית, בשתי המאובחנות עם type III galactosemia ההתפתחות המינית הייתה תקינה, עם ערכי FSH, LH ו-estradiol תקינים. ריכוזי Gap-1-Phosphate בכדוריות האדומות נותרו מוגברים בילדות, אם כי היו נמוכים מערכים אלה שנמצאו במטופלים עם גלקטוזמיה קלאסית בהיותם מטופלים. בחסר של GALT יש יצירה אנדוגנית משמעותית של גלקטוז כמו גם יצירה של UDP-galactose על ידי היפוך של מסלול ה-pyrophosphorylase (Berry וחב' ב-Lancet משנת 1995). באופן תאורטי, בחסר GALE יצירה אנדוגנית כזו של גלקטוז אינה אפשרית בעיקר בגין החסר ביצירה של גלקטו-פרוטאינים וגלקטו-ליפידים. אחת הגישות הטיפוליות היא מניעת דיאטה המכילה גלקטוז, אם כי כמויות קטנות של לקטוז נכללות בה, כדי לאפשר יצירה של גליקופרוטאינים וגליקוליפידים חיוניים.
בשנות ה-90 שובט הגן המקודד ל-GALE ואופיין ה-cDNA לכל אורכו (Daude וחב' ב-Biochem Mol Med משנת 1995), ואופיינו מוטציות האחראיות לצורה ההיקפית של חסר GALE (על פי Maceratesi וחב' ב-Mol Genet Metab משנת 1998). נמצא שבכל הילדים עם type III galactosemia המוטציה המשותפת להם היא V94M (Wohlers וחב' ב-Am J Hum Genet משנת 1999) .
מנגנון הפעולה של GALE
הפיכת UDP-galactose ל-UDP-glucose: GALE הופך את הקונפיגורציה של קבוצת hydroxyl '4 של UDP-galactose תוך סדרה של 4 צעדים. על ידי הקישור ל-UDP-galactose' השייר המשומר של טירוזין באתר הפעיל הוא נוטל פרוטון מקבוצת hydroxyl '4 (Michell ב- Nat. Rev. Mol. Cell Biol משנת 2008, ו-Ten Hagen וחב' ב-Glycobiology משנת 2003). במקביל, מתווסף ה-hydride '4 ל- si-face של +NAD, ליצירה של NADH ושל תוצר הביניים ketopyranose-4, המבצע סיבוב של 180° בסמוך לקשר של pirophosphoryl בין החמצן הגליקוזילי ואטום ה-β-phosphorus המציג את המשטח ההפוך של תוצר הביניים ketopyranose, המבצע סיבוב של 180° בסמוך לקשר של pirphosphryl בין החמצן הגליקוזילי phosphoryl ואטום ה-β-phosphorus. ל-NADH (Ten Hagen ו-Alfalah ב-Curr Biol משנת 1999). הטרנספר של הידריד מ-NADH למשטח ההפוך האמור, גורם לשינוי של הסטראוכימיה של ה-center '4. השייר המשומר של טירוזין תורם את הפרוטון שלו, מה שמביא לרה-גנרציה של קבוצת hydroxyl '4.
הפיכת UDP-GlcNAc ל-UDP-GalNAc
איזופורמים של GALE באדם ובמספר סוגי חיידקים, מקטלזים את הפיכת UDP-GlcNAc ל-UDP-GalNAc דרך מנגנון זהה, תוך שינוי הקונפיגורציה של קבוצת ה-hydroxyl '4 של הסוכר in vitro, אך המנגנונים הפוגעים בפעילות האנזים in vivo עדיין לא הוכחו (Timson ב-FEBS J משנת 2005). אך ללא קשר, הרמות הממוצעות של galactose-1-phosphate פועלות כמנבאות המדויקות ביותר של חומרת התסמינים הכרוכים ב-type III galactosemia (Alano וחב' ב-J Inherit Metab Dis משנת 1998).
הסינתזה של UDP-GalNAc
משפחה של גליקוזיל-טרנספראזות הידועה כ-UDP-N-acetylgactosamine:polypeptide N-acetylgactosamine transferase (להלן ppGANTases) מבצעת טרנספר של GalNAc מ-UDP-GalNAC לשיירים של serine ו-threonine בגליקופרוטאינים. הגליקוזילציה המתווכת על ידי ppGANTase, מווסתת את הסיווג של חלבונים (Altschuler וחב' ב-Mol Biol Cell משנת 2000, Breuza וחב' ב-Exp Cell Res משנת 2002, Naim ב-J Biol Chem משנת 1999, ו-Zheng ו-Sadler ב-J Biol Chem משנת 2002), את האיתות על ידי ליגנדים (Hooper ו-Gordon ב-Glycobiology משנת 2001, Yeh וחב' ב-Cell משנת 2001, ו-Somers וחב' באותו כתב-עת משנת 2000), עמידות להתקפה פרוטאוליטית (Sauer וחב' ב-Biochim Biophys Acta משנת 2000, ו-Garner וחב' ב-J Biol Chem משנת 2001), ומייצגת את הצעד הראשון בביוסינתזה של mucin.
המטבוליזם של galactose
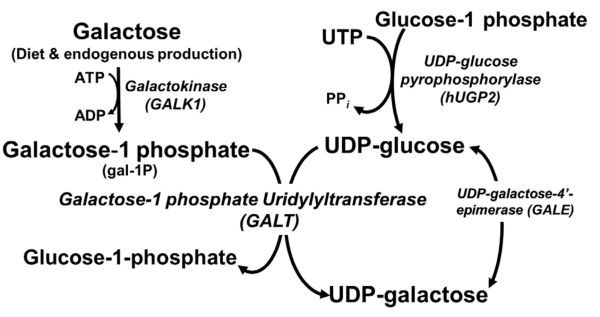
לא קיים מסלול קטבולי ישיר במטבוליזם של galactose, וזה מותמר באופן מועדף ל-glucose-1-phosphate שיכול להיכנס ישירות למעגל הגליקוליזה או למסלול סינתזת inositol (Lai וחב' ב- IUBMB Life משנת 2009). GALE פועל כאחד מתוך 4 אנזימים במסלול Leloir של הפיכת galactose ל-glucose-1-phosphate. ראשית, האנזים galactose mutarotase הופך β-D-galactose ל-α-D-galactos. בצעד הבא galactokinase מזרחן α-D-galactose בעמדת hydroxyl'1 ליצירה של galactose-1-phosphate. בצעד השלישי galactose-1-phosphate uridyltransferase מקטלז את הטרנספר ההפיך של UMP מ-UDP-glucose ל- galactose-1-phosphate ליצירה של UDP-galactose ו-glucose-1-phosphate. בשלב הרביעי של מסלול Leloir, חלה רגנרציה של UDP-glucose מ- UDP-galactose על ידי GALE; ו- UDP-glucose חוזר לצעד השלישי של המסלול. ה- glucose-1-phosphate הנוצר בשלב 3 של המסלול יכול לעבור איזומריזציה ל-glucose-6-phospha הנכנס למעגל הגליקוליזה ליצירה של ATP ופירובאט (Stryer וחב' ב-Biochemistry משנת 2008). יתרה מכך, glucose-6-phosphate יכול להפוך ל-inositol-1-phosphate על ידי inositol-3-phosphate synthase ליצירת קודמן הנחוץ לביוסונתזה של inositol.
התסמינים של congenital Type III Galactosemia
תסמיני המפגע הזה בולטים כבר מלידה, אך הם שונים בחומרתם בתלות בהשתייכותם לצורת המחלה הכללית או ההיקפית. התסמינים יכולים לכלול צהבת יילודים, היפוטוניה של יילודים, מאפיינים דיסמורפיים, איבוד שמיעה נוירו-תחושתי, עיכוב גדילה, חסכים קוגניטיביים, חסר בולט של תאי Purkinje במוחון, כשל שחלתי, היפר-גונדיזם היפרטרופי, כשל של הכבד ו/או הכליות, ירוֹד (קטרקט), וטחול מוגדל.
המחקרים על type III galactosemia חסרים עדיין את המפתח המדויק של המנגנונים הפתוגניים, זאת בעיקר בגלל חסר של מודלים תפקודיים של גלקטוזמיה קלאסית בחיות. נמצא מוטנט ב-GALE ב- Drosophila melanogaster עם תסמינים גלקטוזמיים מה שעשוי לשמש בעתיד כמודל של המחלה בחיות.
בסיס גנטי
לחסר GALE יש מתווה הורשה אוטוזומלי-רצסיבי (Park וחב' ב-Genet in Med משנת 2005). כל אחד מההורים של מאובחן עם גלקטוזמיה נושא עותק אחד של הגן הפגום, אך אף לא אחד מהם אינו לוקה בתסמינים של המפגע. זוהו מוטציות שונות ב-GALE אנושי הגורמות ל-type III galactosemia (Timson ב-FEBS J משנת 2005). אנליזה תפקודית של האיזופורמים של GALE עם מוטציות, מצביעה על כך שיעילות קטליטית מופחתת וסבירות מוגברת לעיכול פרוטאוליטי של האנזים אחראיות יחדיו ל-type III galactosemia. כך לדוגמה, מוטציות נקודתיות כגון V94M, K257R, L313M ו-R335H פוגעות בחוזקה בספציפיות האנזים וגורמות ל- Severe generalized galactosemia (Walter וחב' ב-Arch Dis Child משנת 1999); מוטציות נקודתיות דוגמת S81R, T150M ו-P293L אחראיות לגלקטוזמיה מתונה; מוטציות נקודתיות דוגמת L183P, D103G, G90E ו-N34S פוגעות הן ביעילות האנזים ובספציפיות שלו כמו גם והופכות אותו לפגיע יותר לפרוטאוליזה, ואחראיות ל- Severe generalized galactosemia.
הבסיס הביוכימי של המחלה
חסר של GALE מעכב את הרגנרציה של UDP-glucose, מה שמונע את היצירה של glucose-1-phosphate, ומביא להצטברות של גלקטוז ושל גלקטוז-1-פוספאט. ריכוזים גבוהים של אלה נמצאו מפריעים לפעילות של phosphoglucomutase (Lai ו-Elsas ב-Biochem Biophys Res Commun משנת 2000), glycogen phosphorylase (Guerrero ו-Wherle ב- J Pediatr משנת 1997 ) ו- UDP-glycopyrophosphorylase (Kinoshita וחב' ב-Biochim biophys Acta משנת 1968), במודלים בקטריאליים. החסימה של מסלול Leloir על ידי חסר GALE או על ידי תפקוד לקוי של אנזים זה, משפעלת מסלולי מטבוליזם חלופיים של גלוקוז, המובילים ליצירת galactitol ו-galactonate. התוצר האחרון עובר מטבוליזם במסלול pentose phosphate ואינו נחשב טוקסי. לעומתו, galactitol עלול להצטבר בסיבי העדשה תוך פגיעה בעבירוּת של תאי האפיתל בעדשה, גרימה למות תאים ולקטרקט. חסר GALE גם פוגע בביוסינתזה של גליקוליפידים ושל גליקופרוטאינים כתוצאה מיצירה מופחתת של UDP-GalNAc מ- UDP-GlcNAc.
הטיפול
אלה המאובחנים עם type III galactosemia חייבים לצרוך דיאטה דלה בלקטוז ובגלקטוז, ללא תוצרי חלב כגבינות למיניהן או צמחים מוצילגיניים. מגבלות דיאטטיות הן כרגע הטיפול הזמין היחיד במקרי חסר ב-GALE. כיוון שבמטבוליזם של גליקופרוטאינים וגליקוליפידים נוצר גלקטוז אנדוגני, לא סביר ש- type III galactosemia יכולה להית מטופלת בלבד על ידי הגבלות דיאטטיות.
הוראות לביצוע הבדיקה
דגימות הדם נאספו במבחנת סודיום-הפארין (פקק ירוק), נשטפו בבופר פוספאט, סורכזו לקבלת פלט של אריתרוציטים ואוחסנו בטמפרטורה של 80°C-. נפח אחד של פלא אריתרוציטים שטוף הומס על ידי 3 נפחים של בופר lysis, ונמדד הריכוז של המוגלובין בהמוליזאט. האנליזה של פעילות GALE בהמוליזאט מתבצעת בטכנולוגיית LC-MS/MS כדלהלן: מס-ספקטרומטר (AB Sciex) מצויד ב-Shimadzu HPLC המורכב מ-2 משאבות LC-20AD XR, ודוגם אוטומטי מופעלים ב-ion mode שלילי. קולונת LC של חברת Waters מסוג BEH amide בגודל 2.1X50 מ"מ, והדוגם האוטומטי הורצו בטמפרטורת החדר. ממס A מורכב מ-10 מילימול/ליטר של אמוניום פורמאט באצטוניטריל ומים ביחס של 9:1; וממס B מורכב משני המרכיבים האחרונים ביחס של 20:80. שטחי השיאים (peaks) של LC-MS/MS עברו אינטגרציה עם תוכנת Analyst 4.0.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק